丁苯酞对缺血脑组织RGMa表达及轴索损伤的影响
张勇, 卜春晓, 程敬亮, 李颜良
·实验研究·
丁苯酞对缺血脑组织RGMa表达及轴索损伤的影响
张勇, 卜春晓, 程敬亮, 李颜良
目的探讨丁苯酞对缺血性脑损伤后缺血脑组织排斥导向分子(RGMa)表达的影响。方法120只成年雄性SD大鼠,随机分为假手术组,大脑中动脉闭塞(MCAO)模型组,生理盐水组,丁苯酞干预组。选取缺血后1h、3h、6h、12h、24h,进行神经功能评分,免疫组织化学观察RGMa的表达情况。结果MCAO模型组、生理盐水组、丁苯酞组的改良的神经功能评分(mNSS)均高于假手术组,且随着时间的延长,mNSS评分越高;在缺血后3h、6h、12h、24h时,丁苯酞组的mNSS评分较MCAO模型组降低,差异具有统计学意义(P<0.05)。MCAO模型组、生理盐水组大鼠缺血后,不同时间点缺血区的RGMa蛋白阳性表达均有所增加,呈棕黄色染色。局灶性脑缺血后RGMa蛋白表达逐渐增多,在12h表达量最多;丁苯酞组在相应时间点的RGMa蛋白的表达较MCAO模型组有所降低,在6h、12h、24h时间点差异具有统计学意义。结论丁苯酞可减少缺血性脑损伤大鼠的缺血脑组织的RGMa的表达,从而发挥神经功能保护作用。
丁苯酞; 脑缺血; 轴索损伤; 模型,动物
丁苯酞是我国自主研发的化学药物,其通过改善缺血区微循环降低缺血再灌注损伤,改善缺血脑组织的能量代谢、保护线粒体功能、抑制氧自由基等而发挥脑保护作用[1-3],但其保护机制仍待进一步研究。排斥导向分子A(RGMa)是近年发现神经再生的排斥导向分子,中枢神经受损后,其生长锥塌陷,轴突结构受到严重破坏,将导致神经突起间联系的中断,细胞间信息的传递受损,从而导致神经功能的损伤[4,5]。本研究观察丁苯酞干预后局灶性缺血大鼠RGMa表达以及轴索损伤的影响,为临床治疗提供实验依据。
材料与方法
1.实验分组
挑选清洁级健康成年的SD雄性大鼠120只,体重为280~300 g,平均(293.4±5.8) g,实验所用SD大鼠均由河南省动物实验中心提供[实验动物使用许可证号:SCXK(豫)2010-0002]。动物随机分为假手术组、MCAO模型组、生理盐水组和丁苯酞组,每组分1h、3h、6h、12h、24h 5个时间点。大鼠腹腔注射10%水合氯醛(3 mL/kg体重)麻醉,MCAO模型组参照Longa等[6]报道使用线栓法制作大鼠左侧大脑中动脉缺血模型;假手术组大鼠不插入线栓,其余步骤同MCAO模型组;丁苯酞干预组,Tween80溶液稀释丁苯酞胶囊(由石药集团恩必普药业有限公司提供,批号09110611),MCAO模型制作后腹腔注射给药,大鼠给药剂量按80 mg/kg计算;生理盐水组,MCAO模型制作后腹腔注射给予相同体积的生理盐水。
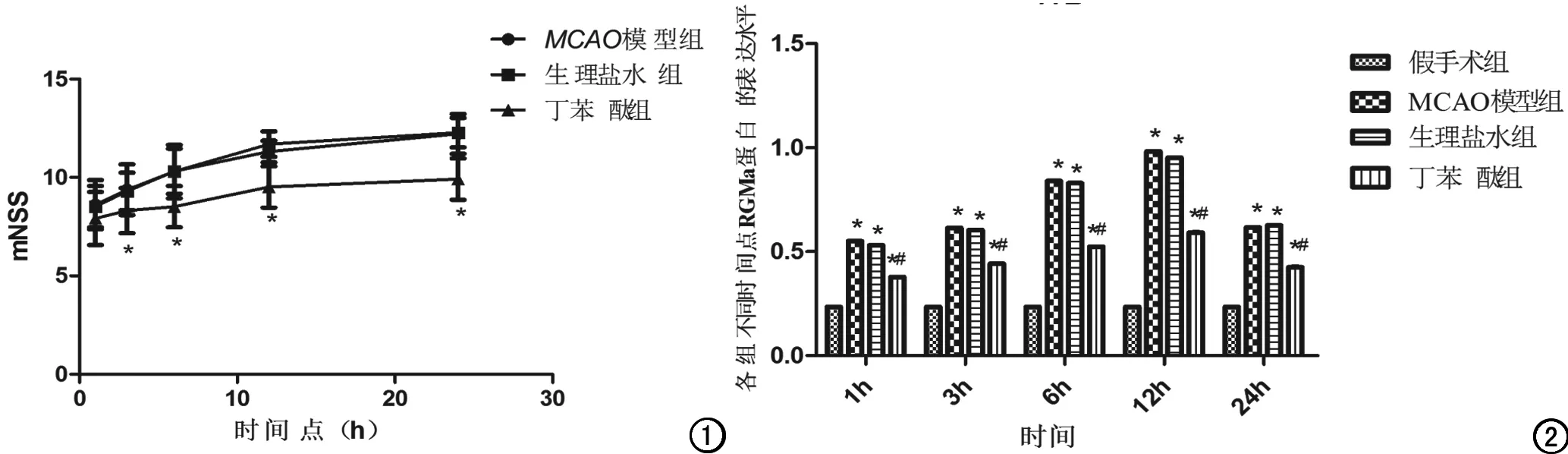
图1 大鼠缺血后不同时间点mNSS。* 代表与MCAO模型组比较差异有统计学意义(α =0.05,P<0.05)。 图2 大鼠缺血后不同时间点缺血侧脑组织RGMa蛋白的表达水平。* 代表与假手术组比较差异有统计学意义(α=0.05,P<0.05)。# 代表与MCAO模型组比较差异有统计学意义(α=0.05,P<0.05)。
2.大鼠神经功能评分
采用文献报道[7]的改良的大鼠神经功能评分标准(Modified neurological severity scores,mNSS),在相应时间点对大鼠进行神经功能评分。严重损伤13~18,中度损伤7~12,轻度损伤1~6。评分标准如表1。

表1 相应时间点对大鼠的神经功能评分标准
3.免疫组织化学检测RGMa及轴突神经丝蛋白-200(NF-200)表达
大鼠麻醉、灌注后取脑,放入4% PFA中固定,24 h后做石蜡包埋,制作石蜡切片( 片厚4 μm) 。用二甲苯和梯度酒精脱蜡,3% H2O2灭活内源性过氧化物酶10 min,枸橼酸缓冲液热修复抗原6 min×4 次,1% TritonX 细胞通透20 min,山羊血清封闭30 min,RGMa兔多克隆抗体(1:50,英国Abcam公司) 及小鼠抗NF-200 一抗(1:100,武汉博士德生物技术有限公司)孵育并于4℃过夜。再用生物素标记的山羊抗兔IgG/山羊抗小鼠IgG孵育,辣根酶标记的链霉卵白素孵育30 min,二抗试剂盒( 北京中杉生物技术有限公司) 。最后二氨基联苯胺(DAB) 显色、梯度脱水及封片。
4.统计学方法

结 果
1.各组不同时间点大鼠神经功能评分
按mNSS评分标准对4组大鼠进行行为学评分,假手术组大鼠未出现神经功能缺损症状,MCAO模型组、生理盐水组及丁苯酞组大鼠的mNSS评分差异具有统计学意义(重复测量设计方差分析,F=64.39,P=0.00)。进一步采用LSD法两两比较,缺血后第3h、6h、12h、24h时,丁苯酞组与MCAO模型组(P<0.05)、丁苯酞组与生理盐水组(P<0.05) 大鼠的mNSS评分差异均具有统计学意义;生理盐水组和MCAO模型组相比差异无统计学意义(图1)。
2.各组不同时间点大鼠脑皮质及海马RGMa 蛋白表达
假手术组大鼠脑皮质及海马区可见少量RGMa蛋白阳性细胞,着色较弱。缺血性脑梗死第1h,MCAO模型组、生理盐水组及丁苯酞组大鼠RGMa 蛋白阳性细胞增多,对RGMa蛋白表达半定量分析可得,4组间RGMa蛋白表达差异有统计学意义(F=421.50,P=0.00)。给予丁苯酞治疗后,在相应时间点同MCAO模型组相比,丁苯酞组大鼠脑皮质RGMa蛋白的表达明显降低,差异具有统计学意义(P<0.05,图2、3)。进一步采用Western blot法检测RGMa蛋白的表达,发现同免疫组化相似的趋势,假手术组大鼠缺血脑梗死灶周围脑皮质仅有少量RGMa蛋白表达。同假手术组相比,MCAO模型组大鼠RGMa蛋白表达显著增高(P<0.05),给予丁苯酞治疗后,在相应时间点同MCAO模型组相比,丁苯酞干预组大鼠脑皮质RGMa蛋白的表达水平明显下降(P<0.05,图4)。

图3 不同组大鼠缺血后不同时间点缺血脑组织的RGMa的表达。A0代表假手术组;A1-A5分别为MCAO模型组1h、3h、6h、12h、24h缺血区脑组织RGMa蛋白表达。随着脑梗死时间的延长,RGMa蛋白表达逐渐增加,12h达到最高值,在24h稍降低;B1-B5分别为生理盐水组1h、3h、6h、12h、24h缺血区脑组织RGMa蛋白表达,RGMa蛋白表达与MCAO模型组无明显差异;C1-C5分别为丁苯酞组1h、3h、6h、12h、24h缺血区脑组织RGMa蛋白表达,RGMa蛋白表达较MCAO模型组降低。

图4 大鼠缺血后不同时间点缺血脑组织NF-200蛋白的表达水平。*代表与假手术组比较差异有统计学意义(α=0.05,P<0.05)。# 代表与MCAO模型组比较差异有统计学意义(α=0.05,P<0.05)。
3.各组不同时间点大鼠脑皮质及海马NF-200蛋白表达
假手术组大鼠的免疫组化染色显示缺血性脑梗死灶周围脑皮质有大量 NF-200反应阳性的细胞;MCAO模型组大鼠在缺血3h时NF-200反应阳性细胞显著减少,阳性纤维结构紊乱,突起中断,长度明显缩短,并随着时间的延长这种现象越明显。对NF-200蛋白表达半定量分析可得,4组间NF-200蛋白表达差异有统计学意义(F=310.82,P=0.00)。丁苯酞组同MCAO模型组相比,大鼠脑皮质及海马NF-200蛋白阳性细胞数目有所增加,在1h和3h这种差异没有统计学意义,在6h、12h及24h差异有统计学意义(P<0.05,图4、5)。
讨 论
RGMa已被证实是一类具有抑制轴突再生的排斥性分子,排斥导向分子(repulsive guidance molecule,RGM)最初被认为是连接视网膜和中脑顶盖神经纤维系统诱导生长锥塌陷的一种膜结合蛋白,其通过糖基磷脂酰肌醇(GPI)锚定于细胞膜,控制神经元的增殖和分化等[8]。使用Rho激酶特异性抑制剂阻止了RGMa所诱导的神经元生长锥塌陷,说明RGMa通过RhoA-Rho 激酶通路,抑制神经轴突再生。也有体外实验[9]证实RGMa可以引起正常皮质神经元的轴突回缩,并伴有细胞内pCRMP-2表达的增多,说明RGMa可以诱导pCRMP-2磷酸化而发挥抑制轴突生长的作用。
Hata等[10]报导RGMa抑制脊髓损伤后神经元轴突再生,使用RGMa抗体干预,脊髓神经功能恢复得以改善,而Yshida等[11]在体外进一步证实了RGMa抑制皮质神经元的轴突再生。Yamashita等[12]研究表明局灶性脑缺血后RGMa免疫阳性细胞在病变区和病变周围聚集,并在缺血后1.5~2.5d达到峰值。本研究选择RGMa作为观察指标,检测其在脑梗死组织及小脑半球的表达情况。
脑组织在发生局灶性脑缺血后,RGMa免疫阳性细胞会聚集在病灶中心及周围区域[12],随着大鼠的脑皮质内RGMa表达的增多,轴突损伤逐渐加重,神经功能缺损也相应严重。Chung等[13]的研究证实其不利于轴突缺血性损伤后的修复剂在再生。本研究建立了稳定的MCAO模型,与假手术组相比较,MCAO模型组RGMa阳性表达显著增加,死亡的神经细胞数量增多,而神经功能评分升高,说明神经功能损伤严重,与前期的研究结果相一致。

图5 不同组大鼠缺血后不同时间点小脑半球的RGMa蛋白的表达。A0代表假手术组;A1-A5分别为MCAO模型组1h、3h、6h、12h、24h小脑半球RGMa蛋白表达,随着脑梗死时间的延长,RGMa蛋白的表达逐渐增加,12h达到最大值,24h稍降低;B1-B5分别为生理盐水组1h、3h、6h、12h、24h小脑半球RGMa蛋白表达,RGMa蛋白表达与MCAO模型组无明显差异;C1-C5分别为丁苯酞组1h、3h、6h、12h、24h小脑半球RGMa蛋白表达,RGMa蛋白表达较MCAO模型组降低。
丁苯酞通过作用于缺血脑组织病理生理过程中的多个靶点而发挥脑保护作用,本研究通过与模型组比较发现丁苯酞组相应时间点的RGMa阳性表达减少,相应时间点的NF-200蛋白阳性细胞数目有所增加,说明丁苯酞能抑制缺血性脑损伤中RGMa的阳性表达,改善神经功能损伤。我们推测在神经损伤中丁苯酞可以减少RGMa表达,减少生长锥塌陷,保护轴突的结构,维持神经突起间联系,保障细胞间信息的传递,最终减轻神经功能的损伤。
综上所述,本研究提示丁基苯酞可减少缺血性脑损伤后大鼠脑组织RGMa表达,从而减轻神经功能的损害。由此可以推测,NBP通过缺血性脑损伤后脑组织内RGMa生成,起到神经保护作用,但丁基苯酞引起表达变化的具体机制又是什么,以及二者之间的具体关系,这值得我们进一步研究,以便为临床脑梗死患者提供新的治疗思路。
[1] 张镛,刘振芳,付庆喜,等.脑缺血和NBP预处理对脑缺血沙鼠NGB和mit-Na,K+-ATP酶活性的影响[J].山东医药,2007,47(1):1.
[2] 高兰,娄季宇,杨宵鹏.丁苯酞对脑缺血再灌注损伤大鼠MMP-9活性和血脑屏障通透性的影响[J].中风与神经疾病杂志,2012,29(2):116-118.
[3] Xu HL,Feng YP.Inhibitory effects of chiral 3-n-butylphthalide on inflammation following focal ischemic brain injury in rats[J].Acta Pharmacologica Sinica,2000,21(5):433-438.
[4] Kuboyama T,Luo X,Park K,et al.Paxillin phosphorylation counteracts proteoglycan-mediated inhibition of axon regeneration[J].Exp Neurol,2013,248(10):157-169.
[5] Kong Y,Rogers MR,Qin X.Effective neuroprotection by ischemic postconditioning is associated with a decreased expression of RGMa and inflammation mediators in ischemic rats[J].Neurochem Res,2013,38(4):815-825.
[6] Longa EZ,Weinstein PR,Carlson S,et aI.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7] Garcia JH,Wagner S,Liu KF,et al.Rat middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[8] Kong Y,Rogers MR,Qin X.Effective neuroprotection by ischemic postconditioning is associated with a decreased expression of RGMa and inflammation mediators in ischemic rats[J].Neurochem Res,2013,38(4):815-825.
[9] Wang T,Wu X,Yin C,et al.CRMP-2 is involved in axon growth inhibition induced by RGMa in vitro and in vivo[J].Mol Neurobiol,2013,47(3):903-913.
[10] Hata K,Fujitani M,Yasuda Y,et al.RGMa inhibition promotes axonal growth and recovery after spinal cord injury[J].J Cell Biol,2006,173(1):47-58.
[11] Yoshida J,Kubo T,Yamashita T.Inhibition of branching and spine maturation by repulsive guidance molecule in cultured cortical neurons[J].Biochem Biophys Res Commun,2008,372(4):725-729.
[12] Yamashita T,Mueller BK,Hata K.Neogenin and repulsive guidance molecule signaling in the central nervous system[J].Curr Opin Neurobiol,2007,17(1):29-34.
[13] Chung HW,Chou MC,Chen CY.Principles and limitations of computational algorithms in clinical diffusion tensor MR tractography[J].AJNR,2011,32(1):3-13.
EffectsofbutylphthalideonRGMaexpressionandaxonalinjuryinischemicbrain
ZHANG Yong,BU Chun-xiao,CHENG Jing-liang,LI Yan-liang.
Department of Magnetic Resonance,the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
Objective:To investigate the effect of butylphthalide on the expression of RGMa in ischemic brain.MethodsOne hundred and twenty healthy male SD rats were randomly divided into following four groups:sham operation group,middle cerebral artery occlusion (MCAO) model group,saline group and the experimental group.Each group would be further divided into 5 subgroups (1h,3h,6h,12h and 24h).The modified neurological severity scores and Western blot assay RGMa expression of ischemia side were performed at 1h,3h,6h,12h,24h after successful MCAO model.ResultsThe Modified Neurological Severity Score (mNSS) of MCAO model group,saline group,butylphthalide group were higher than those of sham group,mNSS were more higher as time went on;at 3h,6h,12h,at 24h after ischemia,mNSS of NBP group compared with MCAO model group,the difference was statistically significant (P<0.05).After ischemia,RGMa protein expression of MCAO model group and saline group in ischemic area had increased,which were staining with brownish yellow.RGMa expression gradually increased as time went on,up to maximum at 12h;RGMa protein expression of NBP group decreased,the difference between NBP group and MCAO group had statistically significant at 6h,12h,24h;RGMa protein expression changes between cerebellum and ischemic area were similar,RGMa protein expression of NBP group were reduced, difference was statistically significant at 1h,3h,6h,12h (P<0.05).ConclusionButylphthalide can reduce the expression of RGMa in ischemic brain tissue of rats with ischemic brain,and thus has a neuroprotective role.
Butylphthalide; Brain ischemia; Axonal injury; Models,animal
R743.31; R651.15
A
1000-0313(2017)10-1018-04
2017-01-20
2017-05-15)
450002 郑州,郑州大学第一附属医院磁共振科
张勇(1977-),男,河南焦作人,副主任医师,主要从事中枢神经系统影像学诊断工作。
程敬亮,E-mail: cjr.chj@vip163.com
2014年国家自然科学基金项目(U1404823)
10.13609/j.cnki.1000-0313.2017.10.005

