MRI对前列腺中央腺体T2WI低信号结节的良恶性分析
叶瑞婷, 邹玉坚, 郑晓林, 袁灼彬, 肖利华
·腹部影像学·
MRI对前列腺中央腺体T2WI低信号结节的良恶性分析
叶瑞婷, 邹玉坚, 郑晓林, 袁灼彬, 肖利华
目的探讨前列腺中央腺体T2WI低信号良、恶性结节的MRI表现,以提高鉴别诊断的能力。方法符合纳入标准的19例前列腺癌结节和61例前列腺增生患者经多序列MRI检查并经组织病理学证实。对两者在T2WI上的信号和边缘。DWI信号强度和ADC值、及多期DCE的最大信号强度和时间信号强度曲线的类型进行比较分析。结果19例前列腺癌结节T2WI上边界不清、部分不清16例,边缘清楚3例,呈均质低信号; 61例前列腺增生结节边缘不清及部分边界不清共34例,边缘清楚27例,信号均匀30例,信号不均匀31例。两者具有显著性的差异(P=0.007)。于DWI,前列腺癌结节信号强度(b值为800 s/mm2)为60.6±10.7明显高于增生结节(49.7±8.5)(t值为-5.793,P=0.00)。前列腺癌结节ADC值为(0.83±0.18)×10-3mm2/s,明显高于增生结节(1.17±0.24mm2/s)(t值为0.460,P=0.00)。多期DCE,前列腺癌的最大信号强度为385.60±108.27,增生结节的最大信号强度为393.21±111.28(t值为-0.270,P=0.788),两者比较没有显著性差异。前列腺癌时间信号强度曲线以速升速降为主,而增生结节以渐进型和速升平台型为主,两者具有显著性差异(P=0.00);其中速升速降型和渐进型曲线于组间具有显著性差异)。结论前列腺中央叶T2WI低信号结节中,前列腺癌与前列腺增生于T2WI边缘和信号均匀性、DWI的信号强度和ADC值、曲线类型均有差异。故MRI多序列成像分析助于对中央腺体T2WI低信号结节良恶性的鉴别诊断。
前列腺肿瘤; 前列腺增生; 磁共振成像
前列腺增生和前列腺癌是中老年男性最常见的病变,发病率逐年上升且呈现年轻化趋势。我国50岁以上的男性人群中,约70%的男性患有各种前列腺疾病[1]。70岁以上中国男性的前列腺癌居男性泌尿生殖系肿瘤发病率第1位[2]。前列腺中叶即解剖学称为尿道周围带和移行带是发生前列腺增生的部位,同时25%前列腺癌也发生在此处。由于前列腺中叶独特的组织结构和血供条件,以平滑肌组织成分和间质纤维成分增生的结节在MRI信号特征上与前列腺癌相似,因血供丰富表现为明显强化,故两者在MRI诊断与鉴别上存在困难。MRI多参数成像是前列腺最佳的影像学检查方法。本文对符合纳入标准的19例中叶的前列腺癌结节和61例结节状增生MRI的T2WI、DWI和多期动态增强的表现进行分析和对照,以达到对前列腺中叶良恶性结节鉴别诊断、进一步提高认识的目的。
材料与方法
1.病例资料
搜集2014年7月-2015年12月共185例行前列腺磁共振成像检查,并经手术或活检取得病理结果的病例,其中发生于或累及前列腺中央腺体的前列腺癌有51例,表现为局限性结节型有19例;发生于中央腺体的增生结节有134例,表现为T2WI低信号结节有61例。前列腺癌(19例)患者组的年龄为54~88岁,平均年龄(71.95±7.11)岁,中位年龄为71岁;前列腺增生(61例)患者组的年龄为56~87岁,平均年龄(72.90±7.48)岁,中位数为68岁。两组临床症状主要表现为尿频、排尿困难,或体检发现前列腺特异抗原(PSA)升高入院进一步行前列腺MRI检查。所有患者在MRI检查前均未进行抗肿瘤药物治疗或其他处理,在MRI检查后1~2周内完成前列腺手术或活检取得病理结果。
2.MR检查方法
使用西门子Symphony 3.0T磁共振扫描仪,腹部相控阵线圈进行检查。所有病例先行盆腔MR大范围常规序列扫描,包括T1WI、T2WI,以观察盆腔情况,在前列腺范围高分辨率扫描:T1WI,轴面,快速自选回波(turbo spin echo,TSE),TR 500 ms,TE 13 ms,扫描视野200 mm×200 mm,矩阵256×256,层厚3 mm,层间距0.3 mm。T2WI,轴面及冠状面加脂肪抑制,TSE, TR 4170 ms,TE 100 ms,视野200 mm×200 mm(轴面)、200 mm×200 mm(冠状面),矩阵256×256,层厚3 mm,层间距0.3 mm。DWI,轴面,自旋回波的平面回波成像(echo planalimaging,EPI), TR 3200 ms,TE 84 ms,视野260 mm×260 mm,矩阵256×256,层厚3 mm,层间距0.3 mm,扩散梯度因子(b值)为b=0、800及1000 s/mm2,扫描时间13 s,自动生成表观扩散系数(apparent diffusion coefficient,ADC)图。
动态增强扫描(dynamic contrast enhanced,DCE)采用三维快速小角度激发扰相梯度回波(3D FLASH)序列,轴面,TR 5.2 ms,TE 2.6 ms,翻转角10°,视野260 mm×260 mm,矩阵256×256,层厚3 mm,层间距0.3 mm。每期26层,扫描时间12 s。用MR专用高压注射器经肘静脉注入对比剂(二乙三胺五醋酸钆双葡甲胺,广州康臣药业有限公司),用量0.1 mmol/kg体重,流率4 mL/s,注射开始5 s行第一次扫描,每隔5 s重复扫描,共扫描20个周期。
3.病变分析
患者纳入标准:病灶局限于中央腺体,病灶呈局灶性,T2WI以低信号为主,图像清晰,没有伪影,经组织病理学证实为前列腺癌或前列腺增生,未见任何治疗和处理,均为首次检查。患者被知情告知并同意者。
患者排除标准:前列腺癌结节突破中央腺体包膜,侵犯广泛者,弥漫性病变。
4.分析方法
由2名放射科医生在不知道病理结果的情况下于T2WI上测量病变的大小(以最大径为标准),观察结节的边缘、信号均匀性,并计数。如意见不同则经协商达成一致。测量结节于DWI (b=1000 s/mm2)信号强度。测量ADC图上的ADC值,兴趣区(rera of interest,ROI )放置在结节中央,不超过其边缘,ROI 面积尽可能大,包含约25~40个像素,测量3次平均值,尽量避开前列腺周围脂肪、血管、气体、尿道组织。
动态增强扫描分析:将多期扫描数据输入MR自带专用工作站,于结节最大层面勾画兴趣区(参照T2WI所用的圆形兴趣区作标记),应用MEAN CURVE软件生成时间信号强度曲线,将曲线的走向分为速升速降型、速升渐进型、速升平台型和缓升型。
回顾性分析,按病理结果将患者分为前列腺癌与前列腺增生两组,将各组结节的T2WI表现、相关测量值和动态曲线进行对照。
统计学处理:对计数资料即两组T2WI的表现和动态增强曲线的类型用Fisher精确检验进行比较。计量资料即两组DWI的测量值进行t检验和F分析作比较,设P<0.05具有显著性的差异,统计学所用软件为SPSS 16.0版本。
结 果
1.前列腺癌与前列腺增生的T2WI表现
19例中央腺体前列腺癌灶结节,于T2WI上多数边界不清、毛糙,形态不规则,呈均质低信号(图1)。61例中央腺体增生结节多数边界较清、光整,形态较规则,T2WI呈低信号或高低混杂信号(图2)。两组比较具有显著性统计学差异(P值为0.007)。癌结节均表现为T2WI均匀低信号,未见不均匀信号;而增生结节则表现为T2WI均匀低信号、轻度不均匀(带点状稍高信号)和不均匀性低信号(带有较明显的略高信号)。两组比较无显著性统计学差异(P=0.096,表1)。

图1 前列腺癌灶结节T2WI示边界不清、毛糙,形态不规则,呈均质低信号(箭)。 图2 前列腺增生结节T2WI示边界较清、光整,形态较规则,呈低信号或高低混杂信号,周缘有包膜样结构(箭)。 图3 a) 前列腺癌结节DWI呈高信号; b) ADC图呈低信号(箭)。 图4 a) 前列腺增生结节DWI呈稍高信号; b) ADC图呈稍低信号(箭)。
前列腺癌结节与增生结节的最大径线平均数分别为(19.16±5.53)及(18.10±5.351)mm,两组比较无显著性统计学差异(P>0.05,表2)。

表1 前列腺癌和前列腺增生的T2WI表现和Fisher精确检验结果
注:结节边缘两组具有显著性差异(P<0.05),信号均匀程度两组无显著性差异(P>0.05)。
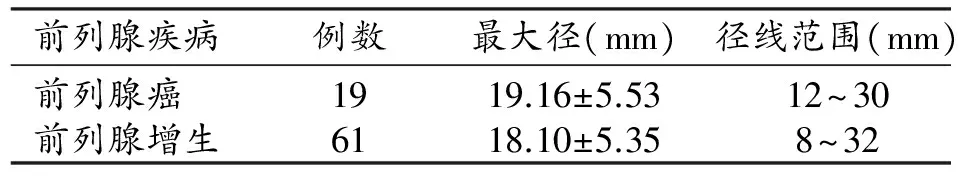
表2 前列腺T2WI低信号结节最大径线及t检验结果
注:t值=0.786,P值=0.434。两组结节经线无显著性差异(P>0.05)。
2.前列腺癌与前列腺增生的DWI表现
前列腺癌结节于DWI呈高信号,DWI平均信号强度为60.6±10.7,ADC图上为低信号,平均ADC值为(0.83±0.18)×10-3mm2/s(图3);增生结节DWI呈等或稍高信号,DWI平均信号强度为49.7±8.5, ADC图为等或稍低信号,平均ADC值为(1.17±0.24)×10-3mm2/s(图4)。癌结节DWI信号强度明显高于增生结节(t=-5.793,P<0.05),而ADC值明显低于增生结节(t=4.600,P<0.05),统计学有显著差异性(表3)。
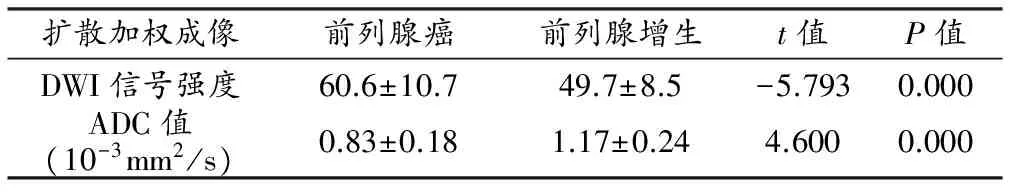
表3 前列腺癌和前列腺增生的DWI和ADC值平均数与t检验结果
注:两组的DWI信号强度和ADC值具有显著性差异(P<0.05)。
3.前列腺癌与前列腺增生的动态增强表现
DCE-MRI示癌结节及增生结节呈明显强化,且癌结节及曲线为速升平台型的增生结节早期强化更加显著(图5、6)。最大信号强度前列腺癌为385.60±108.27,增生结节为393.21±111.28,经t检验(t=-0.270,P=0.788),两组间无显著性差异。时间-信号强度曲线,癌结节以速升平台型为主(图7),其中3例呈典型的速升速降型。增生结节渐进型为主(图8),其中仅1例为速升速降型。两组DCE时间-信号强度曲线比较具有统计学差异(P<0.05)。
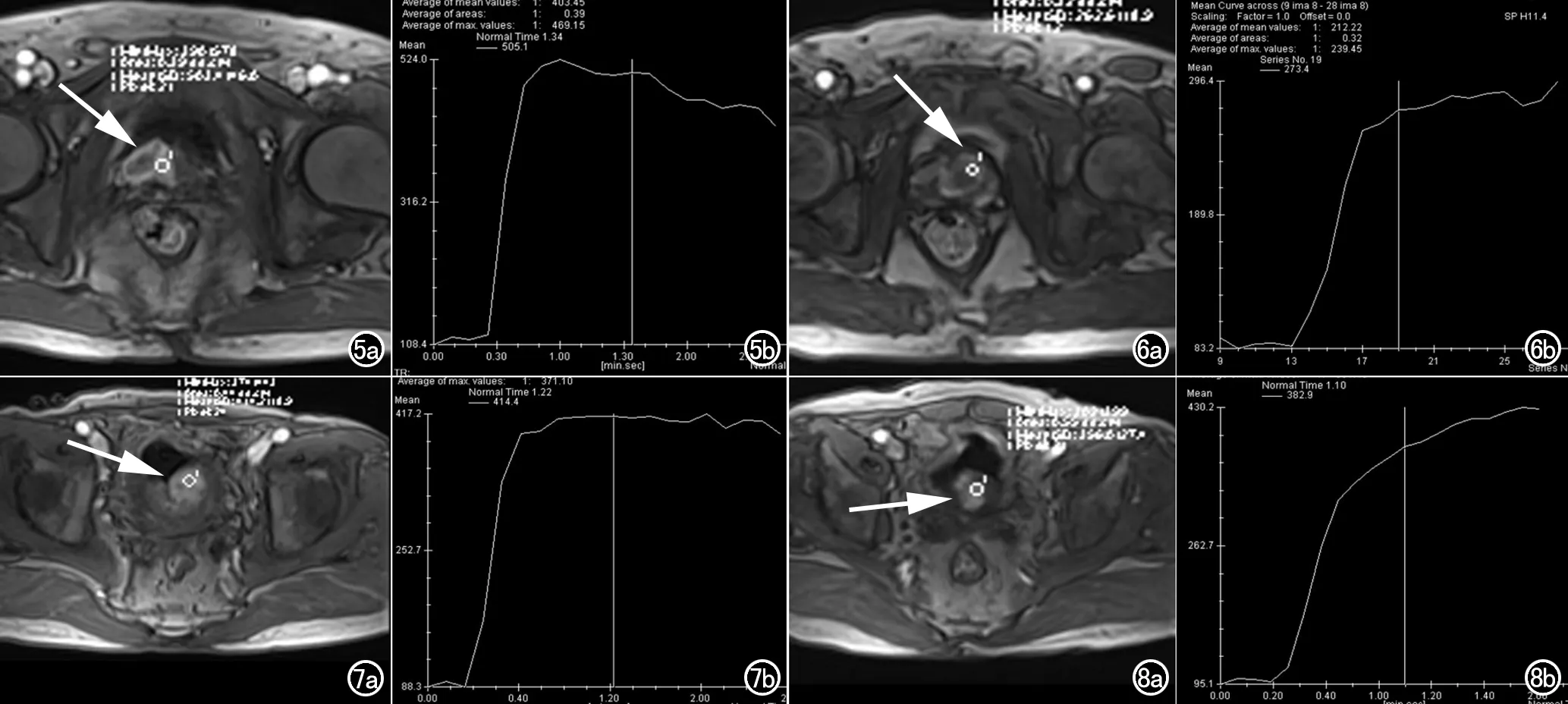
图5 男,80岁,中央叶前列腺癌。a) 动态增强扫描前列腺中央叶明显强化结节(箭); b) 动态增强扫描时间-信号曲线前列腺癌结节早期明显强化。 图6 男,69岁。a) 前列腺中央叶良性增生结节,增强扫描明显强化(箭); b) 动态增强扫描时间-信号曲线前列腺增生结节早期明显强化。 图7 男,69岁,中央叶前列腺癌。a) 前列腺中央叶低信号结节增强扫描周边环形强化(箭); b) 动态增强扫描时间-信号曲线呈平台型。 图8 男,78岁。a) 前列腺中央叶良性增生结节,增强扫描明显强化(箭); b) 动态增强扫描时间-信号曲线呈呈缓慢上升型。
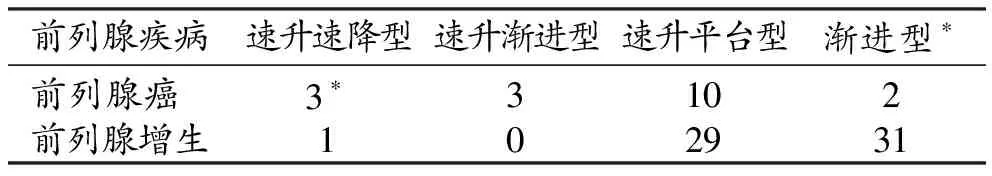
前列腺疾病速升速降型速升渐进型速升平台型渐进型∗前列腺癌3∗3102前列腺增生102931
注:总检验结果具有显著性差异(P<0.05),表示两两检验结果具有显著性差异。
讨 论
1.前列腺良恶性肿瘤发生概况
前列腺疾病在男性生殖泌尿系统中最常见,绝大多数40岁以上的男性患有前列腺增生,而前列腺癌是威胁中老年男性健康的常见肿瘤[2]。据报道在美国成年男性人群中前列腺癌发病率已超过肺癌,病死率仅次于肺癌成为首位危害男性健康的肿瘤[3]。前列腺癌起源于前列腺腺泡或导管上皮,且常常与前列腺增生伴随发生,可在前列腺增生结节基础上发生恶变。统计表明前列腺癌多位于外周带[4],仅25%~30%位于中央腺体,而中央腺体也是良性前列腺增生的发生部位。前列腺良、恶性病变临床症状没有特异性的不同表现,故影像学检查特别是MRI为最佳的方法。
年轻男性前列腺外周带占前列腺体积70%,包含前列腺大部分的腺体组织,70%前列腺癌源于外周带,移行带组成仅占前列腺体积的5%,为环绕尿道周围的前列腺组织,移行带是老年男性良性前列腺增生进而形成结节和肿块的部分。中央带组成占前列腺体积的25%,在前列腺底部包绕移行带,与周带相邻。中老年人前列腺增生实为移行带组织为主,因其体积增大,使外周带变薄,甚至成为包膜状,中央带也显示欠佳,所以中央腺体是用于描述组成前列腺的中央带和移行带区的名词[5]。
2.前列腺中央腺体T2WI低信号增生结节及癌结节的MRI特征
前列腺增生结节是在前列腺增生基础上出现的结节样改变,大部分出现在增生的中央腺体,小部分出现在外侧叶。孔祥田等[6]通过免疫组织化学的研究认为前列腺增生结节应分为间质结节、纤维腺性结节、纤维腺肌性结节、肌腺性结节和腺瘤性结节5类,是腺体与间质增生的不同组合形式。病理切片上前列腺增生结节是腺体和基质增生的混合物,结节内可出现囊性变,结节的周围可包绕致密的基质和萎缩的腺体。由于腺体增生肥大不均匀、囊变、腺体萎缩和纤维基质的局限性过度增生,形成了局限的突起,即前列腺增生结节[7,8]。其中间质结节及纤维腺性结节含纤维基质为主,腺体成分较少,其内液体含量低,故于T2WI上呈低信号表现;而发生在中央腺体的前列腺中央腺体癌区域内有大量紧密排列癌变的腺体组织,癌细胞排列致密,其间黏蛋白和液体的含量明显减少,因而在T2WI上也呈低信号表现,两者在T2WI上难以鉴别。
前列腺中央腺体的血液供应在生理学上远较外侧叶丰富。正常前列腺的血管来源广泛,主要为来自髂内动脉分支的膀胱下动脉,另外一些起源于盆腔和阴部动脉的血管分支也对前列腺起营养作用。供应动脉进入前列腺的位置可分为前列腺的底、体、尖3部分,其中从前列腺底部进入的血管最多,占所有供血动脉的76.1%[9]。从解剖结构上看前列腺中央叶呈锥形,位于前列腺基底部,近段尿道的后方,此区血管最丰富[9]。前列腺中央腺体强化高于外侧叶,这与此区的血管丰富有关。故中央腺体的癌结节和增生结节均可明显强化。MRI联合多序列扫描具有突出的优势,其中T2WI、DWI及多期动态增强序列为观察前列腺结构和病变的重要组成部分。高分辨率T2WI能显示结节的边缘、形态和信号强度。DWI反应细胞内外的水分子扩散运动,运用其量化参数有利于前列腺癌和非肿瘤组织进行鉴别[10]。动态增强DCE-MRI揭示活体前列腺的血液动力学,动态强化方式反映了前列腺各部分的血流变化[9],其生成的时间-信号强度曲线对疾病的鉴别诊断具有价值。
3.前列腺中央腺体T2WI低信号结节良恶性分析
本结果表明前列腺中央腺体的癌结节与增生结节在T2WI均为低信号;前列腺癌结节边缘不清楚,或部分包膜不完整,前列腺增生结节边缘清楚。本组61例增生结节中27例有完整包膜,17例有类似包膜样结构。统计学处理具有显著性的意义(P<0.05),说明前列腺癌与非肿瘤性良性病变的生长方式不同,呈浸润性或侵袭性生长,表现为恶性肿瘤的特征;前列腺增生结节呈膨胀性生长,本研究中符合良性肿瘤的特征。在两组T2WI信号特征上,部分前列腺增生结节信号不均匀,可能是增生结节内含有一定量的腺体结构,而前列腺癌结节呈信号较均匀一致,虽然在统计学上无显著性差异,但可以作为参考征象。本研究的两组病例,前列腺癌结节和增生结节的信号强度不同,具有统计学意义(P<0.05),前列腺癌结节于DWI平均信号强度为60.6±10.7,明显高于增生结节(49.7±8.5);前列腺癌结节的ADC值为(0.83±0.18)×10-3mm2/s,明显低于增生结节,其ADC值为(1.17±0.24)×10-3mm2/s。说明恶性肿瘤的水分子弥散受限较非肿瘤性结节明显。但是研究中有6例增生结节的平均ADC值为0.729,测值上与前列腺癌灶存在重叠,在对两组病例的多期增强观察中,本研究结果为前列腺中央腺体癌结节与增生结节均可出现早期强化(表现为13例癌结节及30例增生结节),两者平均最大信号强度相仿,两组间部分存在重叠,无显著性差异(P>0.05)。前列腺癌DCE时间-信号强度曲线以速升速降型、速升平台型为主,提示肿瘤有大量不成熟的微血管生成,微血管系统的通透性高,对比剂进入肿瘤组织快且多,故表现为早期明显强化;同时血管内外以及血浆与细胞外间隙的对比剂浓度的差别促使对比剂通过血管壁进行转移,这可能是部分肿瘤快速消退的原因[11]。基于中央腺体自身解剖结构,中央腺体的增生结节血供很丰富,其达峰时间也很快,并且有着更长的达峰时间和更强的峰值强度,主要是增生结节内主要为血管和纤维组织,DCE曲线表现为速升平台型或缓慢上升型。从以上多期动态增强时间-信号强度曲线看速升速降型高度提示前列腺癌,而渐进上升型提示为增生结节。前列腺癌组织具有较高的微血管密度,微血管密度增加在良性前列腺增生及前列腺高级别上皮内瘤样变中也常见,前列腺癌及良性前列腺增生存在一定重叠[12],故此其他类型的时间-信号强度曲线在良、恶性之间重叠。
2010年美国学者Oto等[13]报道了DWI结合动态增强检查的方法来研究中央带前列腺癌诊断以及与增生的鉴别方法,其研究结果显示中央带前列腺癌表现为T2WI均匀低信号,DWI高信号,瘤灶边界不清,形态不规则,无包膜,ADC值平均为1.05×10-3mm2/s (95%可信区间为0.97 ~1.11×10-3mm2/s),并且与中央带增生结节的ADC值差异有统计学意义,与本研究结果较一致。到目前为止大部分研究者得到的前列腺癌组织的ADC值和非癌组织间存在不同程度重叠[14,15]。但Tanimoto等[16]所获得的癌组织与非癌组织ADC值没有明显重叠。而本研究中前列腺癌DCE曲线以速升速降型为主,前列腺增生DCE曲线测多表现为速升平台型或缓慢上升型,与国内学者[12,17,18]相一致。
对于前列腺中央腺体癌结节与前列腺增生难以定性和鉴别,MRI联合多序列成像具有价值,通过观察病灶的边缘、信号,结合DWI和多期动态增强及其量化参数分析,能提高诊断与鉴别诊断能力。Kurhanewicz等[19]提出前列腺癌最好的定性方法是联合应用3.0T MR上各项参数资料,即整合常规MRI、弥散、波谱及动态增强的结果。值得提出的是前列腺中央腺体癌结节和前列腺增生结节在上述序列中有一定的重叠,但根据结节的边缘、信号表现、DWI的信号强度及ADC值、多期动态增强等进行综合性分析,具有临床意义。本研究不足之处为中央前列腺癌结节例数偏少,与增生结节样本数差别较大,手术和穿刺获得的组织病理的准确性有待提高,对两组的观察指标部分重叠的解释不够透彻。例如,前列腺癌常与前列腺增生并存,癌结节病理分化多样,增生结节组织成分变化复杂,正确诊断仍具有较大的难度。在本次研究中,有6例前列腺增生MRI表现与前列腺癌极为相似,通过以上鉴别诊断方法未能作出鉴别诊断。因此,对于前列腺中央腺体病变仍需要进一步的研究和探索。本作者将使用大切片、大样本进一步做相关研究。
[1] 林艳端,申锷,胡兵.低频超声联合微泡对比剂开放血-前列腺屏障的研究进展[J].中华临床医师杂志(电子版),2013,7(14) :6626-6627.
[2] 韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330-334.
[3] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[4] 叶定伟,沈益君.应重视前列腺癌根治术后并发症的防治[J].中华医学杂志,2011,91(32):2233-2235.
[5] Sicklerman ES.Magnetic resonance imaging of the prostate[J].Seminars in Roentgenology,1999,34(4):295-312.
[6] 孔详田,曾荔,夏同礼,等.良性前列腺增生中间质结节的免疫组织化学观察[J].中华医学杂志,1999,79(2):153-154.
[7] Van de Voorde wM,Oyen RH,Van Poppel HP,et al.PeripheralIy localijzed benjgn hyperpastic nodules of the prostale[J].Mode Pathol,1995,8(1):46-50.
[8] 侯仲军,吴锡标,刘建平,等.前列腺增生结节的MR动态增强研究[J].实用放射学杂志,2005,21(2):178-181.
[9] 高文彬,孙兆忠,施利国,等.前列腺动脉的应用解剖[J].中国临床解剖杂志,1995,13(1):40-42.
[10] 叶锦棠,蔡文超,王岳,等.体素不相干运动扩散加权成像对前列腺癌的诊断价值[J].放射学实践,2014,29(5):474-476.
[11] 史浩,武乐斌,宁红宇,等.MR动态增强扩散成像和波谱分析在前列腺癌诊断中的价值[J].中华放射学杂志,2006,7(40):678-683.
[12] 景国东,汪剑,陈录广,等.3.0T动态增强MRI在前列腺癌诊断中的价值[J].放射学实践,2014,29(5):482-496.
[13] Oto A,Kayhan A,Jiang Y,et al.Prostate cancer:differentiation,of central gland cancer from benign prostatic hyperplasia by using diffusion-weighted and dynamic contrast-enhanced MR imaging[J].Radiology,2010,257(3):715-723.
[14] 李飞宇,王霄英,许玉峰,等.良性前列腺增生的ADC值定量分析[J].实用放射学杂志,2007,2(2):661-664.
[15] 王希明,白人驹,赵新,等.扩散加权成像鉴别前列腺癌及良性前列腺增生的价值[J].中华放射学杂志,2006,40(7):690-694.
[16] Tanimoto A,Nakashima J,Kohno H,et al.Prostate cancer screening:the clinical value of diffusion-weighted imaging and dynamic MR imaging in combination with T2-weighted imaging[J].J Magnetic resonance Imaging,2007,25(1):146-152.
[17] 袁宪顺,修建军,宁国庆,等.表观扩散系数和MR动态增强对前列腺中央腺体疾病的价值[J].医学影像学杂志,2012,22(4):639-642.
[18] 苗华,栋张,长萃,等.3T VIBE动态增强在鉴别前列腺良恶性病变中的应用[J].Chin Comput Med Imag,2013,19(4):342-345.
[19] Kurhanewicz J,Vigneron DB,Carroll P, et al.Multiparametric magnetic resonance imaging in prostate cancer:present and future[J].Current Opinion in Urology,2008,18(1):71-77.
TheMRIanalysisofbenignandmalignantlowsignalnodesonT2WIinthecentralglandofprostate
YE Rui-ting,ZOU Yu-jian,ZHENG Xiao-lin,et al.
Radiological Department,Dongguan People's Hospital,Dongguan City,Guangdong 523000,China
Objective: To explore MRI manifestations of benign and malignant low signal nodes on T2WI in the central gland of prostate to improve the ability of differential diagnosis.Methods19 patients with prostate carcinomas and 61 with prostate hyperplasia in accordance with inclusion criteria confirmed by histopathology underwent multi-sequences MRI scans.The signal intensity and margin on T2WI,signal intensity and ADC value on DWI,maximal signal intensity and type of time-signal intensity curve were compared between prostate carcinomas and hyperplasia.Results19 prostate carcinomas on T2WI showed that margins of nodes were unclear in 16 cases and clear in 3 cases with homogeneous low signal intensity.61 prostate hyperplasia nodes on T2WI showed that the margins were unclear in 34 cases,clear in 27 cases and the signal of 30 nodes were homogeneous,of 31 nodes were inhomogeneous.There was statistical significance in T2WI manifestations (P=0.007) between carcinoma and hyperplasia.On DWI (b=1000s/mm2),signal intensity of prostate carcinomas was 60.6±10.7 which was higher than that of hyperplasia nodes (49.7±8.5)(t=-5.793,P=0.00).ADC value of prostate carcinomas was (0.83±0.18)×10-3mm2/s,which was lower than that of hyperplasia nodes (1.17±0.24mm2/s)(t=0.460,P=0.00).In multi-phase DCE,maximal signal intensity of prostate carcinomas was 385.60±108.27,and that of hyperplasia nodes was 393.21±111.28 (t=-0.270,P=0.788).There was no significant difference between prostate carcinomas and hyperplasia.The time-signal intensity curve types of prostate carcinomas were mainly rapid rising-and rapid dropping,curve types of hyperplasia nodes were mainly rapid rising-plateau and gradual rising.There was statistical difference in signal intensity curve types between carcinoma and hyperplasia (P=0.00),especially in rapid rising-rapid dropping and gradual rising curve types.ConclusionIn low signal nodes on T2WI in central gland of prostate,the margin and signal homogeneity on T2WI,signal intensity and ADC values on DWI,the time-signal intensity curve types were different between prostate carcinomas nodes and hyperplasia nodes.So MRI multi-sequences imaging was helpful for differential diagnosis between benign and malignant low signal nodes on T2WI in the central gland of prostate.
Prostatic neoplasms; Prostatic hyperplasia; Magnetic resonance imaging
R697.32; R737.25; R445.2
A
1000-0313(2017)10-1041-06
2016-10-09
2017-03-06)
523059 广东,东莞市人民医院放射科
叶瑞婷(1983-),女,广东东莞人,主治医师,主要从事CT/MR及腹部影像诊断工作。
郑晓林,E-mail:dgzhengxl@yahoo.com.cn
10.13609/j.cnki.1000-0313.2017.10.010

