低氧复合运动抑制低氧诱导的骨骼肌NLRP3炎性小体活化
张子怡 薄海 杨爽 王天添 袁瑶 张勇
1天津体育学院天津市运动生理学与运动医学重点实验室(天津 300381)
2武警后勤学院军事训练医学教研室(天津 300309)
低氧(hypoxia)是呼吸系统疾病、心血管疾病、血液疾病、高原病等的重要病理表征,表现为细胞氧供应不足或氧利用障碍。骨骼肌是机体主要的氧利用器官。研究表明,长期低氧暴露造成骨骼肌肌纤维横截面积减小,收缩耐受性和肌力降低,严重影响机体作业能力和生活质量[1]。探讨低氧损伤骨骼肌的病理机制及有效防护措施具有重要意义。研究表明,低氧环境下中等强度的运动训练,即低氧复合运动(exercise train⁃ing in hypoxia)可有效抑制低氧诱导的骨骼肌蛋白降解和细胞凋亡,促进毛细血管生成以提高低氧状态下肌肉组织的氧气供应[2]。
炎症反应是低氧损伤的重要病理机制之一[3]。NL⁃RP3炎性小体(NLRP3 inflammasome)是机体固有免疫系统的重要成员,由识别蛋白NOD样受体、衔接蛋白凋亡相关斑点样蛋白(ASC)和效应蛋白天冬氨酸特异性半胱氨酸蛋白酶-1(caspase-1)共同组成。NOD样受体识别应激源后聚集为NLRP3寡聚体,通过ASC募集并激活caspase-1,活化的caspase-1切割炎症因子白介素1-β(IL⁃1β),使之成熟以参与炎症反应[4]。研究表明,低氧状态下骨骼肌NLRP3炎性小体活性及其调控的IL-1β含量明显升高[5]。提示NLRP3炎性小体活化是机体应答低氧的重要环节。
研究表明,线粒体功能障碍产生高水平活性氧(ROS)是NLRP3炎性小体活化的重要因素[6]。人红细胞衍生核因子2样蛋白2(Nrf2)是细胞中应答氧化应激,并调控抗氧化酶系表达的重要转录因子[7]。研究表明,上调Nrf2[8]或抑制NLRP3炎性小体活化[9]均可有效减轻细胞缺血/缺氧损伤。但Nrf2是否参与NLRP3炎性小体对低氧的应答尚不清楚。我们前期证明,低氧复合运动可有效改善低氧状态下骨骼肌线粒体质量,同时上调抗氧化酶表达[10]。本研究观察低氧复合运动是否能抑制低氧诱导的NLRP3炎性小体活化,并探讨Nrf2在其间的生物角色。
1 材料与方法
1.1 动物分组与干预方案
32只健康雄性Sprague-Dawley大鼠,体重201~233 g,随机分为4组:常氧组(normoxia control group,NC)、常氧运动组(normoxia and exercise training group,NT)、低氧组(hypoxia control group,HC)和低氧复合运动组(hypoxia and exercise training group,HT),每组8只。HC组和HT组进行低氧暴露干预,参照本组前期工作[10],将大鼠饲养于常压低氧帐篷,氧气浓度设置为11.3%,正常进食进水,光照12 h/d,持续4周。HT组大鼠每日一次置于低氧帐篷内,小动物跑台中行跑台训练(5°,15 m/min),1 h/d,5 d/w,持续4周。NC和NT组大鼠于常氧帐篷内饲养,NT组大鼠于常氧帐篷内小动物跑台训练,训练方案同HT组。各组大鼠末次低氧后即刻断头处死,组织剪分离双侧股四头肌,单侧肌肉在动物处死1 h内提取线粒体,另一侧肌肉于-80℃冻存,用于Caspase-1活性、IL-1β含量和蛋白表达检测。
1.2 检测方法
1.2.1 线粒体ROS产生速率测定
参照本组前期工作[11],采用差速离心法纯化线粒体,考马斯亮蓝法测定样品蛋白浓度。0.5 mg线粒体加入反应介质中,加入5 mmol/L苹果酸和10 mmol/L谷氨酸启动线粒体态2呼吸,再加入5 μmol/L还原型二氯荧光素,37℃避光水浴15 min,充分反应后置于荧光分光光度计(激发波长499 nm,发射波长521 nm)连续检测10 min,计算线粒体ROS产生速率。
1.2.2 线粒体DNA中8-oxodG含量测定
严格按照试剂盒(Biovision)说明书纯化mtDNA。参照我们前期工作[12],高效液相色谱法检测线粒体DNA中8-oxodG含量。采用粒径为4 μm的C18反相色谱柱(250 mm×4.6 mm),流动相使用用10 mM醋酸,30 mM氢氧化钠,12.5 mM柠檬酸,25 mM醋酸钠,6%甲醇,流速0.8 mL/min,测量波长为260 nm。试剂盒内8-oxodG标准品制备标准液,同等条件下绘制标准曲线。换算样品中8-oxodG含量。
1.2.3 骨骼肌Caspase-1活性测定
500 mg骨骼肌组织置于组织裂解液(0.1 mmol/L十二烷基硫酸钠、0.5 mmol/L鹅去氧胆酸钠、10 μmol/L抑酞酶和5 μmol/L苯甲基磺酰氟化物),裂解1 h后离心(8000 r/min),收集上清,考马斯亮蓝法检测蛋白浓度。取200 μg样品蛋白加入50 μL反应介质(组织裂解液+1mmol/L YVAD-AFC),避光反应1 h,终产物于微量荧光酶标仪检测。NC组Caspase-1活性定义为1,NT、HC、HT组Caspase-1活性为与NC组比较的相对活性。
1.2.4 骨骼肌IL-1β 含量测定
采用ELISA法检测。严格按照大鼠IL-1β定量酶联检测试剂盒说明书操作,于微量荧光酶标仪检测各组骨骼肌IL-1β含量。
1.2.5 Western blot法检测NLRP3、ASC、Nrf2和NQO 1蛋白表达
以β-actin为内参。将骨骼肌组织匀浆根据浓度不同加入SDS上样缓冲液加热处理5 min。10 μg蛋白样品经SDS-PAGE电泳分离后,湿转于PVDF膜上。1∶2000对应一抗孵育过夜,漂洗后用辣根过氧化物酶标记的二抗孵育1 h,充分漂洗后用荧光显色试剂盒显影,X-ray胶片曝光记录,扫描各条带灰度值。NC组条带灰度值定义为100%,NT、HC和HT组为与NC组比较的相对表达量。
1.3 统计学分析
数据用均数±标准差(±s)表示,使用SPSS 13.0统计软件中双因素方差分析进行组间比较,P<0.05定义为差异有显著性意义。
2 结果
2.1 线粒体DNA中8-oxodG含量和ROS产生速率
HC组线粒体DNA中8-oxodG含量显著高于NC组(P<0.01),HT与HC组线粒体ROS产生速率显著高于NC组(P<0.05,P<0.01)。HT组线粒体DNA中8-oxodG含量及ROS产生速率显著低于HC组(P<0.01)(表1)。

表1 各组线粒体DNA中8-oxodG含量及ROS产生速率的变化
2.2 骨骼肌NLRP3和ASC蛋白表达
HT与HC组骨骼肌NLRP3蛋白表达显著高于NC组(P<0.05,P<0.01),HC组ASC蛋白表达显著高于NC组(P<0.01)。HT组NLRP3和ASC蛋白表达均显著低于HC组(P<0.05,P<0.01)(图1)。
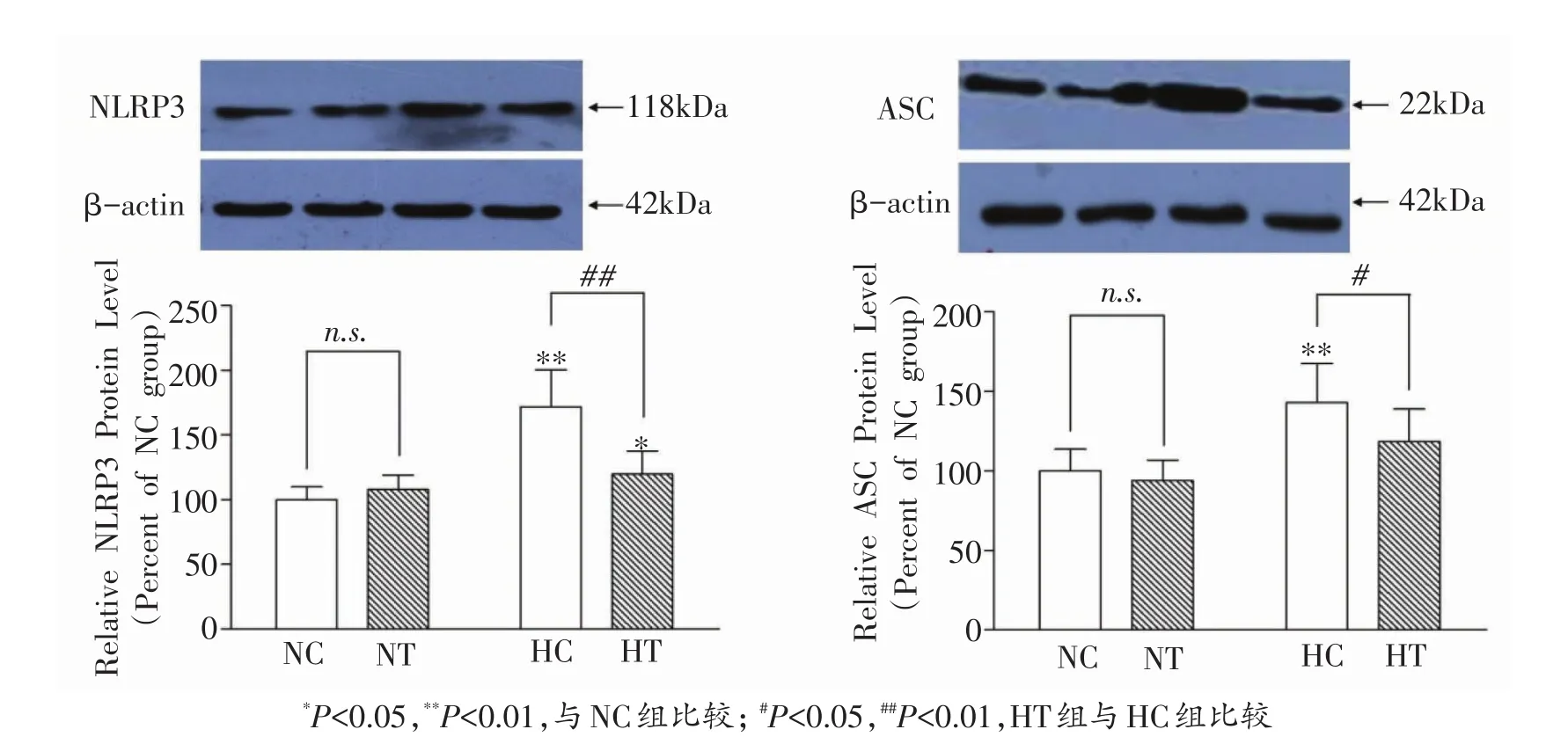
图1 各组骨骼肌NLRP3和ASC蛋白表达的变化
2.3 骨骼肌Caspase-1活性和IL-1β 含量
HC组骨骼肌Caspase-1活性显著高于NC组(P<0.01),HT与HC组IL-1β含量显著高于NC组(P<0.05,P<0.01)。HT组Caspase-1活性和IL-1β含量均显著低于HC组(P<0.05,P<0.01)(表2)。
2.4 骨骼肌Nrf2和NQO1蛋白表达
HC组骨骼肌Nrf2和NQO1蛋白表达均显著低于NC组(P<0.05,P<0.01)。HT组Nrf2和NQO1蛋白表达均显著高于HC组(P<0.01)(图2)。
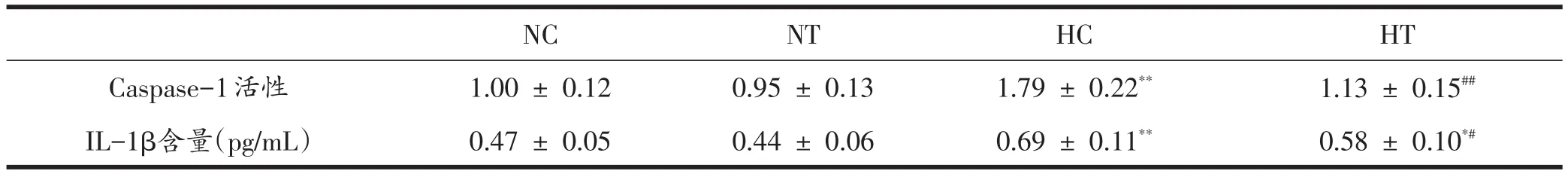
表2 各组骨骼肌Caspase-1活性和IL-1β含量的变化
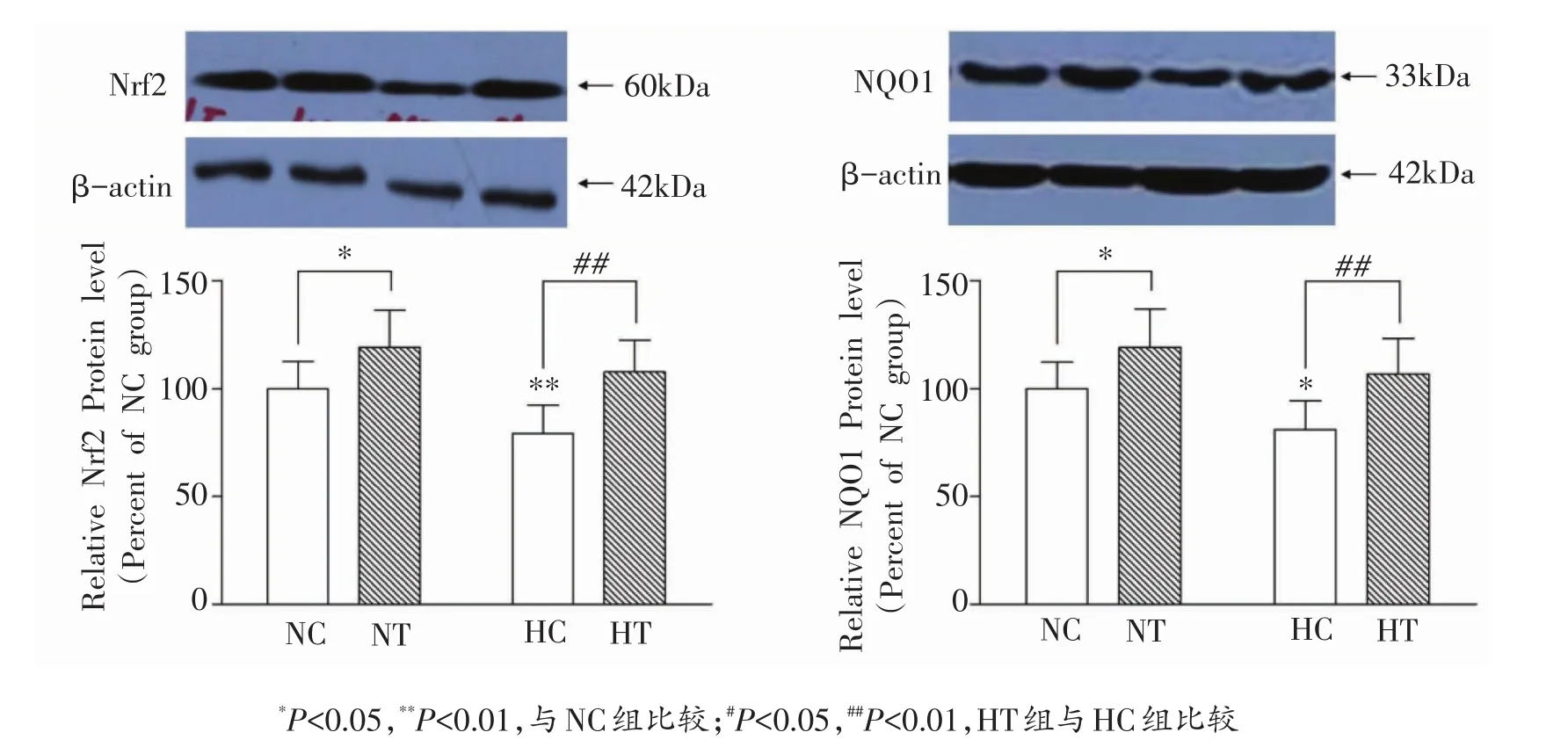
图2 各组骨骼肌Nrf2和NQO1蛋白表达的变化
3 讨论
作为细胞固有免疫的重要组分,NLRP3炎性小体活化是抵御病原微生物等危险因素侵袭的关键环节。但过度且持续的NLRP3炎性小体活化参与糖尿病、肿瘤等一系列疾病发生[4]。本研究中4周低氧暴露明显活化大鼠骨骼肌NLRP3炎性小体,表现为NLRP3炎性小体的三个关键组分NLRP3、ASC和caspase-1蛋白表达增加,同时caspase-1活性及IL-1β含量升高。研究表明,IL-1β可通过活化泛素-蛋白酶体途径参与低氧状态下骨骼肌蛋白降解,导致肌肉萎缩。此外,IL-1β刺激其它细胞因子和趋化因子释放,诱导组织炎性细胞浸润,进一步加重骨骼肌损伤[13]。Cero等[14]报道,低氧暴露下,衔接蛋白ASC敲除小鼠肺动脉平滑肌受损程度显著低于野生型小鼠。以上提示,NLRP3炎性小体活化介导的炎症反应是骨骼肌低氧损伤的病理机制之一。
本研究中,4周低氧复合运动明显抑制了低氧诱导的骨骼肌NLRP3炎性小体活化。Wang等[15]在抑郁症模型小鼠中也发现,4周有氧耐力训练显著抑制海马组织NLRP3炎性小体活化。以上提示,运动训练可在病理状态下通过调控NLRP3炎性小体抑制炎性损伤。所有的NLRP3炎性小体活化因子,如Toll样受体激活物、炎性因子、组织蛋白酶等,均可诱导ROS大量产生[4]。这表明ROS在NLRP3炎性小体活化中的关键作用。研究表明,线粒体自噬障碍导致受损线粒体积累,产生过量ROS并激活NLRP3炎性小体[6]。此外,Oka等[16]报道,mtDNA氧化损伤后可从受损线粒体中释放,直接结合并激活NLRP3炎性小体。本研究中,低氧复合运动明显降低了低氧诱导的骨骼肌线粒体ROS产量和mtD⁃NA中8-oxodG含量。以上提示,低氧复合运动可通过抑制ROS产生及mtDNA氧化损伤,下调低氧状态下NLRP3炎性小体活化水平。
线粒体ROS的量由其产生能力和抗氧化酶系清除能力共同决定。Nrf2与其负调节蛋白Keap1结合而处于无活性状态,ROS或亲电子物质促进Nrf2与Keap1脱偶联,转位入细胞核与DNA中抗氧化反应元件(ARE)结合,调控血红素氧化酶1(HO-1)、超氧化物歧化酶(SOD)、醌氧化还原酶1(NQO1)等一系列抗氧化酶的表达[7]。本研究中,4周低氧暴露显著抑制骨骼肌Nrf2及其下游NQO1的表达。Shimizu等[17]报道,缺血早期心肌Nrf2表达迅速上调,但随着缺血时间的延长,Nrf2表达逐渐降低。ROS是Nrf2活化的启动因素,但持续高水平氧化应激会活化胞核抑制因子Bach1,竞争性抑制Nrf2与ARE基因结合[18]。此外,前列腺素F2α参与调控Nrf2的泛素化和降解[19]。而慢性低氧上调骨骼肌前列腺素F2α表达[20]。这可能是长期低氧抑制骨骼肌Nrf2表达及转录活性的机制之一。
本研究中,低氧复合运动抑制了低氧对骨骼肌Nrf2及其下游NQO1的下调效应,这与ROS和NLRP3炎性小体的变化趋势一致。Liu等[21]报道,在腹膜炎模型中,Nrf2-/-小鼠巨噬细胞ROS产生增加,同时NLRP3炎性小体活化水平及IL-1β含量显著高于野生型小鼠。证明Nrf2参与对NLRP3炎性小体的调控。他们还发现,Nrf2-/-小鼠给予抗氧化剂TBHQ灌胃,NLRP3炎性小体活性被抑制,而ARE相关抗氧化酶中仅NQO1表达升高[21]。表明NQO1清除过量ROS是Nrf2调控NLRP3炎性小体的关键环节。此外,Nrf2可与p62直接结合以上调线粒体自噬,参与线粒体质量控制[22]。我们前期证明低氧复合运动可提高骨骼肌PINK1和Bnip3介导的线粒体自噬[11]。以上表明Nrf2参与了低氧复合运动对NLRP3炎性小体的抑制效应。
4 总结
低氧复合运动可上调Nrf2表达,并至少通过两条途径减少低氧诱导NLRP3炎性小体活化的因素,降低骨骼肌炎性反应:1)提高线粒体健康水平以抑制ROS产生;2)上调抗氧化酶NQO1等抗氧化酶表达,增加ROS清除能力,并抑制线粒体DNA氧化损伤。

