不同时间一次有氧运动对小鼠骨骼肌Nrf2与Keap1结合作用的影响
姬卫秀 毛雅芸 王林佳 罗琳 张缨
北京体育大学(北京 100084)
NF-E2相关因子(NF-E2-related factor 2,Nrf2)是细胞氧化应激反应中的关键转录因子,可调节靶基因Ⅱ相解毒酶和抗氧化酶基因的表达[1,2]。在生理状态下,Nrf2与Kelch样环氧氯丙烷相关蛋白-1(Kelchlike ECH-associated protein-1,Keapl)耦联,被锚定于胞浆中,并通过泛素化介导Nrf2蛋白降解[3]。运动产生的活性氧(ROS)可激活Nrf2,使Nrf2与Keapl发生解偶联,并使其从细胞浆转位至细胞核与Maf蛋白形成杂化二聚体[4],而后与下游抗氧化靶基因DNA上的抗氧化元件(ARE)结合,启动其靶基因的转录[5,6]。
研究发现小鼠在急性运动后骨骼肌和心肌中的Nrf2-ARE结合活性增加[7,8]。年轻男性在急性运动后骨骼肌中Nrf2 mRNA水平也出现升高[9]。Horie等使用电脉冲刺激C2C12细胞模拟急性运动,发现Nrf2的表达增加,且与刺激的强度和持续时间密切相关[10]。我们在前期研究中发现,小鼠一次有氧运动1小时后,骨骼肌Nrf2-ARE结合活性和细胞核内Nrf2蛋白表达量无变化,而一次有氧运动6小时后两者均增加[11]。可见急性有氧运动增强小鼠骨骼肌Nrf2抗氧化信号也依赖于运动的持续时间,但其变化机制并不十分清楚。
因此,本研究在前期研究的基础上,以Nrf2与Ke⁃ap1的结合作用为切入点,进一步探讨不同时间一次有氧运动对小鼠骨骼肌Nrf2/Keap1结合量、Nrf2和Keap1总蛋白表达量、Nrf2核蛋白表达量以及ROS水平的影响,为运动介导Nrf2影响骨骼肌抗氧化作用的分子机制提供理论依据。
1 材料与方法
1.1 研究对象
健康8周龄C57BL/6J雄性小鼠(购于维通利华公司实验动物技术有限公司,动物合格证号:SCX-K(京)2009-0004,30只,体重18.37 ± 2.26 g,每笼3~4只,饲养于北京体育大学动物房,动物房温度保持在20~25°C,相对湿度保持在50%~70%,每天光照12 h(7:00~19:00),实验动物均自由进食和饮水。按体重随机分为3组,分别是安静对照组(0 h组)和一次有氧运动3小时组(3 h组)、一次有氧运动6小时组(6 h组),每组10只。
安静对照组正常饲养不做任何处理,运动组小鼠进行跑台运动,跑速为15 m/min(70%VO2max强度),坡度为0。运动时间分别为3小时、6小时。正式运动前进行2天的适应性运动。
1.2 取材
在运动组小鼠运动结束后即刻,所有组小鼠脱颈处死,迅速取两侧腿部骨骼肌(由于小鼠体型小,取腿部所有肌肉),用锡纸包裹标记,投于液氮,后转移至-80°C冰箱备后续之用。
1.3 指标测定
1.3.1 ROS测定
小鼠骨骼肌ROS的测定使用GENMED试剂盒(中国上海杰美基因医药科技有限公司,GMS10016.3),采用高质荧光进行测定。取100 mg组织进行实验,具体操作严格按照试剂盒的说明书进行。
1.3.2 提取蛋白
提取总蛋白,取100 mg组织,加入800 μl含蛋白酶抑制剂的RIPA蛋白裂解液,超声匀浆,冰上静置30 min,后12000 rpm,4°C离心30 min,取上清溶液即为总蛋白。
提取核蛋白,取100 mg组织,加入800 μl含蛋白酶抑制剂的蛋白裂解液A,超声匀浆,冰上静置10 min,振荡器震荡5 s,再于冰上静置10 min,震荡5 s,然后16000 rpm,4°C离心10 min,弃上清。加入含蛋白酶抑制剂的蛋白裂解液B,振荡器震荡振荡15 s,冰上静置10 min,交替进行,共振荡4次,静置40 min,然后16000 rpm,4°C离心10 min,取上清溶液即为核蛋白。
1.3.3 免疫共沉淀
采用免疫共沉淀法测组织总蛋白中Nrf2/Keap1的结合量。将1 ml蛋白浓度为1 μg/μl总蛋白加入到含20 μl Protein A/G Mix Magnetic Beads(美国 Millipore公司,LSKMAGAG02)的离心管中,4°C摇床2 h,将离心管放到磁力架(美国Millipore公司)上,转移上清;向上清中加入5 μl Keap1抗体(sc-33569,santacruz)(In⁃put中加入Nomal rabbit IgG),4°C摇床过夜;次日加入30 μl Protein A/G Mix Magnetic Beads,室温摇床 2 h,弃上清,PBS清洗3次,加35 μl上样缓冲液洗脱,70°C水浴10 min,转移上清液,重复洗脱第二遍,共吸出上清液70 μl。用Bolt 4%~12%Bis-Tris Plus凝胶(美国life technologies公司)上样30 μl进行电泳。之后采用美国Invitrogen公司的iBlot 2将蛋白从电泳凝胶转移至NC膜上。目的条带标记后用5%的脱脂牛奶或BSA封闭1小时后,加入一抗稀释液Nrf2(ab62352,1:200)于4°C摇床孵育过夜。次日洗脱一抗后加入相应二抗稀释液室温摇床孵育1小时。最后洗脱二抗后加发光液用BIO-RAD凝胶显影仪器进行显影。
1.3.4Western Blot
对提取的组织蛋白(总蛋白和核蛋白)进行BCA蛋白浓度测定(BCA Protein Assay Reagent,美国 Ther⁃mo Scientific公司),根据浓度计算配样,上样量为20μg。采用Bolt 4%~12%Bis-Tris Plus凝胶(美国life technologies公司)和NuPAGE MES SDS电泳缓冲液(美国life technologies公司)进行电泳。之后采用美国Invitrogen公司的iBlot 2将蛋白从电泳凝胶转移至NC膜上。目的条带标记后用5%的脱脂牛奶或BSA封闭1小时后,进行一抗孵育:Nrf2(ab62352,1︰200)、Keap1(sc-33569,1︰500)、总蛋白内参β-actin(sc-47778,1︰1000)、核蛋白内参H1(sc-1999,1︰1500),于4℃摇床孵育过夜。次日洗脱一抗后进行二抗孵育1小时:Nrf2(羊抗兔,中杉金桥,ZB-2301,1︰2000)、Ke⁃ap1(羊抗兔,中杉金桥,ZB-2301,1︰5000)、β-actin(羊抗鼠,中科晨宇,164017,1︰5000)、H1(羊抗鼠,中科晨宇,164017,1︰3000)。最后洗脱二抗后加发光液用BIO-RAD凝胶显影仪器进行显影,用其配套软件进行条带检测与分析。读取灰度值,计算结果,公式如下:

1.4 统计学分析
各实验结果用平均数±标准差表示,采用SPSS17.0软件对实验数据进行统计处理,数据分析方法为单因素方差分析,用P<0.05和P<0.01分别表示具有显著性和非常显著性差异。
2 结果
2.1 不同时间一次有氧运动对小鼠骨骼肌活性氧(ROS)水平的影响
由图1可知,与0 h组相比,3 h组小鼠骨骼肌ROS水平略有升高,但无统计学意义;6 h组小鼠骨骼肌ROS水平显著性升高(P<0.05)。3 h组和6 h组之间无显著差异。
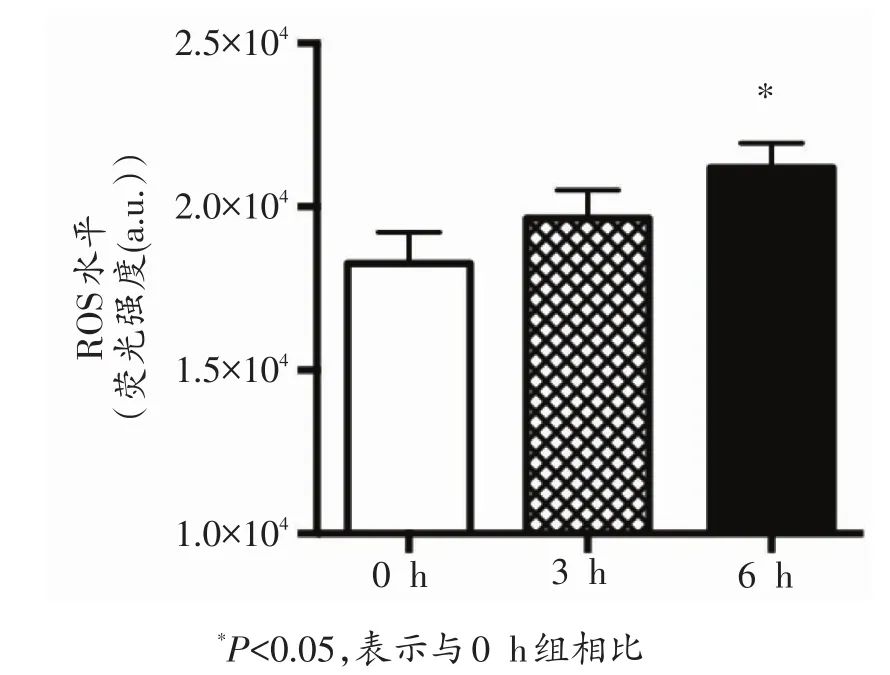
图1 各组小鼠骨骼肌ROS水平的变化
2.2 不同时间一次有氧运动对小鼠骨骼肌Nrf2/Keap/1结合量的影响
由图2可知,一次有氧运动3 h、6 h后小鼠骨骼肌Nrf2/Keap1结合量与0 h组比均显著降低(P<0.05),一次有氧运动两组之间没有显著性变化。
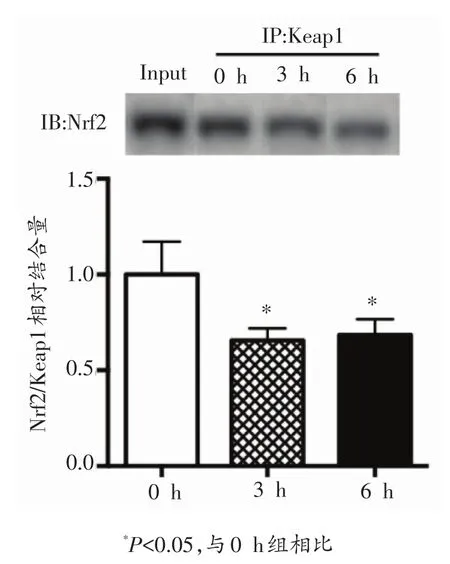
图2 各组小鼠骨骼肌Nrf2/Keap1结合量的变化
2.3 不同时间一次有氧运动对小鼠骨骼肌Nrf2总蛋白、核蛋白表达的影响
由图3可知,与0 h组相比,3 h组和6 h组小鼠骨骼肌Nrf2总蛋白表达出现显著性增加(P<0.05),而3 h组和6 h组之间无显著差异。6 h组小鼠骨骼肌Nrf2核蛋白表达与0 h、3 h组比均显著增加(P<0.05)。
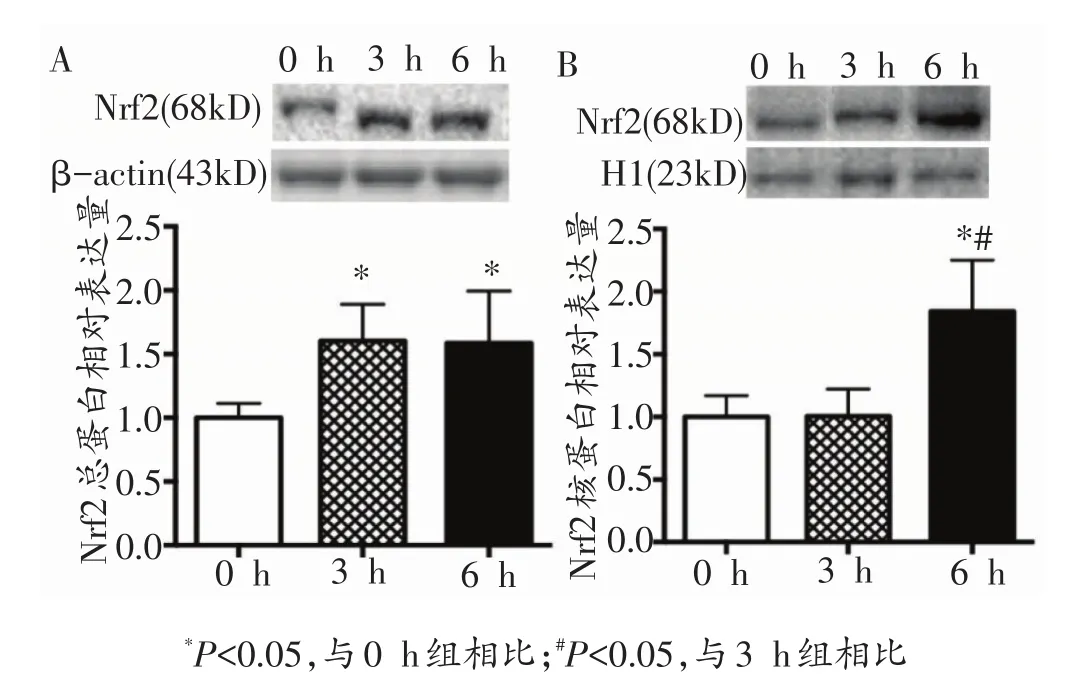
图3 各组小鼠骨骼肌Nrf2总蛋白、核蛋白表达量的变化
2.4 不同时间一次有氧运动对小鼠骨骼肌Keap 1总蛋白表达的影响
由图4可知,不同时间一次有氧运动后小鼠骨骼肌Keap1总蛋白表达基本无变化。
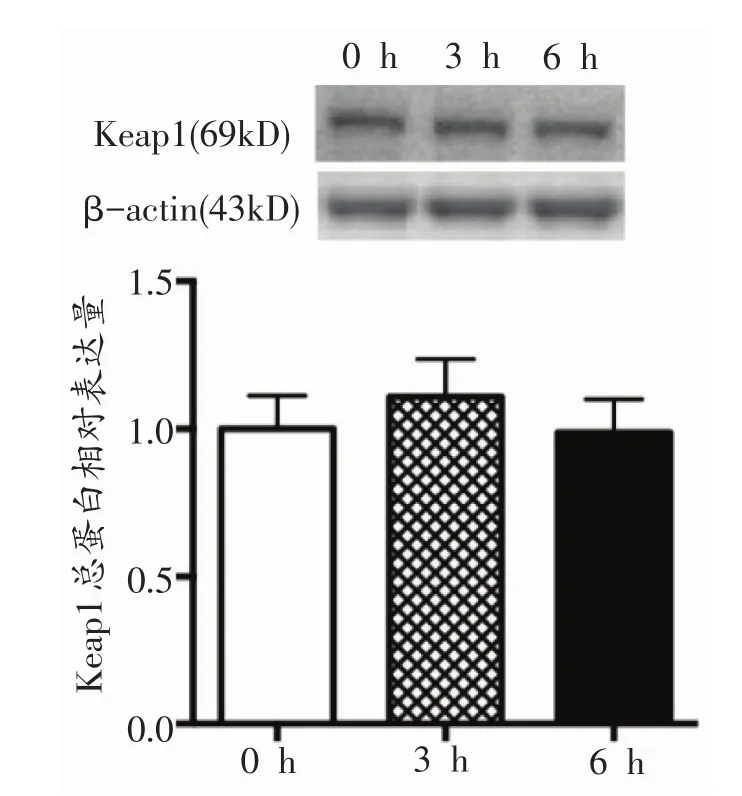
图4 各组小鼠骨骼肌Keap1总蛋白表达量的变化
3 讨论
3.1 不同时间一次有氧运动对小鼠骨骼肌ROS、Nrf2/Keap1结合作用和Nrf2总蛋白表达的影响
运动引起的氧化应激,可使骨骼肌产生过多的活性分子ROS。当生成的ROS超出骨骼肌的清除能力时,会造成氧化与抗氧化系统失衡,从而导致细胞损伤[12]。另一方面,ROS作为信号物质,它的浓度升高可激活Nrf2,促进其诱导的抗氧化酶的表达[13-15]。有研究报道,运动除了引起ROS水平升高外,还可引起活性氮(RNS)[16]、一氧化氮(NO)[17]、促炎性物质[18-20]等浓度的升高,同时研究发现这些物质也可激活Nrf2[17,21-23],进而参与抗氧化反应。在我们研究中发现,一次有氧运动3小时后小鼠骨骼肌ROS水平略有升高,但无统计学意义,这可能与我们选择的一次有氧运动的运动强度不高有关。但在该强度下运动6小时后小鼠骨骼肌ROS水平出现显著升高,说明运动持续时间的延长,增加了骨骼肌ROS的产生。
运动产生的ROS可促进原安静状态下细胞浆中的Nrf2/Keapl复合物产生解偶联作用,生成游离的Nrf2和Keap1[4,13]。已有动物实验表明,持续1小时以下的跑台运动,对Nrf2 mRNA和蛋白表达无显著影响[11,24,25]。我们前期的研究也发现1小时跑台跑运动后Nrf2-ARE结合活性和Nrf2蛋白表达未出现显著性变化[11]。因此,在本研究未对小鼠实施1小时一次有氧运动的观察。在我们的实验中一次有氧运动3小时和6小时后发现,与安静对照组(0 h)相比,小鼠骨骼肌的Nrf2/Ke⁃ap1结合量均出现显著降低,游离Nrf2总蛋白表达显著增加。说明运动应激促进Nrf2/Keapl的解绑作用,除了ROS的激活作用外,可能还有其他物质如RNS等的参与[10,16],但这仍需要进一步研究证实。
3.2 不同时间一次有氧运动对小鼠骨骼肌Keap 1总蛋白表达的影响
在细胞浆中Nrf2与Keapl发生解偶联作用,使游离Nrf2蛋白表达增多的同时,游离Keapl的量也会发生变化[11,26-28]。但在我们研究中却发现,3小时和6小时的不同时间一次有氧运动后小鼠骨骼肌的游离Keap1蛋白表达并无显著性变化。推测这可能与Baird提出的Ke⁃ap1与Nrf2的相互作用遵循“开放”和“闭合”不同构象的循环方式有关[29]。“开放”构象即为一个Nrf2分子结合一个Keap1分子,而“闭合”构象则为一个Nrf2分子与一个Keap1二聚体结合(两个Keap1分子)。当机体受到氧化应激刺激时,处于安静“开放”构象状态的分子可被诱导呈现为“闭合”状态,从“开放”构象解绑释放出的Keap1分子又可重新结合到“闭合”构象,而游离Keap1的分子数量基本没有发生变化[29]。另外,在我们之前的研究中也发现,四周间歇低氧和低氧训练可改变骨骼肌游离Nrf2的总蛋白表达量,但同时对游离Keap1蛋白表达无影响[30]。
3.3 不同时间一次有氧运动对小鼠骨骼肌Nrf 2转位入核的影响
通常,转录因子激活后,需从细胞浆中转移进入细胞核,识别与结合靶基因启动子上的顺式作用元件(一段DNA序列),进而启动和调控下游基因的mRNA表达。因此,Nrf2作为转录因子,也需进入细胞核与其靶基因上的ARE结合,从而发挥Nrf2的抗氧化转录活性[4]。在我们的研究中发现,小鼠一次有氧运动3小时和6小时后,虽然骨骼肌Nrf2总蛋白表达均显著增加,但其骨骼肌Nrf2核蛋白表达仅在6小时后显著升高,而3h组无显著变化。这说明Nrf2从细胞浆转移入核可能需要一定时间,会有一个延迟效应。但这仍需要进一步的实验验证。
4 结论
3小时和6小时的一次有氧运动可降低小鼠骨骼肌Nrf2与Keap1的结合作用,增加游离Nrf2总蛋白表达,且6小时的有氧运动促进Nrf2的转位入核。说明一次有氧运动对小鼠骨骼肌Nrf2与Keap1解绑和Nrf2转位入核的影响与运动时间的长短有关。

