衰老过程中有氧运动干预对海马突触可塑性及PDE-4基因表达的影响
张树玲 李雪 袁琼嘉 王璐
1成都体育学院运动医学与健康学院运动医学与健康研究所(四川成都 610041)
2成都体育学院运动医学与健康学院运动人体科学系(四川成都 610041)
1 引言
脑是机体最高调节中枢,神经系统由神经元借突触连接,并依赖突触来实现脑的调节功能。突触结构和功能的完整性是神经元获取、传递、加工分析、贮存信息的重要前提和保证。衰老可导致脑萎缩,表现为神经元及神经胶质细胞数量减少,形态、结构、组成、功能均发生改变;机体表现出学习记忆、分析、反应、判断、推理等能力减退[1]。有研究指出,虽然衰老大脑某些部位神经元已有不同程度的损伤,其功能却维持在一定的水平,提示可能存在一定程度的脑功能代偿,神经系统具有一定程度的可塑性,即神经元间有建立突触联系的能力。在这一过程中,突触对内外刺激极为敏感,其可塑性能力的改变对神经系统的功能影响重大。突触素(synaptophysin,Syp)是位于突触囊泡膜上的特异性蛋白质,是突触前终末的特异性标记物,可用于检测突触的数量及密度,是突触结构可塑性的重要标志之一[2]。代谢型谷氨酸受体(metabotropic gluta⁃mate receptor,mGluRs)与G蛋白偶联,参与胞内多种信使系统介导的慢突触传递[3]。其中,代谢型谷氨酸受体1(metabotropi glutamate receptor 1,mGluR1)可作为突触可塑性的代表性指标之一[4]。磷酸二酯酶-4(Phos-phodiesterase 4,PDE-4)是细胞内第二信使环腺苷酸(cyclic adenosine monophosphate,cAMP)特异性水解酶,可通过对cAMP信号转导的调控,改善认知记忆,维持和促进神经细胞的生存,阻断药物依赖的形成及抗抑郁等作用,进而改善脑功能障碍[5]。有关运动影响脑功能机制的研究主要包括神经发生、突触可塑性、树突棘密度和血管新生等[6]。运动对海马的积极作用可能是通过调节海马突触可塑性实现的,主要表现为提高海马DG区神经发生,增加树突棘密度,促进血管新生,特别是有助于长时程增强(long-term potentia⁃tion,LTP)等[7]。但是,关于有氧运动对衰老过程中大鼠海马Syp和mGluR1表达以及PDE-4基因的影响仍不清楚。本研究通过成功建立D-半乳糖衰老动物模型,并在建模过程中对大鼠进行中等负荷有氧运动干预,观察大鼠衰老过程中进行有氧运动干预对海马突触可塑性及PDE-4基因表达影响,分析指标变化之间的相互关系及可能作用机制。
2 材料与方法
2.1 动物建模及取材
成年3月龄雄性SPF级SD大鼠45只,体重400±20 g,购于成都达硕生物有限公司[生产许可证号:CSXK(川)2008-24]。大鼠分笼饲养,自由饮食。室温24±2℃,相对湿度45%~60%,国家标准啮齿类动物饲料喂养。适应性喂养1周后随机分为3组:对照组(C组,n=15)、D-半乳糖致衰老模型组(A组,n=15)、D-半乳糖致衰老+有氧运动干预组(AE组,n=15)。A组、AE组采用“腹腔注射D-半乳糖法”建立亚急性衰老动物模型,根据大鼠体重注射量为100 mg/kg/d[8(]D-半乳糖用生理盐水稀释成5%浓度,即浓度为2 ml/kg/d的D-半乳糖生理盐水溶液),C组大鼠则根据体重每天注射一次相同剂量的生理盐水,均连续注射6周。有氧运动干预方式采用中等负荷游泳运动[9],在自制透明的玻璃缸(160 cm×60 cm×110 cm)内进行,水深80 cm,水温34±2℃[8,9]。在建模过程中,AE组大鼠进行游泳运动(不负重),60 min/天,6天/周,为期6周,其余两组不进行游泳运动。实验结束后,大鼠断头取脑,用冰冷生理盐水漂洗,除去血液,冰上切割,剥离海马,分装入冻存管中,迅速投入液氮中保存备用。
2.2 指标检测
2.2.1 大鼠海马神经元尼氏染色
制备石蜡切片,依次进行二甲苯溶液Ⅰ脱水7 min,二甲苯溶液Ⅱ脱水7 min,梯度酒精溶液脱水2 min。之后于37℃恒温箱中2%硫瑾溶液染色8 min,流水冲洗5 min,90%酒精溶液脱色数秒(光学显微镜观察脱色情况以便控制时间,一般情况下酒精溶液浓度越低脱色越快),95%酒精溶液脱水1 min,再依次进行二甲苯溶液Ⅲ透明5 min,二甲苯溶液Ⅳ透明5 min,之后中性树胶封片,于显微镜下观察拍照。
2.2.2 大鼠海马Syp、mGluR 1免疫荧光检测
冰冻的海马组织切割成矢状切片(厚度约4 μm),室温至霜除(约5 min),于4℃下4%多聚甲醛固定10 min,室温PBS洗1 h,在37℃下孵育一抗2 h,4℃过夜,第2天在避光条件下,室温PBS洗1 h,在37℃下孵育二抗1 h,室温PBS洗1 h,DAPI溶液染核,室温PBS洗40 min,双蒸水洗10 min,90%甘油封片。利用激光共聚焦扫描显微镜采集图像,Image pro-plus软件进行图像处理分析,计算积分光密度(integral optical densi⁃ty,IOD值)。
2.2.3 大鼠海马PDE- 4基因Real Time-PCR 检测
采用Trizol法提取海马组织总RNA:取适量海马组织,样品按50~100 mg组织加入1 ml冰Trizol;利用分光光度计(Thermo Scientific NanoRop 2000)测定RNA含量,并估算其纯度及浓度;用2%琼脂糖凝胶分析总RNA的完整性;采用BIO-RAD iScriptTMcDNA Synthe⁃sis Kit试剂盒将RNA反转录成活性稳定的cDNA;采用SsoAdvancedTMSYBR®Green Supermix试剂盒进行Re⁃al-Time PCR扩增反应。由TaKaRa宝生物工程有限公司设计并合成引物序列:β-actin上游序列为5’-CgT AAA gAC CTC TAT gCC AAC A-3’,下游序列为5’-Tag gAg CCA ggg CAg TAA TC-3’,产物长度为99bp;PDE-4上游序列为5’-Agg AgA AAT CAg CgT Tgg AgA-3’,下游序列为5’-TTg Tag ATg gTg Agg gTA gAg gA-3’,产物长度为171 bp。反应结束后,先观察PDE-4和β-actin标准曲线的扩增效率是否接近100%,溶解曲线是否为单一峰以确定PCR的特异性。之后采用2-△△CT(Livak)的方法进行数据处理,比较各组间 PDE-4基因表达水平的差异性数据,由Bio-Rad CFX Manager system自动分析,生成数据及图像。
2.2.4 大鼠海马PDE- 4蛋白Western Blotting ting检测
取适量海马组织称重,按1 mg组织/20 μl裂解液比例加入RIPA裂解液(含PMSF)进行蛋白提取,严格按BCA蛋白浓度测试试剂盒说明书进行总蛋白浓度的测定;将上样缓冲液(2×loading Buffer)与蛋白质按1︰1的比例均匀混合,约在100℃水浴锅加热变性10 min,冷却分装,-20℃保存待用;进行SDS-PAGE凝胶电泳,将蛋白及marker转移至 PVDF膜,用5%脱脂奶粉室温下将PVDF膜封闭1 h,用同样浓度的脱脂奶粉溶液稀释一抗(ab9018,浓度1︰1000),4℃封闭过夜;第2天,室温TBST液洗8×5 min,用同样浓度的脱脂奶粉溶液稀释二抗(山羊抗小鼠lgG/辣根酶标志,浓度1︰2000),37℃封闭孵育2 h;之后室温TBST液洗8×5 min,进行AB显色;暗室内显影;将所得PDE-4和β-ac⁃tin胶片进行扫描,获得图片,再应用Quantity One分析软件上的条带轨迹,用定量分析方法(TraceTracking)对图片条带进行灰度值分析,将各组PDE-4与其β-ac⁃tin值相比,以比值作为目的蛋白表达量。
2.3 统计学方法
利用SPSS19.0统计软件进行数据分析,以±s表示结果。采用单因素方差分析(One-way ANOVA)进行组间比较,P<0.05表示差异性显著,P<0.01表示差异性非常显著;运用Spearman等级相关及Pearson积差相关判断各指标间的相关性。
3 结果
3.1 大鼠一般状态观察结果
C组大鼠精神良好、动作敏捷、食欲良好、体毛光泽、体形健硕等;A组大鼠精神不振、嗜睡、动作迟缓、无食欲、体毛枯黄卷曲、体形瘦弱等,呈现衰老体征;AE组大鼠精神状态、食欲情况、体毛颜色、体形等情况均与C组大鼠相似,未出现衰老体征。
3.2 大鼠海马神经元尼氏染色结果
各组大鼠海马神经元尼氏染色在40倍光镜下结果:C组大鼠海马神经元数量正常,排列整齐有序,细胞间距均匀,胞质中尼氏体着色匀称;A组大鼠海马神经元数量明显减少,排列紊乱,细胞间距增大,胞质中尼氏体着色变浅;AE组大鼠海马神经元数量、排列情况、细胞间距、胞质中尼氏体着色等情况与C组相似。见图1。
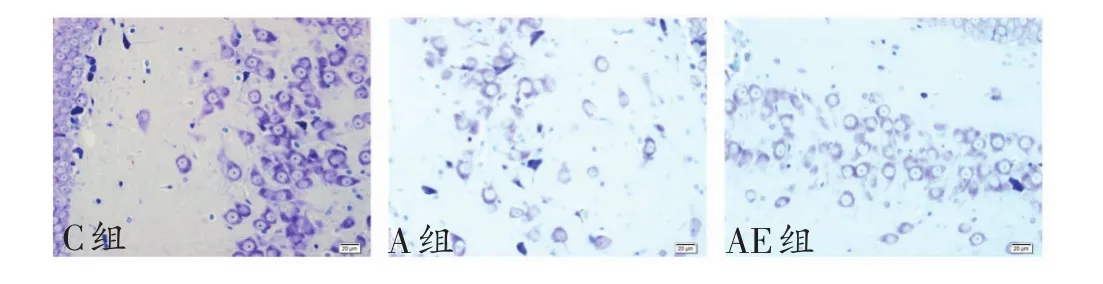
图1 各组大鼠海马DG区神经元尼氏染色
3.3 大鼠海马Syp、mGluRm1免疫荧光检测结果
3.3.1 大鼠海马Syp免疫荧光检测结果
大鼠海马Syp免疫荧光染色结果见图2。与C组比,A组大鼠海马Syp免疫荧光染色IOD值非常显著性降低(P<0.01);与A组比,AE组大鼠海马Syp免疫荧光染色IOD值非常显著性升高(P<0.01)。见表1。
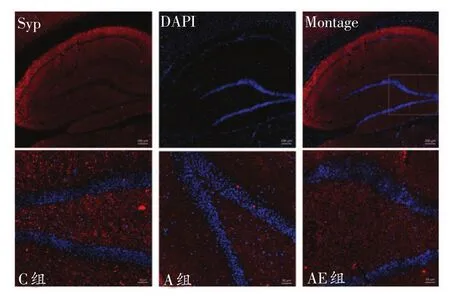
图2 各组大鼠海马DG区Syp免疫荧光染色结果
表1 各组大鼠海马Syp免疫荧光染色IOD值比较(±s)

表1 各组大鼠海马Syp免疫荧光染色IOD值比较(±s)
注:与C组比:▲▲P<0.01;与A组比:★★P<0.01
C组596.59±27.32 AE组589.18 ± 36.68★★A组422.34 ± 32.17▲▲
3.3.2 大鼠海马mGluR 1免疫荧光检测结果
大鼠海马mGluR1免疫荧光染色结果见图3。与C组比,A组大鼠海马mGluR1免疫荧光染色IOD值非常显著性降低(P<0.01);与 A 组比,AE组大鼠海马mGluR1免疫荧光染色IOD值非常显著性升高(P<0.01)。见表2。
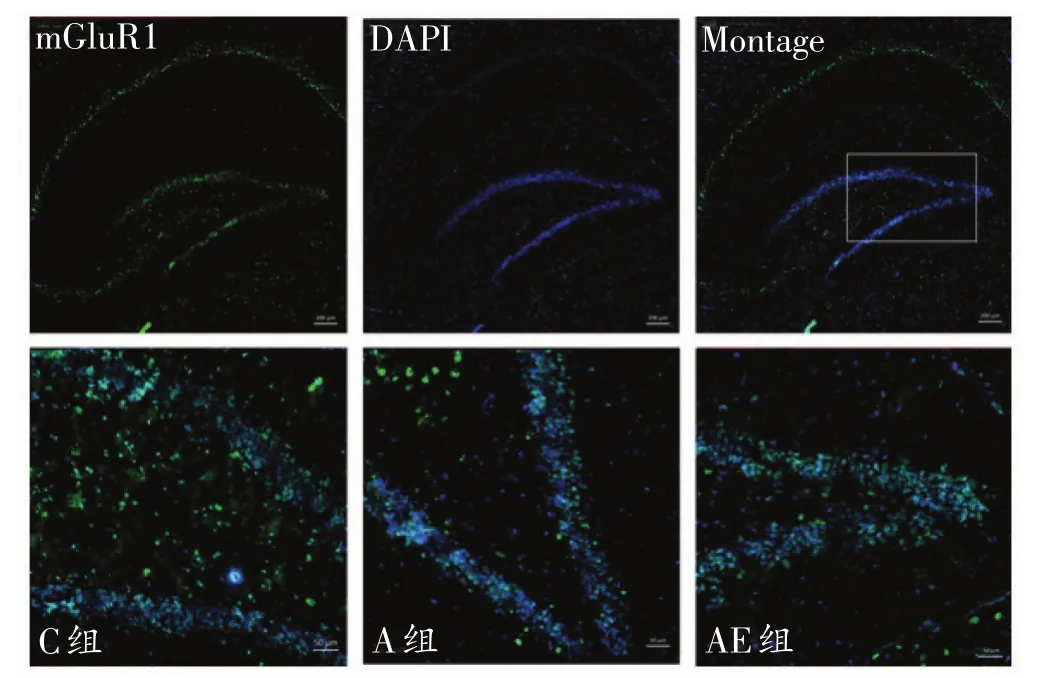
图3 各组大鼠海马DG区mGluR1免疫荧光染色结果
表2 大鼠海马mGluR1免疫荧光染色IOD值(±s)
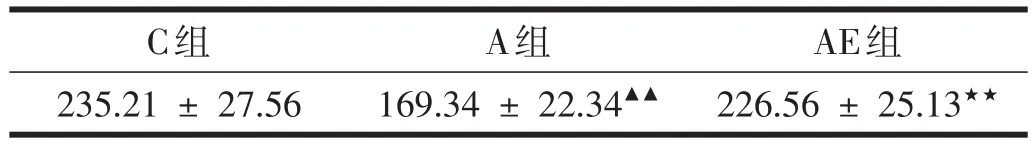
表2 大鼠海马mGluR1免疫荧光染色IOD值(±s)
注:与C组比:▲▲P<0.01;与A组比:★★P<0.01
C组235.21±27.56 A组169.34 ± 22.34▲▲AE组226.56 ± 25.13★★
3.4 大鼠海马PDE- 4 mRNA Real-Time PCR 检测结果
与C组比,A组大鼠海马PDE-4 mRNA表达非常显著性升高(P<0.01);与A组比,AE组大鼠海马PDE-4 mRNA表达非常显著性降低(P<0.01)。见表3。
表3 各组大鼠海马PDE-4 mRNA表达量(±s)

表3 各组大鼠海马PDE-4 mRNA表达量(±s)
注:与C组比:▲▲P<0.01;与A组比:★★P<0.01。
C组1.07±0.059 AE组0.88 ± 0.060★★A组1.20 ± 0.041▲▲
3.5 大鼠海马PDE- 4蛋白Western Blotting ting检测结果
与C组比,A组大鼠海马PDE-4蛋白表达非常显著性升高(P<0.01);与A组比,AE组大鼠海马PDE-4蛋白表达非常显著性降低(P<0.01)。见表4、图4。
表4 大鼠海马PDE-4蛋白表达量(±s)

表4 大鼠海马PDE-4蛋白表达量(±s)
注:与C组比:▲▲P<0.01;与A组比:★★P<0.01。
C组0.31±0.01 AE组0.02 ± 0.01★★A组0.33 ± 0.01▲▲

图4 大鼠海马免疫印迹条带
3.6 PDE- 4与突触可塑性之间相关性分析
PDE-4 mRNA表达与Syp的IOD值呈非常显著性负相关(P<0.01),与mGluR1的IOD值呈显著性负相关(P<0.05);PDE-4蛋白表达与Syp的IOD值和mGluR1的IOD值均呈显著性负相关(P<0.05)。见表5。

表5 大鼠海马PDE-4表达水平与突触可塑性检测结果之间的相关系数矩阵
4 讨论
在相关衰老研究中,衰老动物模型的正确选择和成功建立尤其关键[10]。衰老动物模型包括转基因动物模型、自发性动物模型和诱发性动物模型3种[11、12]。D-半乳糖衰老动物模型已成为国内较公认的诱发性衰老动物模型,与其他衰老模型相比,该模型造模周期短,操作简单,创伤性比较小,易于建成,且重复性好,表现出与自然衰老动物相似的体征等[8、13],已被广泛地应用于白内障、脑老化、延缓脑衰老等方面研究[11]。早期学者发现,衰老时海马神经元出现丢失现象,神经元细胞间距变得疏松[14]。本研究通过6周衰老造模,观察一般状态发现,A组与C组相比,大鼠表现出精神不振、嗜睡、动作迟缓、无食欲、体毛枯黄卷曲、体形瘦弱等明显的衰老体征;在40倍光镜下观察尼氏染色结果发现,与C组比,A组大鼠海马神经元呈现数量明显减少,排列紊乱,细胞间距增大,胞质内尼氏体减少及着色变浅等形态结构退化特征。本研究结果可以证明D-半乳糖脑衰老造模成功。有研究表明8周中等负荷跑台运动能够有效降低海马神经元的凋亡率[15]。刘涛等[16]实验显示,衰老模型训练组大鼠通过6周游泳运动后其海马神经元凋亡细胞数量较衰老模型组显著减少(P<0.01)。本研究结果中AE组大鼠精神状态、食欲、体毛颜色、体形等一般状态及海马神经元数量、排列情况、间距、胞质中尼氏体着色等海马神经元结构形态均与C组相似,未表现出衰老体征,与上述文献一致,提示衰老过程中有氧运动可能保护和修复海马神经元的形态结构。
突触在内外环境刺激作用下形态和传递效能可发生某些适应性变化,该过程称为突触可塑性(synapse plasticity,Sy)[17],具体表现为突触结构和功能可塑性。突触功能可塑性按性质不同分为长时程增强(long term potentiation,LTP)和长时程抑制(long term de⁃pression,LTD),可使突触连接增强或减弱,贮存大量信息,是学习记忆的神经基础[18]。Syp是突触前终末的特异性标记物,可用于检测突触的数量和分布情况,是突触可塑性的重要标志之一[2]。Syp对于Ca2+具有高度亲和力,促使突触囊泡与突触前膜融合,使神经递质快速释放[19],提高突触传递效能。Syp也可激活酪氨酸激酶,促使自身磷酸化,调节内源性神经递质谷氨酸的释放,提高突触传递效能[20]。而突触后致密物(postsynap⁃tic density,PSD)是位于突触后膜质膜下的细胞骨架网,是突触后信号转导和整合的结构基础。LTP形成过程伴随着PSD长度、厚度、面积的增加,推测PSD可能是为突触传递效能增加的物质基础[21]。构成PSD的信号转导相关蛋白质之一的神经递质受体[22、23]分为离子型谷氨酸受体(inootropic glutamate receptor,iGluRs)和代谢型谷氨酸受体(metabotropic glutamate receptor,mGluRs)。其中,mGluRs与多种细胞内第二信使相连,调节中枢神经系统生理及病理过程,如突触可塑性、神经元的退化、神经毒性等[3]。
已有研究表明,运动训练能够增强海马神经元突触可塑性[24]。孙咏虹等[25]实验表明,2个月跑笼运动延缓了快速老化小鼠海马神经元的变性速度,提高了海马突触素表达,进而改善了脑功能。医学领域对于脑缺血及中枢相关性疾病的运动干预有类似的研究。刘传玉[26]探讨了运动康复治疗对局灶脑梗死大鼠脑可塑性的影响,发现运动训练可促进鼠脑梗死后缺血周边区Syp表达量的增加,促进突触的重塑,提高了再建突触的传递效能。刘建锋[27]研究以食物为诱导的意向运动疗法对局灶性脑缺血大鼠皮质缺血区Syp表达的影响,结果发现意向运动疗法可促进局灶性脑缺血大鼠皮质缺血区Syp的表达量上调,进而修复缺损神经,有助于缺损神经功能的恢复。于雪峰等[28]研究发现,运动加针刺康复疗法增加了脑瘫病变皮质区的Syp表达量,修复损伤神经,促进神经功能的康复,有利于恢复脑瘫肢体运动功能。本研究结果表明,各组大鼠海马DG区Syp和mGluR1的IOD值变化趋势一致:A组非常显著性低于C组(P<0.01),AE组非常显著性高于A组(P<0.01)。本研究结果与上述文献一致,提示有氧运动可有效防止Syp、mGluR1的丢失,使Syp和mGluR1数量和密度保持在一定水平上,以维持突触可塑性能力,进而改善脑功能,延缓脑衰老。
环腺苷酸(cyclic adenosine monophosphate,cAMP)和环鸟苷酸(cyclic guanosine monophosphate,cGMP)是生物体内的第二信使物质,参与介导激素、神经递质、多种细胞外信号引发的特定生物学效应,其表达水平对调节细胞的多项生理功能具有重要意义。其中,cAMP参与中枢神经系统短期突触活动,如神经递质合成、储存、释放及其受体的敏感性等[29]。PDEs是细胞内cAMP和cGMP唯一的降解酶,对两者浓度调节起关键性作用。PDEs是一个超级酶家族,PDE-4是PDEs中最大的家族。PDE-4在体内分布广泛,主要分布在脑组织中,是cAMP特异性水解酶[30]。PDE-4通过调节细胞内cAMP/PKA途径和cAMP/细胞外的信号相关激酶途径或延迟cAMP水平升高影响相应蛋白的合成进而引发一系列生物学效应[31]。有研究表明,PDE-4抑制剂使cAMP在细胞内堆积,产生各种生物效应,如抗抑郁、改善认知能力和增强记忆等[32]。新型PDE-4抑制剂氯比普兰可通过增强cAMP/PKA信号通路进而改善老年认知功能及抗抑郁作用[33]。有实验表明[34],给予毒蕈碱M受体激动剂东莨菪碱可以引起工作记忆和参照记忆的损害,应用PDE-4抑制剂可逆转这两种记忆的损害,并推测这些作用可能与PDE-4抑制剂可以通过增加海马cAMP含量,增加海马神经元LTP,增强海马的突触可塑性有关。但衰老过程中有氧运动对大鼠海马PDE-4基因表达的影响仍不清楚,缺少文献资料。本研究结果表明,各组大鼠海马PDE-4 mRNA及蛋白表达变化趋于一致:与C组比,A组非常显著性升高(P<0.01);与A组比,AE组非常显著性降低(P<0.01)。上述实验结果表明,有氧运动可下调大鼠海马中PDE-4基因表达,也可产生与PDE-4抑制剂相同的效应。相关分析结果显示,Syp的IOD值与PDE-4 mRNA呈非常显著性负相关(P<0.01),与PDE-4蛋白表达呈显著性负相关(P<0.05);mGluR1的IOD值与PDE-4mRNA及蛋白表达呈显著性负相关(P<0.05)。PDE-4的表达水平可准确地反映海马突触可塑性,推测有氧运动可以通过下调PDE-4的表达水平,进而提高海马突触可塑性,改善神经系统能力,最终起到延缓衰老的作用。
5 结论
(1)衰老过程中进行有氧运动干预可以修复海马神经元的形态结构,使Syp和mGluR1数量和密度保持在一定水平上,以维持突触可塑性,进而改善脑功能,延缓脑衰老。
(2)运动可能通过下调PDE-4基因表达影响脑功能。

