重症哮喘发病机制的研究进展
郭海琴 马文娴 吴昌归
重症哮喘发病机制的研究进展
郭海琴 马文娴 吴昌归
根据国内外指南,重症哮喘(severe asthma, SA)是指哮喘诊断明确,合并症已排除或得到妥善处理,在过去的1年需GINA 4-5级哮喘药物治疗(大剂量吸入性糖皮质激素(inhaled corticosteroids, ICS)联合一种控制药物),或全身激素治疗≥50%的时间,才能控制或仍未控制的哮喘[1-2]。目前全球范围内约有三亿哮喘患者,其中SA约占5%-10%,但由SA所产生的医疗负担超过哮喘总费用的50%。亚太小组一项调查显示7个发达国家的哮喘患者中,即使在良好的患者依从性、正确吸入药物及合并症得到妥善处理的情况下,仍有160万未控制SA患者[3]。由于SA发病机制不清,早期提出预警、早期干预是目前亟待解决的问题。本文结合近年来的研究结果,对这些问题进行综述。
哮喘是一种主要由嗜酸性粒细胞(EOS)、嗜碱性粒细胞、淋巴细胞、肥大细胞(MC)、呼吸道上皮细胞等细胞及组分参与的慢性变应性炎症为特征的异质性疾病,具有发作性的喘息、气促、胸闷和咳嗽的呼吸道症状,伴有可变的气流受限,呼吸道症状和强度可随时间而变化[2]。目前哮喘治疗的常用药物有吸入型糖皮质激素(ICS)、短效β2受体激动剂(SABA)、长效β2受体激动剂(LABA)白三烯调节剂(LTRA)和茶碱类等,但常规的吸入甚至口服激素对SA疗效不佳,肺功能还可能进行性恶化,严重影响患者生活质量,加重家庭及国家经济负担[1]。近年多项研究发现SA在接受激素治疗后,支气管黏膜下组织或支气管肺泡灌洗液(BALFs)中仍存在较高水平多形核中性粒细胞(PMN),部分患者为持续高水平EOS浸润,多种免疫因子也参与其中,具体机制不清[4]。本文从激素抵抗性、基因多态性、免疫-炎症反应及气道重塑几个方面就SA的发病机制作一简单综述。
激素抵抗性
SA普遍存在着糖皮质激素不敏感的问题,常需吸入大剂量或全身应用糖皮质激素(GCs)才能控制或仍不能控制,产生这种现象的机制尚不完全清楚,可能与以下因素有关:
一、原发性激素抵抗:糖皮质激素受体(GR)突变体及单核苷酸多态性(single nucleotide polymorphism, SNPs)
1 ER22/EK23突变:正常情况下,糖皮质激素受体α(GR-α)在机体广泛表达并调控靶基因的表达,GR-β表达水平相对较低。糖皮质激素主要是通过与GR-α结合发挥其生物学效应,GR-β拮抗GR-α的功能。当ER22/EK23突变时,无功能的GR-β表达增加,进而影响GCs与GR结合发挥生物学效应,可能是SA激素治疗抵抗的原因之一[5]。
2 GR SNPs:包括D641V、N363S、R477H、I559N、R23K、G679S、V729I、I747M等,影响基因转录过程,使GR表达减少并影响其生物活性,还可降低GR与配体结合的亲和力,此为激素抵抗的主要原因[6]。Feng等[6]研究发现GR-α突变体D641V与激素抵抗型哮喘相关。
3 MDR1 SNPs:有研究发现多药耐药基因 MDR1编码P-糖蛋白170,可促进GCs排出细胞外;高MDR1表达可能参与SA的激素抵抗[7]。
4 Bcll限制片段长度多态性:使机体对GCs敏感性降低,可能参与SA激素治疗不敏感[5]。
二、获得性激素抵抗
1 GR修饰

(2)氧化还原反应:Stephenson等[11]发现巯基氧化还原反应的过程可促进GR翻译后修饰并抑制GR的功能,GCs与GR结合受抑,导致SA患者的激素抵抗性。丝氨酸磷酸化、半胱氨酸氧化过程与此类似。
2 促炎转录因子活化或表达增加
(1) JNK/AP-1:JNK是MAPK家族成员之一,可被TNF-α等促炎因子激活,直接使GR磷酸化,抑制其核转移过程,减少与GRE结合[7]。转录激活蛋白1(AP-1,JunB和c-Fos)组分JunB对TH2细胞的生成至关重要。JunB-Batf-IRF4复合物与IL-17基因启动子上的AP1-IRF复合物(AICE)结合,诱导IL-17基因表达。JNK/AP-1途径激活,促炎转录因子表达增高,是SA激素抵抗原因之一[12]。c-Fos还可直接拮抗GR,引起激素抵抗。
(2)JAK3/STAT5:有研究发现,JAK3/STAT5途径激活,IL-2可使GR核转位受抑,参与激素抵抗[5, 7]。
(3) NF-κB:NF-κB有P50和P65亚基,参与免疫反应的许多因子都受NF-B的调控,包括:TNF-α、IL-1β、IL-2、IL-6、IL-8、IL-12、iNOS、COX2、趋化因子、粘附分子、集落刺激因子等;NF-κB对TH2细胞分化也至关重要[13]。已有研究表明NF-κB调控生成的多种组分及因子可能参与SA的发生发展,IL-1β、IL-8和巨噬细胞抑制蛋白1α等与GCs抵抗有关,进一步论证了NF-κB在SA发病机理中的作用[14]。Ghonim等[13]发现丝氨酸残基20位点处NF-κB P50亚基磷酸化,还可能影响DNA依赖性蛋白激酶(DNA-PK)调控VCAM-1表达,参与SA的气道重塑。
3 细胞因子诱导GR-β表达增加:Semlali等[15]研究发现IL-17A和IL-17F可促进GR-β表达,引起激素抵抗。
4 组蛋白乙酰化障碍:Trevor等[16]研究表明HDAC2可使GR去乙酰化,GC与NF-κB结合并激活AP-1形成GC-NFκB/AP-1复合体,抑制促炎因子转录,促炎因子合成减少;此外,HDAC2可使组蛋白去乙酰化也可使促炎因子表达下调参与其抗炎作用。HDAC2表达或活性降低,GCs抗炎作用减弱,导致激素治疗不敏感。Ito等[17]在40名受试者的支气管黏膜活检组织中也发现HDAC2表达水平与哮喘患者的激素疗效有关。而氧化应激时,PI3Kδ被激活,Akt磷酸化,组蛋白去乙酰化酶2(HDAC2)磷酸化后活性降低;过氧亚硝酸盐刺激、组蛋白4赖氨酸5乙酰化减弱等都会引起HDAC2活性降低,可能参与SA的发病机制[18]。
基因多态性
近年来多项研究表明,SA患者与轻中度哮喘患者或健康对照者相比,在遗传学上存在差异,其中最主要的有:细胞因子SNPs、维生素D受体(VDR)SNPs、自噬相关基因Atg5及Atg7 SNPs、YKL-40 SNPs、TSLP SNPs、RORα SNPs等。
一、细胞因子及其SNPs
1 IL-17及IL-17 SNP:有研究发现,IL-17水平及IL-17 SNP rs2275913与SA相关[19]。Th17、iNKT、Trδ等细胞都可产生IL-17,其可诱导上皮细胞、内皮细胞、成纤维细胞等合成并分泌IL-6、IL-8、G-CSF、PGE2,促进ICAM-1的表达[20]。IL-17和IL-17R结合后,可通过MAPK和NF-κB途径发挥其生物学作用,是重要的促炎因子;IL-17还可激活PI3K途径,降低HDAC2活性。其组分IL-17A可引起AHR,还可介导激活先天性免疫系统,促进上皮细胞分泌PMN趋化因子CXCL1和CXCL5,招募并活化PMN,加重SA。IL-22还可加强IL-17A的促炎反应。Nanzer等[21]发现,激素抵抗型哮喘患者血清/BALF中IL-17A水平较激素敏感患者高,抗IL-17A单抗Ixekizumab也被证实对SA具有疗效,进一步说明了IL-17浓度升高及IL-17 SNP可能是SA激素治疗不敏感的原因之一。
2 IL-33和IL-33受体(ST2L):IL-33属于IL-1家族成员,在气道上皮和平滑肌中表达,可促进RBM增厚;IL1RL1编码ST2L和可溶性诱饵受体(sST2),活化NF-κB和MAPK,促进TH2细胞因子的产生,加强炎症反应[22]。Traister等[23]研究发现,SA患者ST2L mRNA较健康对照组表达显著升高,BALFs ST2L浓度较轻中度哮喘患者和健康对照者均高;与ST2L mRNA和/或sST2水平相关的IL1RL1 SNPs(rs1420101, rs1420089, rs1041973, rs1921622和 rs10185897)与哮喘相关联,且sST2水平与IFN-γ mRNA表达增高一致。sST2可通过促进IL-33/ST2L结合,调控IFN-γ 的表达;ST2L也可反馈调节sST2表达。研究还发现,在接受大剂量吸入/口服GCs或使用LTRAs后IL-33、ST2L mRNA仍处于较高水平,且ST2L mRNA与TH2型炎症标志物如血EOS计数、FeNO、CLCA1及CCL26 mRNA表达增高一致[22],也充分解释了部分SA患者在接受大剂量GCs后EOS仍处于较高水平这一现象。
3 IL-6和IL-6受体(IL-6R):重症哮喘研究计划(SARP)小组等[23]研究发现,IL-6R编码的SNP rs2228145(Asp358Ala)与SA患者肺功能一秒用力呼气容积占预计值百分比(FEV1%pred)降低和AHR相关,且SA患者血清中sIL-6R水平较轻中度哮喘患者高。Asp358Ala变异修饰IL-6R肽结构,使其水解分泌至细胞外为sIL-6R,与广泛分布的gp130结合形成sIL-6R/gp130复合体,诱导激活JAK2,信号转导子磷酸化,转录因子3活化,进入细胞核影响炎症基因表达;IL-6也可激活sIL-6R,促进促炎因子生成[24]。Ferreira等[25]在GWAS研究发现,IL-6R SNP rs4129267与IL-6R SNP rs2228145相关。也就是说IL-6R SNP rs2228145、SNP rs4129267及IL-6都可能参与SA发病过程。
4 IL-4和IL-4Rα SNPs:Ricciardolo等[26]发现IL-4 SNPs和IL-4Rα SNPs与SA相关。IL-4主要由活化Th2细胞产生,可上调VCAM-1的表达,刺激气道平滑肌和上皮细胞产生ECP,招募EOS至呼吸道[27]。IL-4R由IL-4Rα和IL-13Rα1组成,即IL-4与IL-13有部分相同受体,故IL-13可能与IL-4在参与SA发病中有协同作用。抗IL-4Rα mAb Dupilumab可抑制IL-4/IL-13,且CCL26、CCL17也受其调控,对SA疗效显著且安全[28]。
5 TNF-α及TNF-α SNPs:Erry等[29]发现,SA患者较轻中度哮喘患者和/或正常对照者TNF-α及TNF-αR1表达增加;Gagliardo等[30]的研究结果提示;TNF-α SNPs与SA相关。Howarth等[31]也发现激素依赖的SA患者BALFs TNF-α水平较轻中度哮喘患者更高,TNF-α基因表达增加。TNF-α作为一种广泛的促炎因子,同IL-1β共同诱导PMN自噬,PMN自噬与NETs(extracellular DNA traps)可通过破坏气道上皮细胞、诱导IL-8生成、活化EOS、加剧气道炎症,参与SA的形成和发展;有研究表明:在SA患者中使PMN活化的炎症因子如IL-8、TNF-α、IL-1β等表达上调[14]。但多项临床随机对照试验结果显示,抗TNF-α mAb Etanercept对SA的疗效不尽一致,可能跟随访时间及个体异质性等有关[31-32]。
6 其他:Walker等[33]研究发现IL-18R SNPs与SA相关。IL-18作为促炎因子,与IL-33有协同作用,诱导IFN-γ表达;它还能增强IL-2、GM-CSF活性。有研究发现TGF-β1 SNPs与SA相关联。TGF-β对细胞的生长、分化和免疫功能都有重要的调节作用,还可能通过对IL-6基因转录的调节促进IL-6的产生[27]。
二、VDR SNPs及VitD
Einisman等[34]发现哮喘患者VDR SNPs FokI、1,25(OH)2D3不足与其激素治疗能否控制症状有关。已有研究证实低水平VitD会提高SA发病风险、哮喘患者ASM增厚、SA急性加重频率增高、控制所用激素量增加[35]。VitD可通过诱导Treg细胞产生IL-10,提高激素敏感性,减少呼吸道感染风险,抑制气道重塑等来防止SA的发展;其还与TNF-α水平呈负相关[21]。也有研究发现1,25(OH)2D3可抑制IL-17A和IL-22的表达,增强CD39+T细胞的表达[25]。
三、Atg5与Atg7 SNPs
Atg5 SNPs、Atg7 SNPs可引起肺 CD11C+、PMN细胞自噬障碍,加强SA患者中性粒细胞性气道炎症和AHR,进一步加重SA,恶性循环;且CD11C+细胞自噬障碍可诱导TH17细胞极化,IL-17A过表达,加重哮喘[36]。已有随机临床试验表明,自噬诱导剂卡马西平,对SA有显著疗效[37]。也有小鼠模型研究发现,敲除了Atg5 和Atg7的小鼠,其PMN脱颗粒减少,介导的炎症反应减弱[14]。充分说明了Atg5 SNPs、Atg7 SNPs可能参与SA发生发展。
四、YKL-40 SNPs
甲壳素是昆虫、甲壳动物、寄生虫、真菌、细菌等多种生物保护机体不受恶劣环境影响的结构多糖,壳三糖酶和YKL-40是人体表达的能降解甲壳素的酶[38]。肺泡巨噬细胞是YKL-40的主要来源,其可储存在PMN的特殊颗粒中,并在PMN激活后释放至血浆中。Otsuka等[38]发现YKL-40水平与PMN水平呈正相关。YKL-40以一种剂量依赖方式刺激组织细胞如成纤维细胞等,与胰岛素样生长因子1(IGF-1)协同调节多种细胞的生存、黏附、迁移和增殖能力;与胶原Ⅰ结合调节胶原纤维的生成,致气道上皮下纤维化和新生血管形成,促进气道重塑。支气管上皮细胞在高水平YKL-40条件下产生高水平的IL-8;IL-8在活化蛋白酶受体2的作用下刺激支气管平滑肌增殖,其对PMN有趋化作用,进一步加强炎症反应[39]。有研究发现几丁质酶3样1(CHI3L1)SNP rs12141494、几丁质酶1(CHIT1)SNP rs4950928与SA、YKL-40水平和持续性气流受限相关;CHI3L1 SNP rs12141494与CHIT1 SNP rs4950928可能存在协同作用[40].
五、Nrf2 SNPs
Nrf2是带亮氨酸支链基序,调控氧化还原反应的一种转录因子,几乎所有组织都有表达。其被抑制蛋白Keap1隔离在细胞质中,在氧化应激时激活并转移至细胞核,与抗氧化应答元件(ARE)结合并激活ARE,上调几种与还原型谷胱甘肽(GSH)合成和抗氧化防御有关的基因表达[41]。McMahon等[41]研究发现SA患儿Nrf2 mRNA和蛋白质表达增加,但却存在功能缺陷;这种功能缺陷,可能是因Keap1引起Nrf2泛素化及其蛋白体降解所致。Nrf2乙酰化、Nrf2磷酸化及Nrf2 SNPs还可导致GSH呈负平衡状态,组蛋白乙酰转移酶(Histone acetyltransferases , HAT)活性增加,组蛋白去乙酰化酶(HDAC)活性降低,使组蛋白乙酰化最终加强IL-8等促炎因子的表达,进一步促进AHR和气道重塑,参与SA[42]。
六、其他
有研究发现TSLP SNPs、RORα SNPs与SA相关联,SA患者S100钙结合蛋白mRNA和CEACAM家族mRNA基因表达也上调,金属蛋白酶33 SNPs与哮喘严重程度、肺功能降低和哮喘急性加重相关[27, 33]。
免疫-炎症
哮喘是由多种细胞及炎症因子介导的慢性炎症性疾病,以下简要阐述了SA可能存在的免疫-炎症机制。
一、固有免疫
1 PMN:欧洲重症哮喘发病机制研究(ENFUMOSA)等多项研究发现,与轻中度哮喘患者相比,SA患者气道黏膜下或BALF中有大量PMN浸润[43]。如上述,PMN与TH17细胞、IL-17、TNF-α、IL-1β、IL-8、CXCR2、CXCL1、CXCL5、MSK1、P38 MAPK等相互交织相互作用影响,加重气道炎症反应;且PMN激活后释放一系列相关酶如MPO、MMP9、NE等,加重气道上皮的破坏,气道重塑,促进SA发展[4]。GCs还可能通过抑制PMN的凋亡使PMN水平升高,促进上述炎症反应,这也可能是SA患者对激素存在抵抗的原因之一[14, 20]。PMN的趋化、活化、凋亡的异常都可能引起患者呼吸道持续性炎性反应,促进SA发展。
2 EOS:在以往的认识中,嗜酸性粒细胞性气道炎症对GCs敏感;但也有文献报道有的SA患者在接受大剂量吸入或口服激素后诱导痰中EOS持续处于高水平,有报道称40-60%的SA为嗜酸性粒细胞性气道炎症[44]。Smith等[45]发现SA患者血液/气道嗜酸性粒细胞造血祖细胞(EOPs)水平较轻中度哮喘患者高,SA持续高水平EOS可能与EOP升高有关;EOS持续存在的哮喘患者气道黏膜下巨噬细胞和TGF-β(+)细胞水平高。EOS持续高水平的SA可能涉及与IL-4、IL-5、IL-13及TGF-β等的相互作用,而这些因子又涉及一个复杂的免疫系统网,共同导致SA的发病[46]。已有研究证实,Benrelizumab、Reslizumab、Mepolizumab、Dupilumab等mAb已被用于治疗嗜酸性粒细胞性SA且取得了良好疗效,进一步说明了EOS是参与SA发病的重要细胞[28,47]。
3 肥大细胞:Lezmi[48]等研究发现,小儿SA患者ASM或黏膜下层肥大细胞(MCs)水平与EOS浸润数量及患者急性加重频率正相关。MCs可通过分泌粒细胞-巨噬细胞集落刺激因子、PGD2及CCR3募集EOS至气道黏膜下层,促进抗炎反应,参与SA。
二、II型固有淋巴样细胞(ILC2s)
有研究发现SA患者BALF ILC2s水平较轻中度哮喘患者高,且ILC2s水平与IL-33正相关[49]。ILC2s是一种非T非B淋巴细胞,介于固有免疫和适应性免疫之间;在IL-25、IL-33、TSLP等作用下产生大量IL-5、IL-13和少量IL-4,CCL26表达增多,招募活化EOS,嗜酸性粒细胞性炎症反应增强。即ILC2s可能通过加强机体内固有免疫和适应性免疫反应,在SA的发生发展中起重要作用。
三、适应性免疫

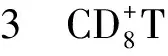
4 脂氧素:脂氧素,由5-脂氧合酶与15-脂氧合酶作用产生的介质,有强烈的抗炎作用。Vachier等[52]发现SA患者较轻中度哮喘患者痰液中脂氧素4(LX4)含量较低;脂氧合酶衍生的类花生四烯酸比率失衡也与哮喘气流受限的程度相关[27]。
气道重塑
重症哮喘主要病理生理学改变主要AHR、炎症和气道重塑;气道重塑包括气道上皮完整性的破坏、网状基底膜(RBM)增厚、细胞外基质沉积、新生血管形成、ASM细胞增生肥大、杯状细胞化生、粘液腺增生[53]。严重的气道重塑将导致不可逆转的气流受限。
从上文可知,EOS、IL-4、IL-5、IL-13、纤维细胞因子TGF-β、VitD等可促进ASM增厚,IL-33促进RBM增厚,IL-17促进ICAM-1表达及诱导成纤维细胞分泌大量炎症因子,YKL-40刺激成纤维细胞与Ⅰ型胶原结合调节胶原纤维的生成,PMN与TH17细胞、IL-17、IL-8、MPO、NE、MMP-9等相互作用,ILC2s通过CCL26、IL-33及TH2细胞因子的作用,各细胞及组分相互影响作用,形成一个错综复杂的系统,参与SA的气道重塑。
一、成纤维细胞及C-C家族趋化因子受体6型(CCR6)及7型(CCR7)
SA患者血循环中成纤维细胞数量较多,且有更强的肌纤维母细胞分化潜能;其ASM中CCR7趋化因子配体19表达增加。成纤维细胞在CCR6、CCR7的作用下迁移至肺组织并定植于气道壁,分泌胶原和平滑肌肌动蛋白α(α-SMA)、细胞外基质蛋白;其分化为肌纤维母细胞后,释放细胞外基质蛋白,介导上皮下纤维化,促进SA气道重塑[54]。
二、基质金属蛋白酶-9(MMP-9)
Blondin等[55]发现发现SA患者ASM/BALF含高水平MMP-9,是气道重塑的一个敏感性标志物。其还与IL-33水平正相关,加重嗜酸性粒细胞性气道炎症,参与SA。
综上所述:SA是一种异质性疾病,同样的临床表型可能存在不同的分子内型,对治疗的反应也不尽相同[56]。GR SNPs、GR修饰(磷酸化、亚硝基化、泛素化、氧化还原应激等)、GR-β表达增加、GCs细胞外排增加、促炎转录如JNK/AP-1、NF-κB、JAK3/ATAT5等信号途径过度激活及促炎转录因子过度表达、组蛋白乙酰化障碍等都可能引起SA存在激素治疗不敏感,病情不能控制。PMN、EOS、MC、ILC2s、FOXP3+Treg细胞、TH2/TH17细胞、成纤维细胞、肺泡巨噬细胞、内皮细胞、上皮细胞、IL-2、IL-4、IL-5、IL-6、IL-8、IL-9、IL-12、IL-13、IL-17、IL-22、IL-25、IL-33、及TGF-β、TNF-α、IL-1β、MMP9、VitD、LX4、PGD2、YKL-40、巨噬细胞抑制蛋白1α、CCR6、CCR7、CCL26等多种细胞及组分都可能参与了SA的发生发展过程。各种细胞及组分相互影响,共同作用引起患者激素抵抗、炎症反应增强、AHR及气道重塑,致SA。针对上述SA发病机制,目前已有的新型治疗方案有:抗炎(磷酸二酯酶4抑制剂、NF-κB抑制剂、IL-5 mAb等)、抗氧化剂、免疫抑制剂、P38 MAPK抑制剂、HDAC2活性增强剂(茶碱、磷酸肌醇-3激酶-δ抑制剂)、VitD、巨噬细胞抑制因子和P-糖蛋白抑制剂、支气管热成形术等,从反方向证实了其可能参与了SA发病机制[7, 57]。因为SA为异质性疾病这一特性,我们需进一步探索出对患者有益的精准治疗方案。
[1] Chung KF,Wenzel SE,Brozek JL,et al.International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma[J].Eur Respir J,2014,43(2):343-373.
[2] Global Initiative for Asthma.Global Strategy for Asthma Management and Prevention(2015 update)[R].http://www.ginasthma.com.
[3] Bice JB, Leechawengwongs E, Montanaro A.Biologic targeted therapy in allergic asthma[J].Ann Allergy Asthma Immunol,2014,112(2):108-115.
[4] Naseem A,Liaqat J,Zaidi SB,et al.Sputum Neutrophilia in Severe Persistent Asthmatics[J].J Coll Physicians Surg Pak,2014,24(6):420-423.
[5] Rodriguez JM,Monsalves-Alvarez M,Henriquez S,et al.Glucocorticoid resistance in chronic diseases[J].Steroids,2016,115:182-192.
[6] Zhao F,Zhou G,Ouyang H,et al.Association of the glucocorticoid receptor D641V variant with steroid-resistant asthma:a case-control study[J].Pharmacogenet Genomics,2015,25(6):289-295.
[7] Barnes PJ,Adcock IM.Glucocorticoid resistance in inflammatory diseases[J].Lancet,2009,373(9678):1905-1917.
[8] Mercado N,Hakim A,Kobayashi Y,et al.Restoration of corticosteroid sensitivity by p38 mitogen activated protein kinase inhibition in peripheral blood mononuclear cells from severe asthma[J].PLoS One,2012,7(7):e41582.
[9] Li LB,Leung DY,Goleva E.Activated p38 MAPK in Peripheral Blood Monocytes of Steroid Resistant Asthmatics[J].PLoS One,2015,10(10):e0141909.
[10] Bhavsar P,Khorasani N,Hew M,et al.Effect of p38 MAPK inhibition on corticosteroid suppression of cytokine release in severe asthma[J].Eur Respir J,2010,35(4):750-756.
[11] Stephenson ST,Brown LA,Helms MN,et al.Cysteine oxidation impairs systemic glucocorticoid responsiveness in children with difficult-to-treat asthma[J].J Allergy Clin Immunol,2015,136(2):454-461.
[12] Glasmacher E,Agrawal S,Chang AB,et al.A Genomic Regulatory Element That Directs Assembly and Function of Immune-Specific AP-1-IRF Complexes[J].Science,2012,338(6109):975-980.

[14] Pham DL,Ban GY,Kim SH,et al.Neutrophil autophagy and extracellular DNA traps contribute to airway inflammation in severe asthma[J].Clin Exp Allergy,2017,47(1):57-70.
[15] Vazquez-Tello A,Semlali A,Chakir J,et al.Induction of glucocorticoid receptor-beta expression in epithelial cells of asthmatic airways by T-helper type 17 cytokines[J].Clin Exp Allergy,2010,40(9):1312-1322.
[16] Trevor JL,Deshane JS.Refractory asthma: mechanisms, targets, and therapy[J].Allergy,2014,69(7):817-827.
[17] Ito K,Caramori G,Lim S,et al.Expression and activity of histone deacetylases in human asthmatic airways[J].Am J Respir Crit Care Med,2002,166(3):392-396.
[18] Lan N,Luo G,Yang X,et al.25-Hydroxyvitamin D3-deficiency enhances oxidative stress and corticosteroid resistance in severe asthma exacerbation[J].PLoS One,2014,9(11):e111599.
[19] Agache I,Ciobanu C,Agache C,et al.Increased serum IL-17 is an independent risk factor for severe asthma[J].Respir Med,2010,104(8):1131-1137.
[20] Chang HS,Lee TH,Jun JA,et al.Neutrophilic inflammation in asthma: mechanisms and therapeutic considerations[J].Expert Rev Respir Med,2017,11(1):29-40.
[21] Nanzer AM,Chambers ES,Ryanna K,et al.Enhanced production of IL-17A in patients with severe asthma is inhibited by 1α,25-dihydroxyvitamin D3 in a glucocorticoid-independent fashion[J].J Allergy Clin Immunol,2013,132(2):297-304.
[22] Saglani S, Lui S, Ullmann N, et al.IL-33 promotes airway remodeling in pediatric patients with severe steroid-resistant asthma[J].J Allergy Clin Immunol,2013,132(3):676-685.e13.
[23] Traister RS,Uvalle CE,Hawkins GA,et al.Phenotypic and genotypic association of epithelial IL1RL1 to human TH2-like asthma[J].J Allergy Clin Immunol,2015,135(1):92-99.
[24] Hawkins GA,Robinson MB,Hastie AT,et al.The IL6R variation Asp358Ala is a potential modifier of lung function in subjects with asthma[J].J Allergy Clin Immunol,2012,130(2):510-515.e1.
[25] Ferreira MA,Matheson MC,Duffy DL,et al.Identification of IL6R and Chromosome 11q13.5 as Risk Loci for Asthma[J].Lancet,2011,378(9795):1006-1014.
[26] Ricciardolo FL,Sorbello V,Silvestri M,et al.TNF-alpha, IL-4R-alpha and IL-4 polymorphisms in mild to severe asthma from Italian Caucasians[J].Int J Immunopathol Pharmacol,2013,26(1):75-84.
[27] Wenzel SE,Busse WW.Severe asthma: Lessons from the Severe Asthma Research Program[J].J Allergy Clin Immunol,2007,119(1):14-21;quiz22-23.
[28] Wenzel S,Castro M,Corren J,et al.Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium-to-high-dose inhaled corticosteroids plus a long-acting β2 agonist: a randomised double-blind placebo-controlled pivotal phase 2b dose-ranging trial[J].Lancet,2016,388(10039):31-44.
[29] Berry MA,Hargadon B,Shelley M,et al.Evidence of a role of tumor necrosis factor alpha in refractory asthma[J].N Engl J Med,2006,354(7):697-708.
[30] Gagliardo R,Chanez P,Profita M,et al.IkappaB kinase-driven nuclear factor-kappaB activation in patients with asthma and chronic obstructive pulmonary disease[J].J Allergy Clin Immunol,2011,128(3):635-645.e1-e2.
[31] Howarth PH,Babu KS,Arshad HS,et al.Tumour necrosis factor (TNFalpha) as a novel therapeutic target in symptomatic corticosteroid dependent asthma[J].Thorax,2005,60(12):1012-1018.
[32] Holgate ST,Noonan M,Chanez P,et al.Efficacy and safety of etanercept in moderate-to-severe asthma: a randomised, controlled trial[J].Eur Respir J,2011,37(6):1352-1359.
[33] Walker ML,Holt KE,Anderson GP,et al.Elucidation of pathways driving asthma pathogenesis: development of a systems-level analytic strategy[J].Front Immunol,2014,5:447.
[34] Einisman H,Reyes ML,Angulo J,et al.Vitamin D levels and vitamin D receptor gene polymorphisms in asthmatic children: a case-control study[J].Pediatr Allergy Immunol,2015,26(6):545-550.
[35] Korn S,Hübner M,Jung M,et al.Severe and uncontrolled adult asthma is associated with vitamin D insufficiency and deficiency[J].Respir Res,2013,14:25.
[36] Suzuki Y,Maazi H,Sankaranarayanan I,et al.Lack of autophagy induces steroid-resistant airway inflammation[J].J Allergy Clin Immunol,2016,137(5):1382-1389.e9.
[37] Otsuka K,Matsumoto H,Niimi A,et al.Sputum YKL-40 Levels and Pathophysiology of Asthma and Chronic Obstructive Pulmonary Disease[J].Respiration,2012,83(6):507-519.
[38] Gomez JL,Crisafi GM,Holm CT,et al.Genetic variation in chitinase 3-like 1 (CHI3L1) contributes to asthma severity and airway expression of YKL-40[J].J Allergy Clin Immunol,2015,136(1):51-58.e10.
[39] Ober C,Tan Z,Sun Y,et al.Effect of Variation in CHI3L1 on Serum YKL-40 Level, Risk of Asthma, and Lung Function[J].N Engl J Med,2008,358(16):1682-1691.
[40] McMahon M,Itoh K,Yamamoto M,et al.Keap1-dependent Proteasomal Degradation of Transcription Factor Nrf2 Contributes to the Negative Regulation of Antioxidant Response Element-driven Gene Expression[J].J Biol Chem,2003,278(24):21592-21600.
[41] To Y,Ito K,Kizawa Y,et al.Targeting Phosphoinositide-3-Kinase-delta with Theophylline Reverses Corticosteroid Insensitivity in Chronic Obstructive Pulmonary Disease[J].Am J Respir Crit Care Med,2010,182(7):897-904.
[42] The ENFUMOSA Study Group.The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma[J].Eur Respir J,2003,22(3):470-477.
[43] Tan LD,Bratt JM,Godor D,et al.Benralizumab: a unique iL-5 inhibitor for severe asthma[J].J Asthma Allergy,2016,9:71-81.
[44] Smith SG,Chen R,Kjarsgaard M,et al.Increased numbers of activated group 2 innate lymphoid cells in the airways of patients with severe asthma and persistent airway eosinophilia[J].J Allergy Clin Immunol, 2016,137(1):75-86.e8.
[45] Chua YL,Liong KH,Huang CH,et al.Blomia tropicalis-Specific TCR Transgenic Th2 Cells Induce Inducible BALT and Severe Asthma in Mice by an IL-4 and IL-13-Dependent Mechanism[J].J Immunol,2016,197(10):3771-3781.
[46] Chung KF.Dupilumab: a potential new treatment for severe asthma[J].Lancet,2016,388(10039):3-4.
[47] Lezmi G,Galmiche-Rolland L,Rioux S,et al.Mast cells are associated with exacerbations and eosinophilia in children with severe asthma[J].Eur Respir J,2016,48(5):1320-1328.
[48] Castanhinha S,Sherburn R,Walker S,et al.Pediatric severe asthma with fungal sensitization is mediated by steroid-resistant IL-33[J].J Allergy Clin Immunol,2015,136(2):312-322.e7.
[49] Chang PJ,Bhavsar PK,Michaeloudes C,et al.Corticosteroid insensitivity of chemokine expression in airway smooth muscle of patients with severe asthma[J].J Allergy Clin Immunol,2012,130(4):877-885.e5.
[50] Tsitsiou E,Williams AE,Moschos SA,et al.Transcriptome analysis shows activation of circulating CD8+ T cells in patients with severe asthma[J].J Allergy Clin Immunol,2012,129(1):95-103.
[51] Vachier I,Bonnans C,Chavis C,et al.Severe asthma is associated with a loss of LX4, an endogenous anti-inflammatory compound[J].J Allergy Clin Immunol,2005,115(1):55-60.
[52] Bergeron C,Tulic MK,Hamid Q.Airway remodelling in asthma: From benchside to clinical practice[J].Can Respir J,2010,17(4):e85-e93.
[53] Irvin C,Zafar I,Good J,et al.Increased frequency of dual-positive TH2/TH17 cells in bronchoalveolar lavage fluid characterizes a population of patients with severe asthma[J].J Allergy Clin Immunol,2014 ,134(5):1175-1186.e7.
[54] Blondin MC,Beauregard H,Serri O.Iatrogenic Cushing syndrome in patients receiving inhaled budesonide and itraconazole or ritonavir: two cases and literature review[J].Endocr Pract,2013,19(6):e138-e141.
[55] Fitzpatrick AM,Stephenson ST,Brown MR,et al.Systemic Corticosteroid Responses in Children with Severe Asthma: Phenotypic and Endotypic Features[J].J Allergy Clin Immunol Pract,2017,5(2):410-419.e4.
[56] Pretolani M,Bergqvist A,Thabut G,et al.Effectiveness of bronchial thermoplasty in patients with severe refractory asthma: Clinical and histopathologic correlations[J].J Allergy Clin Immunol,2017,139(4):1176-1185.
10.3969/j.issn.1009-6663.2017.010.042
国家自然科学基金项目(No 81470223)
710032 陕西 西安,第四军医大学西京医院呼吸内科
吴昌归,E-mail:changgui@fmmu.edu.cn
2017-01-10]

