FHL1和Paxillin在大鼠气道黏液高分泌中的表达
杨艳娟,杨桂兰,郑西卫,张慧芳,程德云
·论 著·
FHL1和Paxillin在大鼠气道黏液高分泌中的表达
杨艳娟1,杨桂兰1,郑西卫1,张慧芳1,程德云2
目的探讨FHL1和Paxillin在大鼠气道黏液分泌中的作用。方法将20只雄性Wistar大鼠分为正常对照组和实验组(内毒素E组)。采用HE染色和阿尔辛蓝-过碘酸雪夫(AB-PAS)染色进行气道上皮杯状细胞计数及检测气道黏液物质表达。采用免疫组化法检测各组大鼠黏液腺FHL1、Paxillin和MUC5AC蛋白的表达,对肺组织切片进行图像分析。结果内毒素E组气道上皮杯状细胞数、气道MUC5AC、气道及肺组织FHL1、Paxillin 和黏液物质表达分别与正常对照组相比升高(P<0.05)。FHL1和Paxillin的表达与MUC5AC的表达呈正相关(r=0.962,0.868,P<0.05)。结论大鼠气道和肺组织高表达FHL1 和Paxillin,可能参与了气道黏液高分泌的发生。
四个半LIM结构域蛋白;桩蛋白;黏液高分泌
慢性气道炎症性疾病在呼吸系统疾病中有很高的发病率,例如慢性阻塞性肺疾病(COPD)和支气管哮喘,而此类慢性炎症性疾病最重要的病理生理改变就是杯状细胞化生和黏液分泌旺盛,气道内积聚过多的黏液,使得本来已狭窄的气道更加阻塞,而阻塞的气道因口径缩小促使气道阻力成倍增加,肺功能下降速度更加明显,同时潴留的气道黏液是细菌天然的培养基,气道内感染反复出现,导致患者病情的急性加重和病死率的攀升[1]。因此研究气道黏液高分泌的机制具有重要的临床价值。既往的研究文献[2-3]发现多种细胞因子参与了气道黏液高分泌机制,笔者之前的研究发现低氧性肺动脉高压肺小血管FHL1和Paxillin高表达[4-6],但FHL1和Paxillin是否参与COPD气道黏液高分泌的进程文献未见报道,为探讨该因子在大鼠气道黏液高分泌中的作用机制,本研究采用大鼠黏液高分泌模型复制的方法,分析该模型中黏液腺FHL1 和Paxillin的表达水平。
1 材料与方法
1.1 试剂:选用美国Sigma公司的内毒素制造动物模型、美国Neomarkers公司的黏蛋白5AC(MUC5AC)单克隆抗体、武汉博士德生物工程有限公司的FHL1兔抗人单克隆抗体和桩蛋白(Paxillin)小鼠抗人单克隆抗体以及SP试剂盒用于免疫组化实验。
1.2 动物模型制备及分组:雄性Wistar大鼠20只(购于四川大学实验动物中心),体质量200~220 g。将雄性Wistar大鼠随机分为正常对照组10只、实验组10只。正常对照组用空针抽取1%戊巴比妥钠(50 mg/kg)进行腹腔内注射麻醉,充分麻醉成功后立即经颈部切开皮肤,逐层将气管清楚暴露在视野中,同时将100 μL生理盐水注入气管内,然后直立大鼠并轻摇1~2 min。将浓度为2 g/L的LPS 100 uL注入实验组大鼠气管腔内。正常对照组和实验组置于同一实验室中,2组大鼠均自由饮水和摄食。
1.3 HE染色和AB-PAS染色:对第4天的内毒素注射组大鼠腹腔注射1%戊巴比妥钠50 mg/kg,然后取大鼠左肺以10%中性甲醛固定3 d,取左肺沿肺门横断取材,石蜡包埋,切片厚道6~8μm,进行HE常规染色,观察气道黏液腺形态学变化。进行HE常规染色和阿尔辛蓝-过碘酸雪夫(AB-PAS)染色,进行杯状细胞计数,同时观察气道黏液物质的水平。用SPOT COOL CCD软件采集图像,用MAGEPRO plus 4.1软件进行灰度扫描分析。
1.4 肺组织免疫组化染色:肺组织标本经10%中性甲醛固定后,石蜡包埋切片,切片厚道6~8 μm,进行免疫组化SP法染色。FHL1单克隆抗体和桩蛋白(Paxillin)单克隆抗体的最佳测试浓度是1∶100和1∶150。DAB显色,苏木素复染,阳性染色结果为细胞质内呈棕黄色,以PBS代替一抗作为阴性对照。对免疫组化染色片进行灰度扫描,观察正常对照组和实验组大鼠气道黏液腺FHL1、Paxillin和MUC5AC表达的相对强度。
1.5 统计学方法:采用SPSS 17.0统计软件进行统计学分析,2组间比较采用两样本均数比较的t检验,相关性分析采用皮尔逊法。
2 结果
2.1 正常对照组和实验组大鼠气道上皮杯状细胞积分和黏液物质的表达水平:实验组(内毒素E组)大鼠无论是杯状细胞积分还是黏液物质的表达均明显高于正常对照组大鼠(P<0.05),见表1。
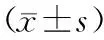
表1 2组大鼠气道上皮杯状细胞积分和黏液物质的表达
2.2 正常对照组和实验组大鼠气道及肺组织病理学改变:正常对照组大鼠气管腔宽敞,管壁组织较薄,管腔周围组织无明显炎症病变,亦未见杯状细胞存在于管腔内,见图1(目录后)。而实验组大鼠气管腔狭窄明显,管壁组织明显增厚,管腔周围组织可见炎症细胞浸润明显,同时管腔内出现大量杯状细胞,增生的杯状细胞分泌大量的黏液充斥在管腔内,有时可见管腔内黏液栓形成,见图2(目录后)。
2.3 正常对照组和实验组大鼠气道FHL1和Paxillin的表达水平:运用免疫组化染色法,图3(目录后)显示正常对照组大鼠FHL1表达很弱,而图4(目录后)显示实验组大鼠FHL1表达明显增强,经MAGEPRO plus 4.1软件分析图像显示,实验组与正常对照组FHL1表达水平差异有统计学意义(P<0.05)。同样,实验组Paxillin和MUC5AC的表达也较对照组明显增强(P<0.05),见图5-图6(目录后),FHL1、Paxillin和MUC5AC表达水平见表2。

表2 2组大鼠FHL1和Paxillin水平变化
2.4 FHL1和Paxillin表达与MUC5AC相关性:运用皮尔逊法发现,大鼠气道黏液腺FHL1表达与MUC5AC呈正相关(r=0.962,P<0.05);Paxillin表达与MUC5AC表达呈正相关(r=0.868,P<0.05)。
3 讨论
气道慢性炎症性疾病是呼吸系统常见病、多发病的病理生理基础,它受各种复杂因素调节和制约,可能通过相同或不同的调节通路调节气道黏液分泌过程。黏液高分泌的病理学基础是杯状细胞的化生和黏液腺体的肥大增生,小气道因为其特殊的解剖结构基础,主要靠杯状细胞的化生,而非黏液腺体的增生。因此作为公认的杯状细胞标志的MUC5AC可体现杯状细胞分泌状态。MUC5AC受多种因素的调节,如通过感染、免疫炎症反应介质、内外环境化合物在转录水平进行调节,也可通过蛋白酶在转录后水平进行调节[2-3]。
FHL1属于FHL(four and half LIM domain)家族,目前发现FHL家族有5个成员,即FHL1、FHL2、FHL3、FHL4、FHL5/ACT(activator of CREM in testis)。该家族蛋白结构中含有四个半LIM结构域,属于LIM超家族。LIM是3种转录因子Lin-11、Lsl-1和Mec3的缩写,LIM结构域由约55个氨基酸残基组成,富含半胱氨酸,形成2个锌指结构,其保守的半胱氨酸和组氨酸残基形成具有Zn2+结合的稳定三级蛋白质结构,是介导与其他蛋白质相互左右的主要区域[8]。桩蛋白是一种主要定位于黏着斑的信号蛋白,包含LD模体、LIM结构域等多种结构域。作为一种多结构域蛋白质,桩蛋白可与多种结构蛋白和信号蛋白结合,不仅可调节多种细胞因子和黏附分子,参与多种信号通路调节细胞黏附、驱化[9],还在很多病理方面起很重要的作用,包括氧化应激、炎症反应、内皮细胞功能障碍及肿瘤转移和迁移等[10-11]。
Christine Veith[12]采用免疫荧光染色、免疫组化技术和Western Blot等技术研究发现,Paxillin或FHL1在人PASMC与肌动蛋白微丝有关,提示纤维连接素增加细胞黏附和促进Paxillin定植在局部黏附复合体。用siRNA敲除的实验也发现PASMC和纤维连接素的连接依赖于Paxillin和FHL1的共同作用。去除Paxillin显示出肌动蛋白骨架的不完整性从而影响细胞黏附。这些结果显示纤维连接素、Paxillin和FHL1相互影响,对于ECM和细胞骨架蛋白的细胞黏附功能来说至关重要。该实验也发现Paxillin和FHL1相互作用,在肺动脉高压患者肺组织中两者均升高,而且其表达依赖于HIF-1α。肺动脉平滑的细胞这些均表明Paxillin和FHL1参与了肺动脉高压肺血管的重建。另有文献显示,低氧诱导/PDGE-BB-依赖的桩蛋白Paxillin激酶磷酸化可以被HIF-1α或imatinib治疗后的消耗所逆转。同时Li Y的研究发现FHL1在香烟诱导(CSE)的肺动脉平滑肌细胞增殖中起很大作用,用基因敲除FHL1表达的siRNA在细胞基础水平和CSE刺激下可以通过细胞周期蛋白依赖性激酶途径显著抑制细胞增殖和抑制细胞周期G1和S期的转录。CSE随着FHL1表达的增加明显增加,但在mRNA水平无变化。这种改变可能与延长FHL1的半衰期有关,导致蛋白降解的中和作用。相反,用腺病毒增加细胞增生和激发细胞周期G1和S期的转录同样可引起过度表达的FHL1。Paxillin 促进肿瘤血管生成、血管转移和侵袭,主要与其细胞黏附、迁移有关。既往文献对FHL1和Paxillin的研究主要集中在肺动脉高压、肺血管重建及骨骼肌方面,且多数与HIF-1α有关。笔者先前的研究也发现类似的结论,即FHL1和Paxillin在低氧性肺动脉高压大鼠肺组织和肺动脉平滑肌中高表达[4-6],而本次研究发现FHL1与Paxillin表达不仅与肺动脉高压肺血管重建有关,与气道炎症及杯状细胞分泌亦有关,在内毒素E组大鼠气道炎症比较明显的腺体组织内FHL1和Paxillin明显表达,而且其表达与MUC5AC的表达呈正相关,我们推测FHL1和Paxillin作为细胞骨架蛋白分子,可促进气道内黏液腺的增生和分泌,但其机制如何、FHL1和Paxillin是通过何种细胞信号通路参与杯状细胞黏液腺增生、与HIF-1α关系如何均需通过后续的试验研究来加以证实。
[1] Lange P,Vestbo J.Chronic mucus hypersecretion and the natural history of chronic obstructive pulmonary disease[J].American Journal of Respiratory and Critical Care Medicine,2016,193(6):602-603.
[2] Ha EV,Rogers DF.Novel therapies to inhibit mucus synthesis and secretion in airway hypersecretory diseases[J].Pharmacology,2016,97(1/2):84-100.
[3] Mahmood MQ,Sohal SS,Shukla SD,et al.Epithelial mesenchymal transition in smokers:large versus small airways and relation to airflow obstruction[J].International Journal of Chronic Obstructive Pulmonary Disease,2015,10(4):1515-1524.
[4] 杨艳娟,郑西卫,杨桂兰,等.低氧性肺动脉高压大鼠肺内FHL1的表达[J].中国现代医学杂志,2013,23(26):5-10.
[5] 杨艳娟,王海滨,杨桂兰,等.FHL1和桩蛋白在低氧/炎症诱导形成肺动脉高压大鼠肺内的表达[J].中国现代医学杂志,2015,25(21):6-10.
[6] 王海滨,杨艳娟,郑西卫,等.FHL1在低氧/炎症诱导形成肺动脉高压作用中的初步研究[J].宁夏医学杂志,2015,37(6):508-510.
[7] Raskin A,Lange S,Banares K,et al.A novel mechanism involving four and a half LIM domain protein-1 and extracellular signal-regulated kinase-2 regulates titin phosphorylation and mechanics[J].The Journal of Biological Chemistry,2012,287(35):29273-29284.
[8] Matulis CK,Mayo KE.The LIM domain protein FHL2 interacts with the NR5A family of nuclear receptors and CREB to activate the inhibin-α subunit gene in ovarian granulosa cells[J].Molecular Endocrinology (Baltimore,Md.),2012,26(8):1278-1290.
[9] Hagel M,George EL,Kim A,et al.The adaptor protein paxillin is essential for normal development in the mouse and is a critical transducer of fibronectin signaling[J].Molecular and Cellular Biology,2002,22(3):901-915.
[10] López-Colomé AM,Lee-Rivera I,Benavides-Hidalgo R,et al.Paxillin:a crossroad in pathological cell migration[J].Journal of Hematology & Oncology,2017,10(1):50.
[11] Watanabe-Nakayama T,Saito M,Machida S,et al.Requirement of LIM domains for the transient accumulation of paxillin at damaged stress fibres[J].Biology Open,2013,2(7):667-674.
[12] Veith C,Marsh LM,Wygrecka M,et al.Paxillin regulates pulmonary arterial smooth muscle cell function in pulmonary hypertension[J].The American Journal of Pathology,2012,181(5):1621-1633.
TheexpressionofFHL1andPaxillininratswithairwaymucushypersecretion
YANGYanjuan1,YANGGuilan1,ZHENGXiwei1,ZHANGHuifang1,CHENGDeyun2.
1.DepartmentofRespiratory,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,China;2.DepartmentofRespiratory,WestChinaHospital,SichuanUniversity,Chengdu610041,China
AbstractObjectiveTo explore the expression of FHL1 and Paxillin in rats mucous hypersecretion.MethodsTwenty males Wistar rats were divided into two groups:the endotoxin group and control group respectively.The count of epithelial goblet cell,the expression of mucin in bronchial tissues were examined by HE and Alcain Blue-Periodic and Schiff (AB-PAS) stained respectively.The expression of FHL1,Paxillin and MUC5AC in the lungs of rats were measured by immunohistochemical.The histological sections of the lungs were examined by image analysis.ResultsCompared with the control group,the count of epithelial goblet cell,the expression of FHL1,Paxillin and MUC5AC protein were increased in endotoin group (P<0.05).The expression of FHL1 and Paxillin were positively correlated with the expression of MUC5AC (r=0.962,0.868,P<0.05).ConclusionThe high expression of FHL1 and Paxillin may play an important role in the pathogenesis process of the airway mucous gland of hypersecretion.
FHL1;Paxillin;MucousHypersecretion
10.13621/j.1001-5949.2017.09.0769
宁夏自然科学基金项目(NZ1202)
1.宁夏医科大学总医院呼吸科,宁夏 银川 750004 2.四川大学华西医院呼吸科,四川 成都 610041
杨艳娟(1973-),女,主任医师,博士学位,主要从事肺动脉高压研究。
http://kns.cnki.net/kcms/detail/64.1008.R.20170926.1023.002.html
R56
A
2017-03-05责任编辑李 洁

