重组脂联素对胰岛素抵抗小鼠心肌脂联素水平的影响
刘雅娟,孙红茜,陈中青,张 青,徐 璐,杨锐英
·论 著·
重组脂联素对胰岛素抵抗小鼠心肌脂联素水平的影响
刘雅娟1,孙红茜2,陈中青1,张 青3,徐 璐4,杨锐英1
目的观察胰岛素抵抗(IR)小鼠心肌脂联素(APN)表达水平是否下降,观察重组APN是否可升高IR小鼠心肌APN表达水平。方法将小鼠分为5组,其中野生型C57BL小鼠分为对照组(CON组)和IR组,APN-/-小鼠分为APN - / -组(KO组),APN-/-+IR组(KIR组)和APN - / - + IR+ APN干预组(APN组)。CON组、KO组小鼠给予普通饲料喂养,IR组、KIR组、APN 组小鼠给予高脂饲料诱导IR模型。APN 组小鼠同时腹腔注射重组APN。喂养12周后取材,测空腹血糖、血清APN和血清胰岛素,计算胰岛素抵抗指数(HOMA-IR),采用免疫组化法和Western Blotting法检测心肌APN的表达。结果与CON组比较,IR组小鼠HOMA-IR水平升高,血清APN和心肌APN水平下降(P<0.05)。与IR组比较,KIR组小鼠HOMA-IR水平无明显差异(P>0.05),血清APN和心肌APN水平下降(P<0.05)。与KIR组比较,APN组小鼠HOMA-IR水平下降,血清APN及心肌APN水平升高(P<0.05)。结论IR时血清APN和心肌APN表达水平下降,重组APN可能通过改善IR升高心肌APN表达水平。
胰岛素抵抗;脂联素
脂联素(APN)具有改善胰岛素抵抗(IR)[1]、抗炎、改善动脉粥样硬化等作用。APN水平下降与高血压、冠心病、糖尿病等多种心血管疾病密切相关。有研究提示高血压时心肌APN水平下降[2],但IR时心肌APN水平是否下降并不明确。本研究以小鼠为观察对象,给予高脂饲料诱导IR,并给予重组APN干预,测定心肌APN等指标,以了解IR时心肌APN水平的变化、重组APN是否能通过改善IR升高心肌APN水平,为IR与APN之间的关系以及APN的应用提供新的依据。
1 材料与方法
1.1 实验动物:6~8周龄的健康SPF级雄性野生型C57BL小鼠16 只和同一品系的雄性APN-/-鼠24只,体重(20±2)g,由上海南方模式生物研究中心提供。在宁夏医科大学实验动物中心分笼饲养,环境为SPF级,温度20~25 ℃,12h/12h昼夜规律。小鼠均适应性喂养1周后进入实验,每周称体重(Weight),喂养12周。
1.2 分组及IR模型的建立:小鼠分为5组,每组8只,共40只,采用随机数字表法分组,其中野生型C57BL小鼠分为对照组(CON组)和IR组,APN-/-小鼠分为APN-/-组(KO组)、APN-/-+IR组(KIR组)和APN-/-+IR+APN干预组(APN组)。CON组、KO组小鼠给予普通饲料喂养,IR组、KIR组、APN 组小鼠给予高脂饲料诱导IR模型。APN 组小鼠同时腹腔注射重组APN 10 μg/(kg·d)。胰岛素抵抗指数(HOMA-IR)用来评估IR的程度。HOMA-IR=空腹血糖(FPG)×空腹胰岛素(FINS)/22.5。
1.3 主要试剂及材料:血糖仪及血糖试纸条购自强生公司。ELISA检测试剂盒购自R&D公司。全蛋白提取试剂盒与BCA蛋白含量检测试剂盒购自江苏凯基生物技术股份有限公司。免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司。普通饲料购自宁夏医科大学实验动物中心,高脂饲料(D12492)购自美国ResearchDiet 公司,高脂饲料含有碳水化合物20%、脂肪60%、蛋白质20%。
1.4 标本采集及实验室指标检测:所有小鼠干预12周后禁食12 h,断尾取血后用快速血糖仪测FPG。然后采用摘除眼球法取血1~2 mL,静置2 h后以3 000 r/min离心10 min分离出血清,-80 ℃保存。血清FINS和血清APN采用ELISA 法检测。
1.5 组织标本:小鼠取血后立即沿胸腔下缘剪开胸腔,取出小鼠心脏立即放进装有4℃生理盐水的培养皿中,摘去心外膜等心脏周围结缔组织,将心腔内储存的血液清洗干净,沿室间隔剪掉右心室,沿房间隔剪去心房,取左心室心尖部置于4%多聚甲醛中固定,其余左心室立即保存至-80 ℃冰箱中。
1.6 免疫组化法检测心肌APN表达水平:左心室组织石蜡切片常规脱蜡,过氧化氢灭活内源性过氧化物酶,胎牛血清封闭液封闭后加入APN一抗,以4 ℃过夜孵育,然后滴加生物素二抗,用DAB显色剂显色。APN阳性染色为细胞质内棕黄色云雾状或粗细不一的颗粒。在10×40倍光镜下观察拍片,选取同一个放大倍数下3个不同视野的图像测定光密度。
1.7 Western Blotting法检测心肌APN表达水平:心肌组织中的蛋白用蛋白提取试剂盒提取,然后检测提取的蛋白浓度。每组蛋白定量后,取50μg蛋白进行SDS-PAGE凝胶电泳,将蛋白转到PVDF 膜上,5%脱脂牛奶TBST封闭后,加入APN一抗4 ℃过夜孵育,次日用山羊抗兔二抗孵育60 min,ECL发光,暗室胶片曝光并进行扫描分析。
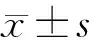
2 结果
2.1 5组小鼠FPG、FINS、HOMA-IR、Weight的比较:见表1。
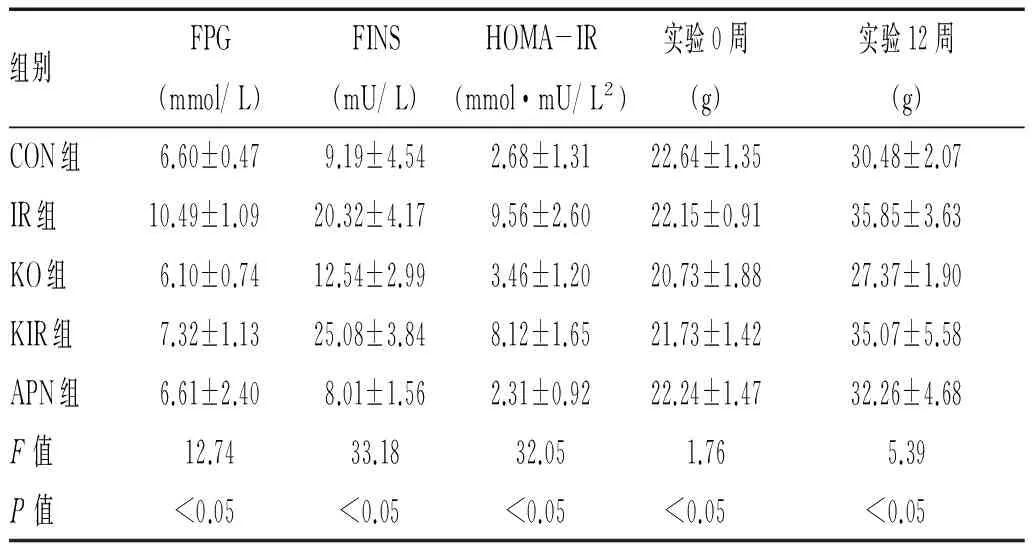
表1 5组小鼠FPG、FINS、HOMA-IR、Weight的比较
2.2 5组小鼠血清APN和心肌APN水平的比较:免疫组化法检测心肌APN(见图1-图4,目录后),APN阳性染色为细胞质内棕黄色云雾状或粗细不一的颗粒。Western Blotting法检测心肌APN表达水平,见表2。
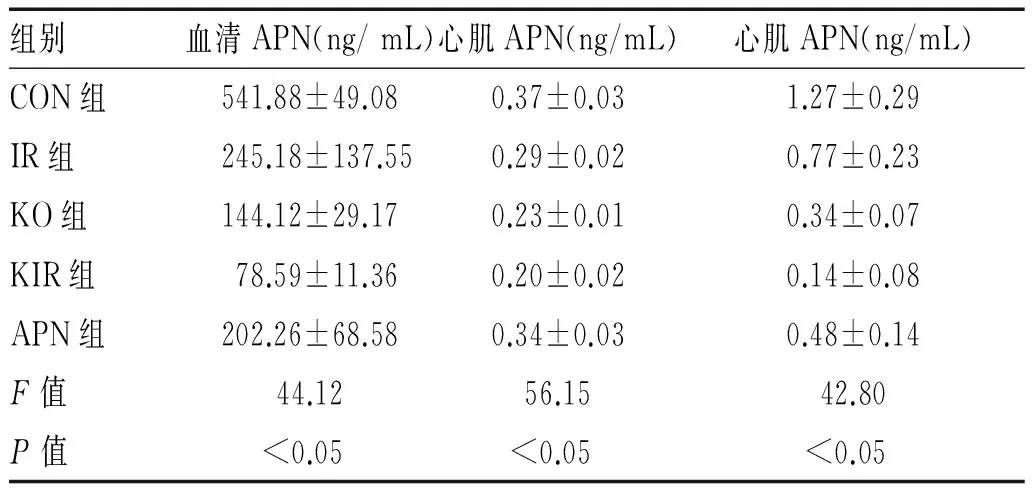
表2 5组小鼠血清APN和心肌APN水平的比较
3 讨论
APN是1995年Scherer 等首先从小鼠脂肪细胞中分离出的细胞因子。APN是目前发现的唯一与脂肪组织容积呈反比的脂肪细胞因子,而且与其他脂肪细胞因子不同的是APN对心血管具有保护作用。研究表明,APN可改善心脏重构、缩小心肌梗死面积[3]、减少心肌缺血再灌注损伤[4]。开始的研究认为,APN是由脂肪组织特异性分泌的。但进一步研究发现,骨骼肌、肝脏、结肠和胎盘也能分泌APN,但分泌量较脂肪组织少。Pieiro等的研究提示人和鼠心肌细胞也能合成和分泌APN,心肌细胞分泌的APN通过自分泌和旁分泌调节心脏功能和心肌代谢[5]。循环中APN浓度主要取决于基因、性别、营养、锻炼、腹部脂肪等因素,肿瘤坏死因子α、C反应蛋白、白介素-1、白介素-6等也可影响APN的浓度。
IR是一种胰岛素效应减低的现象,胰岛素作用的靶器官对胰岛素作用的敏感性下降。IR与心血管疾病密切相关。Stern 等[6]早在1995年就提出“共同土壤学说”,即心血管疾病并非2型糖尿病的并发症,而是以IR为基础的两种疾病并存。有研究表明,IR导致的心室重构可能与心肌APN受体1表达水平下降有关[7]。而本研究结果显示,IR时血清APN和心肌APN水平均下降。临床研究亦提示IR患者血浆APN水平下降[8],另一临床研究表明低APN组患者心血管不良事件发生率高于高APN组[9]。IR时APN水平下降可能通过以下途径:①高浓度胰岛素可抑制APNmRNA 的表达[10];②炎症介质对APN 的抑制作用可能也是IR时低APN血症的原因;③核因子κB(nuclear factor kappa B,NF-κB)是主要的炎症转录因子之一,IR时NF-κB抑制因子激酶引起NF-κB通路的激活,这可能是IR时APN 合成减少的原因之一[11]。
本研究结果显示,合并IR的APN基因敲除小鼠心肌APN水平下降明显,给予重组APN干预的小鼠IR较前减轻、心肌APN水平较前上升,提示重组APN可能通过改善IR起到升高心肌APN水平的作用。研究提示APN改善IR,一方面是通过调节代谢的作用,如增加骨骼肌脂肪酸氧化、抑制肝脏糖异生、直接作用于中枢系统促进葡萄糖利用[12]等;另一方面是对抗由其他脂肪因子和脂肪酸介导下的胰岛β细胞凋亡,保护β细胞免受自身免疫和脂毒性破坏。目前已有部分动物实验表明,直接注射重组APN可减轻动脉粥样硬化,防止心肌重构[7]及心肌缺血再灌注损伤。临床研究也提示罗格列酮[13]、福辛普利[14]等药物可升高血清APN。因为APN对心血管系统具有保护作用,提高APN水平或增强APN信号表达可能是一个有前景的心血管疾病的治疗策略[15]。
综上所述,本研究提示IR时心肌APN水平下降,重组APN可能通过改善IR升高心肌APN水平。这为IR与APN之间的关系提供了进一步研究的方向。但因外源性APN对心血管的保护作用及机制研究仍处于初步阶段,很多重要问题还未能解答,尚需进一步研究。
[1] Balsan GA,Da Costa Vieira JL,DeOliveira AM,et al.Relationship between adiponectin,obesity and insulin resistance[J].Revista da Associacao Medica Brasileira,2015,61(1):72-80.
[2] 孙蕊,薛万里,秦毅,等.福辛普利对自发性高血压大鼠心室重构及血清脂联素、心肌脂联素受体1表达的影响[J].临床心血管病杂志,2014(9):766-769.
[3] Zhang Yanqing,Wang Xiaoliang,Zhao Jianli,et al.Adiponectin inhibits oxidative/nitrative stress during myocardial ischemia and reperfusion via PKA signaling[J].American Journal of Physiology-Endocrinology and Metabolism,2013,305(12):E1436-E1443.
[4] Lau WB,Zhang Yanqing,Zhao Jianli,et al.Lymphotoxin-α is a novel adiponectin expression suppressor following myocardial ischemia/reperfusion[J].American Journal of Physiology-Endocrinology and Metabolism,2013,304(6):E661-E667.
[5] Pieiro R,Iglesias MJ,Gallego R,et al.Adiponectin is synthesized and secreted by human and murine cardiomyocytes[J].FEBS Letters,2005,579(23):5163-5169.
[6] Stern MP.Diabetes and Cardiovascular disease:the“ common soil”hypothesis.Diabetes,1995,44:369-374.
[7] 张青,刘雅娟,徐璐,等.脂联素对胰岛素抵抗及心室重构的影响研究[J].中国全科医学,2016,19(12):1401-1407.
[8] Yamauchi T,Kadowaki T.Adiponectin receptor as a key player in healthy longevity and obesity-related diseases[J].Cell Metabolism,2013,17(2):185-196.
[9] 陈佳纬,王永亮,刘守莲,等.脂联素对行急诊PCI的急性心肌梗死患者预后的预测价值[J].中国循证心血管医学杂志,2015(1):121-125.
[10] 叶银,胡海英,谷卫.胰岛素和人参皂甙Rg1对APNmRNA表达的影响[J].中国病理生理杂志,2006,22(11):2256-2258.
[11] 崔丽娟,都健,曾芙蓉,等.胰岛素抵抗大鼠脂联素与IKK mRNA表达的相关性研究[J].中国医科大学学报,2007,36(6):694-696.
[12] Guillod-Maximin EC.Adiponectin receptors are expressed in hypothalamus and colocalized with proopiomelanocortin and neuropeptide Y in rodent arcuate neurons[Z].2009:105.
[13] 邓宏明,刘红,邓华聪,等.罗格列酮改善2型糖尿病患者体脂分布、脂联素水平和组织胰岛素敏感性[J].中华内分泌代谢杂志,2005,21(3):233-236.
[14] 陈英杰,陈运立,吴贤仁.福辛普利对高血压左室肥厚患者血清脂联素水平的影响[J].山东医药,2010,50(12):71-72.
[15] 张宝伟,雷涛.脂联素及其临床应用前景[J].国际内分泌代谢杂志,2010,30(z1):29-31.
Influenceofrecombinantadiponectinontheexpressionlevelofmyocardialadiponectinininsulinresistantmice
LIUYajuan1,SUNHongqian2,CHENZhongqing1,ZHANGQing3,XULu4,YANGRuiying1.
1.HeartCentre,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,China;2.DepartmentofCardiology,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,China;3.DepartmentofCardiology,ProvincialHospitalAffiliatedtoShandongUniversity,Jinan2500500,China;4.NingxiaMedicalUniversity,Yinchuan750004,China
Correspondingauthor:YANGRuiying,Email:yangruiying@medmail.com
AbstractObjectiveTo observe the expression levels of myocardial adiponectin in insulin resistant mice,and to observe the influence of recombinant adiponectin on the expression levels of myocardial adiponectin in insulin resistant mice.MethodsThe wild type C57BL mice were divided into control group and insulin resistance group (IR group) and divided APN -/-mice into APN-/-group (KO group),APN-/-+insulin resistance group ( KIR group) and APN-/-+insulin resistance + adiponectin intervention group ( APN group).Control group and KO group were given common feed;IR group,KIR group and APN group were given high-fat feed to induce insulin resistance model;APN group was given intraperitoneal injection of recombinant adiponectin.The feed and intervention lasted for 12 weeks.Glucometer was used to detect FPG level,ELISA was used to detect FINS level and serum adiponectin level,and HOMA-IR was calculated.Immunohistochemical method and western blotting method were employed to determine the expression level of myocardial adiponectin.ResultsCompared with control group,IR group was higher in HOMA-IR,lower in the level of serum adiponectin and myocardial adiponectin.Compared with IR group,KIR group was lower in the level of serum adiponectin and myocardial adiponectin.Compared with KIR group,APN group was lower in HOMA-IR,higher in the level of serum adiponectin and myocardial adiponectin.ConclusionInsulin resistance could decrease the expression level of serum adiponectin and myocardial adiponectin.Recombinant adiponectin could elevate the expression levels of myocardial adiponectin in insulin resistant mice.
Insulinresistance;Adiponectin
10.13621/j.1001-5949.2017.09.0772
国家自然科学基金(81360026)
1.宁夏医科大学总医院心脏中心干部病房,宁夏 银川 7500042.宁夏医科大学总医院心脏中心内科,宁夏 银川 750004 3.山东大学附属省立医院心内科,山东 济南 250000 4.宁夏医科大学,宁夏 银川 750004
刘雅娟(1982-),女,主治医师,硕士学位,主要从事冠心病及代谢综合征研究。
杨锐英,Email:yangruiying@medmail.com
http://kns.cnki.net/kcms/detail/64.1008.R.20170926.1023.004.html
R587
A
2017-03-27责任编辑王凯荣

