α3 nAChRs亚基基因中定点氨基酸的突变研究
雷宇苗,朱晓鹏,凌小惠 ,张 璐, 长孙东亭, 罗素兰
(1.海南大学 热带生物资源教育部重点实验室/海口市海洋药物重点实验室,海南 海口 570228;2. 海南大学 海洋学院,海南 海口 570228)
α3 nAChRs亚基基因中定点氨基酸的突变研究
雷宇苗1,2,朱晓鹏1,2,凌小惠1,张 璐1,2, 长孙东亭1,2, 罗素兰1,2
(1.海南大学 热带生物资源教育部重点实验室/海口市海洋药物重点实验室,海南 海口 570228;2. 海南大学 海洋学院,海南 海口 570228)
为了利用重叠延伸PCR技术对α3亚基中指定的氨基酸进行定点突变,以便为今后深入研究烟碱型乙酰胆碱受体(Nicotinic acetylcholine receptors, nAChRs)中关键氨基酸的功能及与药物作用的分子机制奠定基础,本研究以α3 nAChRs亚基基因作为模板,利用重叠延伸PCR技术对α3亚基中指定的氨基酸进行了定点突变,突变后的基因片段被连接到pMDTM18-T载体上,并通过基因测序来验证突变的正确性.结果表明:通过重叠延伸PCR法已将α3 nAChR N端第174位的丙氨酸(Alanine,Ala,A)成功突变为谷氨酸(Glutamic acid,Glu,E).由此认为:重叠延伸PCR法成功实现了α3 nAChRs亚基基因中定点氨基酸的突变,该方法可为更多受体突变型的建立提供借鉴,也可为研究nAChRs中关键氨基酸的功能以及药物与nAChRs相互作用的分子机制奠定基础.
烟碱型乙酰胆碱受体; 定点突变; 重叠延伸PCR
近年来,随着分子生物学研究的不断发展,定点突变技术逐渐成为研究蛋白质结构和功能之间相互作用关系的重要工具[1].尤其是在研究受体和通道蛋白结构及其功能方面,定点突变技术在确定受体和通道蛋白中关键氨基酸的作用、通道开放调控的分子机制以及药物与受体相互作用的分子机理等方面具有广泛的应用前景[2].重叠延伸PCR法是目前常用的一种定点突变技术,该方法主要采用一对互补配对的引物,使PCR产物形成重叠链,然后在随后的扩增反应中通过重叠链的延伸来实现片段的重叠连接[3-4](见图1),并在互补引物中设计突变位点来实现目的片段的突变.该技术不受突变位置及突变类型的限制,可以在DNA的任何位置引入突变,还可以通过设计两侧引物和添加酶切位点来进一步地克隆连接[5].重叠延伸PCR法的成功率很高,且价格低廉,因而其运用广泛.
nAChRs是一种具有重要生理功能的配体门控离子通道,它可以释放多巴胺、去甲肾上腺素、五羟色胺、γ-氨基丁酸等多种神经递质,具有介导中枢和外周神经系统的生理功能,是一种普遍存在于动物界中的具有重要生理作用和临床研究意义的膜蛋白[6].nAChRs可由α亚基或者β亚基单独或者共同组合而形成不同的nAChRs亚型,不同的亚型具有不同的生理功能,其也与许多疾病的发生和发展密切相关,如α3β2或α3β4 nAChR与疼痛、癌症和重症肌无力等有关[7],α6* nAChRs与成瘾和记忆损伤有关[8-9],α7 nAChRs与急性肺损伤、老年痴呆症等疾病有关[10],α9α10 nAChRs与小细胞癌症和慢性疼痛有关[11].由于这些不同亚型的结构都非常相似,许多配体极难区分,因此这也给各种亚型的生理学和药理学功能的研究带来了极大的困难.
α3亚基可参与调节机体器官的平衡,对机体的生长发育具有重要的作用[12].它主要参与α3β2 nAChRs和α3β4 nAChRs两种亚型的组成,这两种亚型主要分布在中枢和外周神经系统中,可参与人体许多生理和病理过程,如癌症,疼痛等;因此,α3* nAChRs也是治疗相关疾病的潜在药物靶点.尽管如此,然而目前有关α3亚基参与调控机体的病理机制仍不清楚,因此,构建α3亚基的点突变型,并利用氨基酸定点突变技术研究α3 nAChRs亚基中关键氨基酸的作用,不仅有助于研究α3 nAChRs亚基结构与其功能的关系,而且也有助于研究药物与α3 nAChRs相互作用的分子机制.鉴此,本实验以α3 nAChRs亚基基因作为模版,设计了一对互补引物(包括突变位点)和一对侧翼引物,同时采用重叠延伸PCR技术对α3 nAChRs N端配体结合区域的第174位氨基酸进行了定点突变,并将突变基因片段克隆到pMDTM18-T载体上,然后将其转化到DH5α大肠杆菌细胞中,最后于提取质粒后通过基因测序来确认其突变结果的正确性.
1 材料与方法
1.1材料
1.1.1 实验材料α3 nAChRs基因、大肠杆菌(E.coli)DH5α均来自本实验室,引物由生工生物工程(上海)股份有限公司合成.
1.1.2 试 剂质粒小提试剂盒购于美国OMEGA公司;DNA Marker DL10000、PrimeSTAR·HS DNA Polymerase、Taq DNA聚合酶、pMDTM18-T、DpnI酶、氨苄青霉素等购于宝生物工程(大连)有限公司;GoldViewⅡ型核酸染色剂购自北京索莱宝科技有限公司.
1.1.3 仪 器PCR仪(ABI 2720)、紫外可见分光光度计(Nanodrop)、小型水平电泳仪(Bio-Rad)、凝胶成像系统(Alphalmager MiNi)等.
1.2方法
1.2.1 PCR引物设计根据重叠延伸PCR介导的定点突变技术的原理,采用Premier 5.0软件设计了4条引物,该引物将α3亚基基因N端(配体结合区)第174位密码子为GCU的Ala突变成密码子为GAG的Glu(见表1).由表1可知,F和R为侧翼引物,用于扩增基因全长;Rm和Fm则为两条完全互补的引物,且已经引入了突变位点(字体加粗的为突变位点),它们分别与侧翼引物F和R搭配来扩增突变基因及其两侧的基因片段.
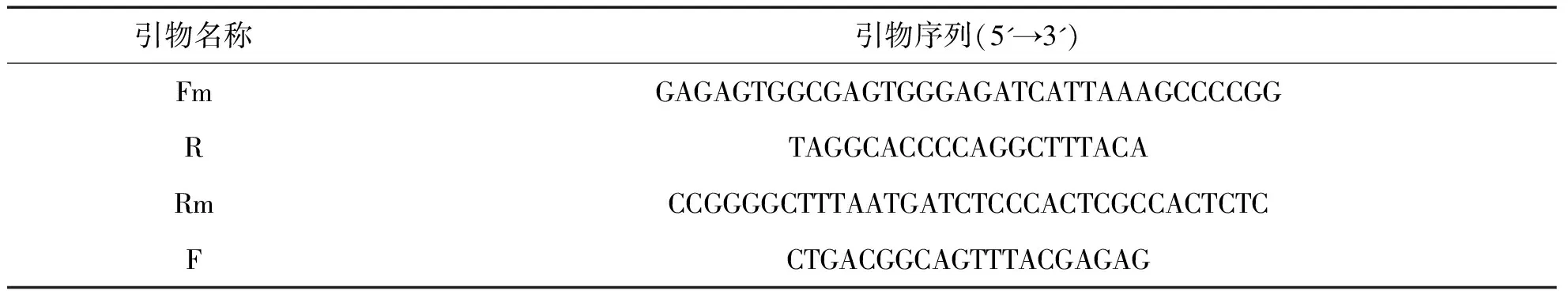
表1 引物列表
1.2.2 目的基因的突变重叠延伸PCR法是通过3轮PCR反应来完成的(原理如图1所示),即使用OMEGA质粒小提试剂盒来提取α3 nAChRs的质粒,并以其为模板,分别以Fm和R以及Rm和F为引物,进行两次独立的PCR以扩增受体基因片段.具体而言就是先以基础质粒作为模板,用正向侧翼引物F和突变引物Rm进行第一轮PCR扩增,并使用PrimeSTAR®HS DNA Polymerase,所得产物是包含突变位点的上游片段;然后也以基础质粒为模板,用反向侧翼引物R和突变引物Fm进行第二轮扩增,也使用PrimeSTAR®HS DNA Polymerase,所得产物为包含突变位点的下游片段;第三步则是将第一轮PCR和第二轮PCR的产物同时作为模版,用正/反向侧翼引物F和R进行第三轮PCR扩增,并使用Taq酶,所得产物即为引入了目的突变的全长基因片段.以上PCR的条件均为94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,共25个循环;末次循环后,72 ℃再延伸5min.第一轮PCR和第二轮PCR的反应体系为50 μL,包括:5×Buffer 10 μL、dNTP 4 μL、PrimeSTAR®HS DNA Polymerase 2 μL、引物(150~200 ng),质粒模板(100~150 ng)、补充到体系50 μL所需的ddH2O;第三轮PCR的反应体系为25 μL,包括:第一轮PCR和第二轮PCR产物各3 μL、5×Buffer 5 μL、dNTP 4 μL、补充到体系25 μL所需的ddH2O 25 μL.

图1 重叠延伸PCR 原理图
注:第一轮PCR和第二轮PCR使用的都是高保真酶,第三轮PCR使用的则是Taq 酶,并提供polyA尾巴,以便连接T载体.
1.2.3 PCR产物的克隆在进行第三轮PCR前,在第一轮和第二轮PCR产物里分别加入1 μL DpnI酶,并在37 ℃水浴2 h以酶解模版质粒(DpnI不酶解PCR延伸产物,这是由于原来的质粒模版来源于常规大肠杆菌,是经Dam甲基化修饰的,它因对DpnI敏感而被切碎;而在体外合成的带突变序列的质粒,由于其没有甲基化而不被切开);然后将第三轮PCR产物在T4连接酶的作用下与克隆载体pMDTM18-T连接,并将连接产物转化到DH5α大肠杆菌感受态细胞中,接着取50 μL摇床培养1 h的菌液,将其涂布于含氨苄青霉素的LB平板中,并于37 ℃培养16 h;最后挑取单个菌落,在含氨苄青霉素的LB液体培养基中培养13 h.
1.2.4 PCR结果测序验证用质粒小提试剂盒提取上述克隆质粒,将提取的重组质粒送到生工生物工程(上海)有限公司进行目的片段序列的测序,并利用NCBI里的Blast将测序结果进行序列比对.
2 结果与分析
2.1各段PCR结果的验证以α3 nAChR的质粒为基础质粒模板,用正向侧翼引物F和突变引物Rm进行第一轮PCR扩增,所得产物是包含突变位点的上游片段,其结果是以w=0.8%的琼脂糖凝胶电泳来验证(见图2).图2A中M孔道为DL 10 000的DNA Maker,第1孔道为第一轮PCR产物,第2孔道为第二轮PCR产物,从从图2A中可以看出,在目的条带区域有符合条件的特异性扩增条带,条带大小约为1 000 bp,但条带不是特别清晰,这可能是由于扩增产物的浓度较低的缘故;接着,也以基础质粒为模板,用反向侧翼引物R和突变引物Fm进行第二轮扩增,所得产物为包含突变位点的下游片段,其结果也以w=0.8%的琼脂糖凝胶电泳来验证(见图2),从结果可知,在目的条带区域有符合条件的特异性扩增条带,条带大小约为1 000 bp,且条带清晰.在第一轮PCR和第二轮PCR的产物里分别加入1 μL的DpnI酶,并于37 ℃水浴2 h以酶切质粒模版,这是为了避免在随后的转化过程中出现假阳性,随后再将第一轮PCR和第二轮PCR的产物同时作为模版,用正/反向侧翼引物F和R进行第三轮PCR扩增,所得产物即为含α3 nAChRs的全长基因片段,其结果以w=0.8%的琼脂糖凝胶电泳来验证(见图2).图2B中M孔道为DL 10 000的DNA Maker,第1孔道为α3 nAChRs质粒,其大小约为4 500 bp;第2孔道为第三轮PCR产物,其大小约为2 000 bp,从图2B中可以看出,第三轮PCR成功地将第一轮PCR产物和第二轮PCR产物连接在一起,实现了片段的重叠延伸.
2.2克隆结果分析将第三轮PCR产物在T4连接酶的作用下与大小为2 692 bp的克隆载体pMDTM18-T(具有Amp+抗性)连接后,可以获得大小约为4 700 bp的片段,当以w=0.8%的琼脂糖凝胶电泳来验证时,其结果见图2.在图2C中,在2 000 bp处有未连接成功的清晰条带,在4 700 bp处也有目的条带,但不是特别清晰,这可能是由于载体模版量比较少,从而导致连接产物较少的缘故.当样品被转化到DH5α大肠杆菌细胞中时,在含抗性的LB平板中可长出菌落(如图3),从图3可看出,菌落长得比较密集,这证明重组质粒的转化效率较高,这可能是由于在第三轮PCR前,已加入了DpnI 酶,其酶解了原来的质粒模版,减小了克隆结果可能出现的假阳性的缘故.在用质粒小提试剂盒提取重组质粒后,取2 μL质粒,并以w=0.8%的琼脂糖凝胶电泳来验证其结果(如图2D),从图2D中可以看出,重组质粒的条带清晰,其大小符合目的片段,这证明克隆载体成功连接.将所提取的重组质粒送到生工生物工程(上海)有限公司进行目的片段的序列测定,并利用NCBI里的Blast对测序结果进行序列比对,通过比对可知,已将目的基因GCT变成了GAG(见图4).

图2 PCR 结果图
A:图A为第一轮和第二轮PCR的结果图,孔道1第一轮PCR产物,孔道2为第一轮PCR产物(孔道2);B:图B为第三轮PCR的结果图,孔道1为α3 nAChR质粒,孔道2为第三轮PCR的产物;C:图C为PCR产物的克隆连接图,孔道1为连接片段;D:图D为重组质粒的琼脂糖电泳图,孔道1为重组质粒;A—D中的M 孔道为DL 10 000的DNA Maker.

图3 重组质粒的转化

图4 序列对比图
3 总 结
nAChRs广泛分布于中枢和外周神经系统中,与许多疾病的发生发展密切相关,近年来已成为科研人员争相研究的热点.但目前nAChRs结构和功能之间的关系还未可知,这也成为研究nAChRs的一大阻碍.而定点突变技术可以通过氨基酸的替换来研究蛋白质结构和功能之间的相互作用关系,已经成为一种的重要研究工具.
α3亚基广泛分布于皮层及丘脑各核团中,可参与调节机体许多重要的生理进程.研究证明,敲除α3基因的小鼠与正常小鼠相比会出现体重下降、生长速度缓慢、智力发育低下、视力发育低下、泌尿功能系统受损等现象[12].α3亚基一般可以与β2或β4亚基结合,形成有功能的α3β2或α3β4 nAChR亚型.α3β2 nAChRs已被鉴定为是一种治疗机械性疼痛的分子靶标,α3β4 nAChRs也被报道可参与到小细胞肺癌的治疗[13-14].由此可见α3亚基不仅在机体的生长发育中起到了重要的调节作用,还是许多疾病的潜在作用靶点,但目前α3亚基参与调控机体的病理机制还未清楚,为此,利用氨基酸定点突变技术来构建α3亚基的点突变型,对研究α3 nAChRs亚基中关键氨基酸的作用,揭示α3 nAChRs亚基结构与功能的关系,为研究药物与α3 nAChRs相互作用的分子机制奠定基础.该研究以α3 nAChR亚基基因为模版,采用重叠延伸PCR技术实现了目的基因的突变,这也为日后更多突变体的构建提供方法.同时也证实了重叠延伸PCR技术是一种高效、经济的DNA突变方法.重叠延伸PCR在设计互补引物时,至少需要有10 bp完全匹配,也可以根据需要使之完全互补配对.在设计两端的侧翼引物时可以根据需要设计酶切位点,以便于进一步的连接克隆.第一轮和第二轮PCR产物之间通过形成的重叠链可在随后的扩增反应中通过重叠链的延伸将片段拼接起来.第一轮和第二轮PCR使用高保真聚合酶可减少碱基之间的错配机率,提高突变的正确率,且第一轮和第二轮PCR产物分别加入DpnI酶,酶切质粒模版,可避免出现假阳性,保证突变的正确性.第三轮PCR使用Taq酶可使PCR产物产生polyA尾巴,便于和T载连接,做进一步研究.
综上结果证明重叠延伸法介导α3 nAChR基因的定点突变方法构建成功,实验室建立了一种对α3 nAChRs结构和功能的研究方法,这对日后更多突变体的构建起到了指导作用,为深入研究受体配体间的关系以及指导药物的改造奠定基础.
[1] 徐芳,姚泉洪,熊爱生,等.重叠延伸PCR技术及其在基因工程上的应用[J].分子植物育种,2006,4(5):747-750.
[2] 雒丽娜,王盛,王玉炯.利用重叠延伸PCR技术进行定点突变研究[J].安徽农业科学,2012,40(10):5 779-5 781.
[3] 张浩,毛秉智.定点突变技术的研究进展[J].免疫学杂志,2000,6(4):108-110.
[4] 帅勇,胡兴旺,易朵,等.重叠延伸PCR法构建小鼠Sumf1基因的定点突变真核表达载体[J].生命科学研究,2009,13(5):430-436.
[5] 戴灿,苗聪秀,卢光琇.基于重叠延伸PCR法的定点突变技术[J].现代生物医学进展,2010,10(3):411-412.
[6] 朱晓鹏,于津鹏,罗素兰,等.乙酰胆碱受体亚型α3β2的表达研究[J].生物技术,2013,23(6):22-26.
[7] Luo S,Akondi K B,Zhangsun D,et al.A typical α-conotoxin LtIA from Conus litteratus targets a novel microsite of theα3β2 nicotinic receptor[J].Journal of Biological Chemistry,2010,285(16):12 355-12 366.
[8] Champtiaux N,Han ZY,Bessis A,et al.Distribution and pharmacology ofα6-containing nicotinic acetylcholine receptors analyzed with mutant mice[J].J Neurosci,2002,22:1 208-1 217.
[9] Vailati S,Hanke W,Bejan A,et al.Functionalα6-containing nicotinic receptors are present in chick retina[J].Mol Pharmacol,1999,56:11-19.
[10] Su X, Lee J W, Matthay Z A, et al.Activation of theα7 nAChR reduces acid-induced acute lung injury in mice and rats[J].American Journal of Respiratory Cell & Molecular Biology,2007,37(2):186-192.
[11] Sulan Luo,Dongting Zhangsun,Peta J,et al.Cloning,synthesis,and characterization of αO-conotoxin GeXIVA,a potent α9α10 nicotinic cetylcholine receptor antagonist[J].Proc Natl Acad Sci USA,2015,111(3):848-858
[12] Madeline N,Daniel C,Silva W I,et al.Functional contribution of α3L8′ to the neuronal nicotinic α3 receptor[J].Journal of Neuroscience Research,2008,86(13):2 884-2 894.
[13]I mprogo MR, Soll LG, Tapper AR, et al. Nicotinic acetylcholine receptors mediate lung cancer growth[J].Front Physiol,2013,4(4):251-255.
[14] Young T, Wittenauer S, Mcintosh J M, et al. Spinalα3β2* nicotinic acetylcholine receptors tonically inhibit the transmission of nociceptive mechanical stimuli[J].Brain Research,2008,1229(5):118-124.
Abstract:In order to lay a foundation for the further functional study of the key amino acids of α3 nAChR, in the study, α3 nAChRs subunit gene was usd as the template, and overlap extension PCR technique was used for point mutation of α3 nAChRs. Then, the mutant was cloned into pMDTM18-T for sequencing. The sequencing results indicated that α3 nAChR’s 174th Ala is mutated to Glu successfully.
Keywords:nAChRs; site-directed mutagenesis; overlap extention PCR
Site-directedMutagenesisofα3nAChRsSubunit
Lei Yumiao1,2, Zhu Xiaopeng1,2, Ling Xiaohui1, Zhang Lu1,2, Zhangsun Dongting1,2, Luo Sulan1,2
(1. Key Laboratory of Tropical Biological Resources of Ministry of Education, Key Laboratory for Marine Drug of Haikou, Hainan University, Haikou 570228, China; 2. The Ocean College, Hainan University, Haikou 570228, China)
R93
A DOl:10.15886/j.cnki.hdxbzkb.2017.0042
2017-03-23
国家自然科学基金(81420108028);长江学者和创新团队发展计划(IRT_15R15);海南省普通高等学校研究生创新科研课题(Hys 2016-15);海南省高等学校科学研究资助项目(Hnky2017-16)
雷宇苗(1993-),女,汉族,硕士研究生 研究方向:海洋药物 E-mail:m18889277924@163.com
罗素兰,女,博士,教授,博士生导师 研究方向:海洋药物 Tel: (0898)66289538 E-mail:luosulan2003@163.com
1004-1729(2017)03-0268-05

