烟酸和1,10-邻菲啰啉构建的Cu(Ⅱ)配合物 与DNA的相互作用
李小芳, 冯小强
(天水师范学院化学工程与技术学院,甘肃天水 741001)
医学上常以DNA为靶分子来设计许多抗癌药物,且药物的抗癌活性与其嵌插结合DNA的能力有关。因此,研究DNA与小分子之间的键合作用,对设计、筛选新型的抗癌新药具有重要的意义。自从顺铂类抗癌药物成功应用于临床后,对结构多样的金属配合物的发光特性、磁性、抑菌活性、抗氧化活性以及与DNA结合方式的研究颇多。铜是生物体内正常的新陈代谢所必须的,具有抗炎杀菌、抗癌抗凝血等功效,是治疗许多疾病的一个主要因素。已报道了铜配合物和铜盐的混合物可以有效地抑制癌细胞增殖,并诱导癌细胞凋亡,并且铜配合物的抗癌药性优于顺铂类抗癌药物[1]。因此,铜配合物的抗癌药性以及与DNA的作用机制引起了药物学家和生物学家的广泛关注。
基于铜配合物具有各种重要的生物活性,如抗肿瘤活性、抗菌作用及作为人工核酸酶,烟酸(NA)具有抗肿瘤、抗菌消炎作用和抑制黄嘌呤氧化酶活性,本文以1,10 -邻菲啰啉(Phen)、NA为配体,合成了三元Cu(Ⅱ) 配合物([Cu(Phen)(NA)]·H2O),通过红外光谱、紫外光谱、热分析和电化学手段对配合物进行了表征,同时采用光谱法、循环伏安法、粘度测定和DNA变性实验,研究Cu(Ⅱ)配合物与鲱鱼精DNA的相互作用。
1 实验部分
1.1 仪器和试剂
Spectrum One傅立叶红外光谱仪(美国,Perkin Elmere公司);TG -DTA热分析仪(美国,Perkin Elmere公司);RF-5301PC荧光光谱仪(日本,岛津公司);UV-2450紫外-可见光谱仪(日本,岛津公司);CHI660B电化学工作站(上海辰华仪器有限公司)。
鲱鱼精DNA(Sigma公司产品,A260/A280=1.85),烟酸(NA)(化学纯,天津化学试剂一厂),1,10-邻菲啰啉(Phen)(分析纯,上海中秦化学试剂有限公司)。
1.2 实验步骤
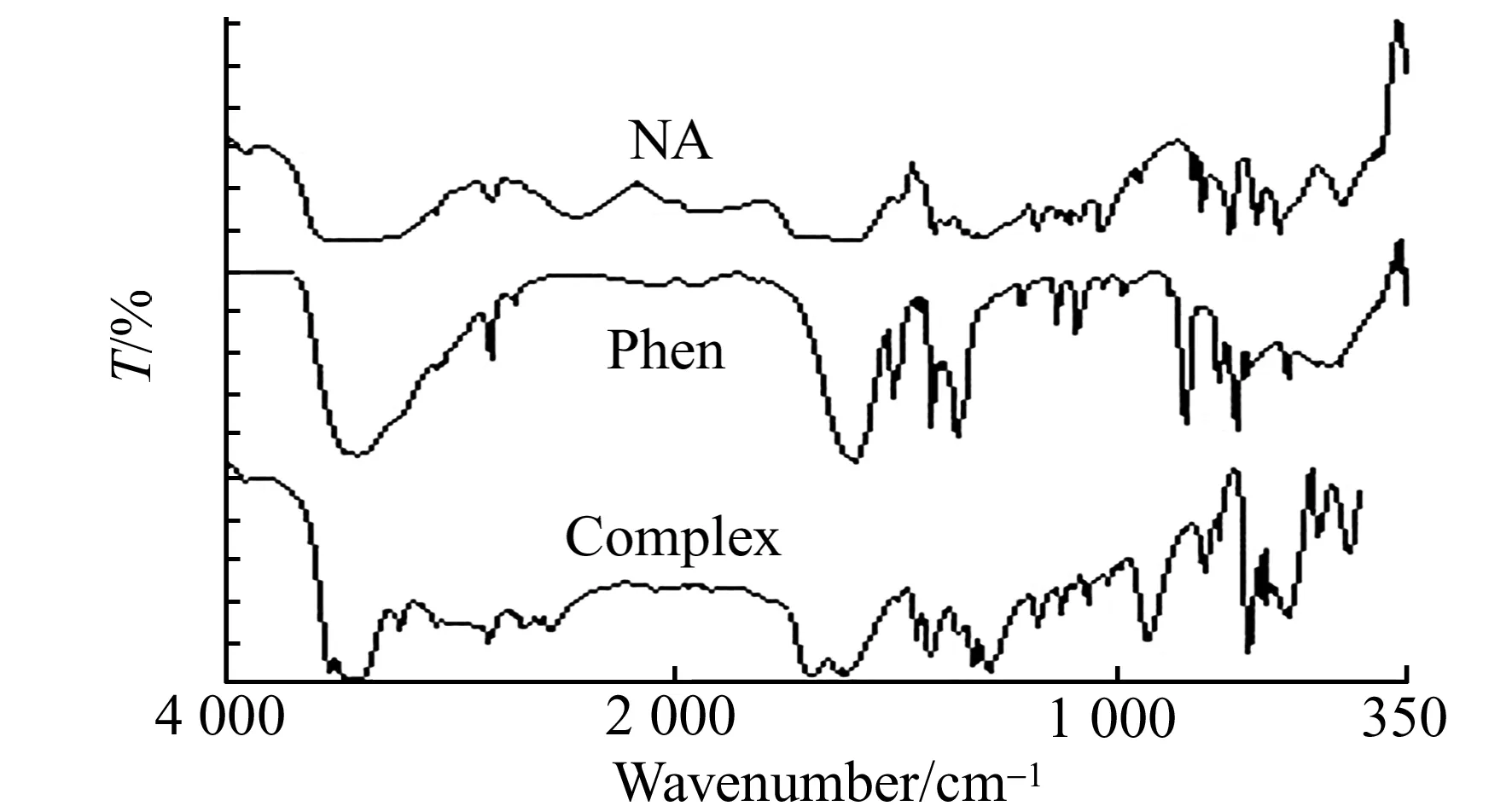
图1 NA、phen和配合物的红外(IR)光谱图Fig.1 IR spectra of NA,phen and complex
1.2.1配合物的合成在搅拌条件下,将5 mL含16 mg NaOH(0.4 mmol)溶液,加入到含49.6 mg NA的15 mL(0.4 mmol)溶液中,然后加入5 mL含64 mg无水CuSO4(0.4 mmol)溶液,室温下搅拌30 min后,缓慢滴加15 mL含79.2 mg(0.4 mmol)Phen的无水乙醇溶液,滴加完毕后于50 ℃下反应6 h。冷却至室温,有深蓝色沉淀析出,抽滤,自然干燥。滤液于室温下静止数周后析出蓝色晶体。配体NA、Phen和配合物的红外光谱图如图1所示:配合物在3 444 cm-1处出现的吸收峰归属为结晶水。配体NA在1 671 cm-1处的羧羰基特征峰在配合物中消失,而出现了羧酸根1 606 cm-1、1 415 cm-1处的反对称和对称振动吸收峰,二者差值为191 cm-1,表明羧基以双齿形式与Cu(Ⅱ)配位[2];配体Phen的特征吸收峰出现在1 561 cm-1和1 506 cm-1处,形成配合物后特征吸收峰分别移到1 616 cm-1、1 518 cm-1,表明Phen以双齿螯合形式与Cu(Ⅱ)配位。同时配合物中还出现配体中没有的Cu-O和Cu-N的振动峰。
紫外光谱表明配体Phen在波长218 nm和278 nm有两个吸收峰,NA在256 nm有π-π*跃迁引起的吸收峰,与Cu(Ⅱ)形成配合物在205 nm、271 nm和293 nm附近出现3个吸收峰,并且吸收强度比游离配体的吸收更宽更强,紫外光谱数据如表1所示。这可能是由于配合物中芳环数目的增多形成了离域的大共轭体系,发生跃迁的几率增大所致。紫外光谱表明Phen和NA配体与Cu(Ⅱ)配位形成了新的配合物。
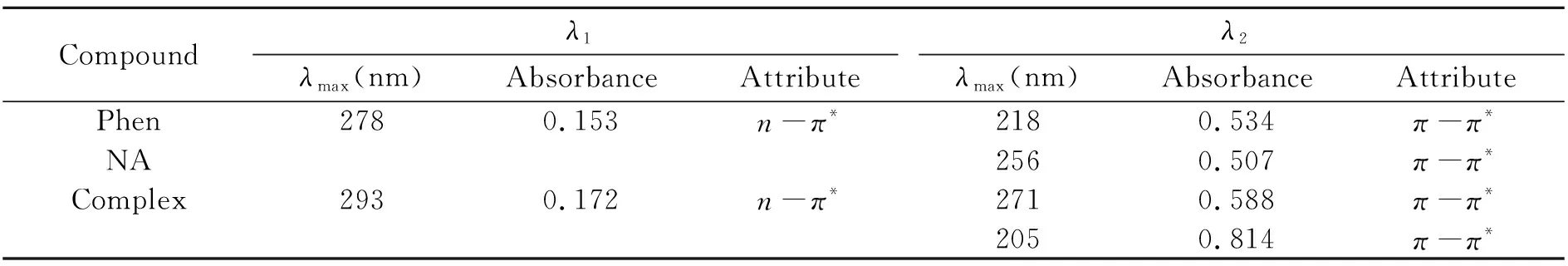
表1 配体、配合物的紫外光谱数据Table 1 UV dates of ligands and complex
在氮气保护下,以10 ℃/min的升温速度升温至1 000 ℃,配合物的热分析(TG -DTG)见图2。TG曲线在100 ℃之前失重3.4%,表明配合物中存在一分子结晶水,水分子也参与配位。当配合物升温至200 ℃,对应TG曲线开始明显下滑,随着温度升高,TG曲线在200~500 ℃之间出现了一个幅度较大失重过程,失重55.6%,是一分子NA的氧化分解。710 ℃附近有一个熔化的吸热峰,对应质量失重为14.0%,该过程属于一分子Phen的氧化分解。当温度持续升高至800 ℃时,配合物质量仍有22.8%的剩余,最终分解产物可能为CuO。结合TG曲线、红外、紫外分析手段,初步确定三元铜配合物组成为[Cu(Phen)(NA)]·H2O。
1.2.2配合物与鲱鱼精DNA的作用在参比池中加入3 mL的蒸馏水,样品池中加入3 mL配合物溶液,每次往两池中同时加入10 μL的DNA溶液,使DNA浓度逐渐增大。混匀放置10 min后,在200~500 nm波长范围内扫描配合物在加入DNA前后吸收光谱的变化;固定DNA浓度,加入一定浓度的配合物,于20 ℃恒温作用30 min,测量流经时间;设定扫描电位区间为-1.2~1.0 V,采用三电极系统(玻碳电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为对电极),在N2气氛下测定配合物在加入DNA前后的循环伏安曲线;将DNA和不同浓度的配合物溶液混合,从30 ℃到100 ℃恒温,每隔5 ℃,取出一定量测定不同温度下的吸光度(A260 nm)[3]。
2 结果与讨论
2.1 紫外光谱法研究配合物与DNA之间的作用
配合物原位于205、271和293 nm的吸收峰,在加入DNA后均有一定程度的减色,同时在205 nm处的吸收峰位出现了明显红移趋势,当滴加120 μL DNA时,峰位从205 nm红移至218 nm处,如图3所示。根据文献报道,减色效应是与DNA双螺旋结构密切相关的光谱性质[4],当在配合物中加入DNA后,其吸收峰强度减少,波长红移,说明配合物与DNA之间以嵌插方式相互结合[5]。
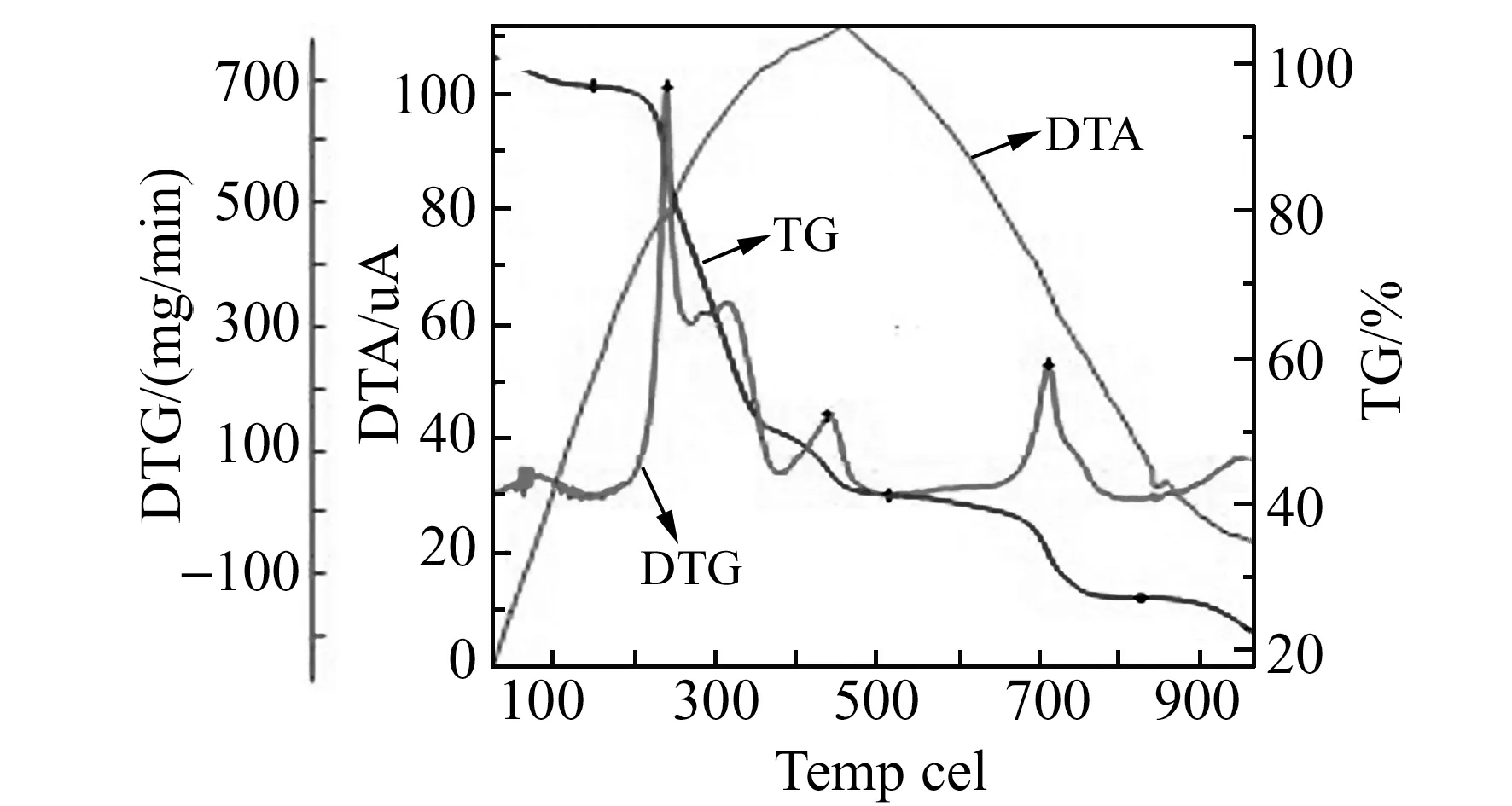
图2 配合物的TG -DTG -DTAFig.2 TG -DTG -DTA of the complex Test conditions:N2 gas protection,the temperature of 10 ℃/min heating up to 1 000 ℃.
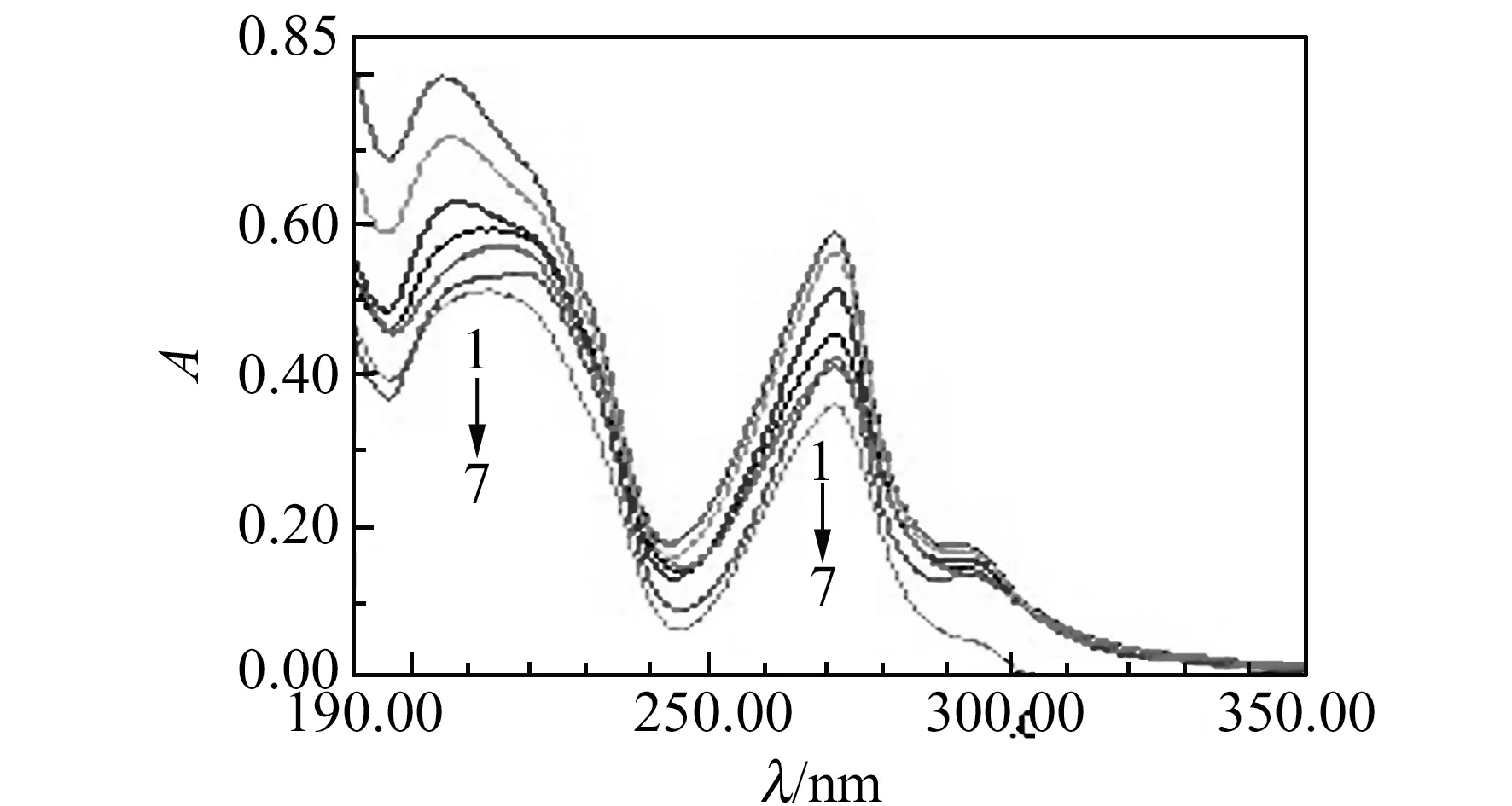
图3 DNA对配合物的紫外吸收光谱影响Fig.3 Effect of DNA on the UV spectra of the complex ccomplex=3.5×10-3 mol/L;cDNA=2.0×10-5 mol/L.1-7:volume of DNA was 0,20,40,60,80,100 and 120 μL, respectively.
2.2 荧光光谱法研究配合物与DNA之间的作用
游离态的中性红(NR)自身的荧光很弱,但当NR分子以嵌插方式与DNA结合后,体系的荧光强度会大幅度增强。但是当有一个能取代键合NR或能破坏DNA结构的小分子加入时,NR-DNA体系的荧光则会发生猝灭或部分猝灭[7]。实验以550 nm为激发波长,DNA与NR以浓度比2:1混合时,测得DNA-NR体系在596 nm处有一强的荧光发射峰,如图4所示。往DNA-NR体系中逐渐滴加配合物时,看到在596 nm处的荧光强度会随之降低,但峰位并没有发生移动。说明配合物能够猝灭DNA-NR体系的荧光,也就是说配合物与DNA之间的作用机理类似于NR与DNA的作用机理。配合物和NR在与DNA结合时存在竞争,会使得结合在DNA位点上的NR置换下来,从而溶液中游离的NR数量增多,表现为荧光强度较DNA-NR减弱。但配合物的浓度增大到一定程度时,荧光强度下降程度很小,说明此时配合物与DNA的结合已经达到饱和。因此,可以推断出配合物与DNA之间能够以插入方式发生键合。
2.3 循环伏安法研究配合物与DNA之间的作用
当扫描速率为0.5 V/s时,在-0.6~1.0 V电位范围内,配合物在0.141 V/-0.205 V出现一对灵敏的氧化还原峰,对应Cu(Ⅰ)/Cu(Ⅱ)的电子转移。氧化峰电流较灵敏,说明铜在电极表面具有非常大的氧化反应速率。当改变扫描速度,发现随着扫描速度的增大,氧化还原峰电流也随之增大,氧化峰电位向正方向移动,还原峰电位向负方向移动,如图5所示。通过Ipc-v1/2作图,发现氧化峰电流(Ipc)与扫描速
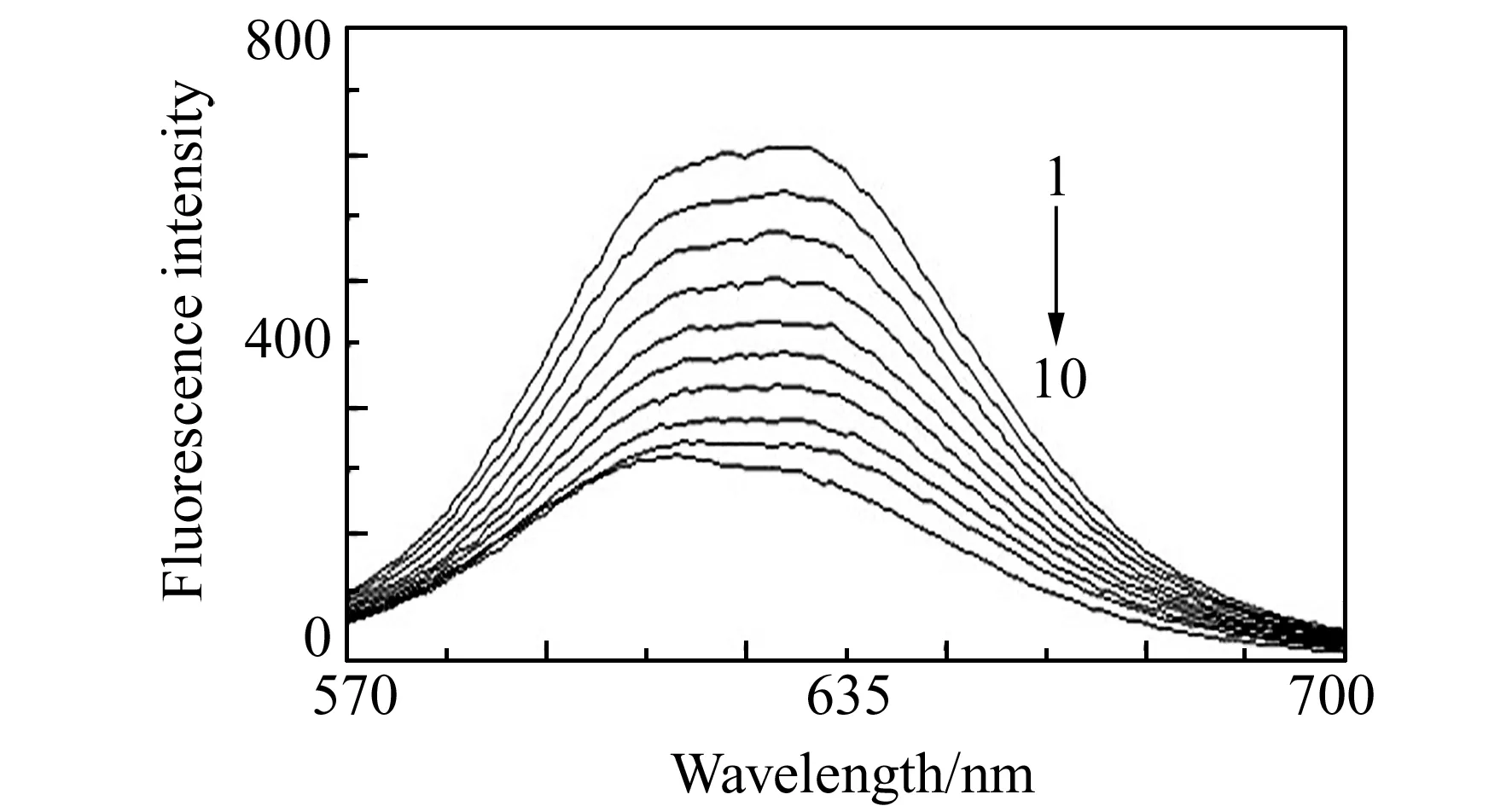
图4 配合物对DNA-NR体系的荧光强度影响Fig.4 Effect of the complexes on fluorescence intensity of the DNA-NR system cDNA=2.0×10-5 mol/L;cNR=1.0×10-5 mol/L. 1-10:concentration of complex was 0,0.9,1.8,2.7,3.6,4.5,5.4,6.3,7.2 and 8.1 mol/L, respectively.
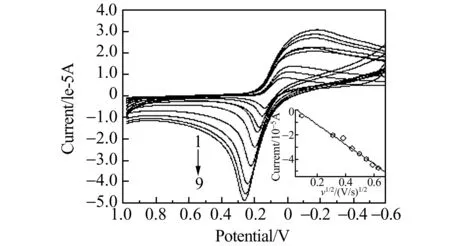
图5 扫描速率对配合物循环伏安(CV)曲线的影响Fig.5 Effect of scan rate on the CV curves of the complex ccomplex=3.5×10-3 mol/L;cDNA=2.0×10-5 mol/L. 1-9:scan rate was 0.01,0.1,0.15,0.2,0.25,0.3,0.35,0.4 and 0.5 V/s,respectively.
度的平方根(v1/2)之间存在良好的线性关系,线性方程为:Ipa(10-5A)=0.43-8.23v1/2(R=0.9935),说明配合物在玻碳电极上的反应过程由扩散过程控制。
依次用DNA进行滴定配合物溶液,每次加入的体积为10 μL,摇匀放置约5 min,配合物与DNA在稀溶液中相互作用的循环伏安曲线,如图6所示。在配合物中加入DNA后,氧化还原峰的电流明显降低,并观察到配合物在0.208 V(峰电流为-2.61×10-5A)附近的氧化峰有正移趋势,但还原峰电位位移不明显。当滴加DNA体积达到50 μL时,配合物的氧化峰正移至0.312 V处,说明式量电位也发生正移,峰电流降至-1.98×10-5A。这是由于DNA与配合物之间发生了相互作用,导致溶液中游离的配合物浓度减小,氧化还原峰电流随之降低[8]。根据文献报道,如果配合物的式量电位在加入DNA后向正方向偏移,说明两者发生了嵌入作用[2]。根据循环伏安曲线的变化,再次证明配合物以嵌入方式与DNA作用,形成了非电化学活性的复合物。
2.4 熔点法研究配合物与DNA之间的作用
通常将DNA变性,即增色效应达到一半时的温度,称为DNA熔点(Tm)。Tm是使DNA的双螺旋结构解旋一半时的温度,是衡量DNA分子稳定性的一个指标。一些能作为DNA插入试剂的配合物与DNA作用时,插入试剂与DNA的碱基对之间发生π-π堆积,使DNA的双螺旋变得稳定,DNA的熔点会明显升高,而且升高的幅度与结合强度有关[9]。配合物对DNA熔点的影响如图7所示:配合物与鲱鱼精DNA结合后,DNA的变性温度升高到78.9 ℃,而单独的DNA的正常变性温度是70 ℃。黎泓波等人[10]发现血卟啉-DNA体系的Tm为80 ℃,较DNA的正常变性温度升高10 ℃,认为这是因为血卟啉嵌入DNA的碱基对中,导致DNA稳定性升高。图7说明了配合物能够嵌入DNA的碱基对中,使DNA稳定性升高。
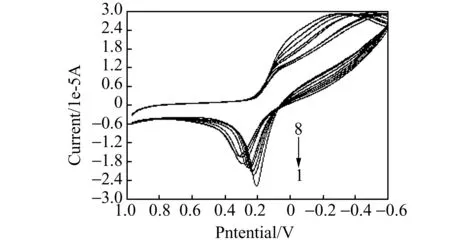
图6 配合物与DNA作用的循环伏安图Fig.6 The cyclic voltammograms of complex with DNA ccomplex=3.5×10-3 mol/L;cDNA=2.0×10-5 mol/L . 1-8:volume of DNA was 0,10,20,30,40,50,60 and 50 μL,respectively.
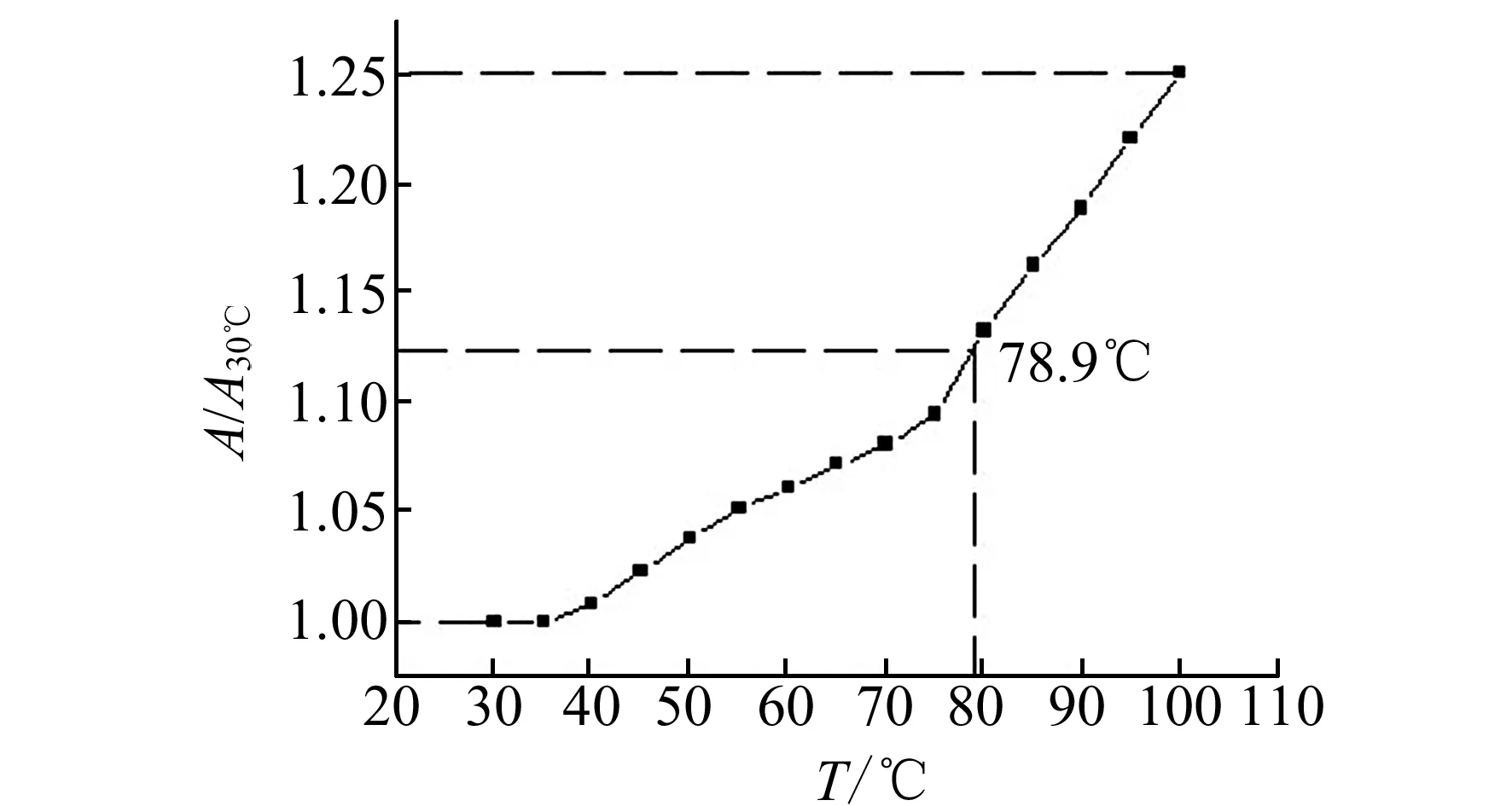
图7 配合物对DNA变性温度的影响Fig.7 Influence the complex on DNA melting point ccomplex=3.5×10-3 mol/L;cDNA=2.0×10-5 mol/L.
3 结论
合成了配合物[Cu(Phen)(NA)]·H2O,该配合物与DNA之间存在嵌入结合。该研究工作对诊断并治疗与DNA有关疾病的药物设计提供参考,深入的研究正在进行中。

