Cu-ZrO2-CeO2/γ-Al2O3催化甲醇水蒸气重整制氢反应的性能
黄媛媛,巢磊,李工,丁嘉,郭剑桥
Cu-ZrO2-CeO2/γ-Al2O3催化甲醇水蒸气重整制氢反应的性能
黄媛媛,巢磊,李工,丁嘉,郭剑桥
(常州大学石油化工学院,江苏常州 213164)
以γ-Al2O3为载体,采用浸渍法制备Cu-ZrO2-CeO2/γ-Al2O3催化剂,用XRD、N2吸附-脱附、H2-TPR、NH3-TPD、CO2-TPD等方法对其进行表征。在连续流动常压固定床微型反应器上评价Cu-ZrO2-CeO2/γ-Al2O3催化剂对甲醇水蒸气重整制氢反应的催化性能,考察了反应温度、水醇比和质量空速对催化性能的影响,反应结果表明Cu-ZrO2-CeO2/γ-Al2O3催化剂具有较高的催化活性和稳定性,在温度为260℃、水醇摩尔比为1.2∶1、质量空速为3.6h–1的条件下,甲醇的转化率可达99%以上,氢气的选择性为98%以上,一氧化碳的选择性低于2.5%。表征结果显示助剂CeO2和ZrO2的加入促进活性组分在载体表面的分散性,影响催化剂的孔结构和酸碱性,增强了催化剂的活性。
氧化铝;催化剂载体;选择性;制氢
随着世界范围内环境法规的日益严格以及社会对洁净新能源关注的加深[1-2],氢能作为一种高效清洁的环境友好能源备受专家学者的青睐[3-5]。通常的制氢方式有电解水制氢、裂化石油气制氢和水煤气制氢等[6-7],而甲醇水蒸气重整制氢的工艺在中小规模用氢领域具有简便和良好的经济效益[8-9],因此研究开发新的制氢工艺或改进甲醇水蒸气重整制氢的工艺具有重要意义。目前铜基催化剂是用于甲醇水蒸气重整制氢反应最常见的催化剂[10-11],这类催化剂具有原料价格低廉易得、反应条件温和等优点[12-13]。例如IDEM[14]制备了Cu/Al2O3系列催化剂,向其中添加助剂Cr、Mn、Zn,有利于活性中心的稳定,从而进一步提高催化剂的低温活性,降低CO的含量。在Cu/Al2O3催化剂[15]中添加CeO2可以提高催化剂的活性和稳定性,当CeO2含量为20% 时,催化剂活性最佳。在反应温度250℃,水醇摩尔比为1.0,液体空速为3.28h–1的条件下,甲醇转化率为95.5%,氢气选择性为100%,且降低了重整气中CO的含量。以氧化铈和氧化锆作为载体负载铜制备催化剂[11],当氧化铈和氧化锆的原子比为60∶40,铜的负载量为10%~15%时,所制备催化剂的活性最高,在温度为250℃,水醇比为1.1∶1,反应空速为40000h–1时甲醇的转化率达到73%,氢气的选择性为100%,一氧化碳的选择性为2.4%。Cu-ZnO-ZrO2催化剂[16]用于甲醇水蒸气重整制氢反应时,在反应温度240℃,水醇摩尔比为1.3的条件下,甲醇转化率达到81.2%,H2和CO2的选择性都为100%。此外还有Ni-Cu/ZrO2催化剂[17]、Cu/ZnO/ZrO2/Al2O3催化剂[18]、Cu/Fe2O3/ZrO2催化剂[19]等。甲醇水蒸气重整制氢这种方法也存在催化剂稳定性较差、产物中CO含量偏高等缺点[20]。目前把Cu、ZrO2和CeO2按一定比例同时负载到γ-Al2O3上的文献报道较少,本文以γ-Al2O3为载体,采用浸渍法制备了以Cu为主活性组分,ZrO2和CeO2为助剂的催化剂,用于催化甲醇水蒸气重整制氢反应,考察其催化性能。
1 实验部分
1.1 仪器与试剂
连续流动式常压固定床微型反应器,实验室自制;SP-3420气相色谱仪,北京中惠分析技术研究所;上分1102气相色谱仪,上海仪电分析仪器有限公司;D/max 2500 PC 型X射线衍射仪,日本理学公司;ASAP2010C型氮气吸附-脱附分析仪,Micromeritics公司。γ-Al2O3,工业用,辽宁省抚顺市石油三厂;无水甲醇,硝酸铜,硝酸锆,硝酸铈,以上均为分析纯,国药集团化学试剂。
1.2 催化剂的制备方法
催化剂采用浸渍法制备,具体制备过程如下:首先用分析天平准确称量按不同配比计算好的Cu(NO3)2·3H2O,Zr(NO3)4·5H2O和Ce(NO3)2·6H2O,加等体积去离子水溶解,混合均匀,再将称量好的γ-Al2O3粉末加入到硝酸盐混合溶液中,室温下浸渍12h,将其放入烘箱于110℃下干燥12h,随后在管式炉内于550℃焙烧3h,用氢氮混合气(含氢气15%)在300℃还原2h,冷却至室温后压片成型,再筛分出40~80目的颗粒,得到所需催化剂,记作Cu()-ZrO2()-CeO2()/γ-Al2O3,其中、和分别表示质量分数。
1.3 催化剂的活性评价
用于甲醇水蒸气重整制氢的催化剂对甲醇的水蒸气重整反应的催化活性评价在连续流动式常压固定床微型反应器上进行,反应管内径为6mm。反应前将称量好的催化剂置于恒温段,上下添加石英砂,将催化剂先在300℃下通氢气还原2h后降温至需要反应的温度,待温度稳定后开始进料,反应温度范围为220~300℃,反应器进料甲醇与水的摩尔比为(1∶1)~(1∶1.8),原料液由双柱塞微量泵定量输出,自上而下的通过反应器,通过六通阀手动进样,利用SP-3420气相色谱仪将重整反应的产物进行在线分析,其中色谱分析基本参数:3m柱长,由GDX-401担体作为填料,氢气为载气,流速为40mL/min,热导检测,柱温120℃,TCD检测器温度120℃,进样器温度100℃,热导电流温度为140℃,灵敏度为0.05,六通阀箱温度为135~145℃。
1.4 甲醇转化率和产物选择性的计算方法
利用碳平衡法计算甲醇的转化率()和一氧化碳、二氧化碳选择性()的公式如式(1)~式(3)。
甲醇转化率
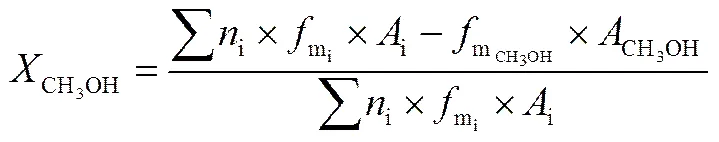
一氧化碳选择性
(2)
二氧化碳选择性

二氧化碳的选择性越高,则氢气的选择性也越高,根据甲醇水蒸气重整制氢反应机理[21-22],氢气选择性()按式(4)计算。
氢气选择性
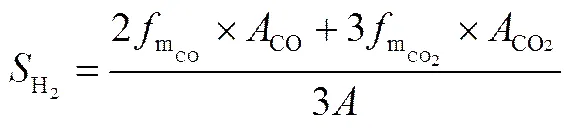
其中
(5)
式中,i为反应物或产物分子中碳原子数量,f为相对摩尔校正因子,A为峰面积。
1.5 催化剂的表征
X射线衍射(XRD)分析采用日本理学 D/max 2500 PC型X射线衍射仪,Cu靶,Kα射线,管电压40kV,管电流100mA,制备催化剂在2为5°~80°扫描样品的晶态结构,扫描速度为2°/min。
N2吸附-脱附等温线在Micromeritics公司的ASAP2010C型氮气吸附-脱附分析仪上测定,氮气为吸附质,在液氮温度(77K)下测定,比表面积和平均孔径通过BET法计算,孔径和孔容分布采用BJH法计算。
程序升温还原(H2-TPR)在改装的气相色谱仪上进行,样品用量30mg,还原气为N2和H2(含量为10%)的混合气体,以10℃/min的速率由100℃升至600℃,由热导检测器检测耗氢信号。
催化剂的CO2-TPD表征在自制的TPD装置中进行,载气为高纯氢气,流量30mL/min,催化剂用量0.2g,首先升温至300℃,通氢气活化1h后降至50℃,在50℃吸附CO2至饱和,然后用氢气吹扫除去气相游离的和物理吸附的CO2,以10℃/min的速率从50℃升温至600℃,用TCD检测器检测程序升温过程中脱附的CO2。
催化剂的NH3-TPD表征在实验室自建的装置上进行,高纯H2作为载气,流量30mL/min。表征时称取30mg催化剂样品,300℃下通H2活化1h后降温至100℃,吸附 NH3至饱和,通H2吹扫1.5h,接着以10℃/min的升温速率从100℃升温至600℃,TCD检查器检测程序升温过程中脱附的NH3。
2 结果与讨论
2.1 不同因素对催化性能的影响
2.1.1铜含量对催化性能的影响
铜含量在不同反应温度下对催化活性的影响见表1。从表中数据可知,对于不同的铜含量,甲醇转化率随着反应温度的升高而逐渐升高;在不同的反应温度条件下,随着铜含量的增加甲醇的转化率也增加,但铜含量增加到一定程度时,甲醇转化率的增加幅度不大,且氢的选择性有所下降。表明铜负载量过高时,其在γ-Al2O3载体上的分散度下降,颗粒增大,并导致产物的选择性降低,综合实验结果,铜的负载量约为15%较为合适。
2.1.2二氧化锆的含量对催化性能的影响
通过实验表明二氧化锆本身对甲醇水蒸气重整制氢反应并没有催化活性,但γ-Al2O3载体同时负载铜和二氧化锆能明显提高催化剂的活性和选择性,表明二氧化锆具有助催化作用[23]。当铜的负载量为15%时,二氧化锆的加入量对催化剂性能的影响见表2,从表中数据可以看出,Cu(15)-ZrO2(7)/γ-Al2O3催化剂的活性最高,在260℃时甲醇转化率达到97.74%,CO的选择性为1.75%,继续增加氧化锆的负载量,催化剂的活性反而有所下降,表明7%的二氧化锆负载量恰好与15%的铜负载量形成较好的相互作用,再增加二氧化锆的负载量会使载体表面二氧化锆富集,覆盖表面铜物种,使催化剂的活性降低,产物选择性下降,因此二氧化锆的最佳负载量约为7%。
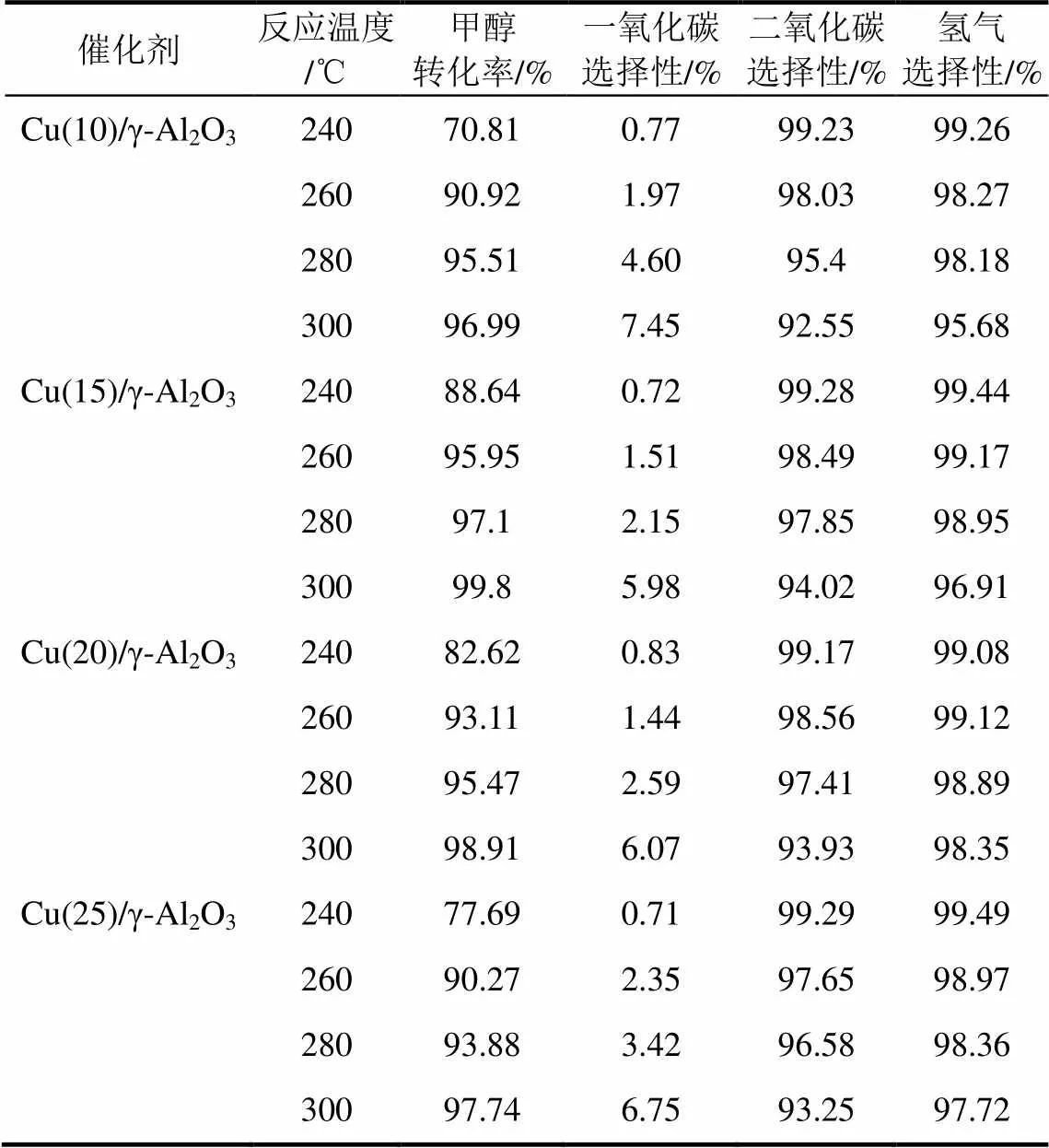
表1 铜含量对催化性能的影响
注:反应条件为催化剂用量0.5g,质量空速(WHSV)3.6h–1,水醇比1.2∶1。
2.1.3二氧化铈的含量对催化性能的影响
二氧化铈本身对甲醇水蒸气重整制氢反应也没有催化活性,但实验表明在铜和二氧化锆中加入一定量的二氧化铈能明显提高催化剂的活性和选择性,当铜的负载量为15%,二氧化锆的加入量为7%时,二氧化铈的加入量对催化剂性能的影响见表3,可以看出二氧化铈的负载量为2%时催化剂的活性最高,在260℃时对甲醇的转化率和氢气的选择性均可达到99%以上,CO的选择性低于2%。增加二氧化铈的负载量,催化剂的活性反而有所下降,可能是因为添加少量二氧化铈能够与氧化锆之间形成某种相互作用共同促进催化剂活性的提高,但过量的二氧化铈会覆盖表面的铜物种,堵塞载体的孔道,从而降低催化剂的活性,因此,二氧化铈的最佳负载量约为2%。
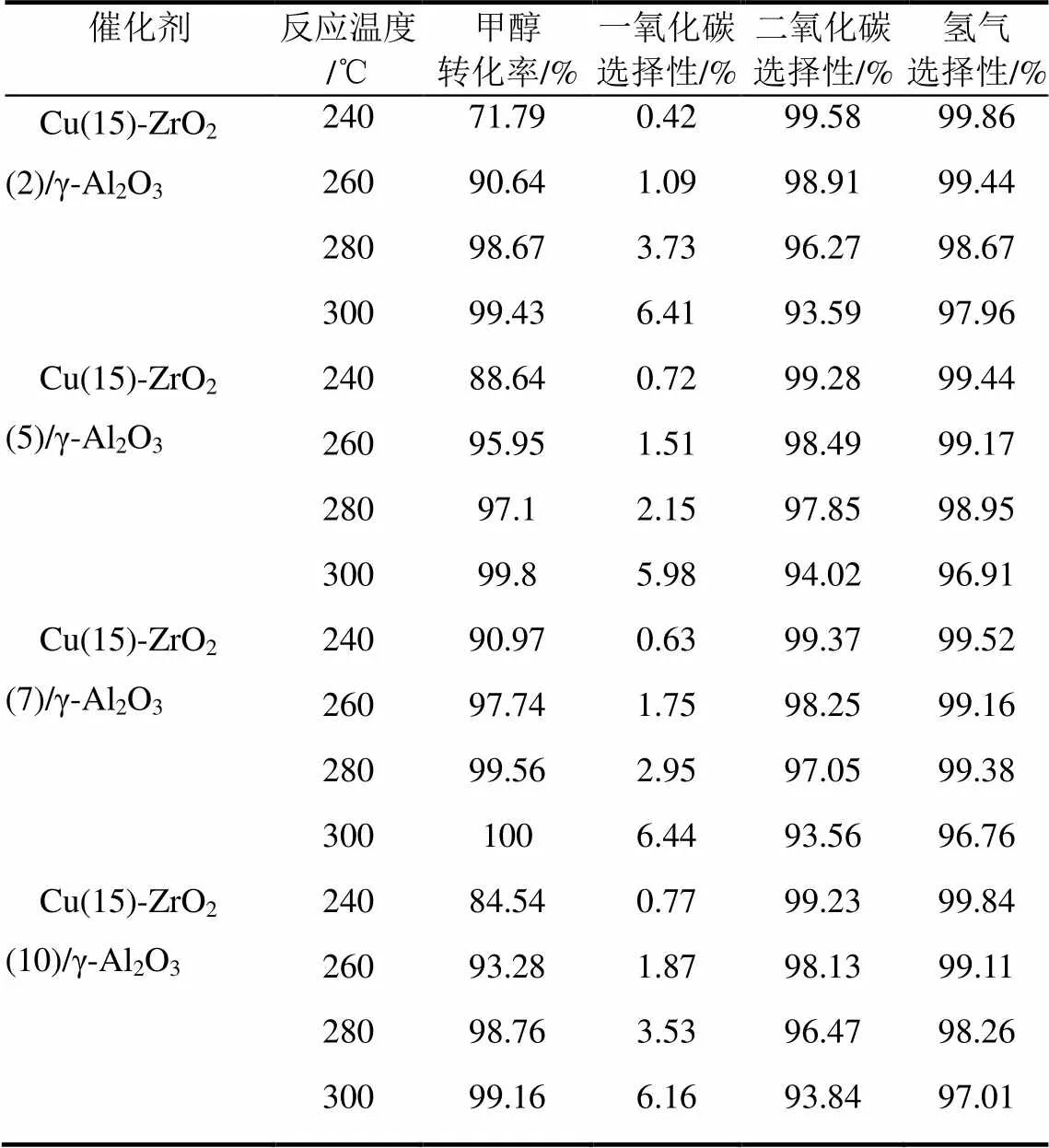
表2 ZrO2的含量对催化性能的影响
注:反应条件为催化剂用量0.5g,质量空速(WHSV)3.6h–1,水醇比1.2∶1。
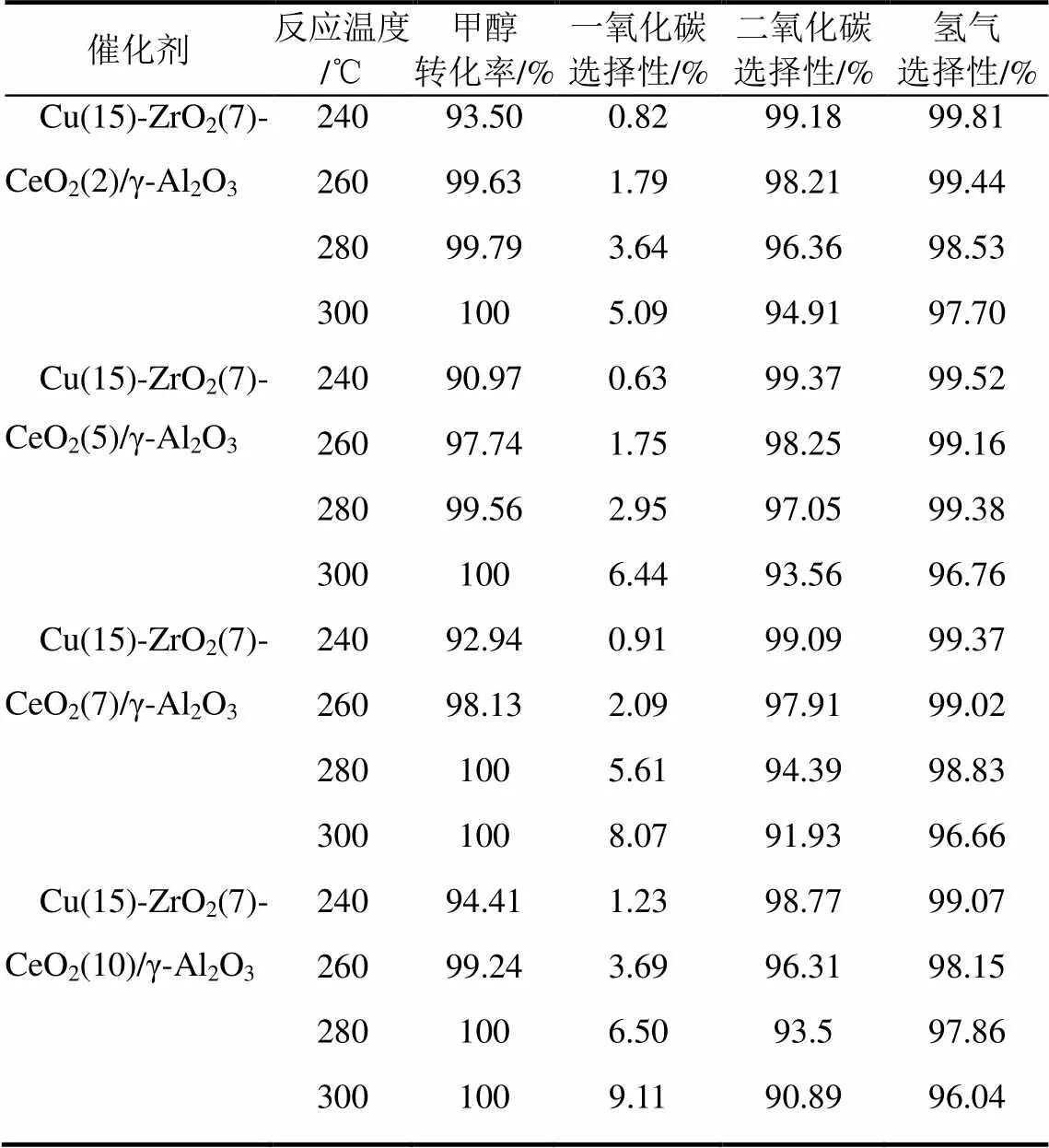
表3 CeO2的含量对催化性能的影响
注:反应条件为催化剂用量0.5g,质量空速(WHSV)3.6h-1,水醇比1.2∶1。
2.1.4反应温度对催化性能的影响
考察反应温度对甲醇水蒸气重整制氢反应的影响见图1,所用催化剂为Cu(15)-ZrO2(7)- CeO2(2)/
γ-Al2O3。从图中可以看出,甲醇的转化率随着温度的升高而逐渐增大,260℃后增幅趋缓,260℃时甲醇的转化率达到99.63%,而氢气的选择性在温度高于260℃时出现了降低趋势,同时一氧化碳的选择性逐渐增大,由此可见,温度升高有利于甲醇转化率的提高,但是过高的温度会降低氢气的选择性,因此,比较适宜的反应温度约为260℃。
2.1.5水醇摩尔比对催化性能的影响
Cu(15)-ZrO2(7)-CeO2(2)/γ-Al2O3催化剂在反应温度260℃时,水醇摩尔比对甲醇重整制氢反应的影响见图2,通常情况下,甲醇转化率会随着水醇摩尔比的增大而提高,当水醇比为1.2∶1时,甲醇转化率可以达到99%以上,氢气的选择性高于99%,一氧化碳的选择性低于2%。当水醇比高于1.2∶1时,在260℃甲醇的转化率均能达到 97.5%以上,但CO的选择性也在逐步增大,并且大量水蒸气的存在会增加系统的负荷,增加能耗,因此最佳水醇比约为1.2∶1,此时甲醇转化率较高,CO的选择性较低,H2的选择性较高。
(催化剂用量0.5g,质量空速(WHSV)3.6h–1,水醇比1.2∶1)a—CH3OH;b—CO;c—CO2;d—H2
(温度260℃,催化剂用量0.5g,质量空速(WHSV)为3.6h–1,水醇比1.2∶1)a—CH3OH;b—CO;c—CO2;d—H2
2.1.6 质量空速对催化性能的影响
质量空速(WHSV)对甲醇水蒸气重整制氢反应的影响见图3,催化剂为Cu(15)-ZrO2(7)- CeO2(2)/γ-Al2O3。可以看出,甲醇转化率随着质量空速的增加而逐渐降低,氢气和一氧化碳的选择性变化不大,可知过高的空速不利于甲醇的转化,当质量空速为3.6h–1时,甲醇转化率达到99.75%,此时氢气的选择性为99.32%,CO的选择性为2.03%。
2.1.7 反应时间对催化性能的影响
Cu(15)-ZrO2(7)-CeO2(2)/γ-Al2O3为催化剂,反应温度为260℃,连续反应50h的结果见图4。可知从反应开始至35h,甲醇的转化率和氢气的选择性均保持在99%以上,一氧化碳的选择性低于2.5%。当反应35h后,甲醇的转化率有所降低,一氧化碳的选择性有所增加,但反应至50h时甲醇的转化率和氢气的选择性仍为97.5%以上,一氧化碳的选择性低于3.1%。表明Cu(15)-ZrO2(7)- CeO2(2)/γ-Al2O3的催化活性比文献报道的Cu/ZrO2-CeO2[11]和Cu/ZrO2-ZnO[16]的高,与Cu-CeO2/Al2O3[15]相比,甲醇的转化率略高,但氢气的选择性略低。另外,传统商用甲醇水蒸气重整制氢系列催化剂Cu/ZnO/Al2O3[22,24]中Cu的含量较高,大于25%,在250℃反应时,甲醇最高转化率为99.14%,氢气选择性为99.19%。因此,Cu(15)-ZrO2(7)- CeO2(2)/γ-Al2O3与传统商用的催化剂对比可知,Cu用量较少,反应温度略高,甲醇转化率相近,氢气选择性略低。
2.2 催化剂的表征
2.2.1 XRD表征结果
对所制备的催化剂进行XRD分析,结果见图5,可知b、c、d、e样品均在2为43.2°、50.8°、66.1°、74.0°处出现单斜相Cu的特征衍射峰。b和c的衍射峰差别不大,说明氧化锆可能以无定形的非晶态或高度分散的状态存在。单独加入CeO2的d样品在2约为28.7°处有一小的CeO2衍射峰,同时36.8°处Cu的衍射峰强度明显降低,表明CeO2对Cu的分布有一定影响。同时添加ZrO2和CeO2的e样品其28.7°和处36.8°处的衍射峰较小而宽,ZrO2和CeO2可能以复合氧化物形式与Cu共同分布于γ-Al2O3孔内孔外的表面上。
(温度260℃,催化剂用量0.5g,质量空速(WHSV)为3.6h–1,水醇比1.2∶1)a—CH3OH;b—CO;c—CO2;d—H2
(温度260℃,催化剂用量0.5g,质量空速(WHSV)为3.6h–1,水醇比1.2∶1)a—CH3OH;b—CO;c—CO2;d—H2
2.2.2 BET表征结果
所制备3种催化剂的N2吸附-脱附等温线和孔径分布见图6和图7,比表面积、孔体积和平均孔径见表4。可知Cu/γ-Al2O3和Cu-ZrO2-CeO2/γ- Al2O3的平均孔径和比表面积比γ-Al2O3的减小,原因是一部分Cu、ZrO2和CeO2进入载体γ-Al2O3的孔道中,阻塞了分子筛的孔道所导致。另外,Cu-ZrO2-CeO2/γ-Al2O3催化剂的平均孔径和比表面积比Cu/γ-Al2O3的略为增大,表明加入ZrO2、CeO2后,二者能与Cu在载体的孔道内外表面上较好地分散。
a—γ-Al2O3;b—Cu/γ-Al2O3;c—Cu-ZrO2/γ-Al2O3;d—Cu-CeO2/γ-Al2O3;e—Cu-ZrO2-CeO2/γ-Al2O3
a—γ-Al2O3;b—Cu/γ-Al2O3;c—Cu-ZrO2-CeO2/γ-Al2O3
图7催化剂的孔径分布
a—γ-Al2O3;b—Cu/γ-Al2O3;c—Cu-ZrO2-CeO2/γ-Al2O3
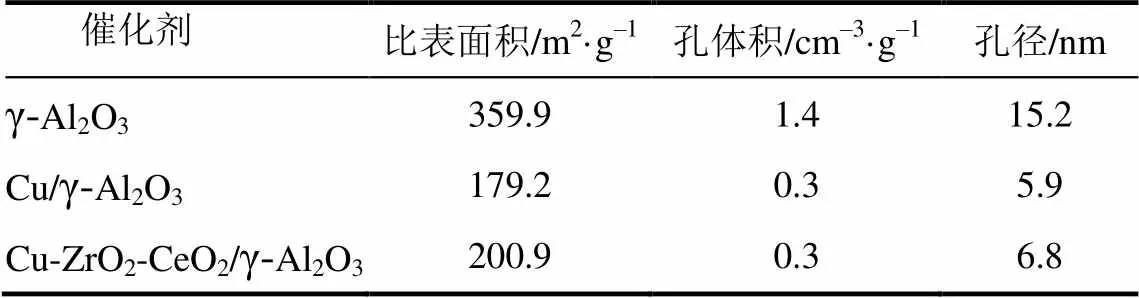
表4 3种催化剂的孔结构参数
2.2.3 CO2-TPD和NH3-TPD表征结果
所制备催化剂样品的CO2-TPD结果见图8,由图可见,催化剂的CO2脱附峰有两个,分别对应碱性较弱和较强的两种吸附位,其中,样品a和b的两个脱附峰温度都相近,约为170℃和428℃,样品c的低温脱附峰和样品a和b相同,但高温脱附峰增高至456℃,说明单独加入CeO2能增加强碱性位的强度。同时加入CeO2和ZrO2的样品d其低温脱附峰增高到约200℃,但高温峰与a和b的相近,约为428℃,表明同时添加一定量的CeO2和ZrO2后,弱碱性位的碱性有所增强,对强碱性位没有影响。
催化剂样品的NH3-TPD结果见图9,可以看出样品a、b、c和d均有2个脱附峰,低温峰为NH3的物理吸附和弱酸位吸附,高温峰为中强酸性位吸附,样品a和b的高温脱附峰均约为420℃,但低温脱附峰分别为194℃和184℃,表明加入ZrO2可降低弱酸性位的强度。样品c的低温脱附峰与b相同,但强酸性位脱附峰比b的高36℃,说明加入CeO2可增加强酸性位的强度。同时加入CeO2和ZrO2可使弱酸性位脱附峰温降低至171℃,强酸性位的高温脱附峰温与a和b的相近,约为423℃。结合CO2-TPD结果可知,Cu-ZrO2-CeO2/γ-Al2O3含有碱性中心也含有酸性中心,同时加入CeO2和ZrO2后可使弱酸位强度降低,弱碱性位强度增强,对强酸位和强碱位影响不大,这种强度的酸碱位相互配合可能有利于增加Cu对甲醇水蒸气重整制氢的催化活性和选择性。
2.2.4 H2-TPR表征结果
所制备催化剂样品的程序升温还原结果见图10。图中a曲线可以看出在225℃有一个大的CuO还原峰,在256℃有一个小的还原峰,可能对应孔道深处少量CuO的还原。b、c、d样品都在200~270℃有一个宽的CuO还原峰,表明同时或单独加入ZrO2和CeO2后,使CuO低温还原峰面积减小,高温还原峰面积增大,使二者结合为一个较宽的还原峰,这是由于ZrO2和CeO2增强了CuO在载体表面的分散造成的,其结果可增加Cu的分散度和阻止Cu在催化反应中的烧结,有利于提高催化剂的稳定性。
a—Cu/γ-Al2O3;b—Cu-ZrO2/γ-Al2O3;c—Cu-CeO2/γ-Al2O3;d—Cu-ZrO2-CeO2/γ-Al2O3
a—Cu/γ-Al2O3;b—Cu-ZrO2/γ-Al2O3;c—Cu-CeO2/γ-Al2O3;d—Cu-ZrO2-CeO2/γ-Al2O3
a—Cu/γ-Al2O3;b—Cu-ZrO2/γ-Al2O3;c—Cu-CeO2/γ-Al2O3;d—Cu-ZrO2-CeO2/γ-Al2O3
3 结论
(1)采用浸渍法制备出Cu-ZrO2-CeO2/γ-Al2O3催化剂,其Cu、ZrO2和CeO2的最佳含量分别为15%、7%和2%,在反应温度260℃、质量空速3.6h–1、水醇比1.2∶1的条件下,对甲醇水蒸气重整制氢反应中甲醇的转化率可达到99.63%、对H2和CO的选择性分别为99.44%和1.79%。
(2)BET和孔分布结果表明,加入ZrO2和CeO2并没有降低或减小改性前Cu/γ-Al2O3的比表面积和平均孔径,而且略为增大。H2-TPR结果显示加入ZrO2和CeO2可增加Cu的分散度和阻止Cu在催化反应中的烧结,有利于提高催化剂在反应过程中的稳定性。
(3)CO2-TPD和NH3-TPD表征结果显示,Cu-ZrO2-CeO2/γ-Al2O3同时含有碱性中心和酸性中心,加入CeO2和ZrO2后可使弱酸位强度降低,弱碱性位强度增强,对强酸位和强碱位影响不大,CeO2和ZrO2本身没有催化活性,但加入它们能调节催化剂弱酸碱位的强度,增加铜对甲醇水蒸气重整制氢的催化活性和选择性。
[1] ZINI G,TARTARINI P Solar hydrogen energy systems:science andtechnology for the hydrogen economy[J].Springer Ebooks,2015:1-184.
[2] PADRÓ C E G,LAU F.Advances in Hydrogen Energy[M].
US:Springer,2002.
[3] CIPRIANI G,DIO V D,GENDUSO F,et al. Perspective on hydrogen energy carrier and its automotive applications[J].International
Journal of Hydrogen Energy,2014,39(16):8482-8494.
[4] MOUGIN J.Hydrogen production by high-temperature steamelectrolysis-compendium of hydrogen energy-8[M]//Compendium of Hydrogen Energy,2015:225-253.
[5] BARRETO L,MAKIHIRA A,RIAHI K.The hydrogen economy in the 21st century:a sustainable development scenario[J].International Journal of Hydrogen Energy,2003,28:267-284.
[6] 吴川,张华民,衣宝廉.化学制氢技术研究进展[J].化学进展,2005,17(3):423-429.
WU C,ZHANG H M,YI B L. Recent advances in hydrogen generation with chemical methods[J]. Progress in Chemistry,2005,17(3):423-429.
[7] 罗明,王树众,王龙飞,等.基于化学链技术制氢的研究进展[J].化工进展,2014,33(5):1123-1133.
LUO M,WANG S Z WANG L F,et al. Advances in hydrogen production using chemical-looping technology[J].Chemical Industry and Engineering Progress,2014,33(5):1123-1133.
[8] 刘一鸣.工业制氢方法的比较与选择[J].化学与生物工程,2007(3):72-74.
LIU Y M.Comparison and selection of process of hydrogen production[J].Chemistry & Bioengineering,2007,24(3):72-74.
[9] 闫月君,刘启斌,隋军,等.甲醇水蒸气催化重整制氢技术研究进展[J].化工进展,2012,31(7):1468-1476.
YAN Y J,LIU Q B,SUI J,et al. Research progress of hydrogen production with methanol steam reforming[J].Chemical Industry and Engineering Progress,2012,31(7):1468-1476.
[10] 张新荣,史鹏飞,刘春涛.甲醇水蒸气重整制氢催化剂性能的研究[J].化工进展,2002,21(7):487-489.
ZHANG X R,SHI P F,LIU C T,et al. Properties of catalysts for steam reforming of methanol[J].Chemical Industry and Engineering Progress,2002,21(7):487-489.
[11] DAS D,LLORCA J,DOMINGUEZ M,et al.Methanol steamreforming behavior of copper impregnated over CeO2-ZrO2derived from a surfactant assisted coprecipitation route[J].International
Journal of Hydrogen Energy,2015,40(33):10463-10479.
[12] 赵宁,尹燕华,王新喜,等.铜基催化剂上甲醇水蒸汽重整制氢Ⅰ.催化剂组成的影响[J].分子催化,2009(4):346-350.
ZHAO N,YIN Y H,WANG X X,et al.Methanol steam reforming over Cu-based catalysts Ⅰ. Effect of catalyst composition [J].Journal of Molecular Catalysis,2009,23(4):346-350.
[13] 严会成,许云波,李华波,等.铜基甲醇水蒸气重整制氢催化剂活性研究[J].山东化工,2015,44(15):23-25.
YAN H C,XU Y B,LI H B,et al. Catalytic activity of methanol steam reforming Cu-based catalysts[J].Shandong Chemical Industry,2015,44(15):23-25.
[14] IDEM O R.Production of hydrogen from the low-temperature steam reforming of methanol [microform][D].Canada:University of Saskatchewan,1995.
[15] 张新荣,史鹏飞.CeO2改性Cu/Al2O3催化剂上甲醇水蒸气重整制氢[J].物理化学学报,2004,19(1):85-89.
ZHANG X R,SHI P F.Catalytic production of hydrogen from steam reforming of methanol on CeO2promoted Cu/Al2O3catalysts[J].Chinese Journal of Chemical Physics,2003,19(1):85-89.
[16] 云虹,陈建华,张慧,等.ZrO2在Cu-ZnO-ZrO2甲醇水蒸汽重整制氢催化剂中的作用[J].物理化学学报,2004,20(5):550-553.
YUN H,CHEN J H,ZHANG H,et al. The effects of on catalysts for hydrogen generation by steam reforming of methanol[J].Chinese Journal of Chemical Physics,2004,20(5):550-553.
[17] PÉREZ-HERNÁNDEZ R,ESPINOSA-PESQUEIRA M E,ESTANISLAO M L,et al.Effect of the bimetallic Ni/Cu loading on theZrO2support for H2production in the autothermal steam reformingof methanol[J].Catalysis Today,2015,250:166-172.
[18] PARK J E,YIM S D,CHANG S K,et al.Steam reforming of methanol over Cu/ZnO/ZrO2/Al2O3catalyst[J].International Journal of Hydrogen Energy,2014,39(22):11517-1527.
[19] 李永红,任杰,孙予罕.Fe助剂对Cu/ZrO2甲醇水蒸气重整制氢催化剂的影响[J].燃料化学学报,2004,30(5):29-432.
LI Y H,REN J,SUN Y H.Effect of iron on Cu/ZrO2catalysts in production of hydrogen from methanol-steam reforming[J].Journal of fuel Chemistry and Technology,2004,30(5):29-432.
[20] 曹勇,姚成漳,王路存,等.一种用于甲醇蒸汽重整制氢的铜锆催化剂及其制备方法:1772378[P].2006-05-17.
CAO Y,YAO C Z,WANG L C,et al.Method for preparing a copper-containing hydrogenation reaction catalyst and their preparation methods:1772378[P].2006-05-17.
[21] SHOKRANI R,HAGHIGHI M,JODEIRI N,et al.Fuel cell grade hydrogen productionmethanol steam reforming over CuO/ZnO/Al2O3nanocatalyst with various oxide ratios synthesizedviaurea-nitratescombustion method[J].International Journal of Hydrogen Energy,2014,39(25):13141-13155.
[22] 张磊.甲醇水蒸气重整制氢催化剂的研究[D].大连:大连理工大学,2013.
ZHANG L. Methanol steam reforming catalyst for hydrogen production research[D]. Dalian:Dalian University of Technology,2013.
[23] 王嵩,毛东森,吴贵升,等.铜/氧化锆催化剂的制备及应用研究进展[J].化工进展,2008,27(6):837-843.
WANG S,MAO D S,WU G S,et al. Progress in preparation and application of zirconia-supported copper catalysts[J].Chemical Industry and Engineering Progress,2008,27(6):837-843
[24] 张新荣,史鹏飞,刘春涛.甲醇水蒸气重整制氢Cu/ZnO/Al2O3催化剂的研究[J].燃料化学学报,2003,31(3):284-288.
ZHANG X R,SHI P F,LIU C T. A study onCu/ZnO/Al2O3catalysts for hydrogen production by steam reforming of methanol[J].Journal of Fuel Chemistry and Technology,2003,31(3):284-288.
Performance of Cu-ZrO2-CeO2/γ-Al2O3catalysts for hydrogen production from steam reforming of methanol
HUANG Yuanyuan,CHAO Lei,LI Gong,DING Jia,GUO Jianqiao
(School of Petrochemical Engineering,Changzhou University,Changzhou 213164,Jiangsu,China.)
Cu-ZrO2-CeO2/γ-Al2O3catalysts were prepared by the impregnation method using γ-Al2O3as the support. The catalysts were characterized by means of XRD,N2adsorption-desorption,H2-TPR,CO2-TPD,NH3-TPD and BET. Hydrogen production by the steam reforming of methanol over the Cu-ZrO2-CeO2/γ-Al2O3catalyst was studied in a fixed bed micro-reactor. The effects of reaction temperature,mole ratio of H2O to methanol,WHSV on the catalytic performance and the stability of the catalysts were investigated. The experimental results showed that the methanol conversion rate reached 99%,the selectivity of hydrogen was 98%,while the selectivity of carbon monoxide was only 2.5% under the conditions of temperature 260℃,mole ratio of water to methanol of 1.2∶1,and WHSV of 3.6h–1. Characterization results showed that the addition of CeO2and ZrO2promoted the dispersion of the active component on the surface of the carrier,affected the pore structure and acidity of the catalysts,and increased their activity.
alumina;catalyst support;selectivity;hydrogen production
TQ314
A
1000–6613(2017)01–0216–08
10.16085/j.issn.1000-6613.2017.01.028
2016-04-06;修改稿日期:2016-08-14。
黄媛媛(1988—),女,硕士研究生。联系人:李工,教授。E-mail:ligong136@126.com。

