快离子导体隔膜的制备及在Cu-Zn可逆电池中的应用
周贻森,梁姗姗,杨超,朱甜,张汉平
快离子导体隔膜的制备及在Cu-Zn可逆电池中的应用
周贻森,梁姗姗,杨超,朱甜,张汉平
(常州大学石油化工学院,江苏常州 213164)
具有NASICON结构的锂离子快离子导体Li1.3Al0.3Ti1.7(PO4)3可以通过压片烧结制备成快离子导体隔膜。以NH4H2PO4、Li2CO3、TiO2和Al2O3为原料,用固相法在900℃烧5h合成Li1.3Al0.3Ti1.7(PO4)3粉末,将其制备成锂离子快离子导体隔膜。研究了压力、烧结温度和厚度对Li1.3Al0.3Ti1.7(PO4)3快离子导体隔膜离子电导率的影响,并采用X射线衍射、扫描电子显微镜和交流阻抗技术对材料粉末以及烧结片相组成、结构和离子导电性进行表征和测试分析。隔膜的最优制备条件为压力10.0MPa,烧结温度900℃,厚度0.500mm。将快离子导体隔膜用于Cu-Zn电池模型中,将正负电解液分开,使Li+能够自由地穿过,而其他离子不能通过,从而组装了可进行反复充放电的铜锌模型电池。通过循环伏安测试证实Cu-Zn电池的可逆性,所得可充电Cu-Zn模型电池的电压范围为0.800~1.50V,进行100次循环后充电容量保持初始充电容量99%以上,具有长期循环稳定性。
电化学;膜;电解质;Cu-Zn电池
Cu-Zn电池早在1836年就已被英国的丹尼尔提出,这是一种将锌放置于硫酸锌溶液中作负极,将铜放置于硫酸铜溶液作正极,并用盐桥将两极电解液连接的原电池。放电时,负极的Zn将失去电子转化为Zn2+,电子通过外电路流到正极,在正极电解液中的Cu2+将会得到电子,从而被还原成单质铜,放电过程中,负极的Zn2+浓度不断增大,正极中的Cu2+浓度减小,盐桥连接两极电解液,使电荷得到中和[1]。
在Cu-Zn电池中,若没有使用分离正负极电解液和传导离子作用的盐桥时,电池内部将直接发生反应,电流不会从外电路流出。然而盐桥或隔膜只能减少Cu2+的传递,在起传导作用的同时,也会有部分Cu2+从Cu电极传递到Zn电极,而且减少的Cu2+会在Zn电极表面还原成Cu,这是一种自放电,降低电池性能。在进行充电的时候,会使Cu2+的移动变强,大量的Cu2+将会通过导电介质迁移到对电极,电池将会被破坏,因此Cu-Zn电池不能充电[2]。这使得该电池使用成本高,但Cu-Zn电池制备方便,而且使用了水溶液电解液,在安全性能上有很大的优势。尤其重要的是,铜和锌分别具有高达843mAh/g和820mAh/g的理论容量。因此,有研究人员对Cu-Zn电池的可充电性能进行了探究。其中VIRKAR团队[3]探讨了该电池在100℃下充电的可能性,后来XIA团队[4]研究了室温下的充电性能。这些研究都表明Cu-Zn电池可以研制成可逆电池。在传统的Cu-Zn电池中,Cu2+和Zn2+只作为溶液中的电解质,在可逆电池中这些离子将成为活性物质,这说明在可逆的Cu-Zn电池里既包含了Cu2+和Zn2+液体电极之间的反应,又包含了金属锌和金属铜固体电极之间的反应[5-8]。在电池中,充当活性物质的可以是固体、液体甚至是气体,随着固体电解质和离子交换膜研究的发展,采用液体电极的电化学系统被广泛研究[9]。GOODENOUGH团队[10-11]提出了液体阴极在锂离子电池中的使用。ZHOU团队[12]结合了水溶液和非水溶液构建了可充电的Ni-Li电池。ZHAO等[13]提出了高输出电压的Li–I混合氧化还原电池。这些成果对研究可充电Cu-Zn电池有一定的借鉴意义。
使Cu-Zn电池可逆化需要一种离子选择性膜,允许导电的离子通过,阻隔Cu2+和Zn2+通过。快离子导体又被称作固体电解质,相对于一般离子导体,快离子导体的离子导电活化能低,一般在0.5eV以下,从而使得快离子导体在一定温度下的离子电导率接近液态电解质。研究发现,快离子导体Li1.3Al0.3Ti1.7(PO4)3(LATP)为NASCION结构,锂离子主要是通过在三维结构隧道中迁移实现导电,用这种材料制备的隔膜具有锂离子选择通过的特性[14-18]。本研究采用高温固相法制备LATP快离子导体,在最优压力、烧结温度和厚度的条件下得到最高离子电导率的离子选择性隔膜,此隔膜能分离Cu2+和Zn2+,允许Li+通过,从而组装了可进行反复充放电的Cu-Zn电池。
1 实验部分
1.1 实验材料
制备LTAP主要原料为NH4H2PO4、Li2CO3、TiO2和Al2O3,均为分析纯试剂。
Cu-Zn可逆电池主要原料为铜片、锌片,纯度均为99.9%,石墨电极为常规市售产品,Li2SO4、CuSO4以及ZnSO4均为分析纯试剂。
1.2 仪器与表征
X射线衍射(XRD)用于确定物质晶体结构,恒流充放电测试在新威(NEWARE)充放电测试仪上进行,测试电池的充放电性能。循环伏安法用来研究电极反应的可逆性。分别以铜和锌片为工作电极,以石墨为对电极,组装半电池,扫描速度为0.500mV/s。交流阻抗用来测试隔膜的离子电导 率[19]。将隔膜夹在不锈钢对称电极之间,测试的振幅为5.00mV,频率为 0.0100~100 kHz。离子电导率按公式(1)计算。
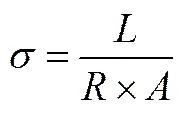
式中,为离子电导率;为隔膜厚度;为隔膜与电极接触面积;为交流阻抗值大小。
循环伏安测试和交流阻抗测试均在辰华 CHI660D型电化学工作站上进行。
1.3 实验方法
快离子导体膜的制备:以NH4H2PO4、Li2CO3、TiO2和Al2O3为原料,按化学计量比进行配料后,充分混合均匀,得到的混合物在马弗炉中以2.00℃/min升温至900℃煅烧5h,冷却后球磨5h得到LATP粉体。将所得粉体在一定的压力下压制成直径为10.0mm的圆片,在马弗炉中以速率2.00℃/min升温至不同温度,烧结5h后得到陶瓷 隔膜。
Cu-Zn电池的组装:将铜片和锌片打磨、冲洗、干燥处理,分别作为Cu-Zn电池的正负极。正极电解液为0.200moL/L Li2SO4+0.200moL/L CuSO4,负极电解液为0.200moL/L Li2SO4+0.200moL/L ZnSO4。在H型电池中间装配LATP隔膜,在两侧的电解槽中分别加入等体积的正负极电解液,将铜电极插入到正极电解液中,锌电极插入到负极电解液中。
2 结果与讨论
2.1 快离子导体隔膜性能
图1为原料混合物的DSC-TG曲线。DSC曲线在197℃左右出现第一个吸热峰,同时对应着质量损失是由于原料NH4H2PO4和Li2CO3在200℃附近自身分解所致,Li2CO3分解产生CO2与NH4H2PO4分解产生NH3和H2O也有贡献。在600~900℃对应的DSC曲线明显上升,表明在这温度区间发生了反应,然而在此温度区间内质量没有发生变化,说明发生了相结构的改变,新的晶相可能在这个温度区间产生,最终形成纯相LATP。这种相的转变主要是NH4H2PO4和Li2CO3分解气体之后产生的物质与TiO2、Al2O3发生的反应,最终形成Li1.3Al0.3Ti1.7(PO4)3。考虑到在加热过程中有气相生成,因此将升温速率设定为2.00℃/min,为了能够使反应充分,合成LATP的最终温度设定为900℃。发生的化学反应如式(2)。
(3–2)Li2CO3+4TiO2+(2–2)Al2O3+6NH4H2PO4—→2Li3–2x(Al1–xTi)2(PO4)3+6NH3↑+(3–2)CO2↑+ 9H2O↑ (2)
图2(a)是Li3–2x(Al1–xTi)2(PO4)3(=1.05~0.680)体系经900℃固相反应5h后得到的固相产物的XRD衍射图谱。由于原料的化学计量比符合Li1.3Al0.3Ti1.7(PO4)3,且Li1.3Al0.3Ti1.7(PO4)3是由铝离子固溶到LiTi2(PO4)3中形成的,所以Li1.3Al0.3Ti1.7(PO4)3和LiTi2(PO4)3的晶格结构相同,两者的峰位相对应。因而XRD的谱图对应于LiTi2(PO4)3晶相。在=0.680,0.750样品的图谱中2角为21.8°的位置有AlPO4相的峰出现,2角为22.6°、27.8°的位置有TiP2O7相的峰出现,而=0.85时相应的峰消失,说明此时Al3+取代了LiTi2(PO4)3的部分Ti4+,得到的物质为纯相Li1.3Al0.3Ti1.7(PO4)3化合物。而图中衍射峰的位置随=1.05~0.680组分的不同向衍射角较高的方向偏移,说明A13+取代了部分Ti4+,使得晶格参数发生变化,这主要是因为A13+的离子半径(0.535Å,1Å=0.1nm)小于Ti4+的离子半径(0.605Å)造成的。该图谱与JCPDS标准(PDF卡号为35-0754)及其他文献上的图谱对比一致[20],因此为0.85的组分为Li1.3A10.3Til.7(PO4)3。图2(b)为取0.85的产物在不同温度烧结后隔膜的XRD图谱。由XRD图可以看出X射线衍射峰很尖锐,衍射强度比较强,无杂质峰,说明了所合成的产物结晶性比较好,晶型比较完整,而且各烧结温度下的图谱中衍射峰位置基本一致,说明烧结后的物质没发生变化。
图3中(a)~(d)为压力分别为6.0MPa、8.0MPa、10.0MPa、12.0MPa下制得膜在900℃烧结5h后的扫描电镜图。可以看出,在压力较小的时候膜的表面有较大的孔隙,随着制片压力的增大,材料之间挤压紧密,孔隙变小。图4中(a)~(d)为在10.0MPa压制下,烧结温度分别为700℃、800℃、900℃、1100℃时制得的隔膜扫描电镜截面图。从图中可以看出,在温度比较低的时候材料间的孔隙较多,隔膜致密性差,随着温度的升高,有利于减小颗粒之间的孔隙,增大颗粒之间的接触面积。
图5为不同条件下隔膜的交流阻抗图和离子电导率图,压制的隔膜直径均为10.0mm,烧结时间均为5h。图5(a)和(d)分别为烧结温度在900℃,膜厚度为0.500mm不同压力下所得隔膜的交流阻抗图和根据该交流阻抗计算所得的离子电导率,结果表明随着压力增大,离子电导率先增大后减小,压(a)~(c)分别为不同压力、不同烧结温度以及不同厚度下的隔膜电阻;(d)~(f)分别对应于(a)~(c)条件下的Li+电导率力为10.0MPa时所对应的离子电导率最大。一方面,压力小会使隔膜致密度降低,孔隙率增大,除了锂离子通过外还有其他离子通过,影响锂离子迁移数,由此导致锂离子电导率降低;另一方面,当压力大时致密度增大,电阻变大,因此导致离子电导率减小。由此可知最优压力为10.0MPa。
图5(b)为压力10.0MPa,膜厚度0.600mm不同烧结温度时制备隔膜的交流阻抗图,图5(e)为对应的锂离子电导率。烧结温度就是陶瓷的致密化温度。可以看出随着烧结温度的升高,离子电导率呈现先缓慢上升后急剧下降的趋势,主要是由于低温烧结出来的圆片隔膜致密性差。随着温度的升高,有利于减小颗粒之间的孔隙,增大颗粒之间的接触面积,电导率上升。但是温度过高,接近磷酸钛铝锂的熔点时致密度会增强,再加上颗粒间发生团聚结块以及颗粒内部的结构会破坏,使得锂离子电导率降低。可以看出烧结温度在900℃时最优。图5(c)和5(f)分别为压力10.0MPa,烧结温度900℃不同厚度隔膜的交流阻抗图和锂离子电导率变化图。可以看出,隔膜的厚度在0.390~0.700mm时随着厚度的增加,电阻变化微小,但是当厚度大于0.700mm时电阻随之增大。随着隔膜厚度的增加,离子电导率先降低后增加。原因可能是隔膜厚度太薄孔隙率很大,太厚了粒子间的空孔增多,而且整体电阻增大。结合电阻和离子电导率两个因素,隔膜厚度为0.500mm时为优。
综上,LATP快离子导体隔膜制备的最优条件为压力10.0MPa,烧结温度900℃,膜厚度0.500mm,膜直径10.0mm,选最优条件下制备的隔膜,装配于Cu-Zn电池中。
2.2 Cu-Zn电池的可逆性
图6(a)、(b)均以石墨为对电极,分别以铜和锌为工作电极组装成半电池的循环伏安图,可以看出铜和锌的循环伏安曲线各有一对明显的氧化还原峰,铜的氧化还原峰对应的电位分别为0.300V和0.180V,锌曲线中氧化还原峰对应的电位分别 为–0.850V和–1.10V。这说明在铜和锌电极上所产生的这些电化学反应都是可逆的,而在传统的Cu-Zn电池中,溶液中的正离子只起到参与导电作用,电池几乎是不可逆的。在本研究构建的Cu-Zn可逆电池中,一方面隔膜允许Li+作为导电离子,可以自由的穿过;另一方面隔膜对Cu2+和Zn2+进行分隔,使其不能穿过,只能作为电极进行反应。由于这两个电极反应都是可逆的,因此可以构造成为可逆 电池。
2.3 充放电特性
图7为Cu-Zn电池的首次充放电曲线,可以看出设计的电池不仅能够放电,还能够充电,证明了电池的可充电性,电压范围为0.800~1.50V,在限定放电容量为1.00Ah的条件下,电池的充电效率可以达到60.0%。放电时电池的反应机理为:正极Cu2++ 2e–—→Cu;负极 Zn—→Zn2++ 2e–。在放电过程中,负极电解液中有部分新的Zn2+生成,而正极电解液中有部分Cu2+消耗掉,因此导致负极电解液中离子呈现富阳离子状态,正极电解液中离子呈现贫阳离子状态,为了保持正负极电解液中阴阳离子的平衡性,Li+就会穿过快离子导体从负极电解液到达正极电解液中,从而使两侧电解液中的离子呈现平衡状态。充电的时候机理相反:正极Cu—→Cu2++ 2e–,负极Zn2++2e–—→Zn。当对电池进行充电时,正极电解液中有部分新的Cu2+生成,而负极电解液中有部分Zn2+消耗掉,为了保持正负极电解液中阴阳离子的平衡性,Li+就会透过快离子导体从正极到达负极电解液中,从而使两侧电解液中的离子呈现平衡状态。
图8是Cu-Zn可逆电池的长期循环性能图。从图中可以看出,经过100周循环之后,充电容量几乎没有发生变化,保持在初始容量99.0%以上。表明所设计的Cu-Zn可逆电池具有长期循环稳定性。在限定放电容量为1.00Ah的条件下,充电效率为60.0%以上,通过进一步改进电解液和电极制备工艺,可以有效提高充电效率,有关研究正在进行中。
3 结论
采用固相合成法得到LATP快离子导体,在最优的压力10.0MPa、温度900℃和厚度0.500mm条件下制得LATP离子选择性膜。以LATP作为电池隔膜构建的Cu-Zn电池可以进行有效的充放电。在构建的电池中,利用Li+能够自由地穿过选择性隔膜,而Cu2+和Zn2+不能穿过隔膜的特性,通过Li+的迁移来平衡电池内部离子浓度。所得可充电Cu-Zn电池的工作电压范围为0.800~1.50V,进行100次循环后容量保持99.0%以上,显示良好的循环性能。
[1] MARTINS G F. Why the Daniell cell works[J]. Journal of Chemical Education,1990,67(6):482-482.
[2] ZHANG H P,YANG T,WU X,et al. Using Li+as the electrochemical messenger to fabricate an aqueous rechargeable Zn-Cu battery[J].Chemical Communications,2015,51(34):7294-7297.
[3] GIRIJA T C,VIRKAR A V. Low temperature electrochemical cells with sodium β″-alumina solid electrolyte(BASE)[J]. Journal of Power Sources,2008,180(1):653-656.
[4] DONG X,WANG Y,XIA Y. Re-building Daniell cell with a Li-ion exchange film[J]. Scientific Reports,2014,4:6916-6916.
[5] GU S,GONG K,YAN E Z,et al.A multiple ion-exchange membrane design for redox flow batteries[J]. Energy & Environmental Science,2014,7(9):2986-2998.
[6]MASQUELIER C. Solid electrolytes:lithium ions on the fast track[J]. Nature Materials,2011,10:649-650.
[7] KHURANA R,SCHAEFER J L,ARCHER L A,et al. Suppression of lithium dendrite growth using cross-linked polyethylene/poly
(ethylene oxide) electrolytes:a new approach for practical lithium-metal polymer batteries[J]. Journal of the American Chemical Society,2014,136(20):7395-7402.
[8] MAURYA S,SHIN S H,KIM M K,et al. Stability of composite anion exchange membranes with various functional groups and their performance for energy conversion[J]. Journal of Membrane Science,2013,443:28-35.
[9] HUSKINSON B,MARSHAK M P,SUH C,et al. A metal-free organic-inorganic aqueous flow battery[J]. Nature,2014,505(7482):195-198.
[10] LU Y,GOODENOUGH J B,KIM Y. Aqueous cathode for next-generation alkali-ion batteries[J]. Journal of the American Chemical Society,2011,133(15):5756-5759.
[11] ZHAO Y,DING Y,SONG J,et al. Sustainable electrical energy storage through the ferrocene/ferrocenium redox reaction in aprotic electrolyte[J]. Angewandte Chemie International Edition,2014,53(41):11036-11040.
[12] LI H,WANG Y,ZHOU H,et al. Rechargeable Ni-Li battery integrated aqueous/nonaqueous system[J]. Journal of the American Chemical Society,2009,131(42):15098-15099.
[13] ZHAO Y,HONG M,YU G,et al. A 3.5V lithium-iodine hybrid redox battery with vertically aligned carbon nanotube current collector[J]. Nano Lett,2014,14:1085-1092.
[14] JAKM J G,PONTFOORT M S,VAN L N,et al. Composite cell components for elevated temperature all-solid-state Li-ion batteries[J]. Solid State Ionics,2001,143(1):57-66.
[15] 叶飞鹏,王莉,何向明,等.钠离子电池研究进展[J].化工进展,2013,32(8):1789-1795.
YE F P,WANG L,HE X M,et al.Advance in Na-ion batteries [J]. Chemical Industry and Engineering Progress,2013,32(8):1789-1795.
[16] 牟怀燕,高云玲,付坤,等.离子印迹聚合物研究进展[J].化工进展,2011,30(11):2467-2480.
MU H Y,GAO Y L,FU K,et al. Progress in template-ion imprinted polymer[J]. Chemical Industry and Engineering Progress,2011,30(11):2467-2480.
[17] 李作鹏,赵建国,温雅琼,等.超级电容器电解质研究进展[J].化工进展,2012,31,(8):1631-1640.
LI Z P,ZHAO J G,WEN Y Q,et al. Research progress of electrolytes in supercapacitor [J]. Chemical Industry and Engineering Progress,2012,31(8):1631-1640.
[18] 李祥,张忠国,任晓晶,等.纳滤膜材料研究进展[J].化工进展,2014,(33)5:1210-1218.
LI X,ZHANG Z G,REN X J,et al. Progress in nanofiltration membrane materials[J]. Chemical Industry and Engineering Progress,2014,33(5):1210-1218.
[19] CHEN L,GUO Z,XIA Y,et al. High-voltage aqueous battery approaching 3V using an acidic-alkaline double electrolyte[J]. Chemical Communications,2013,49:2204-2206.
[20] WU X M,LI X H,WANG S W,et al. Preparation and characterization of lithium-ion-conductive Li1.3Al0.3Ti1.7(PO4)3 thin films by the solution deposition[J]. Thin Solid Films,2003,425(1/2):103-107
Preparationofafastionconducting membrane for rechargeableCu-Znbatteries
ZHOU Yisen,LIANG Shanshan,YANG Chao,ZHU Tian,ZHANG Hangping
(School of Petrochemical Engineering,Changzhou University,Changzhou 213164,Jiangsu,China)
Lithium fast ion conductor Li1.3Al0.3Ti1.7(PO4)3with NASICON structure is prepared by solid state reactions using NH4H2PO4,Li2CO3,TiO2and Al2O3sintered at 900℃ for 5h. The powders are then pressed into tablets and calcined to prepare separators for conducting lithium ions. The effects of pressure, sintering temperature and the thickness on the ionic conductivities are studied. The phases and features of the membrane are investigated by X-ray diffraction and scanning electron microscope, respectively. The ionic conductivities are measured by AC impedance spectra. Optimal conditions referenced to fabricate the membrane are as follows:the pressure is 10.0MPa;the sintering temperature is 900℃ and the thickness is 0.500mm. The prepared membrane is employed to separate the cathode and the anode electrolytes apart,where lithium ions can freely pass through whereas other ions cannot. In this way we successfully assemble a rechargeable Cu-Zn battery. The working voltage of the resulting battery is 0.800—1.50V,and the charge capacity remains over 99% of its original capacity after 100 cycles,which shows a good cyclic stability.
electrochemistry;membranes;electrolytes;Cu-Zn battery
O646
A
1000–6613(2017)01–0282–07
10.16085/j.issn.1000-6613.2017.01.035
2016-04-18;修改稿日期:2016-06-29。
国家自然科学基金项目(51273027)。
周贻森(1990—),男,硕士研究生。联系人:张汉平,副研究员,研究内容化学电源、储能材料及器件、太阳能电池等。E-mail:jinhongshi0001@163.com。

