粉单竹竹青色素提取工艺及其成分分析
金 叶 李广兴 刘 义 骆莲新 李明富
(1.广西大学轻工与食品工程学院,广西南宁,530004;2.广西清洁化制浆造纸与污染控制重点实验室,广西南宁,530004)
·竹青色素提取·
粉单竹竹青色素提取工艺及其成分分析
金 叶 李广兴 刘 义 骆莲新*李明富
(1.广西大学轻工与食品工程学院,广西南宁,530004;2.广西清洁化制浆造纸与污染控制重点实验室,广西南宁,530004)

粉单竹竹青;色素;超声波提取
木材是世界造纸工业最常用的原料,而我国木材资源十分紧缺,原料的供应成为制约造纸工业发展的关键问题之一[1]。我国竹资源丰富,素有“竹子王国”之称,竹子是优质的造纸原料,但是竹子高得率浆具有漂白难、易返黄的特性,其高得率法制浆尚处于研究阶段[2]。
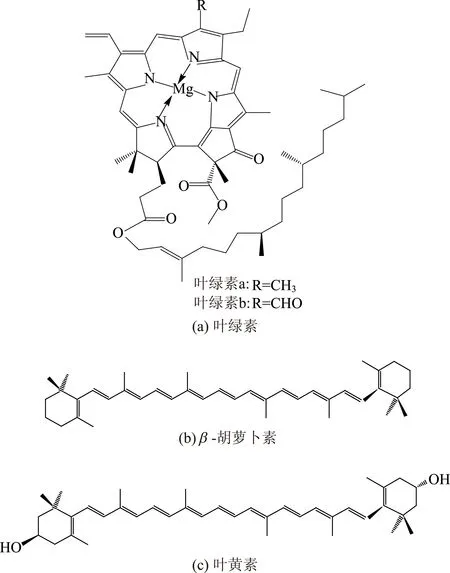
图1 叶绿素与类胡萝卜素分子结构
竹青(竹子外表皮),中医上又称竹茹,《中药辞海》中记载,竹茹为禾本科刚竹属、箣竹属和牡竹属中一些竹种的茎秆所刮下的外皮层或相邻一层[3],绿色植物的颜色来自于叶绿素[4],绿叶中色素的提取物主要是叶绿素、类胡萝卜素以及一些无色的物质。其中叶绿素具有较强的抗氧化能力[5],类胡萝卜素也具有强大的抗氧化活性,且是一种很好的自由基清除剂[6-7]。在H2O2的漂白过程中,色素的存在会消耗一部分H2O2。大部分绿色植物主要含有叶绿素a和叶绿素b,其分子结构如图1(a)所示,在分子结构中,一部分是含有四吡咯环构成的卟啉环骨架,一部分是一个很长的脂肪烃侧链,称为叶绿醇[8-9]。类胡萝卜素分为胡萝卜素和叶黄素,其分子结构如图1(b)、图1(c)所示,二者在结构上均由8个类异戊二烯单元演变而成,具有多个共轭双键[10-12]。楼鼎鼎[13]采用超临界CO2流体萃取技术从刚竹属竹子茎秆的外皮层中提取“竹子三菇皂戒元”,该物质是一种标准化制剂由木栓酮、羽扇豆烯酮及其同系物为主的五环三菇类化合物组成(EZR2002);Nishina A等人[14]从毛竹的茎皮中检出了抗菌活性成分2,6-二甲氧基对苯醌。由此可知,竹青组分含有不饱和键的发色或助色基团,在高得率竹浆制备过程中,如果这些基团残留在竹浆中,会对竹子高得率浆白度及白度稳定性造成不利影响[15]。前人研究表明,通过揉搓分丝可破坏竹子的表皮蜡质层能有效改善漂白效果,增加预浸、水洗人工剥离表皮色素量,可提高竹子化机浆白度2%~3%,并降低纸浆返黄程度[16]。笔者初步研究了粉单竹去除竹皮与未去除竹皮磺化化学机械浆(SCMP),发现未去除竹皮SCMP返黄值(1.05)大于去除竹皮SCMP返黄值(0.66),且在相同漂白条件下,去除竹皮SCMP白度的增加略大于未去除竹皮SCMP白度的增加。
本实验主要研究粉单竹竹青色素提取工艺及其成分分析,为今后提高竹子高得率浆白度提供理论依据。
1 实 验
1.1原料
从广西林业科学研究院取得2~3年生的新鲜粉单竹。
1.2实验仪器
FZ102微型植物试样粉碎机,北京市永光明医疗仪器有限公司;PL-S80超声波清洗仪,东莞康士洁超声波科技有限公司;RE-52A旋转蒸发器,上海亚荣生化仪器厂;Analytik Jena紫外可见分光光度计、Magnet System 500′54 Ascend核磁共振波谱仪、Tensor II傅里叶变换红外光谱仪,德国布鲁克分析仪器公司。
1.3实验方法
1.3.1原料的制备
将刚采伐的粉单竹洗净、刮皮、风干,经植物粉碎机粉碎,然后将磨成粉的竹青过60目筛得竹青粉,密封避光冷藏备用。
1.3.2超声波提取法
称量竹青粉1 g于100 mL烧杯中,加入乙醇溶液。将浸润的样品放入频率40 kHz、额定功率1500 W的超声波清洗仪中进行超声处理,得到竹青粗提液。
1.4竹青色素定性及定量检测方法
将竹青粗提液用0.45 nm有机滤膜过滤,过滤液用乙醇稀释9倍。在紫外可见光区(400~800 nm)测稀释过滤液的紫外光谱图,并选择合适吸收峰波长作为定性检测。读取645、663 nm波长吸光度,按Arnon公式[17]计算叶绿素a和叶绿素b含量以及提取的叶绿素总含量。
Ma=(12.71A663-2.59A645)·9V/(1000W)
(1)
Mb=(22.88A645-4.67A663)·9V/(1000W)
(2)
Mc=Ma+Mb
(3)
式中,Ma为叶绿素a的含量,mg/g;Mb为叶绿素b的含量,mg/g;Mc为叶绿素总含量;mg/g;V为提取液的体积,mL;W为竹青粉质量,g;A645为645 nm处的吸光度。A663为663 nm处的吸光度。
1.5竹青粗提液的柱层析分离
竹青色素纯化:取5 g竹青粉,按照最佳提取方法提取竹青色素,旋转蒸发提取液到20 mL,用10 mL石油醚(30~60℃)萃取,取上层液,然后用蒸馏水洗涤上层液两次,放置备用。
柱层析分离:层析柱的固定相为中性氧化铝(100~200目),用石油醚平衡,洗脱剂依次为石油醚-丙酮(10∶1)、石油醚-丙酮(5∶2)、石油醚-丙酮(5∶3)、甲醇阶梯洗脱,收集分离的色素,然后在400~800 nm处测紫外光光谱图。
1.6核磁谱图的分析
将竹青粗提液纯化后的竹青色素旋转蒸发通氮气干燥,然后溶解在氘代氯仿(CDCl3)中,在500 MHz的频率下测其1H-NMR谱图。
1.7红外光谱分析
将竹青粗提液纯化后的色素旋转蒸发通氮气干燥,与KBr混合压片进行红外光谱测定。
2 结果与讨论
2.1超声波提取单因素实验结果
叶绿素a和叶绿素b在红光区最大吸收峰分别为663、645 nm附近,在蓝光区最大吸收峰为453、429 nm附近[18]。蓝光区易受类胡萝卜素的干扰。竹青粗提液在400~800 nm的紫外可见光吸光光谱图如图2所示,该图与芒果树叶叶绿素粗提液吸收光谱图相似[19],在666 nm处有明显的吸收峰。故本实验选择666 nm作为竹青色素的定性检测红外波长。
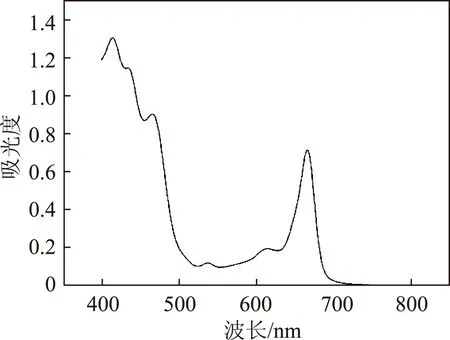
图2 竹青粗提液紫外可见吸收光谱
2.1.1乙醇浓度
叶绿素是一种酯,易溶于有机溶剂,由于丙酮、乙醚有毒,且价格相对较高,所以本实验选择乙醇为提取剂。在料液比1∶30、超声时间60 min、超声温度55℃的条件下,研究乙醇浓度对叶绿素含量和吸光度的影响,结果见图3。由图3可知,当乙醇浓度由60%增加到90%(体积分数)时,叶绿素含量和吸光度不断增加;当乙醇浓度超过90%时,吸光度减小,这可能是由于叶绿素a与叶绿素b结构中均有一个极性的“头部”,所以用含有一定水量的有机溶剂来提取叶绿素效果更好,故乙醇提取的最佳浓度为90%。

图3 乙醇浓度对叶绿素含量和吸光度的影响
2.1.2超声温度
在乙醇浓度90%、料液比1∶30、超声时间60 min的条件下,研究超声温度对叶绿素含量和吸光度的影响,结果见图4。由图4可知,当超声温度由35℃升高到55℃时,叶绿素含量逐渐增加,当温度超过55℃时,叶绿素含量下降,这是因为叶绿素不稳定,温度过高可能使叶绿素结构发生改变或竹青粉内杂质溶出,不利于叶绿素的提取,所以超声温度最佳为55℃。
2.1.3超声时间
在乙醇浓度90%、超声温度55℃、料液比1∶30的条件下,超声时间对叶绿素含量和吸光度的影响结果见图5。由图5可知,当超声时间由20 min延长到40 min时,叶绿素含量不断增加,超声时间超过40 min后随着超声时间的增加,叶绿素含量逐渐减小,其原因可能是过长的超声时间导致其他杂质的溶出从而导致叶绿素含量下降。超声持续的机械振动与空化作用导致叶绿素的分子结构受到破坏也会导致吸光度降低,所以超声时间应选择40 min。

图5 超声时间对叶绿素含量和吸光度的影响
2.1.4料液比
料液比是提取过程的一个重要影响因素,在乙醇浓度90%、超声温度55℃、超声时间60 min的条件下,料液比对叶绿素含量和吸光度的影响见图6。由图6可知,在料液比1∶20~1∶35范围内,随着提取液的增加,叶绿素含量不断增加,当超过1∶35时,叶绿素含量反而减小。从传质速率的角度看:主要表现在影响固相主体和液相主体之间的浓度差,即传质推动力。料液比大,提取过程中液相浓度增加快,两相间的浓度差减少加快,从而使传质推动力衰减加快,影响传质速率。料液比的减小必然会在较大的程度上提高传质推动力,但是过低的料液比可能会导致杂质析出,影响叶绿素的提取,同时考虑到成本以及提取液的回收,较佳的料液比为1∶35。

图6 料液比对叶绿素含量和吸光度的影响
从图3~图6可知,竹青色素定性测量的变化趋势与Arnon公式计算叶绿素含量的变化趋势相一致。
2.1.5提取次数
在乙醇浓度90%、超声时间40 min、超声温度55℃、料液比1∶35的最佳工艺条件下,依次提取竹青叶绿素四次,每提取一次,使用紫外光谱仪检测一次,并根据Arnon公式计算叶绿素含量,计算结果见表1。由表1可知,经过两次提取,竹青叶绿素已基本提取完全,从经济的角度考虑,竹青叶绿素可以提取两次,提取率约为0.39%。
2.2紫外光谱分析
通过石油醚萃取,下层液含有许多杂质,将上层液通过柱层析分离,依次得到橙黄色、蓝绿色、黄色和绿色4种色素,这4种色素分别在可见光区测紫外光谱图,结果如图7~图9所示。

表1 提取次数对叶绿素含量影响
注A666是波长666 nm处的吸光度。

图7 橙黄色色素紫外光谱图
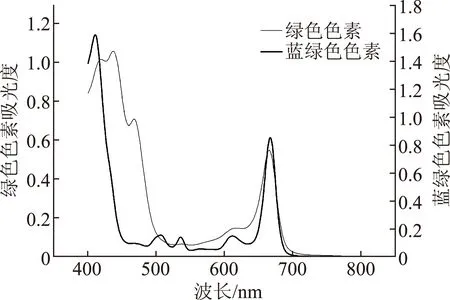
图8 蓝绿色和绿色色素紫外光谱图
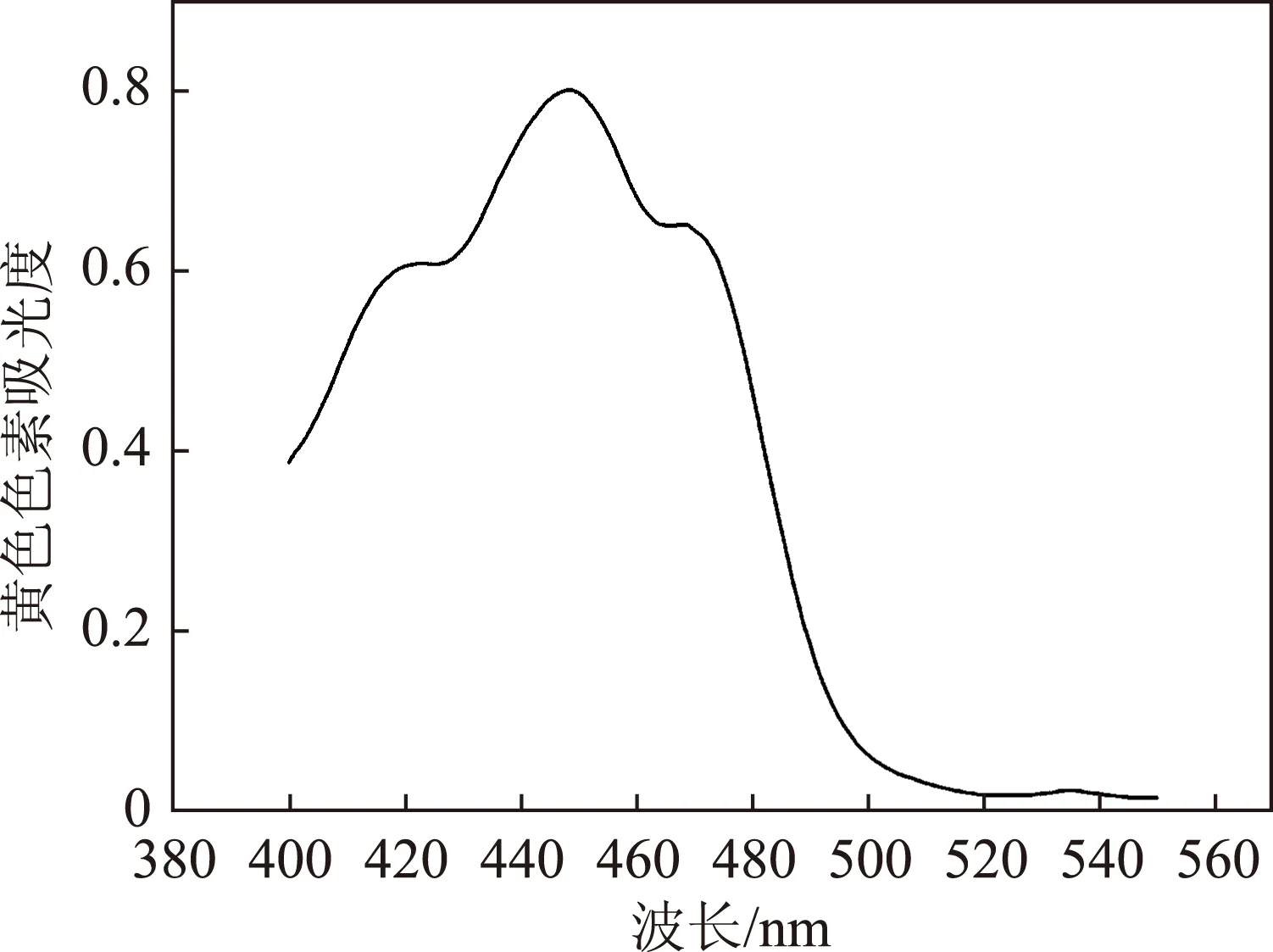
图9 黄色色素紫外光谱图
叶绿素a和叶绿素b及其衍生物对红光区(620~700 nm)和蓝紫光区(400~500 nm)的光吸收特别强烈,而对绿光区(520~580 nm)的光则吸收较弱,因而叶绿素呈现绿色[20]。由图8可知,蓝绿色色素和绿色色素分别在蓝光区410 nm、437 nm处有最大吸收峰,在红光区667 nm、665 nm处有最大吸收峰,并且与相关文献[21-24]的叶绿素a、叶绿素b的紫外光谱图相似,类胡萝卜素由于分子结构中具有共轭双键这个独特的发色基团,所以在紫外蓝光区(400~500 nm)有特征吸收峰,能呈现出红、橙、黄色[7],图7和图9分别在447 nm、449 nm处出有最大吸收峰,并且与相关文献[9,24]的类胡萝卜素的紫外光谱相似。通过以上分析可判断提取的色素分别是叶绿素和类胡萝卜素。

图11 竹青粗提液纯化后的红外光谱图
2.3核磁谱图分析
据有关文献可知[12,25-27],δ为7.26处为CDCl3溶剂峰,δ大于11.7处是杂峰,δ为11.2~8.5处为四吡咯环上的H,主要来源于叶绿素及其衍生物上的次甲基质子,由于叶绿素b上含有醛基,所以峰位在前段,δ为8.0~7.0处存在芳香族上的H,δ为7.0~5.4处为类胡萝卜素萜烯的链以及与其他有着共轭双键峰(叶绿素及其衍生物上的共轭双键)重叠峰的区域,δ为5.4~5.0之间可能存在着脂肪酸上双键质子,δ为5.0~3.0处是氧原子上的饱和氢,可能是甾醇、甘油树脂等产生的,而δ为2.4~0.8是脂肪族上的饱和氢,δ为-1.5~-2.0是叶绿素卟啉类化合物上的N—H键上的H引起的。由图10可知,竹青色素纯化液中除了色素可能还含有其他物质,如脂肪酸、甾醇等。

图10 竹青粗提液纯化后的核磁谱图
2.4红外光谱分析

3 结 论
3.1以乙醇为提取剂,超声波提取法提取粉单竹竹青色素,得出最佳提取条件为:乙醇浓度90%,料液比1∶35,超声时间40 min, 超声温度55℃;从经济的角度考虑,竹青叶绿素可以提取两次,提取率为0.39%。
3.2竹青提取液经石油醚萃取纯化后通过柱层析分离色素得到橙黄色、蓝绿色、黄色、绿色4种色素,通过测4种色素紫外光谱图,可知所测光谱图与叶绿素a、叶绿素b以及类胡萝卜素图相似。

[1] ZHAN Huai-yu. Supply and Application of Non-wood Fiber and WastePaper for Papermaking[J]. China Pulp & Paper, 2010, 29(8): 56. 詹怀宇. 我国造纸用非木材纤维和废纸原料供应与利用[J]. 中国造纸, 2010, 29(8): 56.
[2] Wang Yu-Long, Zhao Chuang-shan, Liu Yan-Xin, et al. Giant reed SCMP for process conditions[J]. China Pulp & Paper Industry, 2002, 25(11): 40. 王玉珑, 赵传山, 刘艳新, 等. 芦竹磺化化机浆工艺条件[J]. 中华纸业, 2002, 25(11): 40.
[3] She Chuang-long, Huang Tai-kang, Ding Zhi-zun. Traditional Chinese medicine example (The first volume)[M]. Beijing: Chinese medical science and technology press, 1993. 佘传龙, 黄太康, 丁志遵. 中药辞海(第一卷)[M]. 北京: 中国医药科技出版社, 1993.
[4] Willstätter R Facts. Nobel Prize Lecture, 1915. Available at Nobel’s prize home page, http://nobelprize.org (accessed Jun 2007).
[5] Tang Xiao-jun, Zhang Ming-wei, Chi Jian-wei et al. Studies on the stability of chlorophyll in momordicacharantia L[J]. The Food Industry, 2008(2): 1. 唐小俊, 张名位, 池建伟, 等. 苦瓜叶绿素稳定性研究[J].食品工业, 2008(2): 1.
[6] Trevithick-Sutton C C, Foote C S, Collins M, et al. The retinal carotenoids zeaxanthin and lutein scavenge superoxide and hydroxyl radicas; Achemiluminescence and ESR study[J]. Molecular Vision, 2006(12): 1127.
[7] Hui Bo-di. Carotenoids chemistry and biochemistry[M]. Beijing: China Light Industry Press, 2005. 惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社, 2005.
[8] Willstätter R. On Plant Pigments. Nobel Prize Lecture, June3, 1920. Available at Nobel’s prize home page, http://nobelprize.org (accessed Jun 2007).
[9] Gao Gui-zhen, Wu Xiao-ming, Lu Guang-yuan, et al. Analysis of carotenoids content in seeds from several oil crops[J]. Chinese journal of oil crop sciences, 2008, 30(3): 312. 高桂珍, 伍晓明, 陆光远. 几种油料作物种子中类胡萝卜素含量的分析[J]. 中国油料作物学报, 2008, 30(3): 312.
[10] Li Tang-luo, Ding Lan, Shan Wei-wei, et al. The Carotenoids Extraction Technology from Sweet Potato[J]. Journal of Anhui Agri.Sci., 2016, 44(1): 115. 李帑洛, 丁 岚, 单卫威, 等. 甘薯中类胡萝卜素提取工艺[J]. 安徽农业科学, 2016, 44(1): 115.
[11] Robert A, Reinhold C, Jürgen C, et al. Isolation of carotenoids from plant materials and dietary supplements by high-speed counter-current chromatography[J]. Journal of Chromatography A, 2005(1074): 99.
[12] Juan V, Hervé T.1H-NMR Quantitative Determination of Photosynthetic Pigments from Green Beans(Phaseolus vulgaris L.)[J]. J. Agric. Food Chem., 2008(56): 314.
[13] Lou Ding-ding. Components analysis and Functions research of the extract of bamboo bark by SFE[D]. Hangzhou: Zhejiang University, 2005. 楼鼎鼎. 竹茹超临界革取物的组成分析和功能性研究[D]. 杭州: 浙江大学, 2005.
[14] Nishina A, Hasegawa K, Uchibori T, et al. 2.6-Dimethoxy-P-benzoquinone as an antibacterial substance in the bark of phyllostachysheterocycla var. Pubescens, a species of thick-stemmed bamboo[J]. J. Agric. Food Chem., 1991, 39(2): 266.
[15] SONG Xue-ping, LUO Lian-xin, LIN Ji-zhen, et al. Effect of Main Components of Bamboo Succus on the Brightness of Bamboo APMP[J]. China Pulp & Paper, 2012, 31(2): 1. 宋雪萍, 骆莲新, 林积圳, 等. 竹沥液主要组分对APMP竹浆白度的影响[J]. 中国造纸, 2012, 31(2): 1.
[16] Guan Liang. The Analysis of Succus Bambusae Component and Its Impact on the Bleaching and Black to the Yellow[D]. Nanning: Guangxi University, 2008. 关 亮. 竹沥液成分测定及对漂白、 返黄性能影响的分析[D]. 南宁: 广西大学, 2008.
[17] ArnonD I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris[J]. Plant physiology, 1949, 24(1): 1.
[18] Sun Jun-bao, Wang Jian-xin. Study on Method for Determination of Chlorophyll in Cherry Leaves[J]. Journal of Shandong Agricultural Sciences, 2010, 38(3): 18. 孙俊宝, 王建新. 樱桃叶绿素含量测定方法研究[J]. 山东农业科学, 2010, 38(3): 18.
[19] Xie Yu-qi, Chen Hong, Luo Ying, et al. Study on Chlorophyll Extraction Process from Mango [J]. Light Industry Science and Technology, 2013, 9(9): 36. 谢宇奇, 陈 宏, 罗 颖, 等. 芒果叶绿素的超声波辅助提取工艺研究[J]. 轻工科技, 2013, 9(9): 36.
[20] Hecht S S, Hoffmann D. Tobacco-specific nitrosamines, an important group of carcinogen in tobacco and tobacco smoke[J]. Commentary A-merican Health Foundation, 1998, 9(6): 875.
[21] Deng Xiang-yuan, Gao Kun, Zhang Li-juan. Preliminary Study on Spectral Characteristics and Content of Chlorophyll in Mulberry Leaves[J]. Journal of Anhui Agri. Sci., 2010, 38(31): 17423. 邓祥元, 高 坤, 张丽娟. 桑叶叶绿素光谱特征及其含量测定的初步研究[J]. 安徽农业科学, 2010, 38(31): 17423.
[22] Wang Xue-fang. Study on Chlorophyll Content Determination and Applicationin Rapeseed[D]. Wuhan: Hua Zhong Agricultural University, 2008. 汪雪芳. 油菜籽叶绿素测定方法研究及应用[D]. 武汉: 华中农业大学, 2008.
[23] Ji Ping-xiong, Xue Wei-liang, Luo Yu-mei. Separation and identification of the bamboo leaf’s chloroplast pigment[J]. Guangdong Agricultural Sciences, 2011(15): 80. 纪平雄, 薛伟亮, 骆玉媚. 竹叶叶绿体色素的分离与鉴定[J]. 广东农业科学, 2011(15): 80.
[24] Hendrik K, Sven S, Aravind P. Fast, Sensitive, and Inexpensive Alternative to Analytical Pigment HPLC: Quantification of Chlorophylls and Carotenoids in Crude Extracts by Fitting with Gauss Peak Spectra[J]. Anal. Chem., 2007(79): 7611.
[25] Fatma M M, Jessica K M, Jodrey B, et al. Structural Characterization of a Novel Antioxidant Pigment Produced by a Photochromogenic Microbacteriumoxydans Strain[J]. Appl.Biochem Biotechnol, 2016 (180): 1286.
[26] Loredana S, Simonetta F, Maria I A, et al. The Potential Exploitation of the Mediterranean Invasive Alga Caulerpacylindracea: Can the InvasionBe Transformed into a Gain?[J]. Mar. Drugs, 2016(14): 210.

(责任编辑:董凤霞)
ExtractionTechnologyandCompositionAnalysisofBambooBarkPigmentfromBambusaChungii
JIN Ye LI Guang-xing LIU Yi LUO Lian-xin*LI Ming-fu
(1.CollegeofLightIndustryandFoodEngineering,GuangxiUniversity,Nanning,GuangxiZhuangAutonomousRegion, 530004; 2.GuangxiKeyLabofCleanPulpingandPapermakingandPollutionControl,Nanning,GuangxiZhuangAutonomousRegion, 530004)

BambusaChungii bamboo bark; pigment; ultrasonic extraction
金 叶女士,在读硕士研究生;主要研究方向:清洁化制浆造纸新技术与污染控制。
TS721+.2
A
10.11980/j.issn.0254- 508X.2017.09.005
2017- 08- 02(修改稿)
国家自然科学基金项目“高得率竹浆中非木素组分的光热诱导返色机理和生物调控”(项目批准号:31660182)。
*通信作者:骆莲新,副教授;研究方向:清洁化制浆造纸新技术与污染控制。
(*E-mail: lxluo919@163.com)

