亚麻籽油纳米脂质体的制备及体外释放性能研究
张贝贝,田少君
(河南工业大学 粮油食品学院,郑州 450001)
油脂化学
亚麻籽油纳米脂质体的制备及体外释放性能研究
张贝贝,田少君
(河南工业大学 粮油食品学院,郑州 450001)
为了达到避免亚麻籽油氧化和提高机体消化吸收的目的,通过纳米脂质体包埋技术,采用乙醇注入-超声法制备亚麻籽油纳米脂质体。由单因素实验优化亚麻籽油纳米脂质体制备工艺,并对制备的脂质体进行了表征,对其体外释放性能进行了研究。结果表明:制备亚麻籽油纳米脂质体的最佳工艺条件为磷酸盐缓冲液pH 6.6、亚麻籽油添加量40%(占大豆卵磷脂、β-谷甾醇和吐温-80 总量的比例)、超声时间20 min、超声功率141 W,在此条件下亚麻籽油纳米脂质体的包封率为84%,平均粒径为97 nm,平均电位为-3.5 mV,多分散指数为0.226;在透射电镜下观察到的亚麻籽油纳米脂质体呈圆球状而且分散均匀;在模拟胃肠液消化过程中,亚麻籽油纳米脂质体的释放行为分别符合零级动力学方程和Higuchi方程。
亚麻籽油;纳米脂质体;乙醇注入-超声法;包封率;模拟胃肠液消化
Abstract:In order to avoid the oxidation of flaxseed oil and improve digestion-absorption in human’s body,flaxseed oil nanoliposome was prepared by ethanol injection-ultrasound method.The preparation process of flaxseed oil nanoliposome was optimized by single factor experiment,and the nanoliposome was characterized,and then its in vitro release performance was studied.The optimal process conditions were obtained as follows: phosphate buffer solution pH 6.6,dosage of flaxseed oil 40% (based on total mass of soybean lecithin,β-stitosterol and Tween80),ultrasonic time 20 min and ultrasonic power 141 W.Under these conditions,the entrapment efficiency,particle size,average potential and poly dispersity index of flaxseed oil nanoliposome were 84%,97 nm,-3.5 mV and 0.226,respectively.The particles were spherical and dispersed uniformly via the transmission electron microscopy observation.The release behaviors of flaxseed oil nanoliposome in vitro simulated gastrointestinal digestion were consistent with the zero-order kinetics equation and the Higuchi equation respectively.
Keywords:flaxseed oil; nanoliposome; ethanol injection-ultrasound method; entrapment efficiency; in vitro simulated gastrointestinal digestion
我国是油料生产大国,亚麻籽作为一种富含营养功能成分的油料作物,长期以来备受人们关注[1]。亚麻籽中粗蛋白质、脂肪、总糖含量之和高达84.07%[2]。亚麻籽油中含有多种不饱和脂肪酸,含量高达90%以上,其中以α-亚麻酸含量最高(超过54%)。α-亚麻酸为n-3系人体必需脂肪酸,在体内可转化为EPA和DHA,具有促进胎儿和婴儿大脑生长发育、增强记忆力、提高免疫力、改善和维持视力、预防脑血栓和心肌梗塞等生理功能[3-5]。因此,亚麻籽油是开发补充n-3多不饱和脂肪酸的最经济资源,具有很好的开发应用前景。由于亚麻籽油中不饱和脂肪酸含量高,容易氧化,从而产生不良的风味甚至有害物质,影响货架期。将亚麻籽油制备成纳米脂质体可以很好地延缓及避免亚麻籽油在加工、运输、消费过程中的氧化[6]。
脂质体作为一种新的营养物质递送系统,具有细胞亲和、组织相容和靶向性等优点,已成功应用于生物、医药、化工等领域[7]。近年来,脂质体在食品中的应用日益受到关注,主要用于包埋营养素、酶、食品添加剂和抗菌剂等[8]。通过一定技术手段制备的纳米级脂质体,与传统的脂质体相比,在提高机体消化吸收利用方面更具有优越性。王璇[9]研究发现,番茄红素具有较强的抗肝肿瘤作用,但是番茄红素不溶于水,体内吸收利用很低,通过使用纳米脂质体作为载体,可以促进其在体内的吸收,提高生物利用度。Ghorbanzade等[10]为了防止鱼油的氧化以及掩盖其强烈的气味,通过包埋技术将鱼油制备成纳米脂质体,改善了鱼油的食用品质,扩大了鱼油的应用范围。Sebaaly等[11]研究发现纳米脂质体系统有利于稳定丁香油的挥发性不稳定成分。
目前,常用的纳米脂质体制备方法包括逆相蒸发法、薄膜-超声法、乙醚注入-超声法等。然而,这些方法由于不可避免地使用了大量有毒有机溶剂而不适用于食品工业,也难以满足工业化大规模生产的要求。而乙醇注入-超声法制备脂质体具有操作简单、不使用有毒试剂、重现性好、产品粒径小等优点。因此,本研究采用乙醇注入-超声法,利用单因素实验对亚麻籽油纳米脂质体的制备工艺和配方进行优化,并对产品进行表征和模拟胃肠液释放性能进行研究,为充分开发利用亚麻籽油资源提供了理论依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
亚麻籽油:河北欣奇典食品有限公司;大豆卵磷脂(纯度≥90%)、β-谷甾醇:上海蓝季科技有限公司;吐温-80:天津市科密欧化学试剂有限公司;无水乙醇(分析纯)、石油醚(分析纯,沸程为30~60.℃):天津市天力化学试剂有限公司;胃蛋白酶(≥474 U/mg)、胰蛋白酶(≥243 U/mg):北京索莱宝科技有限公司。
1.1.2 仪器与设备
电热恒温水浴锅:北京市永光明医疗仪器有限公司;TDL-5-A 台式离心机:上海安亭科学仪器厂;TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;JY92-ⅡDN超声波细胞破碎仪:宁波新芝生物科技股份有限公司;RE-52系列旋转蒸发仪:上海亚荣生化仪器厂;Zetasizer Nano ZS90 型纳米激光粒度分析仪:英国马尔文仪器有限公司。
1.2 实验方法
1.2.1 亚麻籽油纳米脂质体的制备
采用乙醇注入-超声法[12]制备亚麻籽油纳米脂质体。称取大豆卵磷脂330 mg与β-谷甾醇110 mg 于锥形瓶中,加入一定量亚麻籽油和100 mg 吐温-80,以及5 mL无水乙醇,置于45.℃的水浴振荡器中振荡20 min,使其充分溶解。用注射器将溶解好的脂质溶液注入到50 mL磷酸盐缓冲液(0.05 mol/L)中,然后将其转移到圆底烧瓶中,置于45.℃水浴中真空旋转蒸发除去乙醇,处理时间20 min,再超声一定时间,直至形成均匀乳液。
1.2.2 亚麻籽油含量的测定
经过对亚麻籽油的紫外扫描可以得出在215 nm 处,亚麻籽油、大豆卵磷脂以及β-谷甾醇的吸收强度最大,但是在242 nm处,亚麻籽油的吸收强度明显高于大豆卵磷脂和β-谷甾醇,因此把242 nm作为亚麻籽油的吸收波长能避免大豆卵磷脂和β-谷甾醇的干扰。
配制一系列不同质量浓度的亚麻籽油石油醚溶液(0、0.2、0.4、0.6、0.8、1.0 mg/mL),以石油醚为参比溶液,在242 nm处测定吸光值。以亚麻籽油质量浓度为横坐标、吸光值为纵坐标绘制标准曲线,获得回归方程为y=0.754 4x-0.011 8,R2=0.995 1。
1.2.3 亚麻籽油纳米脂质体包封率的测定[13-14]
采用破壁-低速离心法测定亚麻籽油纳米脂质体的包封率。具体操作过程是:移取10 mL亚麻籽油纳米脂质体至锥形瓶中,加入50 mL无水乙醇,用探头式超声波细胞破碎仪进行破壁后加入石油醚提取,再将混合溶液进行离心 (4 500 r/min,20 min)。取20 mL上清液于50 mL容量瓶中,用石油醚定容至刻度,在242 nm处测定吸光值A1,同法破壁后测定没有加亚麻籽油纳米脂质体的吸光值A0,计算ΔA1(A1-A0)。同法测定没有进行超声破壁的亚麻籽油纳米脂质体的吸光值A2和没有加亚麻籽油纳米脂质体的吸光值A0,计算ΔA2(A2-A0)。亚麻籽油纳米脂质体的包封率计算公式如下:
(1)
1.2.4 亚麻籽油纳米脂质体粒径和电位的测定
根据动态光散射技术,用 Zetasizer Nano ZS90 型纳米激光粒度分析仪分析亚麻籽油脂质体的平均粒径、多分散指数和电位。测定条件:测定温度25.℃,准确吸取亚麻籽油纳米脂质体样品2 mL[15]。每个样品分别测定3次,取平均值。
1.2.5 亚麻籽油纳米脂质体的微观形态观察
取亚麻籽油纳米脂质体1 mL,用磷酸盐缓冲液稀释到磷脂质量浓度为0.6 mg/mL,用移液枪吸取10 μL稀释后的亚麻籽油纳米脂质体滴到附有碳支持膜的铜网上,吸附10 min后用滤纸从边缘吸除多余液体,待自然晾干后,再向支持膜上滴加1滴2%的磷钨酸染色。染色5 min后,用滤纸吸去染色液,自然晾干,在透射电镜下观察脂质体的微观形态。
1.2.6 模拟胃肠液释放实验
1.2.6.1 模拟胃肠液的配制
模拟胃液:取0.2 g的NaCl,7 mL的HCl,0.32 g 的胃蛋白酶,用0.1 mol/L的盐酸调整溶液的pH至1.2,定容到100 mL。
模拟肠液:取0.68 g的KH2PO4,0.5 g的胰蛋白酶,用0.1 mol/L的NaOH调整溶液的pH至7.5,定容到100 mL。
所有溶液应现用现配,避免酶失活。
1.2.6.2 模拟胃肠液释放行为
取适量的亚麻籽油纳米脂质体置于配好的胃液中,保持在37.℃的水浴中,搅拌速度为100 r/min,模拟人体的胃液消化功能,30 min测量1次亚麻籽油的释放量,测量时应在92.℃条件下灭酶2 min[16]。模拟肠液的消化过程同模拟胃液的消化过程。
按照包封率的计算方法计算累积释放率:
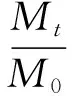
(2)
Higuchi方程:Q=kt1/2
(3)
零级动力学方程:Q=kt
(4)
式(2)中:Qt为t时刻亚麻籽油的累积释放率,%;Mt为t时刻释放出亚麻籽油含量,mg;M0为释放初始时刻纳米脂质体中的亚麻籽油含量,mg;ΔAt为t时刻未破壁亚麻籽油纳米脂质体在242 nm处的吸光值减去没有加亚麻籽油纳米脂质体的吸光值;ΔA0为初始破壁后的亚麻籽油纳米脂质体在242 nm 处的吸光值减去没有加亚麻籽油纳米脂质体的吸光值。
式(3)和式(4)中:Q为累积释放率;k为营养物质释放体系的特性常数,随不同物质或不同处方以及不同释放条件而变化,其大小是表征释放速率大小的重要参数;t为消化时间。
2 结果与分析
2.1 制备工艺对亚麻籽油纳米脂质体包封率的影响
选择磷酸盐缓冲液pH、亚麻籽油添加量、超声时间、超声功率为考察因素,研究各因素对包封率的影响(当考察以上某单一因素影响时,其他因素基本条件为:磷酸盐缓冲液pH 6.6、亚麻籽油添加量40%(占大豆卵磷脂、β-谷甾醇和吐温-80总量的比例)、超声功率141 W、超声时间20 min)。
2.1.1 磷酸盐缓冲液pH对亚麻籽油纳米脂质体包封率的影响(见图1)
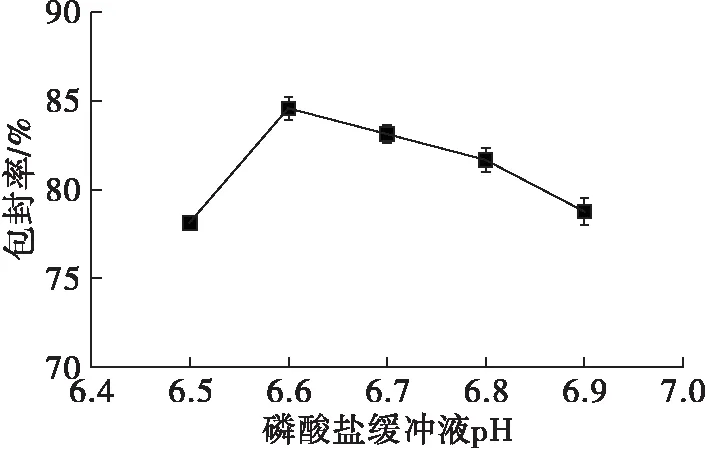
图1 磷酸盐缓冲液pH对亚麻籽油纳米脂质体包封率的影响
由图1可知,在磷酸盐缓冲液pH为6.6时,亚麻籽油纳米脂质体的包封率达到最大值,磷酸盐缓冲液pH高于或低于6.6包封率均有所下降。这可能是由于pH的大小改变了脂质体膜表面的电荷性质,从而改变了脂质体膜的通透性[17],降低了亚麻籽油被包埋的质量。
2.1.2 亚麻籽油添加量对亚麻籽油纳米脂质体包封率的影响(见图2)
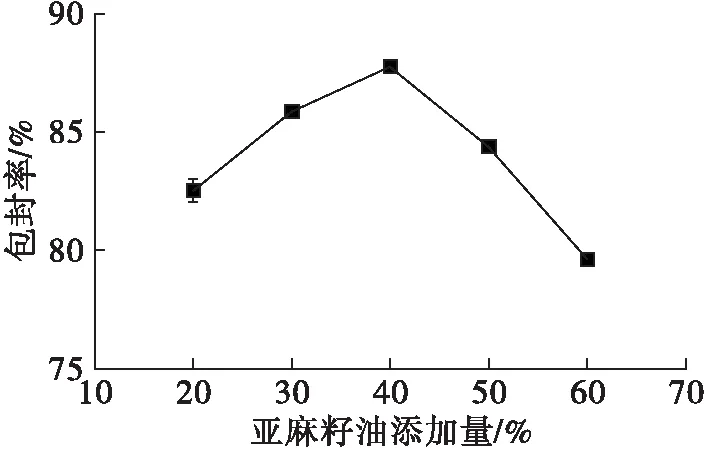
图2 亚麻籽油添加量对纳米脂质体包封率的影响
由图2可知,随着亚麻籽油添加量的增加,亚麻籽油纳米脂质体的包封率呈现先增加后减小的趋势,亚麻籽油添加量为40%时包封率最大,这可能因为脂质体的空间有限,对亚麻籽油的包埋具有饱和性,一旦亚麻籽油添加量超过脂质体膜饱和限度,部分亚麻籽油就有可能进入外面胶团中,无法形成稳定的脂质体[18]。
2.1.3 超声功率对亚麻籽油纳米脂质体包封率的影响(见图3)
超声是为了使乙醇注入法制得的脂质体粒径均匀和使形成的多层脂质体分散成单层脂质体。由图3可知,随着超声功率的增加,包封率先增大后减小,但超声功率大于141 W之后随之降低,原因可能是超声功率的适当增加有助于脂质体形成,但超声功率过大会导致部分脂质体的双层膜结构破裂,致使内含的亚麻籽油外泄,包封率下降。
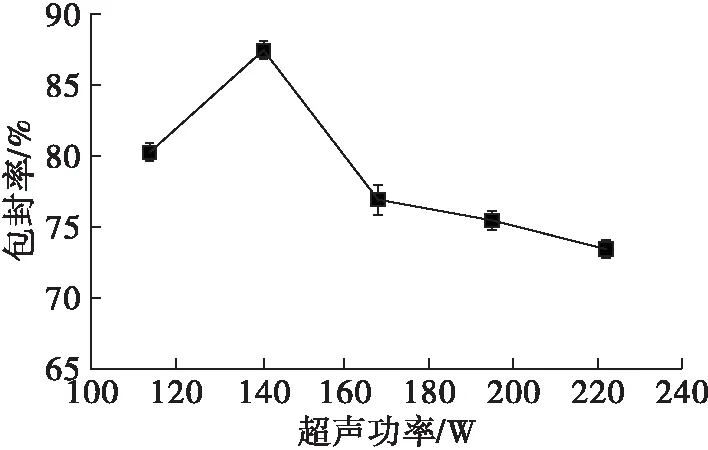
图3 超声功率对亚麻籽油纳米脂质体包封率的影响
2.1.4 超声时间对亚麻籽油纳米脂质体包封率的影响(见图4)
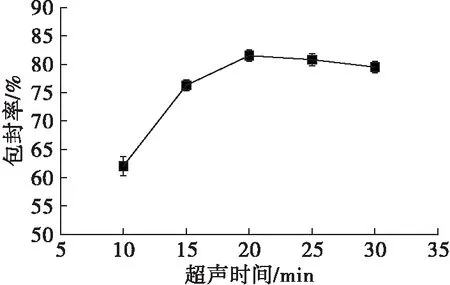
图4 超声时间对亚麻籽油纳米脂质体包封率的影响
由图4可知,随着超声时间的延长亚麻籽纳米脂质体的包封率逐渐增大,到20 min时包封率最大之后略有降低,说明超声产生的空穴效应使亚麻籽油已形成分散均匀的纳米脂质体,但是过长的超声时间会对其结构造成损害,致使包封率降低。
根据单因素实验得出的制备亚麻籽油纳米脂质体的最佳工艺条件为:磷酸盐缓冲液pH 6.6,亚麻籽油添加量40%,超声时间20 min,超声功率141 W。 在最佳工艺条件下,亚麻籽油纳米脂质体的包封率为84%。
2.2 亚麻籽油纳米脂质体的表征
2.2.1 亚麻籽油纳米脂质体粒径分析(见图5)
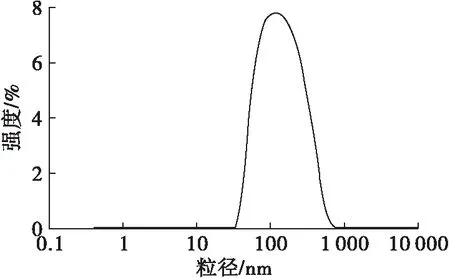
图5 亚麻籽油纳米脂质体粒径分布
由图5可知,亚麻籽油纳米脂质体的粒径主要分布在100 nm左右,平均粒径为97 nm,多分散指数为0.226,说明其粒径小且分布均匀。多分散指数反映的是胶体体系中粒径大小分布范围,其值越小,表示粒径分布的范围越窄,即体系中粒子的粒径具有较好的规整度[19]。本实验测得的亚麻籽油纳米脂质体具有较小的多分散指数,充分说明其分散性良好。
2.2.2 亚麻籽油纳米脂质体电位分析(见图6)
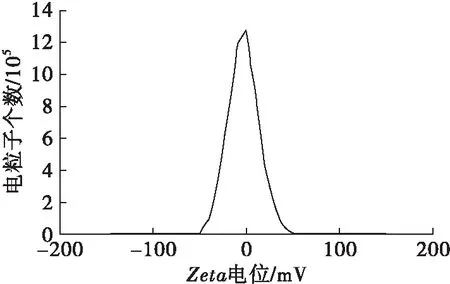
图6 亚麻籽油纳米脂质体电位分布
由图6可知,亚麻籽油纳米脂质体的平均电位为-3.5 mV,电位分布主要集中在0左右,说明亚麻籽油纳米脂质体的表面电荷相互中和,脂质体相互之间保持稳定。
2.2.3 亚麻籽油纳米脂质体微观结构观察(见图7)

图7 亚麻籽油纳米脂质体透射电镜图
从图7可以看出,亚麻籽油纳米脂质体的外形呈圆球状,而且分布均匀。
综上,通过激光粒度仪和透射电镜对亚麻籽油纳米脂质体的表征,可以得出乙醇注入-超声法制备的亚麻籽油纳米脂质体粒径小,多分散指数小,电位低,纳米脂质体外观形态好。
2.3 亚麻籽油纳米脂质体在模拟胃肠液中的释放性能
2.3.1 模拟胃液中的释放行为
依据机体消化食物的时间规律,模拟亚麻籽油纳米脂质体在胃液中的释放行为,结果见图8。
由图8可知,在模拟胃液消化开始时,亚麻籽油的累积释放率不到10%,而随着消化时间的延长,累积释放率呈缓慢增长的趋势,由于胃酸对纳米脂质体结构造成了破坏,使亚麻籽油的释放量增大[20]。总体来看,亚麻籽油纳米脂质体在模拟胃液消化的过程中,呈现缓慢释放的趋势,最高释放率为45%,这与郑会娟[21]的研究一致,其模拟胃液消化时中链脂肪酸的累积释放量为48%。在胃液中部分脂质体结构被瓦解,释放出的亚麻籽油随着消化液进入肠道,供机体吸收利用,提供能量,结构完整的脂质体进入肠道,为机体持续提供能量。
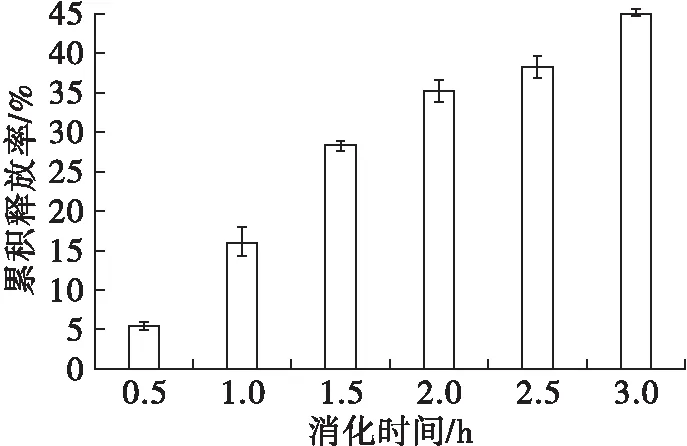
图8 亚麻籽油在模拟胃液中的累积释放率
Higuchi方程和零级动力学方程是评价脂质体释放行为常用的方程,其释放机制分别为Fick扩散和恒速释放,这两种机制能够解释营养物质缓慢释放的行为[22]。脂质体的缓释性是指脂质体进入机体内,被包封的物质由于氢键作用或脂质体膜的保护作用而无法快速释放,因而能持久地在机体内发挥作用,提高机体对被包埋物质的吸收利用率[23]。根据亚麻籽油纳米脂质体在模拟胃液中的缓释效果,用Higuchi方程和零级动力学方程对其在模拟胃液中的消化过程进行拟合,结果见图9、图10。

图9 Higuchi方程拟合曲线

图10 零级动力学方程拟合曲线
由图9和图10可知,零级动力学方程的拟合系数比Higuchi方程的大,为0.973 9,说明亚麻籽油纳米脂质体在模拟胃液中的消化行为符合零级动力学方程,释放机制为恒速释放。
2.3.2 模拟肠液中的释放行为分析
依据机体消化食物的时间规律,模拟亚麻油纳米脂质体在肠液中的释放行为,结果见图11。
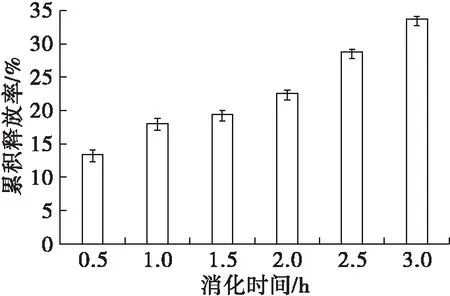
图11 亚麻籽油在模拟肠液中的累积释放率
由图11可知,亚麻籽油纳米脂质体在模拟肠液中的累积释放率呈现均匀释放的趋势,比在模拟胃液消化过程中释放率趋势更加平缓。在开始时,亚麻籽油的累积释放率为13%,到2 h时,累积释放率为20%,可能是添加的β-谷甾醇增加了脂质体膜的刚性,使膜内部的微极性小,分子结合更紧密,有效降低膜的渗透率[24],减少了胰蛋白酶的作用位点,从而增强了对酶的耐受性。随着消化时间的延长,亚麻籽油的累积释放率呈缓慢增长的趋势,到3 h时,累积释放率达到34.1%,实现了亚麻籽油在肠液中的缓释作用,有利于机体对其营养物质的充分吸收。
根据亚麻籽油纳米脂质体在模拟肠液中的消化趋势,用Higuchi方程和零级动力学方程对其在模拟肠液中的消化过程进行拟合,结果见图12、图13。

图12 Higuchi方程拟合曲线
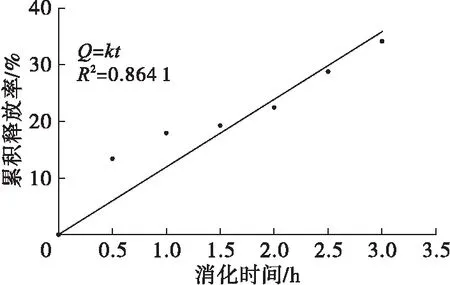
图13 零级动力学方程拟合曲线
由图12和图13可知,Higuchi方程的拟合系数为0.964 9,比零级动力学方程的拟合效果好,说明亚麻籽油纳米脂质体在模拟肠液中的消化行为更符合Higuchi方程,释放机制为Fick扩散。
3 结 论
通过单因素实验得到亚麻籽油纳米脂质体的最佳制备工艺条件为磷酸盐缓冲液pH 6.6、亚麻籽油添加量40%、超声时间20 min、超声功率141 W,在此条件下亚麻籽油纳米脂质体的包封率为84%。对乙醇注入-超声法制备的亚麻籽油纳米脂质体进行表征,脂质体平均粒径为97 nm,平均电位为-3.5 mV,多分散指数为0.226;在透射电镜的观察下,亚麻籽油纳米脂质体分散均匀且呈圆球状。在模拟胃肠液消化过程中,亚麻籽油纳米脂质体具有缓释行为,在模拟胃液消化时的释放行为符合零级动力学方程,在模拟肠液消化时的释放行为符合Higuchi方程。
[1] 邓乾春,马方励,魏晓珊,等.亚麻籽加工品质特性研究进展[J].中国油料作物学报,2016,38(1):126-134.
[2] 赵利,党占海,李毅,等.亚麻籽的保健功能和开发利用[J].中国油脂,2006,31(3):71-74.
[3] 任海伟,李雪,唐学慧.亚麻籽粒及其油脂的特性分析与营养评价[J].食品工业科技,2011,32(6):143-145.
[4] MOZAFFARIAN D,WU J H.Omega-3 fatty acids and cardiovascular disease: effects on risk factors,molecular pathways,and clinical events[J].J Am Coll Cardiol,2011,58(20):2047-2067.
[5] GALLARDO G,GUIDA L,MARTINEZ V,et al.Microencapsulation of linseed oil by spray drying for functional food application[J].Food Res Int,2013,52(2):473-482.
[6] 林传舟,李进伟,蒋将,等.亚麻籽油多层微胶囊的制备及性质研究[J].中国油脂,2016,41(1):17-21.
[7] TAYLOR T M,DAVIDSON P M,BRUCE B D,et al.Liposomal nanocapsules in food science and agriculture[J].Crit Rev Food Sci Nutr,2005,45(7/8):587-605.
[8] 刘玮琳,魏富强,韩剑众.脂质体在食品中的应用及体外消化研究进展[J].食品科学,2015,36(23): 295-300.
[9] 王璇.番茄红素纳米分散体抗肝肿瘤功效及机制初探[D].江苏 无锡:江南大学,2009.
[10] GHORBANZADE T,JAFARI S M,AKHAVAN S,et al.Nano-encapsulation of fish oil in nano-liposomes and its application in fortification of yogurt[J].Food Chem,2016,216:146-152.
[11] SEBAALY C,JRAIJ A,FESSI H,et al.Preparation and characterization of clove essential oil-loaded liposomes[J].Food Chem,2015,178(3):52-62.
[12] 刘玉珍,熊华,蒋岩,等.薏苡仁油脂质体的制备及质量评价[J].食品科学,2009,30(16):193-197.
[13] 王倩倩.罗非鱼鱼油的提取及其纳米脂质体的制备和性质研究[D].合肥:合肥工业大学,2015.
[14] 刘高梅,任海伟.葵花籽油脂质体的制备及其稳定性研究[J].中国粮油学报,2011,26(11):47-50.
[15] 张斌.不同磷脂膜材对脂质体稳定性的影响[D].郑州:河南工业大学,2016.
[16] 田蒙蒙,李娜,魏富强,等.脂质体在体外消化过程中的氧化稳定性[J].食品工业科技,2016,37(22):154-159.
[17] 欧春凤,梁艳兰,沈生文,等.乙醇注入法制备姜黄素脂质体工艺研究[J].南方农业学报,2011,42(10):1259-1262.
[18] 刘成梅,王瑞莲,刘伟,等.中链脂肪酸脂质体的制备及其特性评价[J].食品科学,2007,28(10):143-146.
[19] 范明辉.红景天苷纳米脂质体的研制[D].江苏 无锡:江南大学,2008.
[20] LIU W,YE A,LIU C,et al.Structure and integrity of liposomes prepared from milk- or soybean-derived phospholipids during in vitro digestion[J].Food Res Int,2012,48(2):499-506.
[21] 郑会娟.羧甲基壳聚糖包覆的中链脂肪酸纳米脂质体的制备及其性质研究[D].南昌:南昌大学,2012.
[22] JAIN A,JAIN S K.In vitro release kinetics model fitting of liposomes: an insight[J].Chem Phys Lipids,2016,201:28-40.
[23] NALLAMOTHU R,WOOD G C,PATTILLO C B,et al.A tumor vasculature targeted liposome delivery system for combretastatin A4: design,characterization,and in vitro evaluation[J].AAPS Pharm Sci Tech,2006,7(2):E7-E16.
[24] 杨贝贝,曹栋,耿亚男,等.植物甾醇与胆固醇对脂质体膜性质的影响[J].食品工业科技,2013,34(7):77-81.
Preparationandinvitroreleaseperformanceofflaxseedoilnanoliposome
ZHANG Beibei,TIAN Shaojun
(College of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
TS225.1;TS201.7
A
1003-7969(2017)09-0049-06
2017-05-17;
2017-06-28
张贝贝(1990),女,硕士研究生,研究方向为粮食、油脂与植物蛋白工程(E-mail)zhangbeibei345@163.com。
田少君,教授(E-mail)shaojun_tian@haut.edu.cn。

