苦杏仁多酚氧化酶的分离纯化及部分特性分析
申 辉,张清安,张馨允,史芳芳,范学辉
(1.陕西师范大学 食品工程与营养科学学院,西安710119;2.华南理工大学 食品科学与工程学院,广州510641)
综合利用
苦杏仁多酚氧化酶的分离纯化及部分特性分析
申 辉1,2,张清安1,张馨允1,史芳芳1,范学辉1
(1.陕西师范大学 食品工程与营养科学学院,西安710119;2.华南理工大学 食品科学与工程学院,广州510641)
以苦杏仁为原料,采用(NH4)2SO4分级沉淀法对苦杏仁多酚氧化酶进行初步分离后经Sephadex G-75凝胶柱层析进一步纯化,冷冻干燥后即得苦杏仁多酚氧化酶纯品;通过凝胶电泳和热分析试验测定多酚氧化酶的相对分子质量和变性温度。结果表明:经分离纯化后苦杏仁多酚氧化酶的纯化倍数为49.03倍,该酶可能存在同工酶且相对分子质量分别约为21.9 kD和23.2 kD;苦杏仁多酚氧化酶变性温度为60.03.℃。为苦杏仁加工过程中的酶促褐变控制提供部分理论参数。
苦杏仁;多酚氧化酶;分离;酶活;褐变
Abstract:With apricot kernels as raw material,the (NH4)2SO4fractional precipitation and Sephadex G-75 gel chromatography were employed to precipitate and purify the polyphenol oxidase from apricot kernel respectively,and the pure polyphenol oxidase was obtained after freeze drying.In addition,the relative molecular weight and denatured temperature of the purified polyphenol oxidase were also determined by the electrophoresis experiment and thermal analysis.The results showed that the purification fold of the polyphenol oxidase was 49.03 times after isolation and purification,and the relative molecular weights of its isozyme were about 21.9 kD and 23.2 kD respectively,and its denatured temperature was 60.03.℃.The research results could provide some theoretical parameters for the control of enzymatic browning in the processing of apricot kernel.
Keywords:apricot kernel; polyphenol oxidase; isolation; enzyme activity; browning
杏(ArmeniacavulgarisLam.),蔷薇科杏属植物,落叶乔木,地生,主要分布于我国北方地区。杏仁是杏的种子,含有丰富的蛋白质、油脂、糖、苦杏仁苷、维生素和微量元素等多种成分[1],按照苦杏仁苷含量的不同可分为甜杏仁和苦杏仁。甜杏仁常作为食品加工业的原辅料或者直接食用。苦杏仁中含有丰富的不饱和脂肪酸、人体必需氨基酸和苦杏仁苷,可作为良好的营养保健食品和药用植物资源进行开发利用。近几年,围绕杏仁蛋白[2]、杏仁油[3]、苦杏仁苷[4]、杏仁皮[5-6]等方面的研究呈上升趋势,这对于提高苦杏仁附加值、促进杏仁产业发展具有重要意义。然而,在苦杏仁的加工过程中,由于其成分复杂及加工贮藏工艺的限制,常会发生复杂的化学变化导致品质下降,从而降低了苦杏仁制品的商业价值。这是因为在加工过程中苦杏仁组织结构遭到破坏与氧气接触,酚酶催化氧化酚类物质生成醌,而后醌类物质通过聚合作用生成有色物质,从而导致苦杏仁品质下降,即酶促褐变反应是引起苦杏仁加工品质降低的重要原因,其主要酶则是多酚氧化酶(PPO)。因此,了解苦杏仁PPO的相关理化性质对于有效控制苦杏仁酶促褐变具有重要意义,但目前有关这方面的研究较少。
本文结合酶分离纯化常用的(NH4)2SO4分级沉淀法和凝胶柱层析法[7-9]对苦杏仁PPO进行分离和纯化,并测定其相对分子质量和变性温度,以期为基于酶活性进行苦杏仁酶促褐变控制奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
苦杏仁,购于西北药材市场,挑选形态饱满、无破损、无病虫害的苦杏仁备用;无水乙醇、丙酮、(NH4)2SO4、KH2PO4、NaOH、聚乙烯吡咯烷酮(PVPK30)等试剂或药品均为分析纯;牛血清蛋白,上海伯奥生物科技有限公司;考马斯亮蓝G-250,国药集团化学试剂有限公司;Sephadex G-75,Pharmacia公司。
1.1.2 仪器与设备
PHS-3C型pH计;JA2003N型电子天平;2-16PK台式高速冷冻离心机,Sigma公司;UV-1700紫外可见分光光度计;Alphal-4型真空冷冻干燥机,德国Marin Christ公司;KQ3200B超声波清洗器;SHB-Ⅲ型循环水式多用真空泵;MDF-U5410超低温冰箱,日本Sanyo公司;Q1000DSC+LNCS+FACS Q600SDT热分析系统,美国TA公司。
1.2 试验方法
1.2.1 样品的制备
称取适量苦杏仁,按质量比100∶1加入聚乙烯吡咯烷酮(PVPK30)作为酚类物质的去除剂,充分粉碎后快速取出,加入经-28.℃预冷的丙酮至完全浸没,在4.℃条件下静置2 h,然后用预冷过的丙酮反复抽滤除油,直至成为白色粉末,即得经丙酮去油后的苦杏仁粉样品(丙酮粉),置于低温下保存[10-12]。
1.2.2 (NH4)2SO4分级沉淀
磷酸盐缓冲液(0.05 mol/L pH 6.50)的制备:称取KH2PO46.80 g,加入0.10 mol/L的NaOH溶液152 mL,然后用蒸馏水定容至1 000 mL,经pH计校准后即得磷酸盐缓冲液。
称取一定量丙酮粉,与磷酸盐缓冲液按料液比1∶5混匀,5 000 r/min离心10 min。取上清液并加入(NH4)2SO4盐析,按质量体积比区间0~1∶15、1∶15~2∶15、2∶15~3∶15、3∶15~4∶15、4∶15~5∶15、5∶15~6∶15进行分级沉淀,每个样品均置于4.℃下盐析2 h。经9 000 r/min离心10 min后收集沉淀,在-28.℃下冷冻后置于真空冷冻干燥机中干燥24 h,收集冻干品即得苦杏仁PPO粗提物。通过测定酶活性,找出苦杏仁PPO沉淀最集中的区间,以提高(NH4)2SO4盐析的效果。由于不同饱和度下的(NH4)2SO4分级沉淀法操作相对烦琐,故在此转化为质量体积比区间进行盐析沉淀。
1.2.3 酶活性和蛋白质质量浓度的测定
将上述冻干的苦杏仁PPO粉末用磷酸盐缓冲液制备成溶液,在25.℃条件下向比色皿中加入浓度为0.2 mol/L的邻苯二酚溶液2 mL,然后加适当浓度的苦杏仁PPO溶液1 mL,立即摇匀后于410 nm波长下开始测量[10],每隔6 s记录一次吸光度,连续测定3 min,以最初近似直线的部分计算酶活性。由于沉淀中不仅存在杂蛋白,也可能存在非蛋白质类杂质,均影响着酶的纯度。在此,引入比活力和酶活力的定义[13],通过计算后比较各个区间内沉淀的比活力和酶活力,以选择PPO纯度最高的比例区间。
比活力定义为:在试验条件下,每毫克蛋白质1 min 内引起吸光度随时间增加0.01为一个比活力单位。
酶活力定义为:在试验条件下,每毫克沉淀1 min 内引起吸光度随时间增加0.01为一个酶活力单位。
比活力可以反应单位质量蛋白质中PPO的占比,比活力越大说明杂蛋白越少,PPO纯度越高;酶活力反应单位沉淀内的PPO含量,酶活力越大说明沉淀中杂蛋白和非蛋白类杂质越少,PPO纯度越高。通过计算,找出比活力和酶活力均较高的区间,以此作为(NH4)2SO4分离纯化苦杏仁PPO的依据。
以牛血清蛋白为标准蛋白,采用考马斯亮蓝G-250 比色法测定可溶性蛋白含量。以0、200、400、600、800、1 000 μg/mL牛血清蛋白质量浓度为横坐标,410 nm波长下的吸光度为纵坐标,绘制标准曲线,得线性方程:y=0.000 4x-0.001 1(R2=0.999 2),通过此方程计算样品溶液的蛋白质质量浓度。
1.2.4 Sephadex G-75凝胶柱层析
经(NH4)2SO4分级沉淀后,找出最佳的质量体积比区间,收集该区间内的沉淀,经冷冻干燥后配制成质量浓度为30 mg/mL的苦杏仁PPO溶液,取2 mL 上样于经磷酸盐缓冲液(0.05 mol/L pH 6.50)平衡的Sephadex G-75凝胶柱(1.5 cm×75 cm)进行柱层析分离纯化,用0.4 mL/min的磷酸盐缓冲液洗脱,每管收集3 mL。柱层析结束后测定每管洗脱液酶活性及280 nm下的吸光度(A280),收集蛋白质吸收峰与酶活性峰重叠的洗脱液。
1.2.5 电泳法测定苦杏仁PPO的相对分子质量
经1.2.4收集蛋白质吸收峰与PPO活性峰重叠的洗脱液后,向洗脱液中加入适量的(NH4)2SO4沉淀PPO,收集沉淀经冷冻干燥后即得PPO粉末,然后进行SDS-PAGE垂直板电泳试验。采用5%的浓缩胶和12%的分离胶,上样质量浓度为2 mg/mL,每孔上样量15 μL,样品在浓缩胶和分离胶中迁移时的电压分别为100 V和120 V,以检测苦杏仁PPO的分离纯化效果并测定其相对分子质量。
1.2.6 热分析法测定苦杏仁PPO的有关特性
取适量1.2.5中制得的PPO粉末进行差示扫描量热(DSC)试验和热重分析(TGA)试验,以测定苦杏仁PPO的有关热力学特性。
2 结果与讨论
2.1 (NH4)2SO4分级沉淀结果
(NH4)2SO4分级沉淀结果见表1。
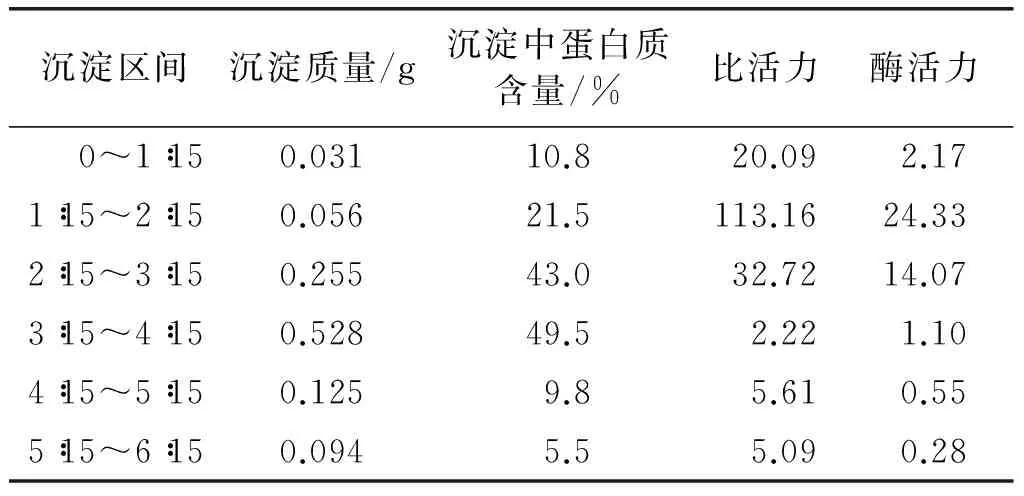
表1 (NH4)2SO4分级沉淀结果
由表1可知,蛋白质的析出主要集中于1∶15~4∶15区间内;比活力较高的沉淀主要集中于0~3∶15 区间内;而在0~1∶15 区间内,虽然比活力较高,但酶活力较低,说明沉淀中非蛋白质类物质含量较高,蛋白质纯度低;在3∶15~4∶15区间内,沉淀最多,沉淀中蛋白质含量也最高,但比活力和酶活力均较低。综合考虑上述结果,收集1∶15~3∶15区间内的沉淀进行柱层析试验,对苦杏仁PPO进一步分离纯化。
基于上述结论,称取30 g丙酮粉,加入150 mL磷酸盐缓冲液浸泡,置于4.℃下静置2 h后,5 000 r/min 离心10 min,收集上清液。把上清液分为第一、二组,分别按质量体积比1∶15、6∶15加入(NH4)2SO4,搅匀后置于4.℃下盐析2 h,9 000 r/min 离心10 min,收集沉淀。取第一组上清液15 mL,加2 g(NH4)2SO4进一步盐析,4.℃下静置2 h后9 000 r/min离心即得所需沉淀。沉淀于-28.℃下冷冻后置于冷冻干燥机中干燥24 h,得冻干品即粗酶粉。通过测定每组样品的蛋白质含量和酶活性,可计算得(NH4)2SO4分级沉淀法对苦杏仁PPO的初步分离纯化效果,结果如表2所示。

表2 (NH4)2SO4分级沉淀法对苦杏仁PPO的初步分离纯化结果
由表2可知,1∶15~3∶15区间内集中了91.14%的PPO,因此收集该区间内的沉淀进行Sephadex G-75 凝胶柱层析分离试验;通过(NH4)2SO4分级沉淀,可对杂蛋白进行初步分离,使苦杏仁PPO的纯化倍数达到10.30倍。
2.2 凝胶柱层析试验结果
以洗脱管数为横坐标,以280 nm(蛋白质吸收峰)下的吸光度A280及酶活力为纵坐标,绘制洗脱图,结果如图1所示。
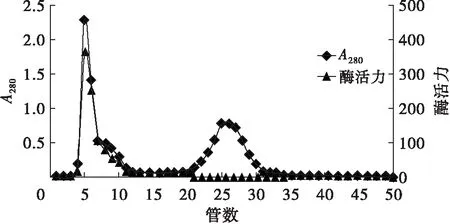
图1 苦杏仁PPO的Sephadex G-75洗脱曲线
由图1可以看出,第一个蛋白质吸收峰对应有较高的酶活,第二个蛋白质吸收峰无酶活,说明第一个吸收峰(蛋白质峰与酶活性峰重叠部分)为苦杏仁PPO的洗脱峰。收集第4~10号管内洗脱液,经(NH4)2SO4盐析,冷冻干燥后即得苦杏仁PPO纯品,测定其比活力为288.27,计算得纯化倍数高达49.03倍,说明用此方法分离纯化苦杏仁PPO是可行的。
2.3 苦杏仁PPO相对分子质量的测定
采用SDS-PAGE凝胶电泳试验测定苦杏仁PPO的相对分子质量,结果如图2所示。
由图2可以看出,经Sephadex G-75凝胶柱层析后一部分杂蛋白被分离,且试验结果显示存在2条明显的酶带,推测可能存在苦杏仁PPO同工酶,计算得其相对分子质量约为21.9 kD和23.2 kD。这与朱继英等[9]报道的双孢蘑菇PPO相对分子质量约为25.5 kD和胡婉峰等[14]报道的莲藕PPO相对分子质量约为21.0 kD接近。
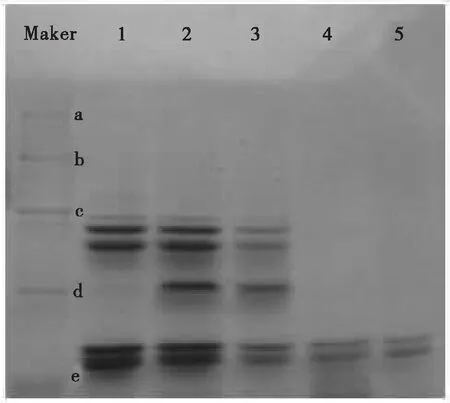
注:编号1、2、3、4、5分别表示0~6∶15区间内的沉淀、1∶15~3∶15区间内的沉淀、1∶15~3∶15区间内的沉淀(重复试验)、柱层析后的PPO、柱层析后的PPO(重复试验)。标准蛋白及相对分子质量分别为:a为兔磷酸化酶B,97.4 kD;b为牛血清白蛋白,66.2 kD;c为兔肌动蛋白,43.0 kD;d为牛碳酸酐酶,31.0 kD;e为胰蛋白酶抑制剂,20.1 kD。
图2苦杏仁PPO电泳图
2.4 热性质分析
2.4.1 DSC试验
DSC主要用来研究蛋白质的热变性,通过测定蛋白质在升温过程中的能量变化,进而对蛋白质的相关特性进行研究。试验结果如图3所示。

图3 苦杏仁PPO的DSC图
由图3可以看出,苦杏仁PPO的热变性温度(Td)为60.03.℃,焓变(ΔH)为50.50 J/g。Td值反映PPO的热稳定性,ΔH是指引起PPO变性所需要的热量。因此,理论上当把温度升高到60.03.℃以上,同时给予充分的加热时间,便可使苦杏仁PPO失活,从而抑制苦杏仁酶促褐变的发生。在实际加工生产中,对苦杏仁原料的烘干温度是高于60.03.℃的,而在后续加工过程中仍会发生酶促褐变,这可能是由于PPO处于苦杏仁未遭到破坏时的复杂体系中,与苦杏仁内的其他成分在结构上发生交联,从而导致酶活难以失去。因此,如何优化加工条件,最大限度抑制苦杏仁酶促褐变,还需进一步研究。
2.4.2 TGA试验
TGA是测量样品质量随温度变化的一种常用的热分析方法,可以反应样品的水分含量、水化程度、物质组成、分解温度等信息[15]。试验结果如图4所示。

图4 苦杏仁PPO的TGA图
由图4可以看出,随着温度的升高,苦杏仁PPO的质量损失过程可分为3个阶段:第一个阶段是当温度升高至200.℃时,自由水分的蒸发和PPO高级结构遭到破坏的过程;第二个是热分解阶段,在此过程中,苦杏仁PPO中的结合水开始失去,羟基基团遭到破坏;第三个是其他杂质发生分解的过程。蛋白质的TGA曲线与蛋白质水分含量、分子间作用力及聚集态有关。苦杏仁PPO质量损失的前两个阶段可能与其自身结构的破坏过程有关,首先是第一阶段中高级结构的破坏,这个过程伴随着酶的变性失活与自由水的散失;当温度升高到400.℃左右时,结合水开始失去,高级结构及化学基团遭到更加严重的破坏,同时肽键可能发生断裂,进而影响酶的一级结构。酶活性究竟与哪些化学基团有关以及存在于酶结构中的哪个部位还需要深入研究探讨。
3 结 论
采用(NH4)2SO4分级沉淀法对苦杏仁PPO进行初步分离纯化,收集质量体积比1∶15~3∶15区间内的沉淀冻干,通过测定酶活性可知此步的纯化倍数为10.30倍;然后经Sephadex G-75凝胶柱层析试验,对PPO进一步分离纯化,去除杂蛋白,计算得纯化倍数为49.03倍,说明此方法分离纯化苦杏仁PPO的效果较好。通过凝胶电泳试验可知苦杏仁PPO可能存在同工酶,相对分子质量约为21.9 kD和23.2 kD;通过热分析试验得苦杏仁PPO的热变性温度为60.03.℃,加热过程中PPO质量的损失可能与其结构破坏的顺序有关。
通过对苦杏仁PPO的相关特性进行分析,寻求最佳的褐变控制方法,并对去皮工艺进行改进。因苦杏仁PPO纯品的热变性温度为60.03.℃,因此可以把去皮、烘干等工序的温度控制在热变性温度以上,以降低酶活;但温度不宜过高,以避免非酶褐变的发生。因此,在实际生产中应合理控制加工条件,尽可能在抑制酶促褐变的同时,降低高温对苦杏仁其他成分的影响,最大限度地保护其原有品质。
[1] 李科友,史清华,朱海兰,等.苦杏仁化学成分的研究[J].西北林学院学报,2004,19(2): 124-126.
[2] 冯郁蔺,陈伟,张清安.杏仁蛋白质的提取及功能特性研究进展[J].农产品加工(学刊),2011(9): 61-63,66.
[3] 贾晓艳,张清安,张霞,等.响应面法优化微波辅助提取扁杏仁油工艺及成分分析[J].中国粮油学报,2011,26(3): 60-63.
[4] 吕建珍,邓家刚.苦杏仁苷的药理作用研究进展[J].现代药物与临床,2012,27(5): 530-535.
[5] 文连君,张清安,张志琪.响应曲面法优化苦杏仁皮总黄酮的微波提取工艺研究[J].南方农业学报,2011,42(1): 74-78.
[6] 申辉,范学辉,张清安.苦杏仁皮水不溶性膳食纤维提取工艺优化及其特性分析[J].食品科学,2014,35(20): 6-10.
[7] 付燕秋,王欣宏,管斌,等.利用(NH4)2SO4分步盐析法从麦芽中初步分离极限糊精酶[J].食品与发酵工业,2013,39(1): 199-202.
[8] 孟雅,李刚,崔焱,等.马铃薯多酚氧化酶的提取纯化条件对其活性影响的研究[J].化学与生物工程,2006,23(10): 47-49.
[9] 朱继英,王健,王相友.双孢蘑菇多酚氧化酶的分离、纯化及特性分析[J].园艺学报,2012,39(4): 763-768.
[10] 张清安,范学辉,武海波,等.苦杏仁多酚氧化酶的理化特性[J].食品科学,2014,35(15): 132-135.
[11] ARSLAN O,TEMUR A,TOZLU I.Polyphenol oxidase from Malatya apricot (PrunusarmeniacaL.)[J].J Agric Food Chem,1998,46(4): 1239-1241.
[12] 张百刚.红枣多酚氧化酶 (PPO)特性及抑制其酶促褐变的研究[D].西安: 陕西师范大学,2006.
[13] 曲留柱,金世超,崔洁,等.响应面优化闪式提取香蕉多酚氧化酶[J].食品科学,2013,34(2): 136-142.
[14] 胡婉峰,赵洪雷,万琼红,等.莲藕多酚氧化酶的纯化方法研究[J].食品科学,2009,30(1): 173-176.
[15] CHEN T,OAKLEY D M.Thermal analysis of proteins of pharmaceutical interest[J].Thermochim Acta,1995,248(1): 229-244.
Isolation,purificationandpropertiesofpolyphenoloxidasefromapricotkernel
SHEN Hui1,2,ZHANG Qing’an1,ZHANG Xinyun1,SHI Fangfang1,FAN Xuehui1
(1.College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710119,China; 2.School of Food Science and Engineering,South China University of Technology,Guangzhou 510641,China)
TS201.1;TQ646
A
1003-7969(2017)09-0136-05
2016-12-24;
2017-05-20
国家自然科学基金青年科学基金项目(31101324);陕西省自然科学基金项目(2015JM3097);中央高校基本科研业务费专项(GK201602005)
申 辉 (1989),男,博士研究生,研究方向为食品加工过程控制(E-mail)shsnnu@163.com。
张清安,副教授(E-mail)qinganzhang@snnu.edu.cn。

