反相高效液相色谱法测定Rancimat测量池水中的短链脂肪酸
李咏如,李 徐,陶胜男,章云霄,刘睿杰,金青哲,王兴国
(江南大学 食品学院,江苏 无锡214122)
检测分析
反相高效液相色谱法测定Rancimat测量池水中的短链脂肪酸
李咏如,李 徐,陶胜男,章云霄,刘睿杰,金青哲,王兴国
(江南大学 食品学院,江苏 无锡214122)
采用反相高效液相色谱法测定Rancimat测量池水中甲酸、乙酸、丙酸、丁酸、戊酸、己酸等短链脂肪酸含量,为探明Rancimat测量池水电导率的内在组成变化机理奠定基础。结果表明:高效液相色谱在流速1.0 mL/min、柱温40.℃、紫外检测波长210 nm、进样量10 μL、流动相为磷酸盐溶液(pH 2.8,0.05 mol/L)和甲醇组成的线性梯度洗脱条件下,能同时分离甲酸、乙酸、丙酸、丁酸、戊酸、己酸,其保留时间分别为1.96、2.71、5.81、13.47、19.33、27.72 min。此方法的平均峰面积精密度为2.31%,平均回收率为96.88%;棕榈油、大豆油和亚麻籽油氧化稳定性实验所得水溶液中的短链脂肪酸主要为甲酸和乙酸。此法对深入分析优化油脂氧化稳定性实验具有重要意义。
反相高效液相色谱法;短链脂肪酸;Rancimat测量池;水
Abstract:The contents of short-chain fatty acids including formic acid,acetic acid,propionic acid,butyric acid,valeric acid and caproic acid were determined by reversed-phase high-performance liquid chromatography,and it could lay the foundation for the exploration of the internal composition changes mechanism of conductivity in Rancimat measuring cell water.The results showed that the optimal detection conditions were obtained as follows: flow rate 1.0 mL/min,column temperature 40.℃,UV detection wavelength 210 nm,injection volume 10 μL and linear gradient elution of mobile phase consisted of methanol and phosphate solution(pH 2.8,0.05 mol/L).Under these conditions,formic acid,acetic acid,propionic acid,butyric acid,valeric acid and caproic acid could be separated simultaneously and the retention time was 1.96,2.71,5.81,13.47,19.33 min and 27.72 min,respectively.The average precision of peak area and average recovery rate of the method were 2.31% and 96.88% respectively.The short-chain fatty acids in palm oil,soybean oil and linseed oil in oxidation stability experiments were mainly formic acid and acetic acid.The method was of great significance for in-depth analysis and optimization of Rancimat evaluation experiment.
Keywords:reversed-phase high-performance liquid chromatography;short-chain fatty acid;Rancimat measuring cell; water
Rancimat氧化稳定测试仪是在特定温度下向定量油脂中通入空气,油脂在热、氧环境下加速氧化产生挥发性小分子如醛、酮、酸等,小分子物质随气流进入测量池,多数酸溶解在测量池水中,仪器依据水电导率变化判定油脂氧化程度。Rancimat氧化稳定评价实验因其操作简便、测量快速、重现性好等优点被广泛应用[1]。然而近年来,市场上不断出现富含不饱和脂肪酸、特殊营养成分的新型特种油品,氧化稳定性能评价过程中常常出现电导曲线异常、测量结果重复性差等问题,而测量池中水的电导率是由溶解其中的短链脂肪酸决定的。
根据油脂自动氧化理论,从脂肪酸自由基反应开始,生成一级氧化产物氢过氧化物,后期氢过氧化物降解成醛,由醛和氧气循环反应不断生成短链脂肪酸[2]。短链脂肪酸为油脂自动氧化的二级产物,在仪器测量池中被蒸馏水吸收,导致蒸馏水电导率改变[3-4]。测定水中的短链脂肪酸常用高效液相色谱法[5-7]、离子色谱法[8-9]、气相色谱法[4]、气质联用[10]等方法,其中高效液相色谱法操作简单、准确率高、成本低,研究其在测定Rancimat测量池水中的短链脂肪酸应用却鲜有报道。
本文采用反相高效液相色谱法,分离测定了甲酸、乙酸、丙酸、丁酸、戊酸、己酸6种短链脂肪酸在Rancimat测量池水中的含量,对深入分析优化油脂氧化稳定性实验具有重要意义。
1 材料与方法
1.1 实验材料
甲酸、乙酸、丙酸、丁酸、戊酸、己酸、邻苯二甲酸氢钾、磷酸,分析纯;甲醇,色谱纯。
1525型高效液相色谱仪(配置紫外可见检测器)、SunFireTMC18色谱柱(Φ4.6 mm×150 mm,5 μm),美国Waters公司;实验用台式pH计,瑞士梅特勒-托利多公司;微量注射器(25 μL)。
1.2 实验方法
1.2.1 色谱条件的确定
分别称取甲酸、乙酸、丙酸、丁酸、戊酸、己酸制成混合溶液。用0.05 mol/L的磷酸盐溶液(pH 2.8)和甲醇为流动相,考察不同甲醇含量对分离的影响,同时调节流动相梯度变化程序,对混合短链脂肪酸进行分离,分析得出最佳的分离方法。鉴于Rancimat测量池水中的短链脂肪酸浓度由低至高逐渐增加,为保证进样量和浓度配合,选取10 μL作为进样量。短链脂肪酸在190~220 nm范围内有较强吸收,鉴于流动相甲醇的紫外截止波长205 nm,选取210 nm作为检测波长。基于C18色谱柱的允许温度范围以及磷酸盐在流动相中的溶解度,选取40.℃作为柱温。
1.2.2 线性范围和检测限确定
分别称取甲酸、乙酸、丙酸、丁酸、戊酸、己酸0.2 g 用蒸馏水定容至50 mL,分别量取0.5、1、2、4、8、16 mL定容至50 mL,制得短链脂肪酸标准溶液。用所确定的色谱分析方法依次对标准溶液进行测定,以液相色谱出峰的绝对面积为纵坐标,标准溶液质量浓度为横坐标作图,得到各种短链脂肪酸的线性范围和检测限。
1.2.3 方法精密度与准确度
取水池吸收液样品经4.5 μm滤膜过滤后进样分析,在相同操作条件下重复6次,计算检测各短链脂肪酸的保留时间精密度和峰面积精密度。
对样品进行加标回收率实验,样品中加入对应量标准品,混匀后膜过滤进样,计算回收率,确定方法准确度。
2 结果与讨论
2.1 色谱条件的确定
经反复实验确定,在流速1.0 mL/min条件下,按表1线性梯度洗脱分离效果最佳。测得短链脂肪酸的标准色谱图见图1。
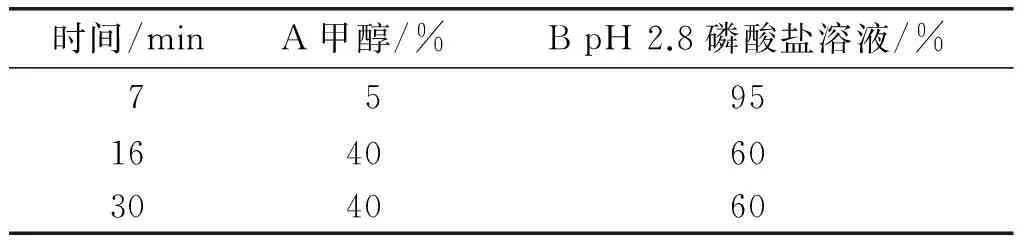
表1 最佳梯度洗脱程序
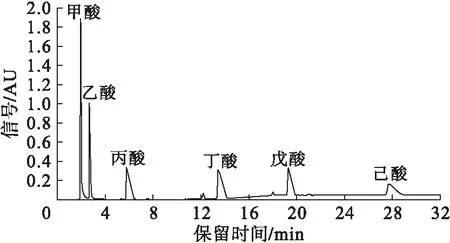
图1短链脂肪酸标准色谱图
有机改性剂甲醇比例的升高,能加快短链脂肪酸尤其是碳链较长有机酸的洗脱并改善峰形。甲醇的加入减弱了有机酸的疏水端与固定相的作用,从而缩短保留时间。然而,流动相中甲醇比例过高,会导致磷酸盐的析出而堵塞仪器,因此选择梯度洗脱终点为40%甲醇效果最佳。本实验由于仪器限制保持流速恒定在1.0 mL/min,在仪器条件允许的情况下,可适当增加流速,进一步缩短丁酸、戊酸、己酸的保留时间。由图1可知,甲酸、乙酸、丙酸、丁酸、戊酸和己酸的保留时间分别为1.96、2.71、5.81、13.47、19.33、27.72 min。
2.2 线性范围和检测限
配制一系列的标准溶液,按照液相色谱条件进行测定,结果见表2。由表2可知,6种短链脂肪酸在相应的线性范围内相关系数均大于0.99,线性关系良好。检测限为15.57~23.52 μg/mL。

表2 工作曲线、线性范围和检测限
注:表中y为绝对峰面积;x为质量浓度,mg/L。
2.3 方法精密度与准确度
采集样品经滤膜过滤后进样分析,在稳定操作条件下重复6次,方法的保留时间精密度和峰面积精密度结果见表3。控制加标物体积不超过试样溶液体积的1%,加标实验结果见表4。由表3、表4可知,方法的平均峰面积精密度为2.31%,平均回收率为96.88%,该方法有较好的精密度和准确度。

表3 方法精密度实验结果

表4 加标实验结果
2.4 Rancimat测量池水试样测定
采集3种油脂氧化稳定性实验所得水溶液,在确定的最佳液相色谱条件下测定其短链脂肪酸组成及含量,结果如表5所示。由表5可知,溶解在水中的短链脂肪酸主要为甲酸和乙酸。

表5 Rancimat测量池水中短链脂肪酸组成及含量 mg/L
注:ND表示未检出。
3 结 论
通过实验确定了检测Rancimat测量池水中短链脂肪酸组成的最佳色谱条件:流动相为磷酸盐溶液(pH 2.8,0.05 mol/L)和甲醇组成的梯度洗脱系统、流速1.0 mL/min、柱温40.℃、紫外检测波长210 nm、进样量10 μL。在最佳色谱条件下,可对测量池水中甲酸、乙酸、丙酸、丁酸、戊酸、己酸进行测定,并且有较好的精密度和准确度。分析了棕榈油、大豆油和亚麻籽油氧化稳定性实验所得水溶液,溶解在水中的短链脂肪酸主要为甲酸和乙酸。此法为深入理解、分析、优化油脂氧化稳定性评价实验奠定了基础。
[1] JAIN S,SHARMA M P.Review of different test methods for the evaluation of stability of biodiesel[J].Renew Sust Energ Rev,2010,14(7): 1937-1947.
[2] HAMMOND E G,WHITE P J.A brief history of lipid oxidation[J].J Am Oil Chem Soc,2011,88(7): 891-897.
[3] MENDEZ E,SANHUEZA J,SPEISKY H,et al.Validation of the Rancimat test for the assessment of the relative stability of fish oils[J].J Am Oil Chem Soc,1996,73(8): 1033-1037.
[4] DEMAN J M,TIE F,DEMAN L.Formation of short chain volatile organic acids in the automated AOM method[J].J Am Oil Chem Soc,1987,64(7):993-996.
[5] 徐泽峰.反相液相色谱法测定循环水中的微量甲酸与乙酸[J].化学工业与工程技术,2015,36(1):76-79.
[6] 辛梅华,李明春,徐金瑞,等.反相高效液相色谱法测定酸雨中的甲酸、乙酸、丙酸等[J].环境工程,2003,21(1):57-59.
[7] 张萍,叶利民.短链脂肪酸的梯度高效液相色谱法分析研究[J].华西口腔医学杂志,2001,19(5):294-295.
[8] CARVALHO A L D,CARDOSO E A,ROCHA G O D,et al.Carboxylic acid emissions from soybean biodiesel oxidation in the EN14112 (Rancimat) stability test[J].Fuel,2016,173:29-36.
[9] JAFFREZO J L,CALAS N,BOUCHET M.Carboxylic acids measurements with ionic chromatography[J].Atmos Environm,1998,32(14/15):2705-2708.
[10] 贾益群,叶福媛,王双,等.生物样品中短链脂肪酸的快速提取与分析方法[J].实验室研究与探索,2012(7):274-276.
Determinationofshort-chainfattyacidsinRancimatmeasuringcellwaterbyreversed-phasehigh-performanceliquidchromatography
LI Yongru,LI Xu,TAO Shengnan,ZHANG Yunxiao,LIU Ruijie,JIN Qingzhe,WANG Xingguo
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,Jiangsu,China)
Q547;O657.7
A
1003-7969(2017)09-0126-03
2016-12-19;
2017-03-16
江苏高校品牌专业建设工程资助项目(PPZY2015A052);江苏省自然科学基金(BK20140156)
李咏如(1994),女,在读本科,研究方向为脂质营养与安全(E-mail)liyongru1994@outlook.com。
刘睿杰,副教授(E-mail)liuruijie163@163.com。

