魔芋葡甘聚糖及其油酸酯化物的体外抗氧化初步研究
马素换,郭萍梅,黄凤洪
(中国农业科学院 油料作物研究所,油料油脂加工技术国家地方联合工程实验室,油料脂质化学与营养湖北省重点实验室,农业部油料加工重点实验室,农业部油料作物生物学与遗传育种重点实验室,武汉 430062)
油脂化学
魔芋葡甘聚糖及其油酸酯化物的体外抗氧化初步研究
马素换,郭萍梅,黄凤洪
(中国农业科学院 油料作物研究所,油料油脂加工技术国家地方联合工程实验室,油料脂质化学与营养湖北省重点实验室,农业部油料加工重点实验室,农业部油料作物生物学与遗传育种重点实验室,武汉 430062)
对魔芋葡甘聚糖(KGM)和魔芋葡甘聚糖油酸酯(KGM酯)体外抗氧化性进行了研究。通过氧化诱导试验、清除DPPH自由基、清除ABTS自由基、对Fe2+螯合能力、还原能力试验发现:KGM和KGM酯均有一定的抗氧化性,酯化度越高,抗氧化能力越强;当菜籽油中KGM和酯化度最高的KGM酯1添加量为0.8%时,与空白对照相比其氧化诱导时间分别延长5.94 h和2.56 h;在KGM酯与茶多酚、VC、TBHQ协同试验中,KGM酯也表现出一定抗氧化性;质量浓度为0.5 mg/mL时,KGM和KGM酯1对DPPH自由基清除率分别为61.68%和36.93%;质量浓度为2.0 mg/mL时,KGM和KGM酯1对ABTS自由基清除率分别为20.31%和17.26%,对Fe2+螯合率分别为17.58%和9.79%。虽然KGM酯化后其抗氧化能力稍有减弱,但仍具有抗氧化性,且与酯化程度呈正相关。
魔芋葡甘聚糖;魔芋葡甘聚糖油酸酯;抗氧化性
Abstract:The antioxidant activities in vitro of konjac glucomannan (KGM) and the konjac glucomannan oleic acid ester (KGM ester) were studied.By oxidation induction test,DPPH free radical scavenging,ABTS free radical scavenging,Fe2+chelating ability and reducing power test,it was found that KGM and KGM ester had certain antioxidant activities and the higher degree of esterification,the stronger the antioxidation capacity.When dosages of KGM and KGM ester 1 with the highest esterification degree were 0.8%,the oxidation induction time of rapeseed oil extended 5.94 h and 2.56 h respectively compared with control group.In the synergy test of KGM ester and tea polyphenols,VCand TBHQ,KGM ester also showed certain antioxidant activity.When the mass concentrations of KGM and KGM esters were 0.5 mg/mL,DPPH free radical scavenging rates were 61.68% and 36.93% respectively.When the mass concentrations were 2.0 mg/mL,the ABTS free radical scavenging rates were 20.31% and 17.26%,and the Fe2+chelating rates were 17.58% and 9.79% respectively.Although the antioxidant capacity of KGM slightly decreased after esterification with oleic acid,it still had antioxidant ability,and it was positively correlated with the degree of esterification.
Keywords:konjac glucomannan; konjac glucomannan oleic acid ester; antioxidant activity
魔芋葡甘聚糖(Konja glucomannan,KGM)是魔芋块茎中的高分子多糖[1],由葡萄糖和甘露糖以β-1,4糖苷键结合而成,是一种水溶性的膳食纤维,对减肥、增加肠蠕动、抑制糖和脂肪的过量吸收都有良好的作用[2],同时所具有的凝胶性、成膜性、抗菌性等特性,使其在食品、工业、医药等领域都有所应用,但其脂溶性差,这一性质限制了其开发应用范围。将功能脂肪酸油酸与KGM进行酯化,合成魔芋葡甘聚糖油酸酯(KGM酯),这样不仅能改善其脂溶性,还能缓解因脂质过量摄入导致的多种现代文明疾病,有望成为一类新型的多功能保健食品素材。
大量研究报道显示很多植物多糖具有抗氧化作用,能清除体内氧自由基,起到延缓衰老的作用[3]。多糖的体外抗氧化评价方法很多,但主要基于两类:一是通过测定样品抑制脂类物质氧化的能力来评定其抗氧化能力,二是对自由基的清除能力来反映其抗氧化活性[4]。已有报道KGM具有抗氧化性,但与油酸酯化合成的酯化物是否具有抗氧化性鲜有报道。本文基于DPPH自由基清除试验、Fe2+螯合能力测定、ABTS自由基清除试验等常用的体外抗氧化评价方法对KGM与用酶法所制备的KGM酯的抗氧化活性进行了研究,为KGM酯的综合利用提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
魔芋葡甘聚糖(KGM)(食品级,纯度≥95%),菜籽油(实验室自制,未添加抗氧化剂)。油酸、4 Å分子筛(使用前经高温活化)、0.1 mol/L HCl标准溶液、75%乙醇、无水乙醇、0.5 mol/L KOH溶液、正己烷、环己烷、正丁醇、酚酞指示剂、VC、茶多酚、特丁基对苯二酚(TBHQ)、司盘80、叔丁醇、DPPH、硫酸亚铁、亚铁嗪、磷酸氢二钠、磷酸二氢钠、三氯乙酸、铁氰化钾、重硫酸钾等均为分析纯。
1.1.2 仪器与设备
XS205万分之一电子天平:瑞士Mettler Toledo公司;743Rancimat 油脂氧化稳定性测定仪:瑞士万通;DU800型紫外分光光度计:德国Beckman Coulter公司;KQ-500DB型数控超声波清洗器:昆山市超声仪器有限公司;纯水制备机:美国Millipore公司。
1.2 试验方法
1.2.1 魔芋葡甘聚糖油酸酯合成[5]
称取一定量底物KGM、油酸置于具塞锥形瓶中,加入脂肪酶Novozym435及叔丁醇于45.℃水浴中振荡(150 r/min)反应。反应至所设定时间(24、36、48 h)后,加入无水乙醇终止反应,反应混合物冷却过滤,旋转蒸发除去反应介质叔丁醇,残留的油酸用正己烷萃取除去后,余下的反应混合物加入等体积水混合,然后加入体积比1∶1的环己烷-正丁醇提取糖酯,并旋转蒸发除去有机相溶剂,得到3种酯化度的KGM酯。
1.2.2 酯化产物酯化度的测定
酯化产物的酯化程度可用酯化度来表示,酯化度可用皂化法[6]测定。
1.2.3 氧化诱导试验
试验①:准确称取KGM和KGM酯,分别按质量分数0.02%、0.04%、0.06%、0.08%、0.10%、0.20%、0.40%、0.60%、0.80%添加到菜籽油中,为了提高KGM、KGM酯和菜籽油的融合性,另外添加适量司盘80,对照油样为菜籽油,每个试验进行3次。
试验②:将质量分数为0.02%的KGM和KGM酯分别与质量分数为0.02%茶多酚、0.02%VC和0.02%TBHQ添加到菜籽油中进行协同试验,每个试验进行3次。
称取5 g油样放置试管中,设置氧化稳定性测定仪测定条件:加热温度120.℃,空气流速20 L/h;根据记录的氧化诱导时间衡量对油脂氧化稳定性的影响。
1.2.4 对DPPH自由基清除能力测定
DPPH自由基清除能力根据文献[7]的方法稍有修改。DPPH溶液(现配现用)配制:称取10 mg DPPH标准品,用无水乙醇定容到10 mL,取上述母液3.8 mL,用无水乙醇再定容到100 mL,DPPH质量浓度为0.038 mg/mL。样品溶液配制:先配制质量浓度为1 mg/mL,然后稀释6个质量浓度梯度0.5、0.2、0.1、0.05、0.01、0.005 mg/mL。
取0.5 mL样品液,加入2.5 mL DPPH溶液,迅速混合均匀后避光反应30 min,以无水乙醇为空白,于517 nm处测定吸光值。按照下式计算DPPH自由基清除率。
1.2.5 对Fe2+螯合能力的测定
参照和智坤等[8]方法。样品溶液配制:用水将样品配制成5 mg/mL样品液,然后再稀释至5个质量浓度梯度2.0、1.0、0.5、0.1、0.05 mg/mL。测定时取2 mL样液,加入0.25 mL 10 mmol/L硫酸亚铁溶液,摇匀后室温放置30 min,然后加入10 mmol/L亚铁嗪0.1 mL,摇匀后室温放置10 min,于562 nm处测得吸光值。按照下式计算螯合率。
式中:A0表示水、硫酸亚铁溶液与亚铁嗪混合液的吸光值;A1表示样品液、硫酸亚铁溶液与亚铁嗪混合液的吸光值;A2表示样品液、硫酸亚铁溶液与水混合液的吸光值。
1.2.6 对ABTS自由基清除能力测定
ABTS自由基清除能力参照文献[9-10]。用磷酸氢二钠和磷酸二氢钠配制pH为7.40、浓度为100 mmol/mL的磷酸盐缓冲液,并用此缓冲液溶解样品配制成5 mg/mL样品液,然后再稀释至5个质量浓度梯度2.0、1.0、0.5、0.1、0.05 mg/mL。ABTS溶液配制:76.82 mg ABTS盐定容到10 mL容量瓶,12.23 mg重硫酸钾定容到10 mL容量瓶中,两种溶液按1∶1比例混合均匀,避光反应16 h。使用时需稀释100倍,现配现用。
将0.08 mL样品液加入4 mL ABTS稀释液,避光反应30 min后测定其734 nm波长处的吸光值。按照下式计算ABTS自由基清除率。
式中:A0表示磷酸盐缓冲液与ABTS混合液的吸光值;A1表示样品液与ABTS混合液的吸光值;A2表示样品液与磷酸盐缓冲液混合液的吸光值。
1.2.7 还原能力的测定[8,11]
样品配成5 mg/mL的水溶液,然后再稀释至5个质量浓度梯度2.0、1.0、0.5、0.1、0.05 mg/mL。用磷酸氢二钠和磷酸二氢钠配制pH为6.60,浓度为100 mmol/mL的磷酸盐缓冲液。测定时,1 mL样品加入2.5 mL磷酸盐缓冲液和2.5 mL的1%铁氰化钾混匀,放置到50.℃水浴中加热20 min,然后加入2.5 mL 10%三氯乙酸,离心后取2.5 mL上清液,分别加入2.5 mL水和0.5 mL 1%三氯化铁,室温下反应5 min,在700 nm波长处测其吸光值。吸光值越大表明还原能力越强。
2 结果与分析
2.1 魔芋葡甘聚糖油酸酯酯化度
用皂化法测定KGM酯酯化度,测得KGM酯1、KGM酯2、KGM酯3酯化度分别为0.69、0.45、0.14。
2.2 氧化诱导试验
1.2.3试验①考察了不同添加量的KGM和KGM酯对菜籽油的抗氧化性,结果见表1。由表1可知,与空白对照相比,KGM和KGM酯均具有抗氧化的作用,且总体随着添加量的增加,氧化诱导时间延长,抗氧化效果明显。当添加量为0.8%时,KGM和KGM酯1与空白对照(6.15 h)相比其氧化诱导时间分别延长5.94 h和2.56 h;KGM酯2和KGM酯3与空白对照(5.23 h)相比其氧化诱导时间分别延长2.83 h和2.00 h。KGM和KGM酯比较,KGM对菜籽油的抗氧化效果优于KGM酯,而不同酯化度的KGM酯比较,酯化度越高,其氧化诱导时间越长,抗氧化能力越强。

表1 不同添加量的KGM和KGM酯氧化诱导时间
1.2.3试验②考察了KGM、KGM酯和茶多酚、VC、TBHQ的协同抗氧化效果,结果见表2。
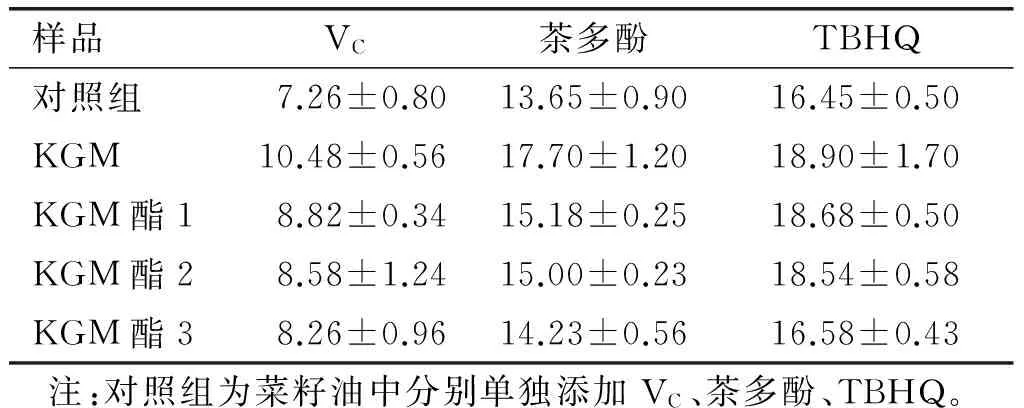
表2 KGM、KGM酯和茶多酚、VC、TBHQ协同氧化诱导时间 h
由表2可知,KGM和KGM酯分别添加了 0.02% 的茶多酚、VC、TBHQ后,其氧化诱导时间比单独使用茶多酚、VC、TBHQ氧化诱导时间都有所延长,尤其在与TBHQ协同试验中,KGM酯1抗氧化效果较好,氧化诱导时间延长了2.23 h,KGM氧化诱导时间也延长了2.45 h,再次证明了KGM和KGM酯具有一定抗氧化作用。
2.3 对DPPH自由基的清除能力
DPPH自由基是一种合成的、具有单电子、稳定的化合物。DPPH 自由基的孤对电子会接受自由基去除剂的一个电子或氢原子,变成稳定的物质,自身溶液会由深紫色变为黄色,颜色转变程度取决于自由基清除活性[12]。KGM、KGM酯对DPPH自由基的清除能力见图1。
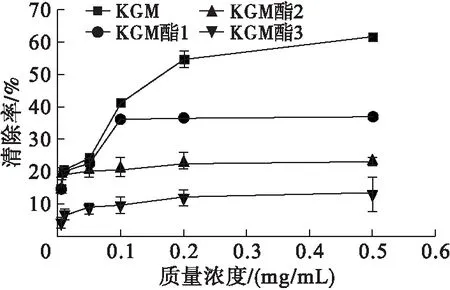
图1 KGM和KGM酯对DPPH自由基清除率
由图1可知,随着样品质量浓度的增加,KGM酯清除DPPH自由基能力增加相对缓慢。KGM清除DPPH自由基能力增加快速,高于KGM酯,当质量浓度为0.5 mg/mL时,KGM对DPPH自由基清除率可达61.68%,KGM酯1对DPPH自由基清除率36.93%。KGM酯较KGM对DPPH自由基清除能力下降原因可能为,多糖与油酸酯化后结构发生改变,使其抗氧化能力下降。3种不同酯化度的KGM酯比较,酯化度越高,其DPPH清除能力越强。
2.4 对Fe2+螯合能力
对Fe2+螯合能力的测定是众多评价体外抗氧化性方法中的一种[13]。 亚铁嗪是二价铁离子的显色剂,抗氧化物质能与铁离子进行螯合,亚铁嗪与未螯合的铁离子形成紫红色的基团在562 nm处有吸收峰,吸光值越大抗氧化性越弱。KGM、KGM酯对Fe2+螯合能力见图2。
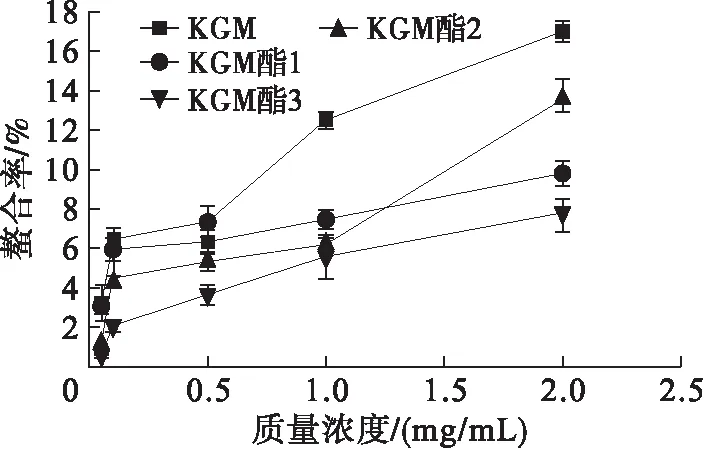
图2 KGM和KGM酯对Fe2+螯合能力
由图2可知,在样品质量浓度梯度0.05~1 mg/mL范围内,随着样品质量浓度的增加,KGM和KGM酯对Fe2+螯合能力不断增强,相同质量浓度,KGM对Fe2+螯合能力强于KGM酯,酯化度高的KGM酯1对Fe2+螯合能力强于酯化度低的KGM酯3。当样品质量浓度为2.0 mg/mL时,KGM和KGM酯1对Fe2+螯合率分别达到17.58%和9.79%。
2.5 对ABTS自由基的清除能力
ABTS自由基的清除原理[14]为,ABTS能与重硫酸钾反应生成蓝绿色的ABTS自由基,其在734 nm处有最大吸收峰,清除自由基的物质与ABTS反应使得颜色褪色,在734 nm处测得吸光值能衡量物质清除自由基能力的大小。KGM、KGM酯对ABTS自由基的清除能力见图3。
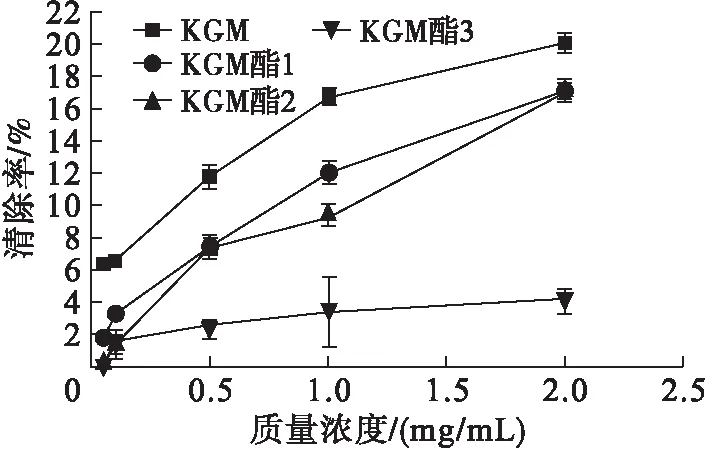
图3 KGM和KGM酯对ABTS自由基清除率
由图3可知,随着KGM和KGM酯质量浓度的增加,ABTS自由基的清除率也不断升高,在质量浓度为2.0 mg/mL时KGM对ABTS自由基的清除率达到20.31%,KGM酯1对ABTS自由基的清除率达到17.26%,KGM清除ABTS自由基的效果好于KGM酯。3种不同酯化度的KGM酯在所试验质量浓度范围内,酯化度越高,清除效果越好。
2.6 还原能力
KGM、KGM酯的还原能力测定结果见图4。
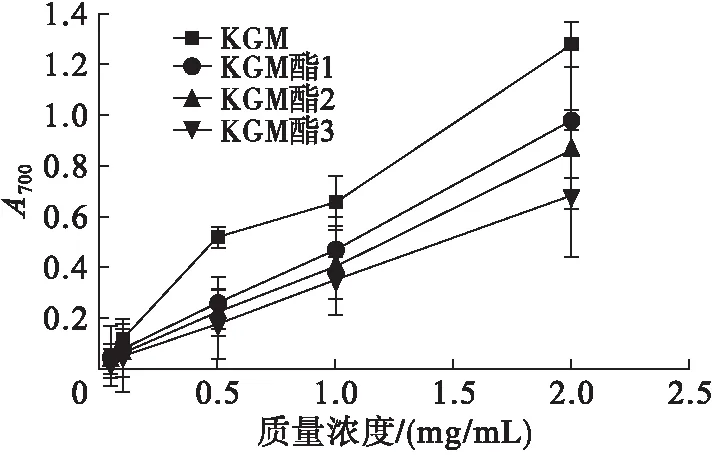
图4 KGM和KGM酯的还原能力
由图4可知,随着样品质量浓度的增加,吸光值不断增大,表明KGM、KGM酯的还原能力也在增强,当质量浓度相同时,KGM的还原能力强于KGM酯,此结果表明与油酸酯化后,KGM的还原能力有所减弱。
3 结 论
通过氧化诱导试验、清除DPPH自由基、对Fe2+螯合能力、清除ABTS自由基、还原能力试验得知,魔芋葡甘聚糖(KGM)和魔芋葡甘聚糖油酸酯(KGM酯)均具有一定抗氧化作用。氧化诱导试验显示:KGM和酯化度较高的KGM酯1添加量为 0.8% 时,与空白对照相比其氧化诱导时间分别延长5.94 h和2.56 h;与茶多酚、VC、TBHQ协同试验中,KGM酯也表现出一定抗氧化性。DPPH自由基清除试验、ABTS自由基清除试验、Fe2+螯合试验得出:KGM和KGM酯1在质量浓度为0.5 mg/mL时,DPPH自由基清除率分别为61.68%和36.93%;KGM和KGM酯1在质量浓度为2.0 mg/mL时,对ABTS自由基清除率分别为20.31%和17.26%,对Fe2+螯合率分别为17.58%和9.79%。KGM与油酸酯化后酯化度越高,抗氧化能力越强,这为KGM酯的综合利用提供了一定的理论依据。
[1] 李斌,汪超.国外魔芋葡甘聚糖结构及其溶液行为研究进展[J].包装与食品机械,2003,21(5):23-26.
[2] 张颖.魔芋葡甘聚糖的提取及其抗氧化活性研究[J].食品研究与开发,2015,36(14):87-91.
[3] 陈建红,周海燕,吴永尧.魔芋葡甘低聚糖抗氧化性初步研究[J].天然产物研究与开发,2006,18(5):713-716.
[4] 蒋厚阳,杨吉霞,赵培君,等.食品抗氧化评价体系及其选择使用[J].食品工业科技,2012(24):414-417,422.
[5] LI G J,QI L,ZONG M H.Preliminary study on the preparation of esterified konjac glucomamman by lipase-catalyzed reactions in non-aqueous systems[J].Acta Sci Natur Univ Sunyatseni,2003,42:102-108.
[6] 吴伟都,施文蓉,贲东旭,等.乙酰化变性淀粉酯化度的测定[J].粮油加工,2010(5):58-59.
[7] 张智敏,夏伯候,周万猛,等.微波辅助提取茶籽多糖的工艺优化及其体外抗氧化活性评价[J].中国油脂,2017,42(4):131-135.
[8] 和智坤,赵改红,李梦婷,等.魔芋葡甘露寡糖的干燥加热硒酸化及其产物的抗氧化性[J].食品科学,2013,34(5):5-9.
[9] RE R,PELLEGRINI N,PROTEGGENTE A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biol Med,1999,26(9/10): 1231-1237.
[10] 周晴芬,徐洲,魏岚,等.4种油茶籽油中多酚类物质的抗氧化活性比较研究[J].中国油脂,2014,39(1):35-38.
[11] 罗莉.大枣生物活性多糖分离及抗氧化活性研究[D].郑州:河南工业大学,2012.
[12] 张飞.连翘花和叶中清除自由基成分分析及其含量测定[D].河北 保定:河北农业大学,2011.
[13] 周静.红肉桃果实多酚类化学成分分析及其抗氧化活性研究[D].武汉:武汉轻工大学,2014.
[14] 韩光亮,李翠梅,CACACE E,等.改良的 ABTS+法及其在优化抗氧化活性物质提取中的应用[J].卫生研究,2004,33(5):620-622.
Preliminarystudyonantioxidantactivityinvitroofkonjacglucomannananditsoleicacidesterifiedproduct
MA Suhuan,GUO Pingmei,HUANG Fenghong
(Key Laboratory of Biology and Genetic Improvement of Oil Crops,Ministry of Agriculture,Key Laboratory of Oilseeds Processing,Ministry of Agriculture,Hubei Key Laboratory of Lipid Chemistry and Nutrition,Oil Crops and Lipids Process Technology National & Local Joint Engineering,Oil Crops Research Institute,Chinese Academy of Agricultural Sciences,Wuhan 430062,China)
TS201.1;S632.9
A
1003-7969(2017)09-0055-05
2016-11-16;
2017-06-08
青年科学基金项目(31601515);中国农业科学院科技创新工程(CAAS-ASTIP-2013-OCRI);现代农业产业技术体系(CARS-13)
马素换(1989),女,硕士,研究方向为粮食、油脂与植物蛋白工程(E-mail)962383174@qq.com。
郭萍梅,副研究员(E-mail)guopingmei@caas.cn。

