术前静滴思美泰对肝癌切除患者术后肝功能的影响及其机制探讨
袁博,张昕辉,张灿灿,李欢送
(徐州市中心医院,江苏徐州221009)
术前静滴思美泰对肝癌切除患者术后肝功能的影响及其机制探讨
袁博,张昕辉,张灿灿,李欢送
(徐州市中心医院,江苏徐州221009)
目的观察术前静滴思美泰(S-腺苷蛋氨酸)对肝癌切除患者术后肝功能的影响,并探讨其机制。方法将60例原发性肝癌患者随机分为A、B组各30例,A组术前3 d连续静滴思美泰,B组不用。两组采用肝门间歇阻断法切肝,记录术中切除肝脏大小、肝门阻断时间、出血量,术后均常规保肝治疗。分别于术前第3天及术后第1、3、5天取空腹静脉血,检测肝功能(ALT、AST、LDH)。术中切取肝组织,ELISA法检测氧化应激指标[丙二醛(MDA)、铜锌超氧化物歧化酶(Cu-Zn SOD)、谷胱甘肽过氧化物酶(GSH-Px)]。结果两组术中切除肝脏大小、肝门阻断时间、出血量比较,差异无统计学意义(P均>0.05)。两组术前第3天血清ALT、AST、LDH比较,差异无统计学意义(P均>0.05)。两组术后血清ALT、AST、LDH均升高,术后第1天达高峰后逐渐降低,术后第5天接近术前水平;A组术后血清ALT(第1、3、5天)、AST(第1、3天)、LDH(第1天)水平均低于B组,差异有统计学意义(P均<0.05)。与B组比较,A组术中肝组织匀浆中MDA水平降低而Cu-Zn SOD、GSH-Px水平升高(P均<0.05)。结论术前静滴思美泰对肝癌切除患者术后肝功能有保护作用,可能与其抑制氧化应激损伤有关。
原发性肝癌;S-腺苷蛋氨酸;急性肝损害;肝功能;丙二醛;超氧化物歧化酶;谷胱甘肽过氧化物酶
肝切除术后常并发肝功能损伤,主要是由于肝门血流阻断导致的缺血再灌注后氧化应激反应造成的[1];另外,手术切除、挤压等可导致肝细胞质膜破裂,线粒体转运功能障碍。内源性肝细胞保护剂谷胱甘肽(GSH)在线粒体中合成,线粒体功能障碍必然导致GSH合成减少,抗氧化作用减弱,肝功能损害逐步加重。肝脏外科术后常规保肝治疗已成规范,而术前使用保肝药物尚无明确规范。在临床工作中,思美泰(S-腺苷蛋氨酸)在胆汁淤积性肝病、酒精性肝病、非酒精性肝纤维化、慢性病毒性肝炎等疾病中的治疗作用已得到证实[2~4]。2012年8月~2016年12月,我们对肝门阻断下原发性肝癌切除术患者术前静滴思美泰,观察其对患者术后肝功能的影响,并探讨其机制。
1 资料与方法
1.1 临床资料 选择同期徐州市中心医院收治的原发性肝癌患者60例,经病史、实验室检查、B超、CT、MRI等确诊。患者中男52例、女8例,年龄36~68岁;肿瘤直径(3.1±7.8)cm,肝功能Child-Pugh A级或接近A级;无广泛肝外转移,符合根治性手术切除标准。将患者术前随机分为A、B组各30例,其性别、年龄肿瘤直径及肝功能Child-Pugh分级具有可比性。
1.2 治疗方法 A组术前3 d连续静滴思美泰150 mg/d,B组不使用思美泰。两组均于常温下行肝门间歇阻断法切肝,记录术中切除肝脏大小、肝门阻断时间、出血量。术后均生理盐水100 mL+注射用复方甘草酸单铵160 mg保肝治疗,另予抗生素预防感染、奥美拉唑预防应激性溃疡及补液支持等治疗,血清白蛋白<30 g/L者予静脉补充人血白蛋白或血浆。
1.3 肝功能检测方法 于术前第3天和术后第1、3、5天,由肘部静脉抽空腹血,常规测定血清肝功生化指标(ALT、AST、LDH)。
1.4 肝组织氧化应激指标检测方法 术中切除部分肝脏组织标本,制备匀浆,取上清液,使用ELISA试剂盒检测氧化应激指标,包括丙二醛(MDA)、铜锌超氧化物歧化酶(Cu-Zn SOD)、谷胱甘肽过氧化物酶(GSH-Px)。
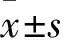
2 结果
2.1 两组手术情况比较 两组均无手术而导致的死亡,术后常见并发症均经积极处理后治愈。两组术中切除肝脏大小、肝门阻断时间、出血量比较,差异无统计学意义(P均>0.05)。见表1。
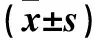
表1 两组术中切除肝脏大小、肝门阻断时间、出血量比较
2.2 两组手术前后血清ALT、AST、LDH水平比较 两组术前第3天血清ALT、AST、LDH比较,差异无统计学意义(P均>0.05)。两组术后血清ALT、AST、LDH均升高,术后第1天达高峰后逐渐降低,术后第5天接近术前水平;A组术后血清ALT(第1、3、5天)、AST(第1、3天)、LDH(第1天)水平均低于B组,差异有统计学意义(P均<0.05)。见表2。

表2 两组手术前后血清ALT、AST、LDH水平比较
注:与同组术前第3天比较,*P<0.05;与B组术后同时点比较,#P<0.05。
2.3 两组术中肝组织匀浆中MDA、Cu-Zn SOD、GSH-Px水平比较 与B组比较,A组术中肝组织匀浆中MDA水平降低而Cu-Zn SOD、GSH-Px水平升高(P均<0.05)。见表3。
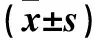
表3 两组术中肝组织匀浆中MDA、Cu-Zn SOD、GSH-Px水平比较
注: 与B组比较,*P<0.05。
3 讨论
目前手术是治疗肝癌的主要方法,而手术会导致肝损伤,甚至肝功能衰竭而死亡。多种因素均会影响肝功能,如肝硬化程度、Child-Pugh分级,肝脏切除的范围、术中阻断肝门时间、出血输血等。缺血再灌注损伤是肝脏外科手术中普遍存在的问题,如何提高肝脏的自我保护能力,调动其内源性保护机制,是目前肝脏外科研究的热点问题。目前,术前保肝治疗尚未得到统一的认可。术前使用思美泰对肝癌切除患者术后肝功能是否有保护作用,是本研究的重点。
S-腺苷蛋氨酸是人体内重要的生理活性物质。在各种试验模型中,发现腺苷蛋氨酸的抗胆汁淤积作用与下列机制有关:①促进腺苷蛋氨酸依赖性质膜磷脂的合成,降低胆固醇与磷脂比例,从而恢复细胞质膜的流动性[5]。②克服转硫基反应障碍,促进内源性解毒过程中硫基的合成[6]。腺苷蛋氨酸对各类肝炎、肝硬化、梗阻性黄疸等急慢性肝病均有良好的作用,广泛应用于临床中。Karaa等[3]研究认为,慢性酒精性刺激联合脂多糖可引起肝脏纤维化,而应用S-腺苷蛋氨酸可抑制氧化应激反应和肝星状细胞活化,显著减轻了肝脏纤维化,保护和修复了受损的肝功能。研究[8]发现,使用S-腺苷蛋氨酸在减轻梗阻性黄疸患者瘙痒症状、恢复总胆红素和碱性磷酸酶方面明显优于使用安慰剂者。
基础研究认为,许多疾病的产生与由自由基和抗氧化剂的失衡有关。过量的自由基最终导致细胞膜、DNA、酶的损伤,引起细胞凋亡与恶变[9]。肝细胞在防御氧化应激损伤中有一系列的抗氧化机制,主要包括一些抗氧化酶(如SOD、GSH-Px、谷胱甘肽还原酶、6-磷酸葡萄糖脱氢酶等)、金属结合蛋白(铁蛋白、铜蓝蛋白)和维生素等[10]。当自由基产生过多、过快,不能及时被抗氧化剂中和时,氧化应激损伤就发生了,相应的引起抗氧化防御功能的下降[11]。这种细胞环境容易引起肝功能异常,逐渐导致肝损伤。例如:缺血再灌注过程中,缺血、缺氧的环境下极易引起急性肝损伤[12~15]。
本研究结果显示,两组术中切除肝脏大小、肝门阻断时间、出血量比较,差异无统计学意义。两组术前第3天血清ALT、AST、LDH比较,差异无统计学意义。两组术后血清ALT、AST、LDH均升高,术后第1天达高峰后逐渐降低,术后第5天接近术前水平;A组术后血清ALT(第1、3、5天)、AST(第1、3天)、LDH(第1天)水平均低于B组,差异有统计学意义。与B组比较,A组术中肝组织匀浆中MDA水平降低而Cu-Zn SOD、GSH-Px水平升高。因此,我们认为术前静滴思美泰对肝癌切除患者术后肝功能有保护作用,可能与其抑制氧化应激损伤有关。
[1] Uchiyama K, Mori K, Tabuse K, et al. Assessment of liver function for successful hepatectomy in patients with hepatocellular carcinoma with impaired hepatic function[J]. J Hepatobiliary Pancreat Surg, 2008,15(6):596-602.
[2] Purohit V, Russo D. Role of S-adenosyl-L-methionine in the treatment of alcoholic liver disease: introduction and summary of the symposium[J]. Alcohol, 2002,27:151-154.
[3] Karaa A, Thompson KJ, McKillop IH, et al. S-adenosyl-L-methionine attenuates oxidative stress and hepatic stellate cell activation in an ethanol-LPS-induced fibrotic rat model[J]. Shock, 2008,30(2):197-205.
[4] Lu SC, Mato JM. S-adenosylmethionine in liver health, injury, and cancer[J]. Physiol Rev, 2012,92(4):1515.
[5] Hao X, Huang Y, Qiu M, et al. Immunoassay of S-adenosyl-L-methionine and S-adenosylhomocysteine: the methylation index as a biomarker for disease and health status[J]. BMC Res Notes, 2016,9(2):498-501.
[6] Montgomery SE, Sepehry AA, Wangsgaard JD, et al. The effect of s-adenosylmethionine on cognitive performance in mice: an animal model meta-analysis[J]. PLoS One, 2014,9(10):756-761.
[7] Noureddin M, Mato JM, Lu SC, et al. Nonalcoholic fatty liver disease: Update on pathogenesis, diagnosis, treatment and the role of S-adenosylmethionine[J]. Exp Biol Med (Maywood), 2015,240(6):809-820.
[8] Perez-Leal O, Moncada C, Clarkson AB, et al. pneumocystis s-adenosylmethionine transport:a potential drug target[J]. Cell Mol Biol, 2011,45(6):1142-1146.
[9] Petrossian TC, Clarke SG. Uncovering the human methyltransferasome[J]. Mol Cell Proteomics, 2011,10(6):110-114.
[10] Cano A, Buqué X, Martínez-Ua M, et al. Methionine adenosyltransferase 1A gene deletion disrupts hepatic very low-density lipoprotein assembly in mice[J]. Hepatology, 2011,54(6):1975-1986.
[11] Tomasi ML, Tomasi I, Ramani K, et al. S-adenosylmethionine regulates ubiquitin-conjugating enzyme 9 protein expression and sumoylation in human cancers[J]. Hepatology, 2012,56(5):982-993.
[12] García-Trevijano ER, Latasa MU, Carretero MV, et al. S-adenosylmethionine regulates MAT1A and MAT2A gene expression in cultured rat hepatocytes: a new role for S-adenosylmethionine in the maintenance of the differentiated status of the liver[J]. FASEB J, 2000,14(3):2511-2518.
[13] Ou X, Yang H, Ramani K, et al. Inhibition of human betaine-homocysteine methyltransferase expression by S-adenosylmethionine and methylthioadenosine[J]. Biochem J, 2007,401(5):87-96.
[14] Agrimi G, Di Noia MA, Marobbio CM, et al. Identification of the human mitochondrial S-adenosylmethionine transporter: bacterial expression, reconstitution, functional characterization and tissue distribution[J]. Biochem J, 2004,379(3):183-190.
[15] Alpert JE, Papakostas G, Mischoulon D, et al. S-adenosyl-L-methionine (SAMe) as an adjunct for resistant major depressive disorder: an open trial following partial or nonresponse to selective serotonin reuptake inhibitors or venlafaxine[J]. J Clin Psychopharmacol, 2004,24(3):661-664.
10.3969/j.issn.1002-266X.2017.34.012
R735.5
B
1002-266X(2017)34-0038-03
2017-03-12)
李欢送(E-mail: shimingyb@aliyun.com)

