MIF、IL-23、RANKL、OPG、DKK1水平在活动性强直性脊柱炎患者中的临床意义
白晶 孙其桓 张征 张艳丽 徐顺新
·论著·
MIF、IL-23、RANKL、OPG、DKK1水平在活动性强直性脊柱炎患者中的临床意义
白晶 孙其桓 张征 张艳丽 徐顺新
目的探讨和分析MIF、IL-23、RANKL、OPG、DKK1水平在活动性强直性脊柱炎患者中的临床意义。方法选取2013年2月至2016年1月接受临床治疗的46例活动性强直性脊柱炎患者作为研究对象,将其作为试验组,并选取同时期进行健康体检的38例健康者作为对照组,检测分析2组的MIF、IL-23、RANKL、OPG、DKK1水平,评价这几项指标在活动性强直性脊柱炎的作用。结果试验组患者的MIF、IL-23、RANKL、OPG、DKK1分别为(25.40±10.87)ng/ml、(374.88±37.21)pg/L、(21.50±16.59)pg/L、(5.02±1.58)pg/L、(0.72±0.15)ng/ml,与对照组健康者的(4.03±0.77)ng/ml、(179.79±20.14)pg/L、(7.56±1.15)pg/L、(1.87±0.29)pg/L、(0.12±0.03)ng/ml相比较,差异有统计学意义(P<0.05);试验组患者的疾病活动因子ESR、CRP分别为(40.24±26.24)mm/h、(4.76±3.38)mg/L,与对照组健康者的(8.25±0.51)mm/h、(2.57±0.32)mg/L相比较,差异有统计学意义(P<0.05);试验组活动性强直性脊柱炎患者的MIF、IL-23、OPG与疾病活动因子ESR、CRP呈正相关关系(P<0.05),试验组患者的RANKL、DKK1与疾病活动因子ESR、CRP没有明显的相关关系(P>0.05)。结论MIF、IL-23、RANKL、OPG、DKK1水平在活动性强直性脊柱炎患者中明显上升,而且与疾病活动因子具有一定的关系。
MIF;IL-23;RANKL;OPG;DKK1;活动性强直性脊柱炎
活动性强直性脊柱炎(ankylosing spondylitis,AS)是临床治疗中比较常见的一种免疫性炎性风湿性的疾病,其发病机制至今尚未明确,属于慢性炎性关节炎,是临床难治性疾病之一。本病患者多存在炎性的腰背痛症状、晨僵时间延长,四肢关节不对称性肿胀,肌腱附着点的炎症改变,且有低热、体重下降、乏力、食欲减退等全身症状。而且活动性强直性脊柱炎患者多存在骨质疏松或者骨量的减少,部分患者甚至出现单眼或双眼的虹膜或葡萄膜炎,亦可有心、肺、肾并发症,严重影响活动性强直性脊柱炎患者的日常生活质量[1]。临床研究表明,在AS炎性骨破坏的过程中,一些炎性细胞因子通过调节细胞核因子κB受体活化因子配体(RANKL)、骨保护素(OPG)等分子间接参与破骨细胞的分化和激活[2]。RANKL、RANK、OPG为调节破骨细胞活性所必需的细胞因子,是造成AS骨质破坏的重要因素。而通过研究Wnt信号发现,天然抑制物 Dick-kopf(DKK)-1受Wnt信号抑制,使得Wnt信号途径强化,外周骨赘过度增生[3]。AS 患者中无骨赘形成者较有骨赘形成者的功能性 DKK1 水平显著增高,与硬骨素(SOST)水平呈正相关。而IL-23在AS患者中含量明显增加,巨噬细胞移动抑制因子(MIF)在AS的表达及其与骨破坏的相互关联尚不明确。本文对于MIF、IL-23、RANKL、OPG、DKK1水平在活动性强直性脊柱炎患者中的临床意义进行一定的研究与探讨,试图为 AS的治疗探索新的靶点和途径,研究的结果报道如下。
1 资料与方法
1.1 一般资料 选取2013年2月至2016年1月期间于我院就诊和接受治疗的46例活动性强直性脊柱炎患者作为试验组,并选取同时期来我院进行健康体检的38例健康者作为对照组。对照组中,男28例,女10例;年龄35~57岁,平均年龄(43.21±1.28)岁;按照文化水平可分为,大专及大专以上文化水平6例,中专文化水平8例,高中文化水平16例,初中及初中以下文化水平8例;试验组中,男30例,女16例;年龄18~43岁,平均年龄(27.2±8.0)岁;按照文化水平可分为,大专及大专以上文化水平6例,中专文化水平10例,高中文化水平20例,初中及初中以下文化水平10例;平均病程(7.6±3.8)年。2组性别比、平均年龄、文化程度等因素差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
1.2.1 纳入标准:符合美国的风湿协会所制定的活动性强直性脊柱炎诊断的相关标准的患者[4];腰背痛的病程至少持续3个月,活动后疼痛减轻,但休息后疼痛不减轻,腰椎活动受限,胸廓扩展范围低于正常值,双侧或单侧骶髂关节炎Ⅱ~Ⅳ级;活动性强直性脊柱炎的疾病活动指数>4分的患者;人体白细胞抗原HLA-B27为阳性的患者;没有接受任何相关治疗的患者;知情同意本研究内容并自愿参与的患者。
1.2.2 排除标准:不符合活动性强直性脊柱炎相关诊断标准的患者;具有严重的干燥综合征、系统性的红斑狼疮、骨关节炎等相关风湿疾病的患者;合并存在严重的心、肝、肾等器官系统相关疾病的患者;孕妇、哺乳期的女性;患有精神障碍而无法进行本研究的患者。
1.3 方法
1.3.1 仪器:OLYM-PUS AU5400 全自动生化分析仪 (日本);低温自动平衡离心机 LDZ5-2(北京);VERSAmax 酶标测试仪(美国);意大利ALIFAX Test-1全自动快速红细沉降率分析仪。
1.3.2 检测方法:采集2组受检者的10 ml静脉血,室温下静置1 h,经3 500 r/min离心10 min后,弃去上清液,放置在-80℃的超低温冰箱进行冻存待检,测定2组MIF、IL-23、RANKL、OPG、抑制因子(DKK1),以及疾病活动因子红细胞沉降率(ESR)、C-反应蛋白(CRP)。CRP检测采用双抗体夹心ELISA法,ESR检测采用传统魏氏法,MIF、IL-23、RANKL、OPG、DKK1检测均采用酶联免疫吸附法(ELISA)。进行炎症细胞因子与骨代谢细胞因子的相关性分析,进一步分析炎性细胞因子与骨代谢细胞因与AS严重程度的关系。
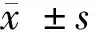
2 结果
2.1 2组MIF、IL-23、RANKL、OPG、DKK1比较 试验组活动性强直性脊柱炎患者的MIF、IL-23、RANKL、OPG、DKK1与对照组对比差异有统计学意义(P<0.05)。见表1。


组别MIF(ng/ml)IL⁃23(pg/L)RANKL(pg/ml)OPG(pg/ml)DKK1(ng/ml)对照组(n=38)4.03±0.77179.79±20.147.56±1.151.87±0.290.12±0.03试验组(n=46)25.40±10.87374.88±37.2121.50±16.595.02±1.580.72±0.15t值12.08128.9835.16412.11024.236P值<0.05<0.05<0.05<0.05<0.05
2.2 2组疾病活动因子ESR、CRP比较 试验组活动性强直性脊柱炎患者的疾病活动因子ESR、CRP与对照组对比差异有统计学意义(P<0.05)。见表2。
2.3 试验组相关因子与疾病活动因子的相关性比较 试验组活动性强直性脊柱炎患者的MIF、IL-23、OPG与ESR、CRP呈正相关关系(P<0.05),试验组患者的RANKL、DKK1与ESR、CRP没有明显的相关关系(P>0.05)。见表3。


组别ESR(mm/h)CRP(mg/L)对照组(n=38)8.25±0.512.57±0.32试验组(n=46)40.24±26.244.76±3.38t值7.5063.975P值<0.05<0.05
3 讨论
活动性强直性脊柱炎是一种全身性的疾病,患者多存在慢性的炎症症状,对活动性强直性脊柱炎患者的机体相关功能以及脊柱的活动度具有明显的不良影响,严重危害活动性强直性脊柱炎患者的机体健康[5,6]。

表3 试验组相关因子与疾病活动因子的相关性比较
活动性强直性脊柱炎是慢性的炎症性的相关疾病,活动性强直性脊柱炎患者的病情发展中有炎症、骨破坏以及新骨的形成共3个明显病理变化[7,8]。相关研究表明,活动性强直性脊柱炎患者在没有出现相关炎症或者已经出现相关炎症及炎症的消退过程中,均有可能会出现相关关节炎症以及骨破坏、骨重塑的相分离的情况[9-11]。
相关研究显示,在活动性强直性脊柱炎患者的炎性骨破坏的过程中,和患者体内的免疫功能的失衡具有一定的关系,部分的相关促炎细胞因子并不是直接的作用于患者的破骨细胞的分化以及激活的过程中,而是通过对患者的OPG、RANKL等一些分子的调节来间接的发挥作用[12-14]。OPG、RANKL、RANK是调节患者体内的破骨细胞的活性的重要细胞因子,是致使患者出现炎性相关的关节疾病的骨质破坏中最为重要的几个影响因素。
MIF则是T细胞源性的一种相关细胞因子,巨噬细胞移动抑制因子可对巨噬细胞的游走具有一定的抑制作用,还可促进巨噬细胞的增殖等,MIF是炎性的细胞因子比如IL-1β、TNF-α的一个重要的上游调控因子,而且,MIF在类风湿关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、慢性肾小球肾炎(chronic glomerulonephritis,CG)等相关疾病患者体内的表达出现较为明显的增强,提示MIF有可能会成为炎性相关疾病的临床治疗的一个新靶点[15,16]。
IL-23是一种炎性的细胞因子,IL-23与人体内的T细胞的免疫功能的异常具有一定的关系,IL-23可以间接的诱导TNF-α等一些促炎性的细胞因子的大量表达,进而导致患者体内的炎性细胞的浸润以及对组织的损害等,活动性强直性脊柱炎患者的体内IL-23水平会出现明显上升,推测IL-23可能是参与了活动性强直性脊柱炎患者的炎症以及骨质破坏的过程[17,18]。
而Wnt信号是活动性强直性脊柱炎患者的新骨形成的一个关键的影响因素,Wnt信号抑制因子(Dickkopf-1,DKK1)是Wnt信号通路的其中一个重要的天然的抑制物,对于Wnt所介导的骨重塑具有十分关键和重要的调节作用,对Wnt信号抑制因子(Dickkopf-1,DKK1)进行有效抑制,可以强化Wnt的信号途径等[19,20]。
OPG可中和可溶性RANKL,阻断RANKL与RANK的结合,抑制破骨细胞前体的分化及成熟,诱导破骨细胞凋亡[21]。MIF并非AS破骨细胞分化之所必需,其在AS骨质破坏中可能并不起主要作用[22]。本研究显示,试验组活动性强直性脊柱炎患者的MIF、IL-23、RANKL、OPG、DKK1分别为(25.40±10.87)ng/ml、(374.88±37.21)pg/L、(21.50±16.59)pg/L、(5.02±1.58)pg/L、(0.72±0.15)ng/ml,明显高于对照组健康者的(4.03±0.77)ng/ml、(179.79±20.14)pg/L、(7.56±1.15)pg/L、(1.87±0.29)pg/L、(0.12±0.03)ng/ml(P<0.05),可见,活动性强直性脊柱炎患者的MIF、IL-23、RANKL、OPG、DKK1均显著高于健康者,说明MIF、IL-23、RANKL、OPG、DKK1与AS的发病有密切关联,活动性AS患者存在骨代谢异常,RANKL、OPG水平显著上升;IL-23、MIF 可能通过介导炎症反应间接参与AS骨代谢。而随着病程的延长,新骨形成机制在关节结构改变过程中发挥主要作用。
ESR、CRP是活动性强直性脊柱炎患者的相关疾病活动因子。本研究中,试验组活动性强直性脊柱炎患者的疾病活动因子ESR、CRP分别为(40.24±26.24)mm/h、(4.76±3.38)mg/L,明显高于对照组健康者的(8.25±0.51)mm/h、(2.57±0.32)mg/L(P<0.05),可以看出,活动性强直性脊柱炎患者的疾病活动因子要明显的高于健康者,AS病情过程中存在着明显的全身炎性反应。
本研究表明,活动性强直性脊柱炎患者的MIF、IL-23、OPG与疾病活动因子ESR、CRP呈正相关关系(P<0.05),而活动性强直性脊柱炎患者的RANKL、DKK1与疾病活动因子ESR、CRP却没有明显的相关关系(P>0.05),说明活动性强直性脊柱炎患者的MIF、IL-23、OPG与相关疾病活动因子具有相关性,研究这几项指标对于疾病的严重程度及治疗有指导意义。
国外研究显示,炎性关节病在无炎症或出现炎症和炎症消退转换的过程中呈现关节损伤的持续进展,关节炎症与骨破坏/骨重塑相分离,在脊柱关节炎,也存在炎症与RANKL/OPG介导骨损伤之间的“分离现象”,这种现象提示,在AS治疗中不仅要重视控制炎症,还应针对骨破坏相关因素进行干预,以增强治疗效果[23]。
综上所述,MIF、IL-23、RANKL、OPG、DKK1水平AS有密切关联,在今后的研究中应对不同病程AS患者的骨免疫学特征进行更深入研究,以进一步揭示炎症和骨代谢的动态变化。与本研究不足之处是没有比较强直性脊柱炎患者的活动期和稳定期的相关指标的表达状况,后面则将其作为重点的研究目标。
1 张兰玲,张菊,庞亚飞,等.重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白联合柳氮磺吡啶诱导缓解并维持治疗活动性强直性脊柱炎的临床研究.中华风湿病学杂志,2014,18:110-113.
2 黄烽.阿达木单抗治疗中国成年人活动性强直性脊柱炎的有效性和安全性.中华内科杂志,2013,52:982-983.
3 叶玉津,王翠翠,邱茜,等.依那西普逐渐减量对活动性强直性脊柱炎疗效的维持.实用医学杂志,2016,32:2642-2645.
4 Vander Linden S,Valkenburg HA,Cats A.Evaluation of diagnosis criteria for ankytosing spondylitis:a proposal for modification of New York criteria.Arthritis Rheum,1984,27:361.
5 王淑兰,陈宗林,周静,等.中药塌渍联合肿瘤坏死因子拮抗剂治疗活动性强直性脊柱炎的临床观察与护理.中国实用护理杂志,2016,32:1089-1093.
6 Shu T,Rong L,Feng F,et al.Indirect comparison of anti-TNF-α agents for active ankylosing spondylitis:Mixed treatment comparison of randomised controlled trials.Clinical and experimental rheumatology,2013,31:717-722.
7 李佳,陈晓翔,姜林娣,等.重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗强直性脊柱炎的多中心随机双盲对照临床研究.中华风湿病学杂志,2015,19:750-755.
8 张爱明,李青,蔡林,等.强直性脊柱炎临床病理分期与疼痛缓解程度的临床应用研究.生物骨科材料与临床研究,2016,13:59-62.
9 韦蓉梅,董丽平,吴红慧,等.血清褪黑素水平与强直性脊柱炎疾病活动性之间的相关性研究.国际检验医学杂志,2013,34:1516-1517,1520.
10 王笙,曾臻,段振华,等.强直性脊柱炎患者生存质量及影响因素分析.中华疾病控制杂志,2013,17:384-387.
11 Ji Y,Yang X,Yang L,et al.Studies on Correlation Between Single-Nucleotide Polymorphisms of Tumor Necrosis Factor Gene and Different Stages of Ankylosing Spondylitis.Cell biochemistry and biophysics,2013,67:915-922.
12 王作龙,钟乃风,马莉,等.强直性脊柱炎患者不同活动期Treg、 Th17细胞的临床意义及其相关性.贵阳医学院学报,2015,40:68-71,75.
13 Sanal HT,Yilmaz S,Simsek I,et al.Apparent diffusion coefficients of sacroiliitis in patients with established ankylosing spondylitis.Clinical imaging,2013,37:734-739.
14 Micu MC,Micu R,Surd S,et al.TNF-α inhibitors do not impair sperm quality in males with ankylosing spondylitis after short-term or long-term treatment.Rheumatology,2014,53:1250-1255.
15 刘怡.依那西普治疗强直性脊柱炎的疗效观察.河北医药,2013,26:121-122.
16 Moraes JCB,Ribeiro ACM,Saad CGS,et al.NT-proBNP levels may be influenced by inflammation in active ankylosing spondylitis receiving TNF blockers:A pilot study.Clinical rheumatology,2013,32:879-883.
17 张洁,黄烽,张江林,等.超敏C反应蛋白对评价依那西普治疗活动期强直性脊柱炎疗效的意义.中华医学杂志,2014,94:204-207.
18 Rodrigues KF,Fariae A,Muccioli C,et al.Incidence of toxoplasma retinochoroiditis in patients with ankylosing spondylitis after using TNF- alpha blockers.Parasitology International,2013,62:272-275.
19 李振彬,马琳,刘彦卿,等.活动性强直性脊柱炎患者外周血骨免疫学指标检测的临床意义.解放军医药杂志,2016,28:42-45.
20 张征,孙其桓,白晶,等.活动性强直性脊柱炎患者MIF、IL-23、RANKL、OPG、DKK1水平在与疾病活动性相关性.心理医生,2017,23:342-346.
21 赵文华,黄少辉,陈君敏.强直性脊柱炎外周血破骨细胞前体细胞活性的研究.中华风湿病学杂志,2010,14:373-376.
22 罗红玉.血清OPG和sRANKL评价强直性脊柱炎病情活动的价值.南京医科大学学报(自然科学版),2011,11:1455-1458.
23 李涛.类风湿性关节炎患者IL-6、IL-17、OPG、RANKL水平检测及临床意义.数理医药学杂志,2014,27:277-279.
ClinicalsignificanceofthelevelsofMIF,IL-23,RANKL,OPG,andDKK1inpatientswithactiveankylosingspondylitis
BAIJing*,SUNQiheng,ZHANGZheng,etal.
*Children’sHospitalofBaodingCity,Hebei,Baoding071000,China
ObjectiveTo investigate and analyze the clinical significance of the levels of MIF,IL-23,RANKL,OPG and DKK1 in patients with active ankylosing spondylitis.MethodsForty-six patients with active ankylosing spondylitis who were treated in our hospital from February 2013 to January 2016 were enrolled as experimental group, at the same time, the other 38 healthy subjects who received health examination in our hospital were enrolled as control group.The levels of MIF,IL-23,RANKL,OPG and DKK1 were detected in both groups,and their role in active ankylosing spondylitis was analyzed.ResultsThe levels of MIF,IL-23,RANKL,OPG, DKK1 in experimental group were (25.40±10.87)ng/ml,(374.88±37.21)pg/L,(21.50±16.59)pg/L,(5.02±1.58)pg/L,(0.72±0.15)ng/ml,respectively,which in control group were (4.03±0.77)ng/ml,(179.79±20.14)pg/L,(7.56±1.15)pg/L,(1.87±0.29)pg/L,(0.12±0.03)ng/ml, respectively,there were significant differences between two groups (P<0.05). The levels of ESR, CRP in experimental group were (40.24±26.24)mm/h,(4.76±3.38)mg/L,respectively,which in control group were (8.25±0.51)mm/h,(2.57±0.32)mg/L,respectively,there were significant differences between two groups (P<0.05).Moreover the MIF,IL-23,OPG were positively correlated to ESR,CRP in experimental group (P<0.05),however, the RANKL and DKK1 were not related with ESR and CRP in experimental group (P>0.05).ConclusionThe levels of MIF,IL-23,RANKL,OPG,and DKK1 are obviously increased in patients with active ankylosing spondylitis,moreover,which are correlated to disease activity factors.
MIF; IL-23; RANKL; OPG; DKK1; active ankylosing spondylitis
10.3969/j.issn.1002-7386.2017.20.007
R 593.23
A
1002-7386(2017)20-3071-04
2017-05-28)
071000 河北省保定市儿童医院(白晶);河北省石家庄心脑血管病医院(孙其桓);河北大学附属医院(张征);河北省雄县医院(张艳丽、徐顺新)

