DMBT1过表达对鼻咽癌细胞生物学行为的影响
刘新彦 李建斌 李志强 王丽坤 路继成 李晓丽 刘晓燕
·论著·
DMBT1过表达对鼻咽癌细胞生物学行为的影响
刘新彦 李建斌 李志强 王丽坤 路继成 李晓丽 刘晓燕
目的观察DMBT1过表达对鼻咽癌细胞生物学行为的影响。方法利用脂质体LipofectamineTM 2000转染鼻咽癌5-8F细胞,Real time-PCR、Western-blot验证转染效率。MTT、流式细胞术检测DMBT1过表达对5-8F细胞增殖、凋亡和细胞周期的影响。Western-blot检测DMBT1过表达对多药耐药基因(P-gp)、肿瘤抑制基因p53蛋白表达的影响。MTT法检测DMBT1过表达对化疗药物敏感性的影响。结果转染pcDNA3.1/DMBT1的5-8F细胞中DMBT1表达显著上调(P<0.05),提示成功构建稳定表达DMBT1基因的鼻咽癌5-8F细胞。DMBT1过表达的鼻咽癌5-8F细胞增殖能力减慢、凋亡率、G0/G1期细胞比例及p53蛋白表达增高,S期、G2/M期细胞比例及P-gp蛋白表达降低,同时细胞对顺铂敏感性增加(P<0.05)。结论DMBT1过表达能够显著抑制鼻咽癌5-8F细胞增殖,诱导其凋亡,并提高癌细胞对化疗药物敏感性。
DMBT1;鼻咽癌;基因功能;生物学行为
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国常见的头颈部恶性肿瘤,约占全部头颈部肿瘤的78%,具有起病隐匿、恶性度高、易转移和复发等特点[1-3]。目前,手术联合放化疗是治疗鼻咽癌的主要手段[4]。其中铂类化疗方案是治疗晚期鼻咽癌的标准治疗手段,能够显著提高患者总生存率和无进展生存率[5,6]。但是,临床资料表明以铂类为基础的化疗方案对部分晚期鼻咽癌患者并未取得良好疗效[7,8]。脑恶性肿瘤缺失基因1(DMBT1)是近年来新发现的一种抑癌基因,定位于人染色体10q26.13,已有研究发现DMBT1表达下调与乳腺癌、膀胱癌、食管癌等多种恶性肿瘤的形成及发展密切相关[9-11]。然而,DMBT1与鼻咽癌细胞生物学行为的关系目前研究尚少,尤其是DMBT1表达下调对鼻咽癌细胞耐药性的影响尚未见报道。本研究采用pcDNA3.1/DMBT1转染鼻咽癌5-8F细胞,观察DMBT1过表达对5-8F细胞增殖、凋亡及顺铂敏感性的影响,以期为以DMBT1为靶点探索鼻咽癌诊断和治疗的新方法提供理论依据。
1 材料与方法
1.1 试剂 人鼻咽癌5-8F细胞购自中科院典型培养物宝藏委员会细胞库;鼠抗人DMBT1多克隆抗体购自美国Santa Cruz公司;Trizol、LipofectamineTM 2000转染试剂盒、RPMI 1640培养基购自美国Invitrogen公司;Real time-PCR试剂盒购自美国Promega公司;MTT试剂盒购自上海碧云天生物技术研究所。
1.2 实验方法
1.2.1 细胞培养及转染:将人鼻咽癌细胞系5-8F置于含胎牛血清和RPMI1640培养基中,于37℃、5% CO2条件下常规培养。当细胞融合达80%~90%时,胰酶消化细胞,以2×105/孔的密度接种于12孔板,利用脂质体LipofectamineTM 2000转染 5-8F细胞。细胞分3组:未处理组(正常5-8F细胞)、阴性对照组(转染空载体pcDNA3.1)、转染组(转染pcDNA3.1/DMBT1)。
1.2.2 Real time-PCR:按照Trizol试剂盒说明书提取对数生长期鼻咽癌5-8F细胞总RNA,在ABI 7300荧光定量PCR仪上进行扩增,引物由上海生工生物工程有限公司合成。以β-actin为内参照基因,2-△△Ct法计算DMBT1基因相对表达水平。见表1。
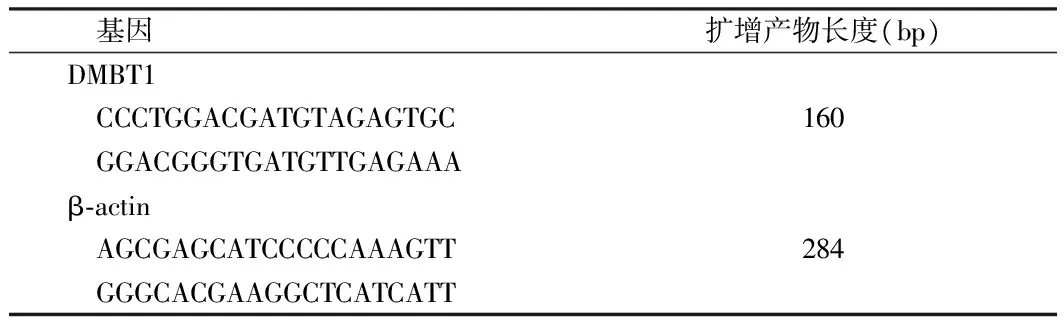
表1 引物序列及扩增产物长度
1.2.3 Western-blot:采用RIPA裂解液提取对数生长期细胞总蛋白,BCA法定量蛋白。取20 μg蛋白经SDS-PAGE分离后电转移至PVDF膜,5%脱脂奶粉封闭1 h,加入鼠抗人DMBT1多克隆抗体,4℃孵育过夜。PBS洗膜3次,加入辣根过氧化物酶标记的兔抗鼠二抗,室温孵育1 h。PBS洗膜3次,以β-actin为内参照基因,ECL化学发光法检测DMBT1蛋白相对表达水平。
1.2.4 MTT实验:取对数生长期细胞接种于96孔板,调整细胞密度为5×103/孔,分别于第1、2、3、4、5天收集细胞,加入20 μl MTT溶液,4 h后弃去培养基加入150 μl DMSO,酶标仪490 nm波长处测定吸光度值(OD490)。
1.2.5 流式细胞术:取对数生长期细胞胰酶消化后离心15 min,弃上清,预冷PBS洗涤细胞2次,依次加入400 μl Binding buffer和5 μl Annexin V-FITC,混匀,4℃避光孵育15 min。 加入10 μl PI,混匀,4℃避光孵
育5 min。1 h内用流式细胞仪检测细胞周期和凋亡率。
1.2.6 化疗药物敏感实验:取对数生长期细胞胰酶消化后以5×103/孔的密度接种于96孔板,每组设5个复孔。分别加入1、2、4、8、10、20 μmol/L顺铂,培养48 h后于酶标仪490 nm波长处测定吸光度值(OD490)。细胞生长抑制率(IR)={ 1-[(药物组-未处理组)/(阴性对照组-未处理组)]}×100%。根据药物浓度-抑制率曲线计算各组细胞对顺铂的半数抑制浓度(IC50)。
2 结果
2.1 DMBT1过表达的鼻咽癌5-8F细胞的鉴定 Real time-PCR和Western-blot结果显示,鼻咽癌5-8F细胞中DMBT1 mRNA和蛋白表达明显高于未处理组和阴性对照组,差异有统计学意义(P<0.05),未处理组和阴性对照组比较差异无统计学意义(P>0.05)。见表2,图1。


组别DMBT1mRNADMBT1蛋白未处理组 1.29±0.181.12±0.16阴性对照组1.31±0.161.14±0.14转染组 6.00±0.94∗5.83±0.90∗
注:与未处理组和阴性对照组比较,*P<0.05

图1 鼻咽癌5-8F细胞DMBT1过表达的Western-blot分析
2.2 DMBT1过表达对鼻咽癌5-8F细胞增殖的影响 MTT实验结果显示,转染组5-8F细胞生长速度明显低于未处理组和阴性对照组,差异有统计学意义(P<0.05),未处理组和阴性对照组比较差异无统计学意义(P>0.05)。见表3,图2。


组别OD4901d2d3d4d5d未处理组 0.02±0.010.10±0.020.29±0.030.41±0.050.58±0.08阴性对照组0.01±0.010.11±0.020.28±0.040.40±0.040.59±0.07转染组 0.02±0.010.06±0.01∗0.16±0.02∗0.27±0.04∗0.39±0.04∗
注:与未处理组和阴性对照组比较,*P<0.05

图2 DMBT1过表达对鼻咽癌5-8F细胞增殖影响的MTT分析
注:与未处理组和阴性对照组比较,*P<0.05
2.3 DMBT1过表达对鼻咽癌5-8F细胞凋亡的影响 流式细胞术结果显示,转染组5-8F细胞凋亡率明显高于未处理组和阴性对照组,差异有统计学意义(P<0.05),未处理组和阴性对照组比较差异无统计学意义(P>0.05)。见表4。


组别早期凋亡(%)晚期凋亡(%)未处理组 2.17±0.334.42±0.51阴性对照组2.19±0.324.39±0.48转染组 5.95±0.67∗38.06±5.23∗
注:与未处理组和阴性对照组比较,*P<0.05
2.4 DMBT1过表达对鼻咽癌5-8F细胞周期的影响流式细胞术结果显示,转染组5-8F细胞G0/G1期细胞比例明显高于未处理组和阴性对照组,S期和G2/M期细胞比例明显低于未处理组和阴性对照组差异有统计学意义(P<0.05),未处理组和阴性对照组比较差异无统计学意义(P>0.05)。见表5。


组别G0/G1SG2/M未处理组 50.47±4.8324.67±2.1518.22±1.69阴性对照组52.03±4.9023.98±2.2017.86±1.42转染组 78.41±5.22∗9.79±0.96∗6.63±0.57∗
注:与未处理组和阴性对照组比较,*P<0.05
2.5 DMBT1过表达对鼻咽癌5-8F细胞顺铂敏感性的影响 MTT实验结果显示,随着顺铂浓度增加,其对5-8F细胞生长抑制率逐渐增加,具有浓度依赖性;而转染组顺铂对5-8F细胞生长的抑制率明显高于未处理组和阴性对照组,IC50值明显低于未处理组和阴性对照组,差异有统计学意义(P<0.05),未处理组和阴性对照组比较差异无统计学意义(P>0.05)。见表6、7。


组别顺铂(1μmol/L)顺铂(2μmol/L)顺铂(4μmol/L)顺铂(8μmol/L)顺铂(10μmol/L)顺铂(20μmol/L)未处理组 8.32±0.4715.05±2.5228.41±4.0340.52±5.2150.78±6.8060.28±7.08阴性对照组8.40±0.4816.15±2.6329.25±4.3541.34±5.5250.99±6.4959.78±7.23转染组 13.69±1.36∗24.77±3.62∗39.33±5.30∗52.76±6.32∗63.88±7.31∗74.76±8.16∗
注:与未处理组和阴性对照组比较,*P<0.05


组别IC50(μmol/L)未处理组 7.95±1.12阴性对照组7.92±1.08转染组 3.28±0.38∗
注:与未处理组和阴性对照组比较,*P<0.05
2.6 DMBT1过表达对鼻咽癌5-8F细胞P-gp、p53基因表达的影响 Western-blot结果显示,转染组P-gp蛋白表达明显低于未处理组和阴性对照组,p53蛋白表达明显高于未处理组和阴性对照组,差异有统计学意义(P<0.05),未处理组和阴性对照组比较差异无统计学意义(P>0.05)。见表8,图3。


组别P⁃gp蛋白p53蛋白未处理组 1.77±0.230.58±0.06阴性对照组1.74±0.250.60±0.07转染组 0.48±0.05∗2.27±0.31∗
注:与未处理组和阴性对照组比较,*P<0.05
3 讨论
据统计,我国鼻咽癌发病率位居世界首位,该病主要好发于我国南方和东南亚地区,男性发病率高于女性,患者死亡率高,预后极差[12,13]。目前,以铂类为基础的同步化疗方案是治疗鼻咽癌的重要手段,能够明显延长晚期鼻咽癌患者总生存期[14]。然而,仍有部分患者化疗效果欠佳,其中化疗耐药是导致临床治疗鼻咽癌失败的原因之一,也是难以取得突破性进展的主要障碍[15,16]。因此,探索化疗耐药的分子标志物对于恢复肿瘤细胞对化疗药物敏感性至关重要。

图3 DMBT1过表达对鼻咽癌5-8F细胞P-gp、p53表达影响的Western-blot分析
1 未处理组;2 阴性对照组;3 转染组
人类DMBT1基因是Mollenhau等[17]于2010年从正常组织与髓母细胞瘤细胞系中克隆出来的癌症相关基因。DMBT1编码产物为一种大分子量的糖蛋白,研究发现其可能通过介导蛋白质间相互作用发挥保护黏膜、促进上皮分化等多种生理作用。越来越多的研究表明DMBT1在癌旁组织和炎症组织中高表达,而在多种恶性肿瘤组织表达缺失,因此DMBT1有可能是一种潜在的抑癌基因。张光斌等[11]在体外成功构建了稳定表达DMBT1的食管癌细胞系EC9706,结果显示DMBT1过表达能够明显抑制EC9706细胞的增殖迁移,并使细胞周期停滞于G0/G1期。贺涛等[18]将稳定表达DMBT1基因的质粒转染胆囊癌细胞系GBC-SD,同样发现DMBT1过表达能够明显诱导GBC-SD细胞凋亡,并抑制GBC-SD细胞趋化迁移。然而,有关DMBT1在鼻咽癌中的作用目前研究尚少,尤其是有关DMBT1表达与鼻咽癌化疗耐药的关系尚未见报道。
本研究选用经典鼻咽癌细胞系5-8F为研究对象,通过pcDNA3.1/DMBT1转染鼻咽癌5-8F细胞,经Real time-PCR、Western-blot验证DMBT1高表达,并通过MTT、流式细胞术检测DMBT1过表达对5-8F细胞增殖、凋亡和细胞周期的影响。结果发现:DMBT1过表达能够明显抑制鼻咽癌5-8F细胞增殖,提高细胞凋亡率和G0/G1期细胞比例,降低S期和G2/M期细胞比例,因此我们推测DMBT1有可能增强鼻咽癌5-8F细胞对化疗药物的敏感性。本实验结果发现,DMBT1过表达能够促进顺铂对鼻咽癌5-8F细胞生长的抑制作用,由此证实DMBT1过表达与顺铂能够发挥协同抑癌作用。研究显示,肿瘤细胞代谢、凋亡及对化疗药物的摄取或外排功能障碍是导致化疗耐药的主要原因[19,20]。为了分析DMBT1过表达改善鼻咽癌5-8F细胞顺铂耐药的原因,我们观察了DMBT1过表达对鼻咽癌5-8F细胞P-gp、p53基因表达的影响。P-gp是一种具有跨膜转运功能的多药耐药基因,主要通过促进化疗药物排出,降低细胞内化疗药物浓度导致细胞耐药[21,22]。p53是一种具有抑癌作用的转录因子,能够调控细胞周期并诱导肿瘤细胞凋亡。本研究结果表明,DMBT1过表达明显抑制鼻咽癌5-8F细胞P-gp基因表达,同时促进p53基因表达(P<0.05)。以上结果表明,DMBT1过表达一方面通过下调P-gp基因表达减少了化疗药物外排,另一方面通过上调p53基因表达诱导鼻咽癌5-8F细胞凋亡。
本研究初步探讨了DMBT1过表达对鼻咽癌5-8F细胞增殖、凋亡、细胞周期及顺铂耐药的影响。结果表明,DMBT1过表达能够显著抑制鼻咽癌5-8F细胞增殖并诱导其凋亡,提示DMBT1在鼻咽癌发生发展过程中可能发挥抑癌基因作用。此外,DMBT1过表达通过调控P-gp、p53基因表达增强鼻咽癌5-8F细胞对顺铂化疗的敏感性,从而改善5-8F细胞对化疗药物耐药。因此DMBT1与顺铂具有协同抗癌作用,DMBT1有可能成为治疗鼻咽癌的潜在分子靶点。
1 Raab-Traubn.Nasopharyngeal carcinoma:An Evolving Role for the Epstein-Barr virus.Curr Top Microbiol Immunol,2015,390:339-363.
2 Chen W,Hu GH.Biomarkers for enhancing the radiosensitivity of nasopharyngeal carcinoma.Cancer Biol Med,2015,12:23-32.
3 Chen ZT,Liang ZG,Zhu XD.A review:Proteomics in nasopharyngeal carcinoma.Int J Mol Sci,2015,16:15497-1530.
4 中国抗癌协会食管癌专业委员会主编.食管癌规范化诊治指南.第2版:北京:中国协和医科大学出版社,2013.
5 Caponigro F,Longo F,Ionna F,et al.Treatment approaches to nasopharyngeal carcinoma:a review.Anticancer Drugs,2010,21:471-477.
6 Guigay J.Advances in nasopharyngeal carcinoma.Curr Opin Oncol,2008,20:264-269.
7 Su SF,Han F,Zhao C,et al.Treatment outcomes for different subgroups of nasopharyngeal carcinoma patients treated with intensity-modulated radiation therapy.Chinese journal of cancer,2011,30:565-573.
8 Wang J,Shi M,Hsia Y,et al.Failure patterns and survival in patients with nasopharyngeal carcinoma treated with intensity modulated radiation in Northwest China:a pilot study.Radiat Oncol,2012,7:2.
9 王瑞海,崔大为,翟宏芳.DMBT1 在乳腺癌组织中的表达及临床意义.肿瘤学杂志,2014,20:102-105.
10 刘治,吴奎,孙涛,等.膀胱癌组织中DMBT1基因的表达及临床意义.临床与实验病理学杂志,2013,29:146-149.
11 张光斌,贺涛,张宁.DMBT1过表达对食管癌细胞系EC9706生物学行为的影响.世界华人消化杂志,2009,17:1759-1763.
12 Hong JS,Tian J,Han QF,et al.Quality of life of nasopharyngeal cancer survivors in China.Curr Oncol,2015,22:e142-147.
13 何跃平,罗晶晶,刘钊,等.靶向livin 的siRNA对鼻咽癌细胞增殖和凋亡的影响.中国免疫学杂志,2014,30:1028-1031.
14 Caponigro F,Longo F,Ionna F,et al.Treatment approaches to nasopharyngeal carcinoma:a review.Anticancer Drugs,2010,21:471-477.
15 Yoshizaki T,Ito M,Murono S,et al.Current understanding and management of nasopharyngeal carcinoma.Auris Nasus Larynx,2012,39:137-144.
16 罗科,顾秀辉,彭辽天.Dishevelled 2在鼻咽癌顺铂耐药中的作用研究.成都医学院学报,2016,11:141-145.
17 Mollenhau RJ,Wiemann S,Scheurlen W,et al.DMBT1,a new member of the SRCR superfamily,on chromosome 10q25.326.1 is deleted in malignant brain tumors.Nat Genet,1997,17:3239.
18 贺涛,刘厚宝,艾志龙,等.体外稳定表达DM BT1对胆囊癌细胞系GBC-SD 趋化迁移的影响.中华普通外科杂志,2010,25:122-125.
19 傅玉峰,陈培,李雪甫.抑癌基因PTEN提高耐药食管癌化疗敏感性的作用及其机制研究.中国临床研究,2016,29:214-217.
20 Rabik CA,Dolan ME.Molecular mechanisms of resistance and toxicity associated with platinating agents.Cancer Treat Rev,2007,33:9-23.
21 朱宝英,黄静,王永林,等.P-糖蛋白及肿瘤多药耐药的逆转.中国药房, 2011,22:550-552.
22 Amin ML.P-glycoprotein inhibition for optimal drug delivery.Drug Target Insights,2013,19:27-34.
EffectsofoverexpressionofDMBT1onbiologicalbehaviorofnasopharyngealcarcinomacellsinvitro
LIUXinyan,LIJianbin,LIZhiqiang,etal.
*DepartmentofEar,Nose,Throat,NeckSurgery,TheSecondHospitalAffiliatedtoHebeiNorthCollege,Hebei,Zhangjiakou075100,China
ObjectiveTo observe the effects of overexpression of DMBT1 on biological behavior of nasopharyngeal carcinoma cells (NPC) in vitro.MethodsThe NPC cell line-5-8F cells were transfected by lipofectamine TM 2000,then the expression levels of DMBT1 were detected by Real time-PCR and Western Blot. The effects of DMBT1 overexpression on proliferation,apoptosis and cell cycle were detected by MTT and flow cytometry.Moreover the effects of DMBT1 overexpression on the expressions of P-gp and p53 were detected by Western Blot.Moreover the effects of DMBT1 overexpression on susceptibility of chemotherapeutics were detected by MTT.ResultsThe expression levels of DMBT1 in 5-8F cells transfected by pcDNA3.1/DMBT1 were significantly up-regulated (P<0.05),which suggested that the 5-8F cells that could express stably DMBT1 gene were successfully established.The overexpression of DMBT1 inhibited the proliferation and promoted the apoptosis of 5-8F cells obviously,and the proportion of cells at G0/G1 stage and the expression of p53 protein were increased significantly,however, the proportion of cells at stage S and G2/M and the expression of P-gp protein were decreased significantly,meanwhile the sensitivity of tumor cells to cisplatin was obviously increased by overexpression of DMBT1 (P<0.05).ConclusionThe overexpression of DMBT1 can significantly inhibit the cell proliferation of NPC,induce its apoptosis and can enhance the sensitivity of cancer cells to chemotherapeutics.
DMBT1; nasopharyngeal carcinoma; gene function; biological behaviour
10.3969/j.issn.1002-7386.2017.20.002
R 739.6
A
1002-7386(2017)20-3051-04
2017-06-18)
项目来源:河北省医学科学研究重点课题(编号:20170181)
075100 河北省张家口市,河北北方学院附属第二医院耳鼻咽喉头颈外科(刘新彦、王丽坤、李晓丽、刘晓燕),病理科(李志强);中国石油天然气集团公司中心医院耳鼻咽喉科(李建斌);河北省张家口市宣化区人民医院检验科(路继成)

