白念珠菌多药耐药基因CaMDR1研究进展
邓稀仁,黄孝天
DOI:10.3969/j.issn.1002-2694.2017.09.015
白念珠菌多药耐药基因CaMDR1研究进展
邓稀仁,黄孝天
CaMDR1是与白念珠菌(Candidaalbicans)多药耐药有关的基因,属于易化载体超家族(major facilitator superfamily,MFS),能介导白念珠菌对苯菌灵、氟康唑等药物的耐受。本文就白念珠菌多药耐药基因CaMDR1所编码蛋白质的结构和功能及该基因转录调控机制研究进展做一综述。
白念珠菌;多药耐药;易化载体超家族;CaMDR1
白念珠菌是一种常见的条件致病性真菌,常存在于正常人皮肤和粘膜,当机体免疫功能下降或菌群失调时,容易造成浅表性或侵入性感染。研究发现,多种机制参与白念珠菌对抗真菌药物耐药性的产生,其中外排泵的过表达是主要的耐药机制之一[1-2]。目前已知与白念珠菌耐药有关的外排泵有两类:一类是含ATP结合区的转运蛋白,即ABC转运蛋白(ATP-binding cassette transporters,ABCT),另一类是易化载体超家族蛋白(major facilitator superfamily,MFS)。MFS家族成员包含一个跨膜孔道,以质子动力势作为能量来源,蛋白能以协同转运、反向转运或单向转运的方式发挥运转作用,CaMDR1(Candidaalbicansmultidrug resistance 1)是白念珠菌与多药耐药有关的MFS家族基因。
1 CaMDR1与白念珠菌耐药性
CaMDR1在白念珠菌6号染色体上有1个拷贝,其编码的蛋白质CaMdr1p由564个氨基酸组成[2-3]。1991年,Fling[3]等从白念珠菌全基因组文库入手,发现ORF1(后来命名为BENr)与苯菌灵、氨甲叶酸耐受有关。Goldway[4]等后续研究发现该基因能使菌株抵抗一些在结构上和功能上不同的药物,基因缺失后菌株对药物敏感性降低,于是将该基因更名为CaMDR1。有研究发现,临床菌株对氟康唑(fluconazole,FLZ)的耐受主要与CaMDR1、CDR1、CDR2和ERG11等基因有关,FLZ敏感菌株几乎不表达MDR1,但当敏感菌株暴露在某种药物压力下时,CaMDR1能被诱导表达,且菌株药物敏感性的强弱取决于CaMDR1的表达水平[2, 5-8]。这些研究提示,CaMDR1与白念珠菌多药耐药有关,且可能有复杂的调控模式。
2 CaMdr1p的结构与功能
2.1 CaMdr1p的结构 CaMdr1p属于MFS中药物/H+逆向转运1(drug/H+ antiporter 1,DHA1)家族,相对分子质量大小约62.9 kDa,以质子动力势作为能量来源,参与药物外排。CaMdr1p含有2个跨膜区(transmembrane domain, TMD),每个跨膜区由6个跨膜片段(transmembrane segment,TMS)构成,并通过胞外的环(extracellular loop,ECL)和胞内的环(intracellular loop,ICL)连接(见图1),ICL3是关键结构,连接2个TMD并维持其固有结构[9]。
Redhu等[10]研究了CaMdr1p的12个跨膜片段,发现带电残基的质子化在质子转运中是关键的步骤,位于TMS4带正电荷的残基R215对于CaMdr1p的药物/H+转运来说是关键位点,而酸性PH有助于R215质子化作用,并且与中性条件相比,酸性条件有利于药物外排。
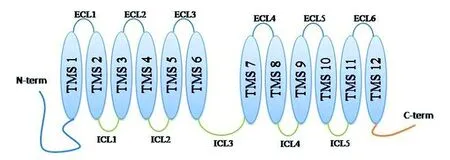
图1 CaMdr1p结构模式图Fig.1 Structure of the CaMdr1 protein
2.2 CaMdr1p的功能 CaMdr1p对多种药物具有外排功能:唑类药物如FLZ,其他药物如苯菌灵、浅蓝菌素、布雷菲德菌素A、氨甲叶酸和二酰胺等[2-3, 5]。不过,CaMdr1p除了外排一些药物,还会选择性地促进一些特殊化合物的摄入,可利用这个特性使化合物在菌体内蓄积从而起到抗真菌的作用[11]。
CaMdr1p与白念珠菌其他功能也有关。Watamoto等[12]研究了在药物压力下白念珠菌生物膜中CaMDR1表达情况,发现CaMDR1表达增强,但这可能是对两性霉素B引起的氧化损伤的一种保护性应答,与两性霉素B耐药关系不大。此外,CaMdr1p可能与白念珠菌天冬氨酸蛋白酶的分泌有关[13]。
3 CaMDR1基因的转录调控
近几年,关于CaMDR1转录调控的研究进展迅速,CaMDR1的转录调控可能对菌株耐药性的产生起了重要作用,多个顺式作用元件和反式作用因子相继被阐明,如启动子近端区域的顺式作用元件和药物反应元件,反式作用因子Mrr1p、Upc2p、Cap1p等。
3.1 顺式作用元件 顺式作用元件是指可影响自身基因表达活性(激活或抑制)的DNA序列。Kumamoto[14]等发现了A型和G型2种CaMDR1启动子区域顺式作用元件,含A型启动子的CaMDR1基因表达活性更强,并且大多数菌株为A型。Sasse[15]等随后发现转录因子Mrr1p和Cap1p都能激活这2种启动子。发生在CaMDR1启动子区域的突变可能会影响反式作用因子与其的结合,从而影响CaMDR1的表达水平。
此外,CaMDR1启动子区域药物反应元件能响应一些化合物的刺激信号。Rognon[5]等发现了2个分别响应苯菌灵和过氧化氢刺激信号的药物反应元件:①苯菌灵反应元件(benomyl response element,BRE),在-296至-260位点之间,响应笨菌灵的刺激,使唑类药物敏感菌株CaMDR1基因表达上调,并且与耐药菌株CaMDR1固有高表达也有关;②过氧化氢反应元件(H2O2response element,HRE),在-561至-520位点之间,可能含有转录因子Cap1p结合位点(TTAG/CTAA),当Cap1p存在时才能响应过氧化氢的刺激信号。
3.2 反式作用因子 反式作用因子是指能直接或间接地识别或结合在顺式作用元件核心上参与调控靶基因转录效率的蛋白质。与CaMDR1转录调控有关的反式作用因子主要包括锌簇家族和碱性亮氨酸拉链转录因子等。
3.2.1 锌簇家族转录因子 锌簇家族转录因子是一类含有锌指模体结构的蛋白质,整个蛋白质分子可含有多个锌指重复单位,在白色念珠菌耐药相关基因的转录调控中起重要作用。锌簇家族有一个保守的DNA结合域,含有2个锌离子和6个半胱氨酸,多位于N-端。
锌簇家族中与CaMDR1转录调控相关的最主要的基因是MRR1(multidrug resisitance regular 1)[16]。MRR1参与了耐药菌株CaMDR1的固有过表达和敏感菌株CaMDR1的药物诱导表达。将药物敏感和耐受的白念珠菌MRR1进行序列比对分析发现,一些发生在耐药菌株MRR1基因的碱基置换是引起CaMDR1过表达的主要原因,这些突变称为获得性功能(Gain of Function,GOF)突变, Dunkel等[17]发现4个突变热点区域分别在氨基酸序列315-381、873-896、997-998和683位点,将GOF突变的MRR1序列引入MRR1缺失的突变株使其重新获得了耐药性。 这些GOF突变主要有K355N、1350L、T360I、T381I、R873T、G878E、A880E、W893R、T895I、G997V、L998F、P683H、P683S、R557K、K844E、F1032L和V887F等[16-19]。对MRR1编码的蛋白质Mrr1p结构分析发现,含有DNA结合域的N-端可能是调控MDR1表达的关键区域[20]。Mrr1p可与其他转录因子共同调控CaMDR1的表达,比如Cap1p和Mcm1p。有趣的是,当过氧化氢作为诱导物时,Cap1p和Mrr1p与CaMDR1的表达有关,而Mcm1p并非必需,但当Cap1p不发挥作用时,含有GOF突变的Mrr1p却需要Mcm1p的参与来诱导CaMDR1的表达[20-21],说明转录调节因子之间存在相互作用。
此外,另一锌簇家族成员Upc2p对CaMDR1也发挥转录调节作用,但Upc2p对菌株耐药性的增强作用有限,研究发现,含GOF突变的Upc2p只有在Mrr1p存在时才能轻微上调CaMDR1表达[22-23]。
3.2.2 碱性亮氨酸拉链转录因子 Cap1p是参与CaMDR1转录调控最主要的碱性亮氨酸拉链转录因子成员,属于AP-1家族。CAP1与酿酒酵母中YAP1基因同源,YAP1与酿酒酵母药物耐受和氧化应激相关,调节FLR1介导的对FLZ的耐药[24]。在对氟康唑耐受的白念珠菌临床菌株和诱导菌株中,CAP1基因和Cap1p蛋白都高度表达[25],但至于Cap1p是CaMDR1的激活因子还是抑制因子尚无定论。
人们预想在白念珠菌中Cap1p是CaMDR1激活因子,然而以CAI4为亲本菌构建基因缺失突变株,发现CAP1缺失没有影响菌株对FLZ、浅蓝菌素、布雷菲德菌素A和二酰胺的敏感性,只是对镉、硝基喹啉、邻二氮菲和过氧化氢的敏感性增加[24]。将C-端区域缺失的CAP1基因引入突变株后,菌株便对上述化合物(除过氧化氢外)高度耐受[24],Sasse[15]等人也有类似的报道,他们发现C-端缺失的Cap1p能激活CaMDR1的表达。更有趣但难以解释的是,以CaMDR1基因高表达的白念珠菌FR2为亲本菌构建CAP1基因中断突变株,发现突变株有更高的CaMDR1表达水平[24],Cap1p似乎是CaMDR1负调节因子。而近来的报道又有所不同,Ramírez-Zavala[26]等发现,Cap1p使Ada2(一种SAGA/ADA转录辅助激活剂)结合在CaMDR1启动子从而诱导CaMDR1的表达,这与Znaidi[27]等关于Cap1p对CaMDR1的表达似乎是强效活化因子的报道类似。总的说来,Cap1p通过转录调控参与了CaMDR1的表达,确定Cap1p如何参与CaMDR1的转录调控以及与其他转录调控因子的相互作用将是研究的重点。
3.2.3 其他 还有一些与CaMDR1表达有关的转录因子的研究,不过具体调控机制尚不是很透彻。Lo等[28]发现,Rep1p可负向调节CaMDR1的表达而影响菌株药物敏感性,在酿酒酵母中表达白念珠菌REP1基因增强了菌株对FLZ的敏感性,而将白念珠菌REP1基因进行无效突变后发现其药物敏感性降低且CaMDR1表达增强。类似的还有CPH1基因,其编码的蛋白质与信息素响应元件结合,参与菌体繁殖和菌丝生长,CPH1也对CaMDR1起负调控作用,将CPH1无效突变后MDR1的表达增强了,且菌株对药物的敏感性降低,而CPH1过量表达将增加菌体对药物的敏感性[29]。
白念珠菌CaMDR1的转录调控是个较为复杂的过程,是顺式作用元件和反式调节因子相互影响、共同作用的结果,具体机制至今尚未完全阐明,并且还可能通过调控具有不同功能的靶基因(比如药物外排、氧化应激相关基因)的表达而发挥不同的作用,明确其调控的靶基因有可能为抗真菌药物的研制提供新思路,为探索白念珠菌耐药机制开辟新的方向。
4 展 望
研究CaMDR1所编码蛋白质的结构、功能及该基因的转录调控机制,对于阐明MDR1介导的耐药机制有重要意义,同时对于抗真菌药物的开发也具有指导作用。各种转录调节因子之间是否有相互作用,是否共同调节了CaMDR1基因的表达,值得深入研究,揭示其内在联系,发现共有的调控途径,寻找关键步骤能为研发抗真菌药物提供新的靶点和思路,有望控制多重耐药。另外,通过抑制或者失活白念珠菌CaMdr1p外排作用而使抗真菌药物在菌体内有效蓄积或影响其他生命活动,从而发挥抗真菌作用,也是一种有意义的新策略。比如单萜类药物能逆转外排泵基因(如CaMDR1)的表达从而起到抗真菌的作用[30]。
[1] Liu J, Shi C, Wang Y, et al. Mechanisms of azole resistance inCandidaalbicansclinical isolates from Shanghai, China[J]. Res Microbiol, 2015, 166(3): 153-161. DOI: 10.1016/j.resmic.2015.02.009
[2] Wirsching S, Michel S, Morschh user J. Targeted gene disruption inCandidaalbicanswild-type strains: the role of the MDR1 gene in fluconazole resistance of clinicalCandidaalbicansisolates[J]. Mol Microbiol, 2000, 36(4): 856-865. DOI: 10.1046/j.1365-2958.2000.01899.x
[3] Fling MF, Kopf J, Tamarkin A, et al. Analysis of aCandidaabicansgene that encodes a novel mechanism for resistance to benomyl and methotrexate[J]. Mol Gen Genet, 1991(227): 318-329. DOI: 10.1007/BF00259685
[4] Goldway M, Teff D, Schmidt R, et al. Multidrug resistance inCandidaalbicans: disruption of the BENr gene[J]. Antimicrob Agents Chemother, 1995, 39(2): 422-426. DOI: 10.1128/AAC.39.2.422
[5] Rognon B, Kozovska Z, Coste AT, et al. Identification of promoter elements responsible for the regulation of MDR1 fromCandidaalbicans, a major facilitator transporter involved in azole resistance[J]. Microbiology, 2006, 152(12): 3701-3722. DOI: 10.1099/mic.0.29277-0
[6] Wirsching S, Michel S, Ko Hler G, et al. Activation of the multiple drug resistance gene MDR1 in fluconazole-resistant, clinicalCandidaalbicansstrains is caused by mutations in a trans-regulatory factor[J]. J Bacteriol, 2000, 182(2): 400-404. DOI: 10.1128/JB.182.2.400-404.2000
[7] Hiller D, Sanglard D, Morschha User J. Overexpression of the MDR1 gene is sufficient to confer increased resistance to toxic compounds inCandidaalbicans[J]. Antimicrob Agents Chemother, 2006, 50(4): 1365-1371. DOI: 10.1128/AAC.50.4.1365[8] Ying Y, Zhao Y, Hu X, et al. In vitro fluconazole susceptibility of 1,903 clinical isolates ofCandidaalbicansand the identification of ERG11 mutations[J]. Microbial Drug Resist, 2013, 19(4): 266-273. DOI: 10.1089/mdr.2012.0204
[9] Mandal A, Kumar A, Singh A, et al. A key structural domain of theCandidaalbicansMdr1 protein[J]. Biochemical J, 2012, 445(3): 313-322. DOI: 10.1042/BJ20120190
[10] Redhu AK, Khandelwal NK, Banerjee A, et al. pHluorin enables insights into the transport mechanism of antiporter Mdr1: R215 is critical for drug/H+ antiport[J]. Biochemical J, 2016, 473(19): 3127-3145. DOI: 10.1042/BCJ20160407
[11] Sun N, Li D, Fonzi W, et al. Multidrug-resistant transporter Mdr1p-mediated uptake of a novel antifungal compound[J]. Antimicrobial Agents Chemother, 2013, 57(12): 5931-5939. DOI: 10.1128/AAC.01504-13
[12] Watamoto T, Samaranayake LP, Egusa H, et al. Transcriptional regulation of drug-resistance genes inCandidaalbicansbiofilms in response to antifungals[J]. J Medical Microbiol, 2011, (60): 1241-1247. DOI: 10.1099/jmm.0.030692-0
[13] Feng W, Yang J, Pan Y, et al. The correlation of virulence, pathogenicity, and itraconazole resistance with SAP activity inCandidaalbicansstrains[J]. Canadian J Microbiol, 2016, 62(2): 173-178. DOI: 10.1139/cjm-2015-0457
[14] Bruzual I, Kumamoto CA. An MDR1 promoter allele with higher promoter activity is common in clinically isolated strains ofCandidaalbicans[J]. Mol Genet Genomics, 2011, 286(5/6):347-357. DOI: 10.1007/s00438-011-0650-z
[15] Sasse C, Schillig R, Reimund A, et al. Inducible and constitutive activation of two polymorphic promoter alleles of theCandidaalbicansmultidrug efflux pump MDR1[J]. Antimicrob Agents Chemother, 2012, 56(8): 4490-4494. DOI: 10.1128/AAC.00264-12
[16] Morschh user M, Barker KS, Liu TT, et al. The transcription factor Mrr1p controls expression of the MDR1 efflux pump and mediates multidrug resistance inCandidaalbicans[J]. PLoS Pathog, 2007, 3(11): e164. DOI: 10.1371/journal.ppat.0030164
[17] Dunkel N, Bla J, Rogers PD, et al. Mutations in the multi-drug resistance regulator MRR1, followed by loss of heterozygosity, are the main cause of MDR1 overexpression in fluconazole-resistantCandidaalbicansstrains[J]. Mol Microbiol, 2008, 69(4): 827-840. DOI: 10.1111/j.1365-2958.2008.06309.x
[18] Eddouzi J, Parker JE, Vale-Silva LA, et al. Molecular mechanisms of drug resistance in clinicalCandidaspecies isolated from Tunisian hospitals[J]. Antimicrob Agents Chemother, 2013, 57(7): 3182-3193. DOI: 10.1128/AAC.00555-13
[19] Morio F, Pagniez F, Besse M, et al. Deciphering azole resistance mechanisms with a focus on transcription factor-encoding genes TAC1, MRR1 and UPC2 in a set of fluconazole-resistant clinical isolates ofCandidaalbicans[J]. Intl J Antimicrob Agents, 2013, 42(5): 410-415. DOI: 10.1016/j.ijantimicag.2013.07.013
[20] Schubert S, Popp C, Rogers PD, et al. Functional dissection of aCandidaalbicanszinc cluster transcription factor, the multidrug resistance regulator Mrr1[J]. Eukaryotic Cell, 2011, 10(8): 1110-1121. DOI: 10.1128/EC.05100-11
[21] Mogavero S, Tavanti A, Senesi S, et al. Differential requirement of the transcription factor Mcm1 for activation of theCandidaalbicansmultidrug efflux pump MDR1 by its regulators Mrr1 and Cap1[J]. Antimicrob Agents Chemother, 2011, 55(5): 2061-2066. DOI: 10.1128/AAC.01467-10
[22] Dunkel N, Liu TT, Barker KS, et al. A Gain-of-Function mutation in the transcription factor Upc2p causes upregulation of ergosterol biosynthesis genes and increased fluconazole resistance in a clinicalCandidaalbicansisolate[J]. Eukaryotic Cell, 2008, 7(7): 1180-1190. DOI: 10.1128/EC.00103-08
[23] Schubert S, Barker KS, Znaidi S, et al. Regulation of efflux pump expression and drug resistance by the transcription factors Mrr1, Upc2, and Cap1 inCandidaalbicans[J]. Antimicrob Agents Chemother, 2011, 55(5): 2212-2223. DOI: 10.1128/AAC.01343-10
[24] Alarco A M, Raymond M. The bZip transcription factor Cap1p is involved in multidrug resistance and oxidative stress response inCandidaalbicans[J]. J Bacteriol, 1999, 181(3): 700-708.
[25] Tan PL, Wang ZJ, Zhao JF. Resistance ofCandidaalbicansisolates against fluconazole and the resistance correlation withCAP1 gene[J]. Chin J Zoonoses, 2015, 3(4): 325-329. DOI: 10.3969/cjz.j.issn.1002-2694.2015.04.007 (in Chinese)谈潘莉, 汪浙炯, 赵金方. 白假丝酵母菌临床菌株对氟康唑耐药性及其与CAP1基因相关性研究[J]. 中国人兽共患病学报, 2015, 3(4): 325-329.
[26] Ramirez-Zavala B, Mogavero S, Scholler E, et al. SAGA/ADA complex subunit Ada2 is required for Cap1- but not Mrr1-mediated upregulation of theCandidaalbicansmultidrug efflux pump MDR1[J]. Antimicrob Agents Chemother, 2014, 58(9): 5102-5110. DOI: 10.1128/AAC.03065-14
[27] Znaidi S, Barker KS, Weber S, et al. Identification of theCandidaalbicansCap1p regulon[J]. Eukaryotic Cell, 2009, 8(6): 806-820. DOI: 10.1128/EC.00002-09
[28] Chen C, Yang Y, Tseng K, et al. Rep1p negatively regulating MDR1 efflux pump involved in drug resistance inCandidaalbicans[J]. Fungal Genetics Biol, 2009, 46(9): 714-720. DOI: 10.1016/j.fgb.2009.06.003
[29] Lo H, Tseng K, Kao Y, et al. Cph1p negatively regulates MDR1 involved in drug resistance inCandidaalbicans[J]. Intl J Antimicrob Agents, 2015, 45(6): 617-621. DOI: 10.1016/j.ijantimicag.2015.01.017
[30] Ahmad A, Khan A, Manzoor N. Reversal of efflux mediated antifungal resistance underlies synergistic activity of two monoterpenes with fluconazole[J]. Europ J Pharmaceutic Sci, 2013, 48(1-2): 80-86. DOI: 10.1016/j.ejps.2012.09.016
ProgressingeneCaMDR1mediatingmultidrugresistanceofCandidaalbicans
DENG Xi-ren, HUANG Xiao-tian
(DepartmentofMedicalMicrobiology,MedicalCollege,NanchangUniversity,Nanchang330006,China)
GeneCaMDR1 is a member of the major facilitator superfamily (MFS), mediating multidrug resistance ofCandidaalbicans, and can confer resistance to benomyl, fluconazole and so forth. In this review, the progress in structure and function of the protein code by geneCaMDR1 and the transcriptional regulation mechanisms ofCaMDR1 are summarized.
Candidaalbicans; multidrug resistance; major facilitator superfamily;CaMDR1
Huang Xiao-tian, Email: xthuang@ncu.edu.cn
国家自然科学基金(No. 31660035, No. 81460300),江西省自然科学基金项目(No. 20142BAB215053,No.20171ACB20003),南昌大学研究生创新专项资金项目(No. cx2016360)联合资助
黄孝天,Email:xthuang@ncu.edu.cn
南昌大学医学部微生物学教研室,南昌 330006
R379.4
:A
:1002-2694(2017)09-0837-04
2017-02-20编辑:梁小洁
Supported by the National Natural Science Foundation of China (Nos. 31660035 and 81460300), the Science and Technology Foundation of Jiangxi Province (No. 20142BAB215053,No.20171ACB20003), and the Innovation Fund Designated for Graduate Students of Nanchang University (No. cx2016360)

