2011-2014年福建省手足口病相关病原柯萨奇病毒A组4型的分子流行病学分析
陈 炜,翁育伟,何文祥,朱 颖,黄 萌,张拥军,谢剑锋,郑奎城,严延生
DOI:10.3969/j.issn.1002-2694.2017.09.003
2011-2014年福建省手足口病相关病原柯萨奇病毒A组4型的分子流行病学分析
陈 炜,翁育伟,何文祥,朱 颖,黄 萌,张拥军,谢剑锋,郑奎城,严延生
目的分析福建省手足口病患者中柯萨奇病毒A组4型(Coxsackievirus A4, CVA4)的流行病学、基因变异及遗传进化等特征。方法应用细胞培养方法获得病毒分离株,RT-PCR方法进行分子分型及扩增CVA4血清型完整VP1区全长序列,并进行序列变异及遗传进化分析。结果2011-2014年,从福建省手足口病其它肠道病毒病例标本中分子分型33例CVA4病例,在407例的其它肠道病毒病例中的构成比为8.1%,其中2012年31例,2014年2例。CVA4病例在性别、年龄组分布特征,与一般手足口病流行特征相比,没有特异性。VP1区序列差异比较表明,2011-2014年福建省CVA4分离株之间VP1核苷酸及氨基酸序列相似性分别在92.6%~100%、95.7%~100%;与原型株及国外地方株的核苷酸序列相似性较低,分别为 83.7%~85.4%、82.1%~89.1%,氨基酸序列相似性分别为96.1%~99.0%、90.4%~99.6%;与国内地方株核苷酸及氨基酸序列相似性较高,分别为87.9%~99.2%、96.1%~100%。进化树结果表明福建CVA4分离株与原型株及国外代表株的遗传距离远,与国内代表株的遗传距离近。福建CVA4分离株在进化树的分布呈多个分支。结论CVA4已成为近年来福建省除EV71、CVA16、CVA6、CVA10外导致手足口病的又一重要病原体。福建CVA4分离株与国内地方株同进化共循环,在福建省各个地区同时流行多条亲缘关系接近的传播链。
手足口病;柯萨奇病毒A4;分子流行病学
手足口病(Hand, foot and mouth disease, HFMD)是由多种型别肠道病毒感染引起的5岁以下患儿常见传染病,除肠道病毒71型(Enterovirus 71,EV71)及柯萨奇病毒16型(Coxsackievirus A 16,CVA16)作为主要病原体外,其它肠道病毒在病原谱构成中也占有部分比例[1-4]。
2008年5月份,手足口病被列入我国丙类法定传染病进行疫情网络直报。福建省手足口病疫情网络直报系统显示,2008-2010年,EV71与CVA16的感染是福建省手足口病的主要病原体,而最近几年其它肠道病毒在病原谱中的构成比例上升显著。但是目前国家手足口病监测方案要求在开展手足口病病原学检测项目中,只对总肠道病毒、EV71和CVA16进行检测,未进一步分型鉴定其它肠道病毒。本研究在对福建省2011-2014年手足口病其它肠道病毒专项分型鉴定研究中,发现33例柯萨奇病毒A4(CVA4)感染病例,次于柯萨奇病毒A6(CVA6)柯萨奇病毒A10(CVA10)。本文对福建省2011-2014年手足口病相关病原CVA4开展流行病学、基因变异及遗传进化等分子流行病学特征进行调查研究。
1 材料与方法
1.1 标本 来源于2011-2014年福建省福州、泉州、漳州、宁德、龙岩、南平等地区按照福建省手足口病监测实施方案要求上送至福建省疾病预防控制中心的其它肠道病毒手足口病标本(咽拭子、粪便等),合计1 525例其它肠道病毒手足口病病例(2011-2014年分别为268例、622例、450例、182例)。
1.2 病毒分离培养 按照《手足口病实验室手册》[5]方法和标准对标本分别用人横纹肌肉瘤细胞(Human Rhabdomyosarcoma, RD)和人喉癌上皮细胞(Human Laryngeal Carcinoma,HEp-2进行两代分离培养,收获细胞培养上清。RD细胞和HEp-2细胞均由中国疾病预防控制中心病毒病预防控制所脊髓灰质炎实验室提供。
1.3 RNA提取 使用QIAamp viral RNA mini kit(QIAGEN, Germany)试剂盒提取病毒的RNA,从140 μL的细胞培养上清中获得50 μL的总RNA溶液,提取的RNA保存在-20 ℃待用。
1.4 分子分型 上述RNA样本采用One step RT-PCR Kit(QIAGEN, Germany)试剂盒和应用肠道病毒通用引物PE1/PE2[5]进行进行肠道病毒筛查。一步法RT-PCR反应体系配置参照试剂盒说明书。扩增反应程序与关于CVA6、CVA10的报道[8-9]一致。得到的RT-PCR产物取5μL经1.5%琼脂糖凝胶电泳后观察。
肠道病毒筛查阳性的病例标本采用Access one step RT-PCR Kit (Promega, USA)试剂盒和应用292/222引物[6]进行一步法RT-PCR反应,反应体系参照试剂盒说明书。扩增反应程序与关于CVA6、CVA10报道[8-9]一致。取5 μL RT-PCR产物经1.5%琼脂糖凝胶电泳后观察,阳性产物经胶回收纯化测序,得到的序列应用http://www.rivm.nl/mpf/enterovirus/typingtool网站进行病毒血清型别的分型确定。
1.5 完整VP1区基因序列的获取 血清型别为CVA4的病例标本使用One step RT-PCR Kit(QIAGEN, Germany)试剂盒和应用引物486/488, 487/489[7]分段扩增整个VP1区基因。扩增反应程序参照关于CVA6、CVA10的报道[8-9]。取5 μL RT-PCR产物经1.5%琼脂糖凝胶电泳后观察,阳性产物经胶回收纯化测序。
1.6 生物信息学分析 采用DNASTAR软件对CVA4型病毒进行核苷酸与氨基酸序列分析及同源性比较,构建系统发生树采用Mega 6.0软件的邻接法(Neighbor-Joining)方式。
2 结 果
2.1 一般情况 共收集了福建省2011-2014年1 525例病例的其它肠道病毒标本(绝大部分为咽拭子,极少数为肛拭子),上述标本分别经过两种细胞(RD/Hep-2细胞)两代次的细胞分离培养及分子分型鉴定,共获得407例其它肠道病毒病例毒株,其中33例鉴定为柯萨奇病毒A4(CVA4),为8.1%,次于柯萨奇病毒A6(CVA6),为48.9%(199例)和柯萨奇病毒A10(CVA10),为25.3%(103例)。
2.2 CVA4流行病学特征
2.2.1 时间分布 2011-2014年33例CVA4病例主要分布在2012年(31例)和2014年(2例),2011年及2013年未检测到CVA4病例。2012年的31例CVA4病例分别分布在4月份(6例)、5月份(12例)、6月份(8例)、8月份(2例)、9月份(3例)
2.2.2 地区分布 2012年的31例 CVA4病例分别分布在宁德(16例),漳州(7例),南平(6例),福州(2例);2014年2例分别分布在福州和南平地区。
2.2.3 人群分布
2.2.3.1 性别分布分析,33例的CVA4手足口病病例中,21例男性患者,12例女性患者,男女性别比为1.75∶1,而2008-2014年福建省手足口病总体疫情中的男女病例性别比约为1.7∶1(342 708 /202 172),两者之间没有统计学差异(χ2=0.01,P=0.93>0.05)。
2.2.3.2 年龄组分布 根据0岁组、1岁组、2岁组、3岁组、4岁组、5岁组及以上6个年龄组进行分组,2011-2014年福建省33例CVA4手足口病病例的年龄组分布与手足口病总体病例的年龄组分布相似,主要分布于4岁组及以下年龄的幼儿,占97.0%(32/33),而福建省2008-2014年手足病总体病例中4岁组及以下患儿的构成比为94.3%(514 000/544 880),两者之间没有统计学差异(χ2=0.08,P=0.78>0.05)。
2.2.4 病例类型分布 按照疾病严重程度分类,2011-2014年福建省33例CVA4手足口病病例中,30例普通病例,3例重症病例,无死亡病例。CVA4感染导致重症和死亡的频率为9.1%(3/33),而2008-2014年福建省手足口病实验室监测数据得到的EV71感染导致重症和死亡的频率为16.3%(1 376/8 449),两者之间无统计学差异(χ2=1.25,P=0.26>0.05);与CVA16感染导致重症和死亡的频率(3.2%,115/3 630)相比,也无统计学差异(χ2=2.03,P=0.16>0.05)。
2.3 VP1区核苷酸及编码氨基酸序列分析 对2011-2014年福建省33株CVA4病毒株分两段RT-PCR扩增完整VP1区后测序拼接,得到24株CVA4毒株(其中2012年22株,2014年2株)的完整VP1区核苷酸序列,长度为915个碱基,与原型株(CVA4-High Point)相比,未发现核苷酸的缺失和插入。
2011-2014年福建省的24株CVA4分离株之间的VP1核苷酸序列相似性在92.6%~100%之间,氨基酸序列相似性在95.7%~100%之间。与原型株(CVA4-High Point)的核苷酸序列相似性在83.7%~85.4%之间,氨基酸序列相似性在96.1%~99.0%之间。与1999-2014年国外美国、俄罗斯、印度、日本、肯尼亚等地方分离株的VP1核苷酸序列相似性在82.1%~89.1%之间,氨基酸序列相似性在90.4%~99.6%之间。与1998-2014年的国内吉林、山东、安徽、宁夏、重庆、湖南、上海、广东、云南等地方分离株的VP1核苷酸序列相似性在87.9%~99.2%之间,氨基酸序列相似性在96.1%~100%之间。
将VP1完整编码区翻译成氨基酸序列进行分析,发现2011-2014年福建省的24株CVA4分离株氨基酸序列的第18、34、44、200、281和304位置,是氨基酸变异的频繁区域,详见图1。

图1 福建省CVA4病毒分离株VP1区氨基酸序列差异Fig.1 Amino acid sequence differences in VP1 regions of Fujian CVA4 viruses
2.4 遗传进化分析 采用Mega 6.0软件,以邻接法(Neighbor-Joining)方式,选取CVA16原型株为外群,基于VP1区基因,将福建省2011-2014年24株CVA4地方分离株与从GenBank检索的50株国内外CVA4型代表株构建CVA4种系进化树(图2)。遗传进化分析显示,福建省2011-2014年24株CVA4地方分离株及从GenBank下载的50株国内外CVA4型病毒代表株,可以划分成6个进化分支(A~F),F分支又分为F1~F2两亚分支。CVA4原型株(CVA4-High Point)及1999年肯尼亚株(Kenya11023.1/1999)分别独自组成A分支与B分支;1999-2002年的美国株、2007-2009年印度株及2013年俄罗斯株组成C分支; 2002年、2004年日本地方株及2014年俄罗斯株组成D分支;中国CVA4地方分离株集中分布于E分支及F分支,E分支则由1998年的山东地方株及2006年的吉林地方株组成,而2006年之后的国内地方株,如吉林、山东、安徽、宁夏、重庆、湖南、上海、广东、云南等地方分离株包括2011-2014年的24株CVA4福建分离株共同组成F分支;5株2012年福建分离株(2012FJND180、2012FJND303、2012FJFZ052、2012FJZZ128、2012FJZZ147)与一株2012年重庆地方株组成F1亚分支,其余17株2012年福建分离株及两株2014年福建分离株与多数2006年之后的国内地方株形成F2亚分支。另外,从进化树显示,2011-2014年24株CVA4福建分离株与原型株(CVA4-High Point)及1999-2014年国外(美国、俄罗斯、印度、日本、肯尼亚等)分离株的遗传距离较远,亲缘关系远,与2006-2014年国内地区(如吉林、山东、安徽、宁夏、重庆、湖南、上海、广东、云南等)分离株的遗传距离近,亲缘关系近。24株CVA4福建分离株相互之间的遗传距离较近,亲缘关系近。另外,种系进化树显示,2011-2014年福建省的24株CVA4分离株中,不同地区的CVA4分离株在某个亚分支或某一簇没有明显的集中分布,而是分散分布。
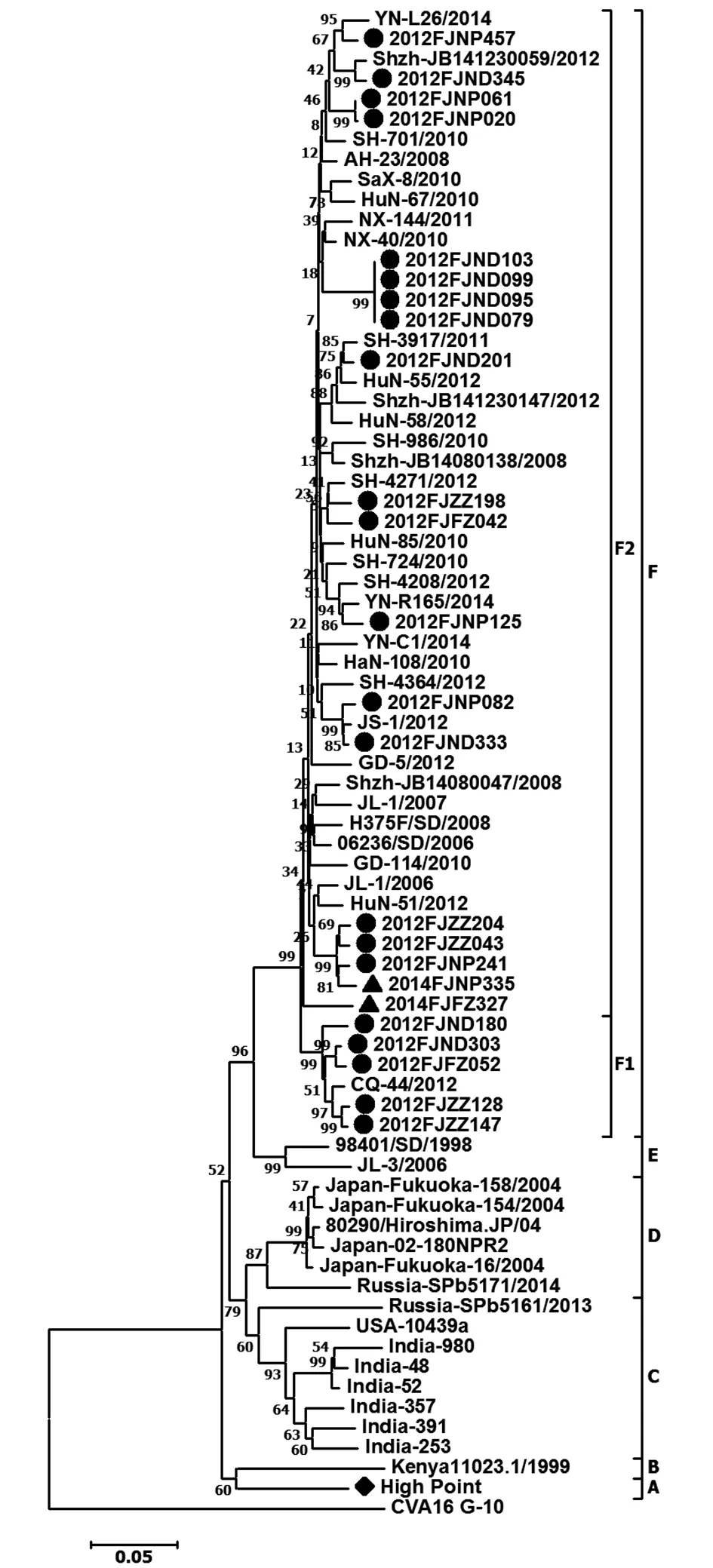
● 2012 Fujian isolates; ▲ 2014 Fujian isolates图2 福建省CVA4病毒分离株VP1区基因序列种系进化树Fig.2 Phylogenetic tree in VP1 regions of Fujian CVA4 viruses
3 讨 论
本研究对福建省2011-2014年共计1 525例其它肠道病毒手足口病病例的标本开展病毒分离培养后分子分型检测,共确定407例其它肠道病毒病例,其中柯萨奇病毒A4(CVA4) 的病例为33例,构成比为8.1%,位居第三位。构成比前两位分别为:柯萨奇病毒A6(CVA6)48.9%(199例)和柯萨奇病毒A10(CVA10)25.3%(103例),关于CVA6及CVA10已做相应的研究报道[8-9]。
福建省2011-2014年33例CVA4手足口病病例的三间分布及病例类型分布等流行病学数据进行分析表明,2008-2010年福建省手足口病病原谱以EV71和CVA16为主,从2011年开始福建省手足口病病原谱发生明显变化,EV71及CVA16的构成比降低,CVA6、CVA10、CVA4等其它肠道病毒在病原谱的构成比上升,与EV71及CVA16共同成为近些年手足病流行的主要型别。CVA4的时间分布分析显示,虽然CVA4在2011-2014年福建省总体手足口病病原普构成比不及CVA6及CVA10,位居第三位,但在某些年份,CVA4在手足口病病原普的构成比也相对较高,如2012年CVA4构成比与CVA10相当。地区分布分析显示,虽然2011-2014年福建省各个地区手足口病病原谱变迁情况较为类似,手足口病新增加的主要病原型别为CVA6、CVA10,但某些年份部分地区,CVA4也成为手足口病主要病原,如2012年宁德地区的CVA4构成比甚至超过CVA6、CVA10,2012年漳州地区CVA4的构成比与CVA10相当。同时,近些年国内外也有关于手足口病疫情相关病原CVA4的研究报道[10-15]。这些提示,CVA4已成为近年来国内外及福建省除EV71、CVA16、CVA6、CVA10外导致手足口病的又一重要病原体。人群分布比较结果显示,CVA4在性别、年龄组的分布特征与总体手足口病病例的性别、年龄组分布特征类似,两者之间没有统计学差异。病例严重程度分布比较结果显示, CVA4感染导致重症和死亡的频率为9.1%,处在EV71(16.3%)和CVA16(3.2%)的中间区域,与EV71和CVA16均无统计学差异,考虑是由于样本量较少,尚不能反映其真实的水平,今后将持续加强监测以获得更多的病例数据资料。
VP1编码区是病毒中和抗体的决定因子,对于病毒的抗原性和病毒血清的遗传多样性具有重要意义。基于VP1区扩增测序分析,已成为肠道病毒分型鉴定的主要方法,对VP1全部或部分基因序列分析已广泛应用于肠道病毒感染的分子流行病学研究[1-2,6]。本研究分别通过扩增部分VP1区基因及扩增完整VP1区基因,来分型鉴定我省其它肠道病毒及分析我省其它肠道病毒的分子流行病特征。
福建省2011-2014年24株CVA4地方分离株的VP1区核苷酸序列及氨基酸序列分析结果显示,福建省的24株CVA4地方分离株与CVA4原型株(CVA4-High Point)在核苷酸序列及氨基酸序列均存在较大差异。遗传进化分析结果显示,福建省的24株CVA4地方分离株与原型株(CVA4-High Point)及1999-2014年国外地区分离株的遗传距离较远,亲缘关系远,与1998-2014年国内地区分离株的遗传距离近,亲缘关系近。因此,福建省2011-2014年24株CVA4地方分离株并不是独立进化,而是与国内其它地区的CVA4地方分离株存在同进化共循环的关联;此外,福建省2011-2014年24株CVA4地方分离株,集中分布于F1、F2亚分支,以及福建省不同地区的CVA4分离株在某个亚分支或某一簇没有明显的集中分布,而是分散分布,提示福建省及福建不同地区存在多条亲缘关系接近的CVA4传播链同时流行,F2亚分支则为近年来国内及福建省CVA4分离株的主要流行分支。此外,将24株福建省CVA4分离株的VP1完整编码区翻译成氨基酸序列后结合系统进化分析,我们发现,分布在F1非主要流行亚分支上的福建省5株分离株(2012FJND180、2012FJND303、2012FJFZ052、2012FJZZ128、2012FJZZ147)与分布在F2主要流行亚分支上的福建省其它19株分离株在VP1区氨基酸第18、34、44、200、281和304等位点存在不同程度的差异。特别是在第18个氨基酸位点,F1非主要流行亚分支上的福建省5株分离株的氨基酸均为K,而F2主要流行亚分支上的福建省其它19株分离株均为R;在第34个氨基酸位点,F1非主要流行亚分支上的福建省5株分离株的氨基酸均为A,而F2主要流行亚分支上的福建省其它19株分离株多数为T。这些氨基酸位点上的差异特别是在第18个氨基酸位点(R / K)是否与CVA4的传播力强弱等方面有关有待进一步的深入研究。
[1] Muir P. Enteroviruses[J]. Medicine, 2009, 37(12): 691-694. DOI: 10.1016/j.mpmed.2009.09.011
[2] Muir P. Enteroviruses[J]. Medicine, 2014, 42(1): 57-59. DOI: 10.1016/j.mpmed.2013.10.009
[3] Wang Y, Feng Z, Yang Y, et al. Hand, foot, and mouth disease in China: patterns of spread and transmissibility[J]. Epidemiology, 2011, 22(6): 781-792. DOI: 10.1097/EDE.0b013e318231d67a
[4] Tapparel C, Siegrist F, Petty TJ, et al. Picornavirus and enterovirus diversity with associated human diseases[J]. Infect Genet Evol, 2013, 14: 282-293. DOI: 10.1016/j.meegid.2012.10.016
[5] National of polio and national measles laboratory. HFMD laboratory manual[R]. Beijing: Chinese Center for Disease Control and Prevention. 2010: 20-26. (in Chinese)
国家脊髓灰质炎和国家麻疹实验室. 手足口病实验室手册[R].北京:中国疾病预防控制中心,2010: 20-26.
[6] World Health Organization Regional Office for Europe. Enterovirus surveillance guidelines[R]. Copenhagen, 2015: 28-39.
[7] Oberste MS, Maher K, Williams AJ, et al. Species-specific RT-PCR amplification of human enteroviruses: a tool for rapid species identification of uncharacterized enteroviruses[J]. J Gen Virol, 2006, 87(1): 119-128. DOI: 10.1099/vir.0.81179-0
[8] Chen W,Weng YW,He WX,et al. Molecular epidemiology of HFMD-associated pathogen coxsackievirus A6 in Fujian Province, 2011-2013[J]. Chin J Virol,2014, 30(6): 624-629. (in Chinese)
陈炜,翁育伟,何文祥,等. 2011~2013年福建省手足口病相关病原柯萨奇病毒A组6型的分子流行病学研究[J]. 病毒学报,2014, 30(6): 624-629.
[9] Chen W,Weng YW,He WX,et al. Molecular epidemiology of HFMD-associated pathogen coxsackievirus A10 in Fujian province, 2011-2014[J]. Chin J Epidemiol, 2016, 37(4): 563-567. DOI: 10.3760/cma.j.issn.0254-6450.2016.04.025 (in Chinese)
陈炜,翁育伟,何文祥,等.福建省2011-2014年手足口病相关病原柯萨奇病毒A组10型的分子流行病学研究[J]. 中华流行病学杂志,2016, 37 (4): 563-567.
[10] Li JS, Dong XG, Qin M, et al. Outbreak of febrile illness caused by coxsackievirus A4 in a nursery school in Beijing, China[J]. Virol J, 2015, 12: 92. DOI: 10.1186/s12985-015-0325-1
[11] Chu PY,Lu PL,Tsai YL, et al. Spatiotemporal phylogenetic analysis and molecular characterization of coxsackievirus A4[J]. Infect Genet Evol, 2011, 11(6): 1426-1435. DOI: 10.1016/j.meegid.2011.05.010
[12] Sarma N. Hand, foot, and mouth disease: current scenario and Indian perspective[J]. Indian J Dermatol Venereol Leprol, 2013, 79(2): 165-175. DOI: 10.4103/0378-6323.107631
[13] Puenpa J,Mauleekoonphairoj J,Linsuwanon P, et al. Prevalence and characterization of enterovirus infections among pediatric patients with hand foot mouth disease, herpangina and influenza like illness in Thailand, 2012[J]. PLoS One, 2014, 9(6): e98888.DOI: 10.1371/journal.pone.0098888
[14] Guan H,Wang J,Wang C, et al. Etiology of multiple non-EV71 and non-CVA16 enteroviruses associated with hand, foot and mouth disease in Jinan, China, 2009-June 2013[J]. PLoS One, 2015, 10(11): e0142733. DOI: 10.1371/journal.pone.0142733
[15] Yao XJ, He YQ, Cai CL, et al. Gene mutation of Coxsackievirus A4 VP1 from Shenzhen, China, 2014[J]. Chin J Zoonoses,2015, 31(6): 565-568. DOI:10.3969/cjz.j.issn.1002-2694.2015.06.015 (in Chinese)
姚相杰,何雅青,蔡春林,等. 深圳地区2014年柯萨奇病毒A组4型VP1区基因特征分析[J].中国人兽共患病学报,2015, 31 (6): 565-568.
MolecularepidemiologyofHFMD-associatedpathogencoxsackievirusA4inFujianProvince,2011-2014
CHEN Wei, WENG Yu-wei, HE Wen-xiang, ZHU Ying, HUANG Meng, ZHANG Yong-jun, XIE Jian-feng, ZHENG Kui-cheng, YAN Yan-sheng
(FujianCenterforDiseaseControlandPrevention,Fuzhou350001,China)
To analyze the epidemiology, genetic variation and genetic evolution of coxsackievirus A4 (CVA4) in patients with hand, foot and mouth disease in Fujian, the virus isolates were molecular typed and amplified the whole VP1 region by RT-PCR, then the genetic variation and evolution were studied. The results showed that 33 CVA4 cases (8.1%) were confirmed from the 407 non-EV71 non-CVA16 HFMD cases in Fujian Province during 2011 and 2014, accounting for 31 cases in 2012 and 2 cases in 2014. Compared with common characteristics of the HFMD epidemic, no specificity in the distribution of CVA4 cases was found between gender and age groups. Sequence analysis of VP1 nucleotide sequences of Fujian CVA4 isolates showed that the nucleotide and amino acid sequences similarity were 92.6%-100% and 95.7%-100% respectively, low similarity with the prototype (83.7%-85.4%, 96.1%-99.0%) and abroad isolates (82.1%-89.1%, 90.4%-99.6%) both in nucleotide and amino acid sequences, high similarity with domestic isolates both in nucleotide and amino acid sequences, with the similarity of 87.9%-99.2% and 96.1%-100%. The results from phylogenetic tree showed that the genetic distance between Fujian CVA4 isolates and the prototype and abroad strains was far, and the genetic distance was close to domestic isolates in China. The distribution of the phylogenetic trees of Fujian CVA4 strains showed multiple branches. Therefore, CVA4 is the major HFMD associated-pathogen other than EV71, CVA16, CVA6, and CVA10 in Fujian Province from 2011 to 2014. CVA4 strains from Fujian Province is co-circulating and co-evolving with other domestic isolates. There is existence of multiple closely related CVA4 transmission chains in various regions of Fujian.
hand, foot and mouth disease (HFMD); coxsackievirus A4 (CVA4); molecular epidemiology
Yan Yan-sheng, Email: yysh@fjcdc.com.cn
福建省自然科学基金(No.2016J01350)与福建省卫计委青年科研课题(No.2014-1-25)联合资助
严延生,Email:yysh @fjcdc. com. cn
福建省疾病预防控制中心,福州 350001
R373.2
:A
:1002-2694(2017)09-0768-06
2017-02-08编辑:梁小洁
Support by the Provincial Natural Science Foundation of Fujian (No. 2016J01350) and the Youth Scientific Research Program of Fujian Provincial Health and Family Planning Commission (No. 2014-1-25)

