腐生葡萄球菌脂肪酶3制备及酶活性研究
罗健,焦洋,杨彦凤
(1.重庆子匀环保工程有限公司,重庆 400039;2.中国兵器工业第五九研究所,重庆 400039)
腐生葡萄球菌脂肪酶3制备及酶活性研究
罗健1,焦洋1,杨彦凤2
(1.重庆子匀环保工程有限公司,重庆 400039;2.中国兵器工业第五九研究所,重庆 400039)
克隆得到腐生葡萄球菌M36的脂肪酶3编码基因,构建了Pet28-Ss-Lip3表达质粒,在大肠菌株中获得腐生葡萄球菌脂肪酶3的高效上清表达,应用Ni2+-NTA亲和层析柱获得了纯度约90%的重组脂肪酶,分子筛检测发现其在溶液中主要以单体形式存在。酶活性分析纯化后的脂肪酶最适宜的反应pH值为7.0,温度为40 ℃。结果表明,腐生葡萄球菌脂肪酶3的碱性和温度耐受性较好,有望通过定点突变获得更好适应性的脂肪酶。
脂肪酶;腐生葡萄球菌;纯化;酶活性
微生物在传统污水处理中扮演着重要角色,但生物制药、石油化工等新兴行业污水成分复杂多样,一般的微生物对于高难度、高浓度的废水束手无策。近年来,利用定向进化技术和基因工程技术筛选出具有靶向性的生物酶制剂,能够有针对性地降解传统生物处理方法无法降解的污染物。其中,脂肪酶(Lipase, EC 3.1.1.3),又名甘油酯水解酶,属羧基酯水解酶类,能在油水界面上水解甘油三酯中酯键,可以催化长链或短链、饱和或不饱和酯的水解,广泛应用于环保、食品、皮革、洗涤剂、医药以及生物柴油等工业领域[1,2]。大多数脂肪酶在乙醇溶液中醇解三酰基甘油,而不是甲醇,因为很多的酶在甲醇中会失去酶活性[3]。目前发现的脂肪酶在室温环境下的活性很低,酶的稳定性和pH值范围比较小,影响了其推广使用[4-5]。本文以腐生葡萄球菌脂肪酶为研究对象,克隆了腐生葡萄球菌(S.saprophyticus)的脂肪酶3编码基因,在大肠杆菌系统表达并纯化了腐生葡萄球菌脂肪酶,并对其活性进行了初步研究。
1 材料与方法
1.1材料
1.1.1粒、菌种及培养条件
质粒pET28a购买Novagen。大肠杆菌(E.coli) DH5α和BL21(DE3)用于质粒的构建和脂肪酶表达。所有菌株培养均采用Luria-Bertani(LB)培养基,于37 ℃培养。根据试验需要,向LB培养基中添加卡那霉素(终浓度50 μg /mL)。向LB 培养基中添加终浓度为20 μg /mL的异丙基-β-D-硫代吡喃半乳糖苷(IPTG)进行脂肪酶表达诱导。
1.1.2试剂
LB 培养基各配料购自英国Oxoid公司,PCR用高保真DNA聚合酶购自Takara公司,各限制性内切酶和DNA 连接酶等购自Takara公司,DNA琼脂糖凝胶电泳胶回收试剂盒购自北京索莱宝科技有限公司,低分子量蛋白质标准和DNA分子量标准购自Fermentas公司。其他试剂均为市售分析纯试剂。
1.2方法
1.2.1分子生物学方法
分子生物学操作如E.coli感受态细胞的制备、质粒DNA 的抽提及纯化、限制性酶切、DNA 片段的连接和转化、PCR、核酸凝胶电泳和蛋白质SDS-PAGE电泳等操作按文献进行,枯草芽孢杆菌的感受态细胞制备和转化按文献进行。
1.2.2基因克隆
以腐生葡萄球菌M36基因组DNA 为模板,采用引物forward primer (5’-CTAGGATCCATGCAGATTAAACTTCCAGAACC-3’)(下划线为BamHI)和reverse primer(5’-TCACTCGAGTTAATTCGACCAATCTAATGATTC-3’)(下划线为XhoI)进行PCR 扩增,PCR 反应条件为: 预变性(94 ℃,8 min),变性(94 ℃,30 s)、退火(60 ℃,30 s)、延伸(72 ℃,50 s),共20个循环。将PCR产物进行纯化回收,与载体pET28a分别在37 ℃水浴进行BamHI和XhoI双酶切3 h,然后使用T4 DNA连接酶将目的基因与载体在16 ℃水浴进行过夜连接。然后转化到克隆菌株大肠杆菌(E.coli) DH5α中,从转化后的LB平板上挑选多个单克隆菌,依次接种于LB液体培养基中(5 mL,卡那霉素抗性),放置于震荡培养箱中培养(37 ℃,200 rpm)至OD600为0.2,挑取菌液为模板进行PCR鉴定。继续培养PCR鉴定为阳性的菌液至OD600为0.8~1.0,收集细菌并提取质粒。将提取的质粒BamHI和XhoI进行双酶切(37 ℃,4 h),琼脂糖电泳鉴定双酶切结果。将酶切鉴定阳性结果送生物技术有限公司进行测序验证。得到的重组质粒命名为Pet28-Ss-Lip3。
1.2.3化表达菌及诱导表达脂肪酶
将Pet28-Ss-Lip3质粒转化大肠杆菌(BL21),再接种于LB平板上(卡那霉素抗性),放置于37 ℃温箱中过夜培养;从LB平板上挑选过个单克隆菌,依次接种于LB培养基中(200 mL,卡那霉素抗性),放置于震荡培养箱中培养(37 ℃,200 rpm)至OD600为0.4~0.6,加入IPTG(终浓度为0.1 mM)后放入摇床于低温(20 ℃,200 rpm)诱导培养20 h。
1.2.4肪酶纯化
低温离心(4 ℃,4000 rpm)15 min收集菌体,加入Lysis 缓冲液(PBS,100 mM,pH 7.4;NaCl,300 mM)搅拌均匀后冰水浴中超声破碎至菌液清凉;低温高速离心(4 ℃,12000 rpm)30 min收集上清,低速穿过预平衡的Ni2+-NTA亲和层析柱;先后分别用10柱体积Lysis 缓冲液和Washing缓冲液(PBS,100 mM, pH 7.4;NaCl,300 mM;20 mM、30 mM和40 mM咪唑)先后分别洗脱非特异结合蛋白质,最后用Elution缓冲液(PBS,100 mM,pH 7.4;NaCl,300 mM;200 mM咪唑)洗脱目的蛋白质。
纯化结果用SDS-PAGE电泳验证,然后将目的蛋白质用超滤缓冲液(PBS,5 mM,pH 7.4;50 mM NaCl)稀释脱盐并超滤浓缩至浓度约1 mg/L, 分装后于-80 ℃保存。分子筛(Superdex 200)用牛白蛋白V (66.2 kDa)、鸡白蛋白(44.2 kDa)、糜蛋白酶原A (24.5 kDa)和溶菌酶(14.4 kDa)进行标定。重组腐生葡萄球菌M36脂肪酶3的洗脱体积为80.1 mL,对应溶液中分子量为鉴定溶液中分子量,标准分子19.2 kDa。
1.2.5酶活性鉴定
脂肪酶活性检测方法参考Ratnaningsih等的方法,脂肪酶的活性检测以PPNP(棕榈酸对硝基苯酯)为底物[6-7]。将0.9 mL 0.1MpPNP与0.1 mL脂肪酶溶液进行混合,并于55 ℃孵育,于410 nm检测产物pNP(对硝基苯酚)的吸收峰。酶活单位定义为:在pH 8.0,37 ℃条件下,以pNPP为底物,1 min内水解产生1 μM的pNP所需的脂肪酶量定义为一个酶活力单位U。
酶的最适pH值的范围为4.0~10.0,缓冲液体系分别为:柠檬酸缓冲液(pH 4.0~6.0),Tris-HCl缓冲液(pH 7.0~8.0),甘氨酸缓冲液(pH 9.0~10.0)。pH值稳定性实验是将酶反应体系在40 ℃相应的pH值缓冲液中孵育30 min后的检测活性。最适温度检测范围为25~60 ℃,反应的缓冲体系为Tris-HCl缓冲液pH 7.0,脂肪酶热稳定性为在相应的温度下孵育30 min后的检测活性。
2 实验结果
2.1基因克隆与表达质粒构建
以本实验室保存的腐生葡萄球菌M36提取的基因组为模板,PCR扩增(图1A)后进行双酶切,然后双酶切后的pET28a载体进行连接,挑选阳性克隆进行PCR鉴定和双酶切鉴定(图1B和1C),送生物公司DNA序列测定。结果显示,没有发生移码和突变。
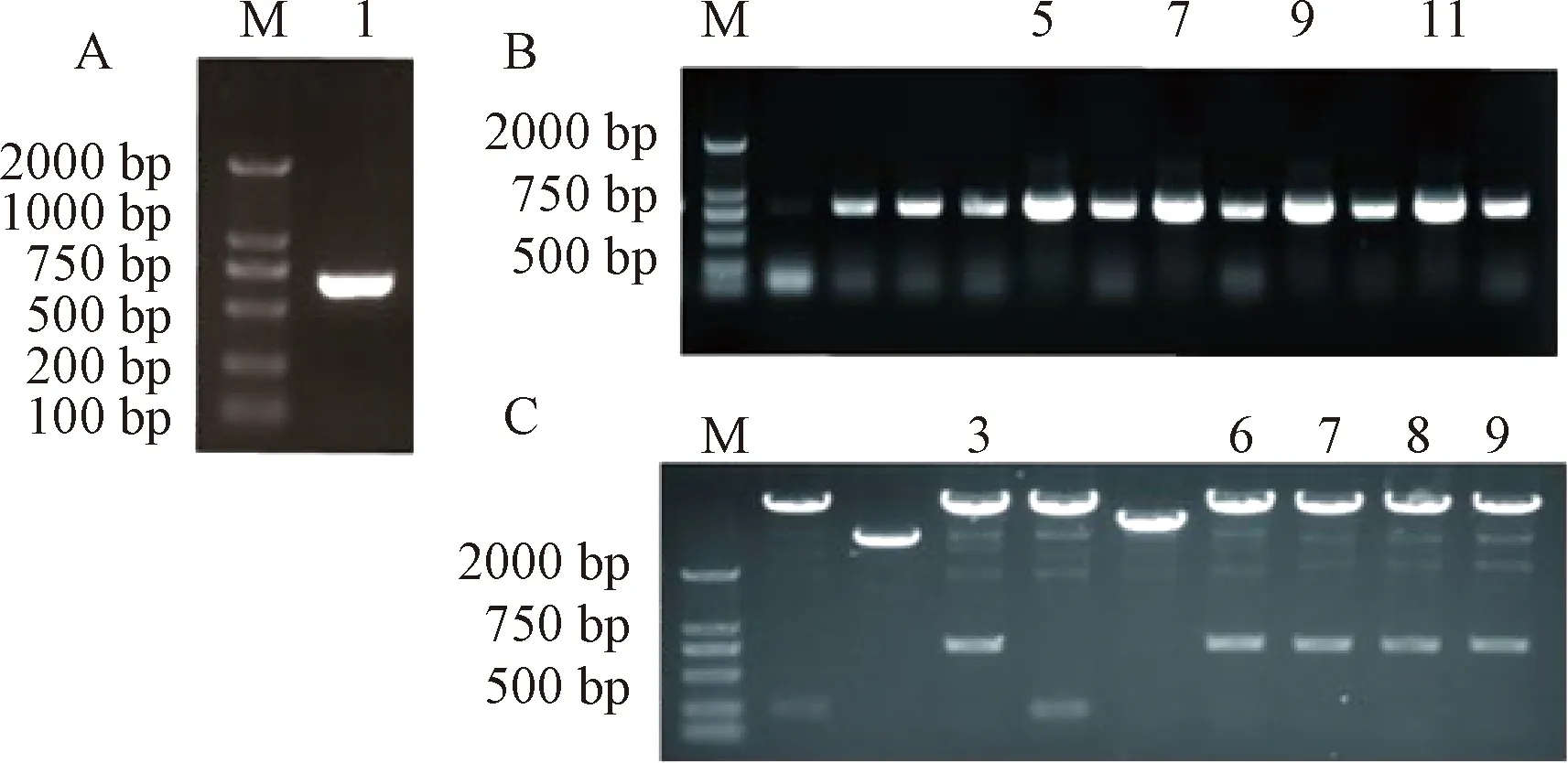
图1 脂肪酶基因克隆与表达质粒构建Fig.1 Gene cloning and plasmid construction of Staph. saprophyticus lipase 3
2.2表达与纯化目的蛋白质
超声破碎得到的上清液的SDS-PAGE结果显示,目的蛋白质在大肠杆菌BL21中大量表达,且以可溶性蛋白质形式表达(图2泳道1和2)。用Elution缓冲液洗脱后用SDS-PAGE验证,目的蛋白质纯度约90%(图2泳道8)。分子筛superdex200洗脱显示,重组腐生葡萄球菌M36脂肪酶3为单洗脱峰,对应溶液中分子量约为19.2 kDa,证明其在溶液中主要单体形式(monomer)存在。
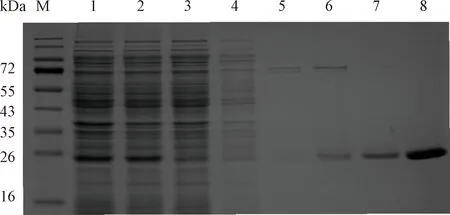
图2 脂肪酶的表达与纯化Fig.2 Expression and purification of SDS-PAGE analysis of Staph. saprophyticus lipase 3
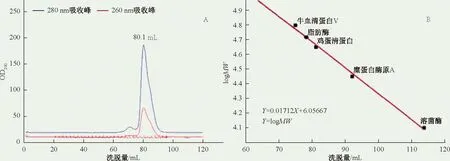
图3 分子筛层析图Fig.3 Chart of size exclusion chromatography
2.3目的蛋白质脂肪酶活性鉴定
纯化后的脂肪酶最适宜的反应pH值为7.0,但是该重组酶能够在碱性缓冲液体系(pH 9.0~10.0)催化降解p-NPP(图4A),而且在40 ℃反应温度下,30 min后仍然保持了约40%的酶活性(图4B)。
纯化后的重组脂肪酶的最适宜反应温度为35~40 ℃,但是在反应温度为60 ℃时,仍能保持30%的活性,即使在30 min后,同样能够保持20%的活性。
上述结果显示,腐生葡萄球菌M36的脂肪酶3具有对pH值和温度的适应范围比较广,在相对极端的条件下,仍然保持有较好的酶活性。
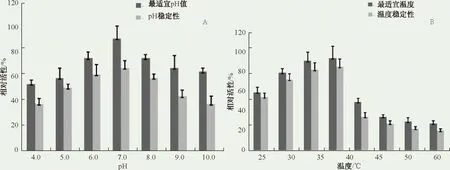
图4 脂肪酶3的酶活性测定Fig.4 Activity and stability of purified recombinant Staph. saprophyticus lipase 3
3 讨论
本研究制备重组腐生葡萄球菌M36的脂肪酶3属于碱性脂肪酶,在高pH值(pH 10.0)情况下仍然具有约70%的酶活性(图3A)。Nthangeni等发现重组地衣芽孢杆菌(B.licheniformis)脂肪酶的最适宜pH值为10.0~11.5[8],重组的Bacillussp. HH-01脂肪酶在pH 4.0~11.0具有稳定的酶活性[9],B.amyloliquefaciensNsic-8脂肪酶对碱性环境也有一定的适应性[10]。Nthangeni等认为除了这些脂肪酶本身具有耐碱性结构外,位于重组蛋白质氨基或者羧基端的His-Tag提升了对碱性环境的耐受性[8]。
Bacillussp. HH-01脂肪酶的最适宜温度为30 ℃,B.amyloliquefaciensNsic-6脂肪酶在20~60 ℃具有较高的酶活性,而本研究报道的腐生葡萄球菌M36的脂肪酶3在40 ℃活性最高,比以前报道的碱性脂肪酶具有更好的高温适应性[19-20]。腐生葡萄球菌M36脂肪酶3分子筛显示其在溶液中以单体形成存在,表明没有形成分子间二硫键。该脂肪酶氨基酸一级序列分析发现,仅在37Cys和118Cys位存在2个半胱氨酸,表明这一对半胱氨酸可能形成分子间二硫键,但是目前尚缺乏该脂肪酶的三维结构的进一步确认。下一步将进行腐生葡萄球菌M36脂肪酶3的三维结构解析,阐明其碱性和温度耐受性的分子基础,有望通过定点突变实现定向进化而获取具有更好适应性的脂肪酶。
[1] Vaquero ME, Barriuso J, Martínez MJ, et al. Properties, structure, and applications of microbial sterol esterases [J]. Appl Microbiol Biotechnol, 2016, 100(5): 2047- 2061.
[2] Barriuso J, Martínez MJ. Evolutionary history of versatile-lipases from Agaricales through reconstruction of ancestral structures [J]. BMC Genomics, 2017, 18(1): 12.
[3] Barriuso J, Vaquero ME, Prieto A, et al. Structural traits and catalytic versatility of the lipases from the Candida rugosa-like family: A review. Biotechnol Adv, 2016, 34(5): 874- 85.
[4] Abrunhosa L, Oliveira F, Dantas D, et al. Lipase production byAspergillusibericususing olive mill wastewater [J]. Bioprocess Biosyst Eng, 2013, 36(3): 285- 291.
[5] Nadar SS, Rathod VK. Sonochemical Effect on Activity and Conformation of Commercial Lipases [J]. Appl Biochem Biotechnol, 2017, 181(4): 1435- 1453.
[6] Ozcan B, Ozyilmaz G, Cokmus C, et al. Characterization of extracellular esterase and lipase activities from five halophilic archaeal strains [J]. J Ind Microbiol Biotechnol, 2009, 36(1): 105- 110.
[7] Sharma R, Chisti Y, Banerjee UC. Production, purification, characterization, and applications of lipases [J]. Biotechnol Adv, 2001, 19(8): 627-662.
[8] Nthangeni MB, Patterton H, van Tonder A, et al. Overexpression and properties of a purified recombinantBacilluslicheniformislipase: A comparative report on Bacillus lipases [J]. Enzyme Microb Technol, 2001, 28(7): 705- 712.
[9] Kamijo T, Saito A, Ema S, et al. Molecular and enzymatic characterization of a subfamily I.4 lipase from an edible oil-degraderBacillussp. HH-01[J]. Antonie Van Leeuwenhoek, 2010, 99(2): 179- 187.
[10] Cai X, Ma J, Wei DZ, et al. Functional expression of a novel alkalineadapted lipase ofBacillusamyloliquefaciensfrom stinky tofu brine and development of immobilized enzyme for biodiesel production [J]. Antonie van Leeuwenhoek, 2014,106(5): 1049- 1060.
Study on Purification and Enzymic Activity of Lipase3from Staph. saprophyticus M36
LUO Jian, JIAO Yang, YANG Yan-feng
(1.Chongqing Ziyun Environment Engineering Co., Ltd., Chongqing 400039, China; 2.No. 59 Institute, China Ordnance Industry, Chongqing 400039, China)
The lipase gene from Staph.saprophyticus M36 was cloned into pet28a vector. The recombinant lipase 3 was expressed in the supernatant of theEcolilysate. The lipase was purified by Ni2+-NTA affinity column with about 90% purity. The size exclusion chromatography experiment confirmed that Lipase 3 existed as monomer in solution. The optimum pH and temperature of the recombinant lipase were 7.0 and 40 ℃, respectively. Collectively, the recombinant lipase 3 had excellent tolerance for alkaline buffer and temperature, implying it was a good candidate for directed evolution to solution to lipase for commercial purposes.
lipase;Staph.saprophyticus; purification; enzymic activity
10.14068/j.ceia.2017.05.020
X172
: A
: 2095-6444(2017)05-0093-04
2017-05-24
罗健(1971—),男,四川泸县人,工程师,主要研究方向为环境工程微生物,E-mail:673359479@qq.com
焦洋(1978—),男,贵州贵阳人,工程师,硕士,主要研究方向为工业废水处理,E-mail:122089103@qq.com

