shRNA沉默Annxin A2基因对放射抗拒鼻咽癌细胞迁移和侵袭的影响
何火聪 苏颖 林可焴 邹长棪 陈超
作者单位:350014 福州 福建省肿瘤医院/福建医科大学附属肿瘤医院放射生物学及肿瘤放射治疗学研究室;福建省科技厅转化医学重点实验室
shRNA沉默Annxin A2基因对放射抗拒鼻咽癌细胞迁移和侵袭的影响
何火聪 苏颖 林可焴 邹长棪 陈超
作者单位:350014 福州 福建省肿瘤医院/福建医科大学附属肿瘤医院放射生物学及肿瘤放射治疗学研究室;福建省科技厅转化医学重点实验室
目的探讨shRNA沉默Annxin A2基因对放射抗拒鼻咽癌细胞迁移和侵袭的影响。方法 采用FuGENE HD将Annexin A2 shRNA转染放射抗拒的鼻咽癌CNE2(R743)细胞,qRT-PCR验证转染细胞中Annxin A2基因的表达,细胞划痕实验和Transwell实验观察下调Annxin A2基因表达及联合照射对鼻咽癌细胞迁移和侵袭的影响,Western blot检测细胞中基质金属蛋白酶2(MMP2)蛋白的表达。结果 转染组细胞Annexin A2基因的mRNA相对表达量为(0.25±0.17),较对照组的(1±0.00)和转染对照组的(0.96±0.06)明显下降,差异有统计学意义(P<0.05)。细胞划痕实验显示,下调Annxin A2基因表达可抑制照射诱导的CNE2(R743)细胞的迁移能力(P<0.05)。Transwell实验结果显示,下调Annxin A2基因表达可抑制照射诱导的CNE2(R743)细胞的迁移和侵袭能力(P<0.05)。Western blot结果表明,下调Annxin A2基因表达能抑制照射诱导的MMP2蛋白的表达上调(P<0.05)。结论下调Annxin A2基因表达能抑制照射诱导放射抗拒的鼻咽癌CNE2(R743)细胞的迁移和侵袭能力,可能与MMP2蛋白表达下调相关。
鼻咽肿瘤;Annxin A2基因;放射抗拒;鼻咽癌CNE2(R743)细胞;迁移;侵袭
鼻咽癌是我国南方常见的恶性肿瘤之一。放疗后残余病灶的局部复发或远处转移是制约其疗效和预后的主要瓶颈,而导致病灶残余的主要原因之一是放射抗拒[1]。Annexin A2是钙离子依赖的磷脂结合蛋白,与多种恶性肿瘤增殖、迁移和侵袭密切相关[2-4]。我们前期的克隆形成实验结果显示,沉默Annexin A2基因可提高放射抗拒鼻咽癌细胞的放射敏感性[5]。但目前有关Annexin A2基因表达及联合照射与鼻咽癌迁移和侵袭的相关性研究未见报道。为探讨Annexin A2基因表达及联合照射对鼻咽癌迁移和侵袭的影响,本研究利用shRNA下调放射抗拒鼻咽癌CNE2(R743)细胞中Annexin A2基因的表达,通过划痕实验、迁移和侵袭实验探讨放射前后鼻咽癌细胞迁移和侵袭能力的变化,并观察各组细胞侵袭转移相关蛋白基质金属蛋白酶2(MMP2)的表达,为探讨Annexin A2基因对鼻咽癌放射敏感性的影响及其机制的研究提供实验依据。
1 材料与方法
1.1 材料
FuGENE HD转染试剂、pGeneClip空载体及pGeneClip ANXA2 shRNA载体购自德国QIAGEN公司;RPMI-1640购自美国HyClone公司;新生牛血清(四季青)购自浙江天杭生物科技股份有限公司;基质胶Matrigel Matrix和纤连蛋白Fibronectin购自美国CORNING公司;胰酶干粉购自美国AMRESCO公司;Millicell细胞培养小室(8.0 μm)购自德国 Merck Millipore公司;24孔细胞培养板购自丹麦NUNC公司;NC 膜购自美国 General Electric Company(GE)公司;Annexin A2、MMP2 和 β-actin 等一抗购自美国CST公司;BCA蛋白定量试剂盒、HRP标记的二抗和ECL化学发光检测试剂盒均购自美国Thermo Fisher Scientific公司;结晶紫染色液购自碧云天生物技术公司;其他试剂均为国产分析纯试剂。
1.2 细胞株及培养
放射抗拒的鼻咽癌CNE2(R743)细胞由福建省肿瘤医院放射生物研究室以鼻咽癌CNE-2细胞经诱导建立并保存[6]。CNE2(R743)细胞培养于含 20%新生牛血清RPMI-1640培养液中,在5%CO2、37℃条件下培养。
1.3 细胞转染
经FuGENE HD转染试剂将pGeneClip空载体及pGeneClip ANXA2 shRNA重组载体转染CNE-2(R743)细胞(对照组)分别构建转染对照组细胞和转染组细胞,转染24 h后加含20%新生牛血清RPMI-1640新培养液,继续扩大培养,用于后续实验。
1.4 qRT-PCR检测Annexin A2基因mRNA的表达
收集细胞,提取细胞总RNA,反转录后进行Annexin A2基因的荧光定量PCR检测。内参照β-actin上游引物:5'-GGAAATCGTGCGTGAC-3',下游引物:5'-ATGCCCAGGAAGGAA-3'。AnnexinA2上游引物:5'-ACCTGGAGACGGTGATTT-3',下游引物:5'-TGCTCTTCTACCCTTTGC-3'。qPCR 反应体系(20 μL):去离子水6 μL,PCR 上下游引物(10 μM)各 1 μL,Master Mix 10 μL,DNA 模板 2 μL。qPCR 反应条件:95 ℃预变性10 min;扩增(95 ℃ 变性10 s,60℃退火10 s,72℃延伸20 s),共40个循环;熔解曲线 95℃ 变性 10 s,60℃退火 1 min,然后升温至95℃(每1℃采集5次荧光,连续采集);40 ℃冷却 30 s。以 2-ΔΔCt值代表Annexin A2基因mRNA的相对表达量。实验重复3次。
1.5 细胞划痕实验
细胞用胰酶消化后,接种于24孔板,待每孔细胞密度约达90%时,以无菌载玻片做依靠,用无菌20 μL移液器tip头在每孔中心轴垂直划痕,温PBS洗尽悬浮细胞,每孔加入1 mL无血清RPMI-1640培养液,倒置显微镜下拍照(0 h),4 Gy X线照射后继续原培养条件下培养,24 h后倒置显微镜下再次拍照,测量划痕的愈合程度,划痕愈合率=(24 h后划痕愈合宽度)/(0 h划痕宽度)。实验重复3次。
1.6 Transwell实验检测细胞迁移能力
吸取 3 μL纤连蛋白(1 mg/mL)均匀涂抹在Transwell小室的上室外膜,置于24孔板中37℃静置4 h。细胞消化后用无血清RPMI-1640培养液调整浓度至 1×106个/mL,取上述细胞悬液100 μL加至Transwell小室的上室,下室加入600 μL含20%新生牛血清的RPMI-1640培养液,各设3个复孔。37℃、5%CO2培养箱中培养24 h。取出Transwell小室的上室,用干棉签轻轻擦尽上室内膜上未迁移的细胞,晾干,甲醇固定30 min,每孔加入0.1%结晶紫染液600 μL,染色10~20 min,弃染液,双蒸水浸洗去除染色液。显微镜下(×200)拍照,计数并比较穿膜的细胞数,每膜计数上、下、左、右、中5个不同视野的总细胞数,取平均值。
1.7 Transwell实验检测细胞侵袭能力
将冻存于-20℃冰箱的Matrigel Matrix胶放置4℃过夜,使成液态。低温下用750 μL无血清RPMI-1640培养液稀释250 μL Matrigel原液。向Transwell小室的上室分别加入100 μL的Matrigel稀释液,放入37℃培养箱中静置1 h使Matrigel Matrix聚合成凝胶。后续步骤同上述Transwell实验,通过计数穿膜细胞数反映细胞的侵袭能力。
1.8 Western blot检测细胞MMP2及Annexin A2基因的表达
胰酶消化、离心收集各组细胞,用含100 μmol/L PMSF的PBS重悬细胞,冰浴中超声破碎细胞,4℃12 000 r/min离心10 min,收集上清液,用BCA试剂盒测定总蛋白浓度。将定量的蛋白经10%聚丙烯酰胺凝胶(SDS-PAGE)电泳,120 V恒压1 h转移至NC膜,3%BSA于4℃封闭过夜,TTBS(Tris-HCl 20 mmol/L pH 7.2,NaCl 150 mmol/L,吐温-20 0.1%)洗膜,然后分别加入Annexin A2、MMP2和β-actin一抗与膜上抗原结合,用相应HRP偶联的二抗与其反应后,加ECL化学发光试剂,在Carestream公司的4000 MM PRO多功能成像分析系统采集数据并分析。以MMP2蛋白与内参照β-actin蛋白电泳条带的吸光度比值表示MMP2蛋白的相对表达量。
1.9 统计学处理
采用SPSS 18.0软件对组间数据进行分析,结果以均数±标准差(±s)表示,两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 shRNA转染下调CNE2(R743)细胞Annexin A2基因的表达
qRT-PCR检测结果表明,转染组细胞Annexin A2基因的mRNA相对表达量为(0.25±0.17),较对照组的(1±0.00)和转染对照组的(0.96±0.06)明显下降,差异有统计学意义(P<0.05);对照组与转染对照组比较差异无统计学意义(P>0.05),见图1。提示转染组细胞Annexin A2基因表达明显下调。
2.2 下调Annexin A2基因表达及联合照射对CNE2(R743)细胞划痕愈合的影响
细胞划痕实验结果显示,划痕后24 h,未照射(0 Gy)转染组划痕愈合率为(40.63±3.12)%,明显低于对照组的(57.78±1.93)%和转染对照组的(56.67±6.67),差异有统计学意义(P<0.05),表明下调Annexin A2基因表达可明显抑制CNE2(R743)细胞迁移。4 Gy照射后,转染组划痕愈合率为(58.55±4.37)%,明显低于对照组的(77.42±3.23)% 和转染对照组的(73.96±6.51)%,差异有统计学意义(P<0.05),见图 2A和图2B。4 Gy照射对照组和转染对照组的划痕愈合率明显高于未照射对照组和转染对照组(P<0.05),提示照射可诱导CNE2(R743)细胞迁移。划痕实验结果表明下调Annexin A2基因表达可明显抑制照射诱导的放射抗拒鼻咽癌CNE2(R743)细胞的迁移能力。
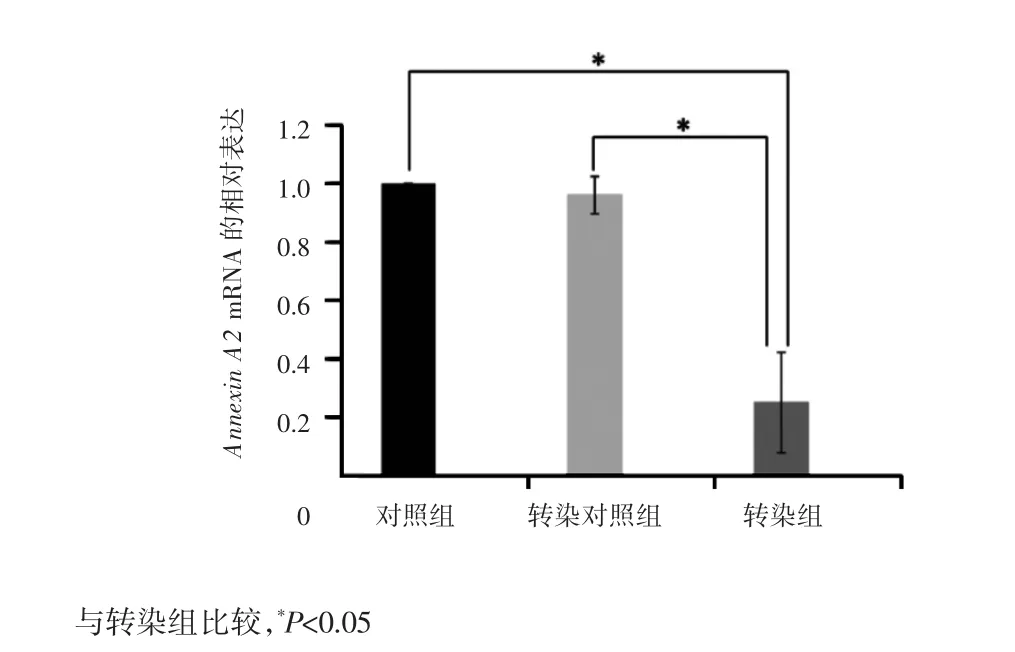
图1 3组细胞Annexin A2基因mRNA的表达
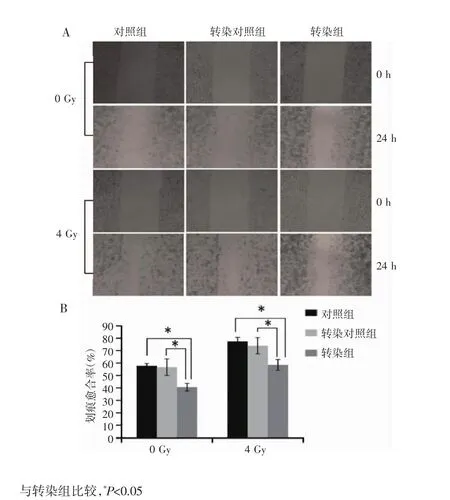
图2 下调Annexin A2基因及联合照射对CNE2(R743)细胞划痕愈合的影响
2.3 下调Annexin A2基因表达可抑制照射诱导CNE2(R743)细胞的迁移
Transwell迁移实验结果显示,未照射(0 Gy)转染组的迁移细胞数为(12±3)个,明显低于对照组的(38±4)个和转染对照组的(37±2)个,差异有统计学意义(P<0.05),提示下调Annexin A2基因表达可抑制CNE2(R743)细胞的迁移能力。4 Gy照射后转染组的迁移细胞数为(32±3)个,明显低于对照组的(62±4)个和转染对照组的(64±1)个,差异有统计学意义(P<0.05),见图3A和图3B。4 Gy照射对照组和转染对照组的迁移细胞数明显高于未照射的对照组和转染对照组(P<0.05),提示4 Gy照射可诱导CNE2(R743)细胞迁移能力增强。上述结果表明,下调Annexin A2基因表达能明显抑制4 Gy照射诱导CNE2(R743)细胞的迁移能力。
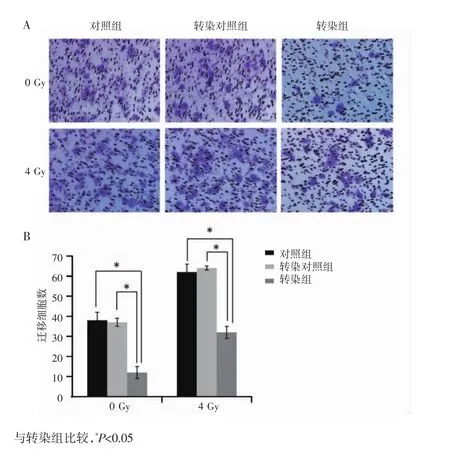
图3 下调Annexin A2基因及联合照射对CNE2(R743)细胞迁移能力的影响
2.4 下调Annexin A2基因表达抑制照射诱导CNE2(R743)细胞的侵袭
本研究利用铺有基质胶的Transwell小室观察Annexin A2基因下调及联合照射对细胞侵袭能力的影响,结果显示,未照射(0 Gy)转染组的侵袭细胞数为(7±1)个,明显低于对照组的(19±2)个和转染对照组的(17±3)个,差异有统计学意义(P<0.05),提示下调Annexin A2基因表达可抑制CNE2(R743)细胞的侵袭能力。4 Gy照射后转染组的侵袭细胞数为(14±2)个,明显低于对照组的(32±3)个和转染对照组的(34±2)个,差异有统计学意义(P<0.05),见图4A和图4B。4 Gy照射对照组和转染对照组的侵袭细胞数明显高于未照射的对照组和转染对照组(P<0.05),提示4 Gy照射可诱导CNE2(R743)细胞侵袭能力增强。上述结果表明下调 Annexin A2基因表达能明显抑制照射诱导CNE2(R743)细胞的侵袭能力。
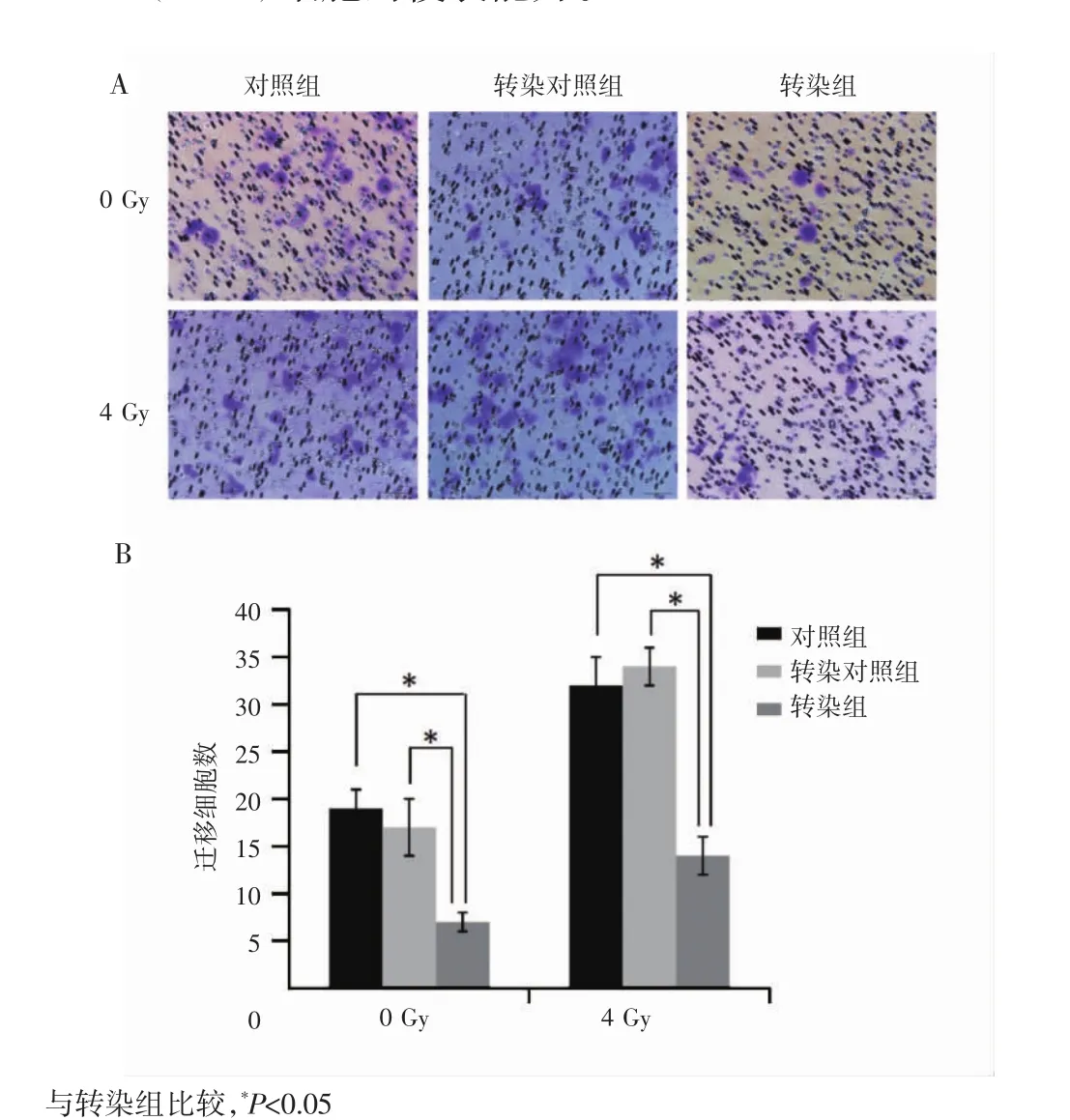
图4 下调Annexin A2基因及联合照射对CNE2(R743)细胞侵袭能力的影响
2.5 下调Annexin A2基因表达及联合照射对MMP2蛋白表达的影响
检测各组细胞MMP2蛋白的表达,结果显示,未照射的转染组细胞MMP2蛋白的相对表达量为(0.14±0.02),较相对应对照组的(0.28±0.01)和转染对照组的(0.29±0.02)明显下降,差异有统计学意义(P<0.05),见图5A和图5B。4 Gy照射后转染组的MMP2蛋白的相对表达量为(0.20±0.02),明显低于对照组的(0.87±0.10)和转染对照组的(0.88±0.08),差异亦有统计学意义(P<0.05)。4 Gy照射的对照组和转染对照组的MMP2蛋白相对表达量明显高于未照射对照组和转染对照组(P<0.05),提示下调Annexin A2基因表达能明显抑制照射诱导CNE2(R743)细胞的MMP2蛋白表达的提高。
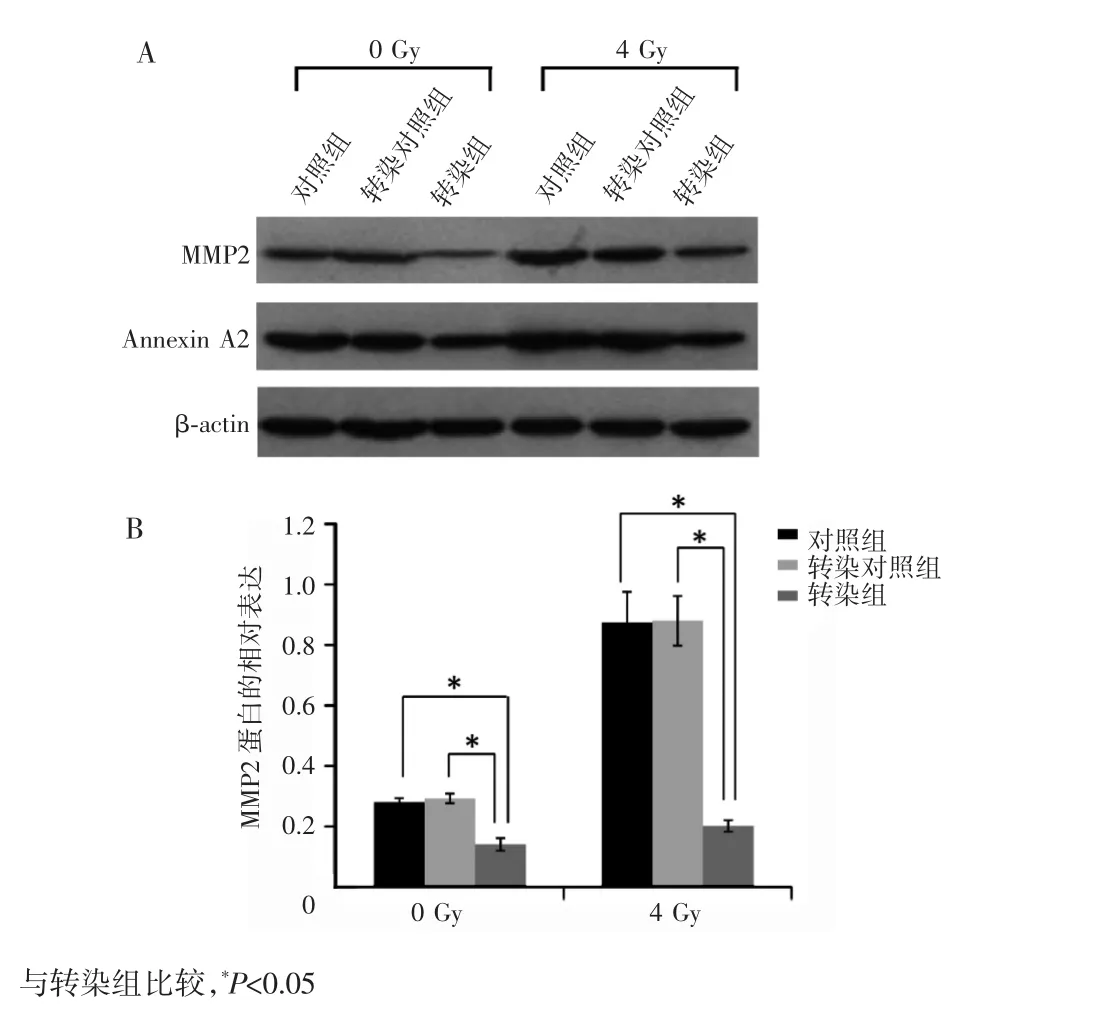
图5 下调Annexin A2基因及联合照射对MMP2蛋白表达的影响
3 讨论
放疗是鼻咽癌首选的治疗方法,随着放疗技术的进步,鼻咽癌患者放疗后局部复发率和远处转移率均明显降低。尤其采用调强放疗技术后,鼻咽癌3年无局部复发生存率可达90%以上,无远处转移率达80%以上,但仍有约80%的肿瘤复发于射线高照射剂量区,约20%的患者最终出现远处转移[7]。鼻咽癌放疗失败的主要原因是鼻咽癌组织中存在一定比例的放射抗拒细胞,放疗后残留的这些肿瘤细胞不仅放射抗拒性增强,而且更具侵袭性,易发生局部复发和远处转移,放射抗拒及侵袭转移成为制约鼻咽癌疗效的瓶颈[8]。
Annexin A2基因过表达与恶性肿瘤的进展密切相关,研究发现上调Annexin A2基因的表达可导致肾癌、子宫内膜癌和结直肠癌恶性进展[9-11]。对14种不同肿瘤(不包括鼻咽癌)共2 321例患者的Meta分析结果表明,Annexin A2基因过表达与患者的不良预后呈正相关[12]。本研究结果显示,下调Annexin A2基因的表达能降低放射抗拒的鼻咽癌细胞的迁移和侵袭能力。目前,Annexin A2基因被认为是与放射抗拒相关的基因之一,我们的前期研究结果表明Annexin A2蛋白过表达的鼻咽癌细胞对X射线较抗拒,低表达的鼻咽癌细胞对X射线较敏感[13]。但有关Annexin A2基因的表达下调及联合照射与鼻咽癌细胞迁移和侵袭的相关性仍未见相关报道,本研究通过划痕和Transwell迁移和侵袭实验探讨Annexin A2基因表达下调及联合照射对鼻咽癌细胞迁移和侵袭能力的影响。
越来越多的研究结果表明,放疗在杀死肿瘤细胞的同时促进了残存的肿瘤细胞的侵袭和转移。Nalla等[14]研究发现放射能促进成神经管细胞瘤侵袭和迁移。Pickhard等[15]证实放射后的头颈鳞状细胞癌HN、BHY和CAL-27细胞的迁移能力增强。高敏等[16]研究发现X线照射后肺腺癌A549细胞侵袭和转移能力较照射前明显增强。本研究通过划痕和Transwell小室实验同样发现,4 Gy剂量照射后对照组和转染对照组细胞划痕愈合率和迁移细胞数增多,穿过铺有基质胶Transwell小室的细胞增多,提示4 Gy照射诱导了对照组和转染对照组鼻咽癌细胞的迁移和侵袭能力增强。但shRNA下调CNE2(R743)细胞Annexin A2基因表达后,细胞的迁移和侵袭能力明显下降,说明shRNA沉默Annexin A2基因能抑制放射诱导鼻咽癌CNE2(R743)细胞的迁移和侵袭能力。
细胞外基质(extracellular matrixc,ECM)是存在于细胞之间的动态网状细胞构架,由胶原、蛋白聚糖和糖蛋白等大分子物质组成,是防止肿瘤细胞侵袭转移的屏障,它的降解是肿瘤侵袭转移的前提[17-19]。肿瘤细胞分泌的许多酶类可以降解ECM成分中的大分子蛋白,其中基质金属蛋白酶MMPs被认为是最重要的一类,它们能特异地与ECM各种成分结合,通过降解ECM在肿瘤侵袭过程中发挥关键作用[20]。MMP2是所有MMPs中分布最广,位于肿瘤细胞质膜上,是MMPs激活过程中的关键酶之一。Kumar等[21]提出直肠癌患者接受高剂量放疗后,肿瘤MMP2的活性增强。此后Speake等[22]也在直肠癌患者放疗前后的肿瘤组织及周围正常黏膜组织中发现,放疗后癌细胞MMP2表达增强,而周围正常黏膜组织MMP2表达无明显改变。本研究结果亦显示,照射可上调鼻咽癌细胞CNE2(R743)MMP2的表达,且细胞迁移侵袭能力的变化与MMP2表达水平一致,即放射诱导鼻咽癌细胞CNE2(R743)MMP2表达增加,从而导致细胞迁移、侵袭能力增强。Annexin A2是异源四聚体,通过结合血纤维蛋白溶酶原使血纤维蛋白溶酶原被剪切成血纤维蛋白溶酶,后者能激活基质金属蛋白酶前体pro-MMPs成基质金属蛋白酶MMPs[23],提示 Annexin A2是调控包括MMP2的MMPs表达的主要基因之一。本研究发现下调鼻咽癌细胞CNE(R743)Annexin A2基因表达能诱导MMP2蛋白表达水平降低,MMP2蛋白表达水平降低可能是Annexin A2基因下调后抑制放射抗拒鼻咽癌细胞CNE2(R743)迁移和侵袭能力的一个主要原因。但X线照射后鼻咽癌细胞侵袭能力及MMP2蛋白表达增强是否导致体内的转移和侵袭能力增强仍有待进一步探索。
本实验采用shRNA沉默鼻咽癌CNE(R743)细胞Annexin A2基因表达,成功构建沉默Annexin A2基因的转染组细胞,该组接受4 Gy X线照射后的细胞划痕愈合率、迁移和侵袭能力均较相对应的对照组和转染对照组下降,可能与MMP2蛋白的表达下调有关,这一结果为Annexin A2基因对鼻咽癌放射敏感性的影响及其机制研究提供了一定实验依据。
[1] Zhu H,Zhu X,Cheng G,et al.Downregulation of microRNA-21 enhances radiosensitivity in nasopharyngeal carcinoma[J].Exp Ther Med,2015,9(6):2185-2189.
[2] Lokman NA,Elder AS,Ween MP,et al.Annexin A2 is regulated by ovarian cancer-peritoneal cell interactions and promotes metastasis[J].Oncotarget,2013,4(8):1199-1211.
[3] Zhang HJ,Yao DF,Yao M,et al.Annexin A2 silencing inhib its invasion,migration,and tumorigenic potential of hepa toma cells[J].World J Gastroenterol,2013,19(24):3792-3801.
[4] Zhai H,Acharya S,Gravanis I,et al.Annexin A2 promotes glioma cell invasion and tumor progression[J].J Neurosci,2011,31(40):14346-14360.
[5] 苏颖,何火聪,吴君心,等.siRNA沉默Annexin A2基因表达对鼻咽癌细胞放射敏感性的影响[J].中华放射肿瘤学杂志,2015,24(2):214-218.
[6] 苏颖,吴君心,何火聪,等.鼻咽癌放射抗拒细胞株CNE-2(R743)的建立及其差异表达蛋白的初步分析[J].福建医科大学学报,2011,45(6):398-403.
[7] Lin S,Pan J,Han L,et al.Nasopharyngeal carcinoma treated with reduced-volume intensity-modulated radiation therapy:report on the 3-year outcome of a prospective series[J].Int J Radiat Oncol Biol Phys,2009,75(4):1071-1078.
[8] Ong YK,Solares CA,Lee S,et al.Endoscopic nasopharyngectomy and its role in managing locally recurrent nasopharyngeal carcinoma[J].Otolaryngol Clin North Am,2011,44(5):1141-1154.
[9] Alonso-Alconada L,Santacana M,Garcia-Sanz P,et al.Annexin-A2 as predictor biomarker of recurrent disease in endometrial cancer[J].Int J Cancer,2015,136(8):1863-1873.
[10] Tristante E,Martínez CM,Jiménez S,et al.Association of a characteristic membrane pattern of annexin A2 with high invasiveness and nodal status in colon adenocarcinoma[J].Transl Res,2015,166(2):196-206.
[11] Yang SF,Hsu HL,Chao TK,et al.Annexin A2 in renal cell carcinoma:expression,function,and prognostic significance[J].Urol Oncol,2015,33(1):22e11-22e21.
[12] Liu X,Ma D,Jing X,et al.Overexpression of ANXA2 predicts adverse outcomes of patients with malignant tumors:a systematic review and meta-analysis[J].Med Oncol,2015,32(1):392.
[13]苏颖,何火聪,吴君心,等.鼻咽癌细胞放射敏感性的比较蛋白质组学研究[J].中华放射医学与防护杂志,2011,31(5):536-541.
[14] Nalla AK,Asuthkar S,Bhoopathi P,et al.Suppression of uPAR retards radiation-induced invasion and migration mediated by integrin β1/FAK signaling in medulloblastoma[J].PLoS One,2010,5(9):e13006.
[15] Pickhard AC,Margraf J,Knopf A,et al.Inhibition of radiation induced migration of human head and neck squamous cell carcinoma cells by blocking of EGF receptor pathways[J].BMC Cancer,2011,11:388.
[16]高敏,张俊红,周云峰,等.X线照射人肺腺癌细胞后侵袭和转移能力变化及机制探讨[J].中华放射肿瘤学杂志,2013,22(2):163-166.
[17] Park CM,Park MJ,Kwak HJ,et al.Ionizing radiation enhances matrix metalloproteinase-2 secretion and invasion of glioma cells through Src/epidermal growth factor receptor-mediated p38/Akt and phosphatidylinositol 3-kinase/Akt signaling pathways[J].Cancer Res,2006,66(17):8511-8519.
[18] McCawley LJ,Matrisian LM.Matrix metalloproteinases:multifunctional contributors to tumor progression[J].Mol Med Today,2000,6(4):149-156.
[19] Harada T,Arii S,Mise M,et al.Membrane-type matrix metalloproteinase-1(MT1-MMP) gene is overexpressed in highly invasive hepatocellular carcinomas[J].J Hepatol,1998,28(2):231-239.
[20] Hulboy DL,Rudolph LA,Matrisian LM.Matrix metalloproteinases as mediators of reproductive function[J].Mol Hum Reprod,1997,3(1):27-45.
[21] Kumar A,Collins HM,Scholefield JH,et al.Increased type-Ⅳ collagenase(MMP-2 and MMP-9)activity following preoperative radiotherapy in rectal cancer[J].British J Cancer,2000,82(4):960-965.
[22] Speake WJ,Dean RA,Kumar A,et al.Radiation induced MMP expression from rectal cancer is short lived but contributes to in vitro invasion[J].Eur J Surg Oncol,2005,31(8):869-874.
[23] Bharadwaj A,Bydoun M,Holloway R,et al.Annexin A2 heterotetramer:structure and function[J].Int J Mol Sci,2013,14(3):6259-6305.
[2017-07-01收稿][2017-07-20修回][编辑 游雪梅]
文稿中数字用法的要求
本刊严格执行国家标准《出版物上数字用法的规定》,文稿中凡是可以使用阿拉伯数字且很得体的地方,均应使用阿拉伯数字。⑴公历世纪、年代、年、月、日和时间、时刻必须使用阿拉伯数字,如20世纪90年代、2006-02-15、5 h、30 min、30 s、14:36:08等;年份不能用简称,“1998年”不能写作“98年”。⑵物理量量值必须使用阿拉伯数字。⑶非物理量量词前面数字一般也应使用阿拉伯数字,如3支、5根等。⑷数值范围的表达要求:5万至10万应写成5万~10万,不能写成 5~10 万;3×109至 5×109应写成 3×109~5×109,或(3~5)×109,不能写成 3~5×109;60%至 70%不能写成60~70%,应写成60%~70%:25.5±0.5 mg应写成(25.5±0.5)mg。⑸带单位的量值相乘时,每个数值后单位不能省略,如4 mm×2 mm×3 mm.不能写成4×2×3 mm或4×2×3 mm3。
(本刊编辑部)
Effects of shRNA-mediated silencing of Annexin A2 on migration and invasion of radioresistant nasopharyngeal carcinoma cells
He Huocong,Su Ying,Lin Keyu,Zou Changyan,Chen Chao
(Fujian Cancer Hospital&Fujian Medical University Cancer Hospital,Laboratory of Radiation Oncology and Radiobiology,Fujian Key Laboratory of Tumor Translational Cancer Medicine,Fuzhou 350014,P.R.China)
ObjectiveTo investigate the effect of shRNA-mediated silencing of Annexin A2 and combined irradiation on the migration and invasion of radioresistant nasopharyngeal carcinoma cells.MethodsAnnexin A2 shRNA was transfected into CNE2(R743)cells using FuGENE HD.The expression of Annexin A2 gene in transfected cells was verified by qRT-PCR.The effect of down-regulation of Annexin A2 expression combined with irradiation on the migration and invasion of nasopharyngeal carcinoma cells were determined by scratch assay and transwell chamber assay.The expression of MMP2 was detected by Western blot.ResultsThe relative expression of Annexin A2 mRNA in transfected group(0.25±0.17)was significantly lower than in control group(1±0.00)and transfected control group(0.96±0.06),the difference was statistically significant(P<0.05).Cell scratches showed that down-regulation of Annexin A2 could inhibit the migration of CNE2(R743)cells induced by irradiation(P<0.05).Transwell assay showed that down-regulation of Annexin A2 expression inhibited the migration and invasion of CNE2(R743)cells induced by irradiation(P<0.05).Western blot analysis showed that down-regulation of Annexin A2 could inhibit the upregulation of MMP2 protein expression induced by irradiation(P<0.05).ConclusionDown-regulation of Annexin A2 can inhibit the migration and invasion of CNE2(R743)cells induced by irradiation,which may be related to the down-regulation of MMP2 protein expression.
Nasopharyngeal neoplasm;Annexin A2 gene;Radioresistant;Nasopharyngeal carcinoma CNE2(R743)cells;Migration;Invasion
Su Ying.E-mail:zjsuying@hotmail.com
R739.63
A
1674-5671(2017)04-07
10.3969/j.issn.1674-5671.2017.04.10
福建省科技计划资助项目(2014Y0014);国家临床重点专科建设资助项目(国卫办医函〔2013〕544号);福建省卫生厅临床重点专科(西医类别)建设资助项目(闽卫科教〔2012〕149号)
苏颖。E-mail:zjsuying@hotmail.com

