miR-205在鼻咽癌组织中的表达及对细胞增殖、侵袭能力的影响△
高英 谢丽
·基础研究·
miR-205在鼻咽癌组织中的表达及对细胞增殖、侵袭能力的影响△
高英 谢丽*
目的探讨miR-205在鼻咽癌组织中的表达及对细胞增殖、侵袭能力的影响。方法选取57例初治鼻咽癌患者和40例对照组,利用实时荧光定量聚合酶链反应(PCR)技术检测2组组织中的miR-205表达。培养人鼻咽癌细胞CNE-2,根据转染物不同,将细胞分为miR-205 minic组、minic-对照组、miR-205 inhibitor组和inhibitor-对照组,利用实时荧光定量PCR技术检测各转染组细胞中miR-205表达,四氮唑蓝(MTT)比色法检测各转染组细胞增殖情况,划痕实验检测各转染组细胞迁移能力,Transwell法检测各转染组细胞侵袭能力。结果鼻咽癌组织中miR-205的相对表达量为1.85±0.17,高于对照组的1.14±0.12,差异有统计学意义(t=25.099,P<0.05)。鼻咽癌组织中miR-205的相对表达量与临床分期、病理分级和颈淋巴结转移有关(P<0.05)。miR-205 minic组细胞中miR-205的相对表达量为0.87±0.12,显著高于miR-205 inhibitor组、minic-对照组和inhibitor-对照组,分别为0.34±0.09、0.53±0.11和0.55±0.12,且miR-205 inhibitor组低于minic-对照组和inhibitor-对照组(P<0.001)。miR-205 minic组细胞48 h、72 h和96 h的增殖能力显著高于minic-对照组和inhibitor-对照组,而miR-205 inhibitor组则低于minic-对照组和inhibitor-对照组(P<0.001)。miR-205 minic组细胞迁移率和侵袭细胞数均高于miR-205 inhibitor组、minic-对照组和inhibitor-对照组,且miR-205 inhibitor组细胞迁移率和侵袭细胞数均低于minic-对照组和inhibitor-对照组(P<0.001)。结论miR-205在鼻咽癌组织中呈高表达,下调miR-205表达可减少鼻咽癌CNE-2细胞增殖、抑制细胞迁移和侵袭能力。(中国眼耳鼻喉科杂志,2017,17:328-332)
鼻咽癌;miR-205;细胞增殖;侵袭能力
鼻咽癌是鼻咽黏膜好发的恶性肿瘤,病因多样且存在地域差异[1]。由于其起病隐匿,恶性程度高,多数患者临床确诊时已处于中晚期,严重影响预后[2]。中晚期鼻咽癌患者初治反应率较低,且5年生存率<60%[3]。目前,鼻咽癌的发病机制尚未完全阐明。有研究[4]指出,鼻咽癌的发病及进展是多因素、多基因、多步骤共同作用的结果。微小RNA(micro RNA,miRNA,miR)是机体广泛存在、高度保守、含20个核苷酸的小RNA,与多种恶性肿瘤的发生及进展密切相关[5]。miR-205作为miRNA的重要类型,在食管癌[6]、神经胶质瘤[7]、卵巢癌[8]等多种恶性肿瘤中发挥重要作用。本研究对鼻咽癌组织中miR-205的表达进行检测,并利用转染miR-205模拟物或抑制物的方法,探讨其对人鼻咽癌CNE-2细胞增殖、侵袭能力的影响,以期为鼻咽癌的发病机制研究提供基础资料。
1 资料与方法
1.1 临床资料 选取2014年3月~2016年4月在本科住院治疗的初治鼻咽癌患者57例,其中男性36例、女性21例;年龄28~74岁,平均(43.2±9.5)岁。所有患者均经病理学检验确诊,均未接受放、化疗。临床分期:Ⅰ期4例、Ⅱ期6、Ⅲ期31例、Ⅳ期16例;病理分级:未分化癌23例、低分化鳞状细胞癌34例;颈淋巴结转移32例。同期选取因其他疾病行鼻内镜手术的鼻咽部标本40例作为对照组,均排除鼻咽癌,其中男性24例、女性16例,年龄27~73岁,平均(44.1±10.2)岁。2组研究对象性别、年龄等一般资料差异无统计学意义。鼻咽癌患者均取治疗前活检标本,对照组通过鼻内镜取鼻咽黏膜组织,保存于-70 ℃液氮中。研究通过本院伦理委员会批准,所有研究对象均知情同意。
1.2 主要试剂和设备 CNE-2细胞株由美国ATCC细胞库提供,RPMI-1640培养基、胎牛血清均购自美国Hyclone公司,Trizol总RNA提取试剂盒购自美国Gibco公司,反转录聚合酶链反应(polymerase chain reaction, PCR)试剂盒购自日本Takara公司,miR-205和内参U6序列均由上海生工生物公司设计合成,miR-205模拟物(miR-205 minic)、miR-205抑制物(miR-205 inhibitor)及相应的对照序列均由上海吉玛制药有限公司设计合成,LipofectamineTM 2000转染试剂盒购自美国 Invitrogen公司,四氮唑蓝(microculture tetrozolium, MTT)细胞增殖与细胞毒性试剂盒购自上海碧云天生物技术有限公司,Transwell小室购自美国Corning公司,紫外分光光度计购自上海仪电分析仪器有限公司,实时荧光定量PCR仪购自美国ABI公司,全自动酶标仪购自美国Thermo公司。
1.3 实时荧光定量PCR技术检测miR-205表达 取鼻咽癌和对照组组织,研磨后加入细胞裂解液进行裂解。用Trizol总RNA提取试剂盒提取组织中总RNA,利用紫外分光光度计对总RNA纯度进行检测,以A260/A280≥1.80作为合格样品。利用反转录试剂盒将总RNA反转录为模板链cDNA,以cDNA为模板,用PCR试剂盒进行PCR扩增。引物序列:miR-205引物,上游:5′-CTTGTCCTTCATTCCACCGGA-3′,下游:5′-TGCCGCCTGAACTTCACTCC-3′;U6引物,上游:5′-CTCGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCA-CGAATTTGCGT-3′。PCR反应条件:94 ℃ 1 min,92 ℃ 30 s,58 ℃ 30 s,73 ℃ 30 s,进行40次循环。每个样品均设置3个平行反应复孔。用2-△△Ct法获得鼻咽癌和对照组组织中miR-205相对表达量。取各转染组细胞,加入细胞裂解液裂解,其余步骤同上。
1.4 细胞培养及分组 用含10%胎牛血清的RPMI-1640培养基对CNE-2细胞株进行培养,置于含5% CO2的37 ℃恒温培养箱中。待细胞稳定传代后,取对数生长细胞,接种于6孔板中,调整细胞密度为5×104/孔,继续培养。待细胞融合度达到85%左右时,利用LipofectamineTM 2000转染试剂盒对细胞进行转染。根据转染物不同,将细胞分为4组。miR-205 minic组转染miR-205模拟序列:5′-UCCUUCAUUCCACCGG-AGUCUG-3′;minic-对照组转染minic对照序列:5′-UUCUCCGAACGUGUCACGUTT-3′;miR-205 inhibitor组转染miR-205抑制物序列:5′-CCGGTGGAATGAA-GG-3′;inhibitor-对照组转染inhibitor对照序列:5′-ACGTCTATACGCCCA-3′。各组转染后,继续在含5% CO2的37 ℃恒温培养箱中培养。
1.5 MTT比色法检测细胞增殖情况 取各转染组细胞,接种于96孔板,调整细胞密度为1×103/孔。每组均设置5个复孔,分别于转染后培养24、48、72、96 h时,将5 g/L的MTT液20 μL加入各孔,继续培养5 h。去除培养液,加入二甲基亚砜(dimethylsulfoxide, DMSO)200 μL,充分振荡12 min,待结晶完全溶解后,利用全自动酶标仪对570 nm处吸光度A值进行检测。
1.6 划痕实验检测细胞迁移能力 取各转染组转染后培养48 h的细胞,胰酶消化后,用RPMI-1640培养液制备单细胞悬液。调整细胞密度为5×105个/mL,接种于背后有划线的6孔板中,1 mL/孔,于恒温培养箱中过夜孵育。待细胞融合度达到100%时,用无菌枪头垂直于背后划横线,每孔连续至少穿过5条。磷酸盐缓冲液冲洗3次,去除漂浮细胞。置于含5% CO2的37 ℃恒温培养箱中培养。分别于划痕0 h和24 h拍照,利用Image-Pro Plus图像分析软件对划痕距离进行分析。细胞迁移率=[(W0 h-W24 h)/W0 h]×100%(W表示宽度)。
1.7 Transwell法检测细胞侵袭能力 Transwell小室上室铺Matrigel胶50 μL,取各转染组转染后培养48 h的细胞,胰酶消化后,用含1%胎牛血清的RPMI-1640培养液制备浓度为1×106个/mL的细胞悬液。取100 μL接种于Transwell小室上室,将含10%胎牛血清的RPMI-1640培养液置于小室下室,于含5% CO2的37 ℃恒温培养箱中培养24 h。用棉签轻轻将上室中的细胞去除,用结晶紫染色,于高倍镜取5个视野,计数穿膜细胞数,取平均值。
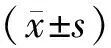
2 结果
2.1 2组组织中miR-205表达 鼻咽癌组织中miR-205相对表达量为1.85±0.17,高于对照组的1.14±0.12,差异有统计学意义(t=25.099,P<0.05)。2.2 鼻咽癌组织中miR-205表达与临床病理特征之间的关系 鼻咽癌组织中miR-205相对表达量与性别、年龄、浸润范围无关(P>0.05),而与临床分期、病理分级和颈淋巴结转移有关(P<0.05)(表1)。
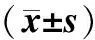
表1 鼻咽癌组织中miR-205表达与临床病理特征之间的关系
2.3 不同转染组细胞中miR-205表达 miR-205 minic组细胞中miR-205相对表达量为0.87±0.12,显著高于miR-205 inhibitor组、minic-对照组和inhibitor-对照组,分别为0.34±0.09、0.53±0.11和0.55±0.12,且miR-205 inhibitor组低于minic-对照组和inhibitor-对照组,差异均有统计学意义(F=34.286,P<0.001)。
2.4 不同转染组细胞增殖能力 miR-205 minic组细胞48 h、72 h和96 h增殖能力显著高于minic-对照组和inhibitor-对照组,而miR-205 inhibitor组则低于minic-对照组和inhibitor-对照组,差异均有统计学意义(P<0.001)(表2)。
2.5 不同转染组细胞迁移能力 miR-205 minic组细胞迁移率为(61.8±13.5)%,显著高于miR-205 inhibitor组、minic-对照组和inhibitor-对照组,分别为(31.6±9.6)%、(48.6±10.7)%和(50.7±11.5)%,且miR-205 inhibitor组细胞迁移率均低于minic-对照组和inhibitor-对照组,差异均有统计学意义(F=40.617,P<0.001)(图1)。
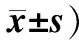
表2 不同转染组细胞增殖能力比较(A值,

图1. 划痕实验检测不同转染组细胞迁移能力 A、C、E、G分别示0 h时miR-205 minic组、miR-205 inhibitor组、minic-对照组和inhibitor-对照组;B、D、F、H分别示24 h时miR-205 minic组、miR-205 inhibitor组、minic-对照组和inhibitor-对照组 ×100
2.6 不同转染组细胞侵袭能力比较 miR-205 minic组侵袭细胞数为(261.8±23.5)个,显著高于miR-205 inhibitor组、minic-对照组和inhibitor-对照组,分别为(131.6±19.4)个、(208.6±18.5)个和(211.7±20.2)个,且miR-205 inhibitor组侵袭细胞数均低于minic-对照组和inhibitor-对照组,差异均有统计学意义(F=53.509,P<0.001)(图2)。
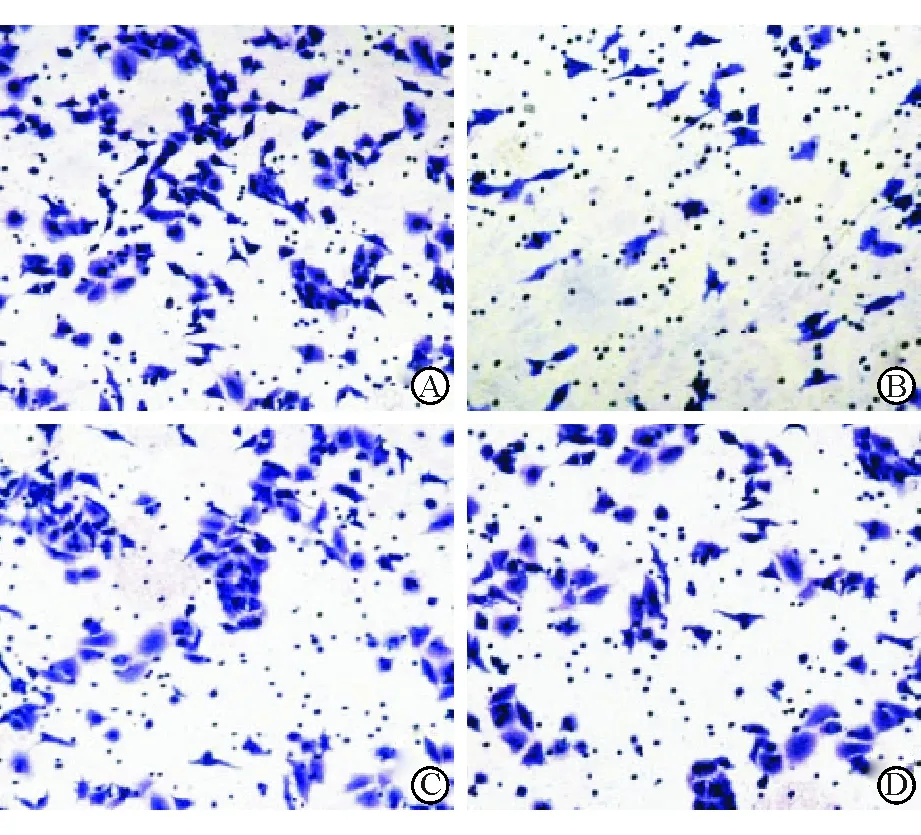
图2 Transwell法检测不同转染组细胞侵袭能力 A. miR-205 minic组;B. miR-205 inhibitor组;C. minic-对照组;D. inhibitor-对照组 结晶紫染色 ×100
3 讨论
鼻咽癌是恶性程度较高的头颈部恶性肿瘤,发生机制较为复杂,涉及多因素、多基因、多步骤。近年来,随着诊疗技术的进展,鼻咽癌诊疗水平得到长足发展,但由于肿瘤恶性程度高、侵袭转移能力强,多数患者预后较差[9]。因此,积极探讨影响鼻咽癌发生及肿瘤侵袭、转移的相关基因或因素,对改善患者预后具有重要意义。miR-205是miRNA家族成员之一,其在肿瘤发生及进展中发挥重要作用,既可发挥癌基因作用[10],又可作为抑癌基因而抑制肿瘤发生[11]。本研究结果显示,鼻咽癌组织中miR-205的相对表达量高于对照组,说明miR-205可能作为癌基因参与了鼻咽癌的发生。邓铃等[12]通过筛选鼻咽癌石蜡标本中miRNA的表达差异发现,miR-205在鼻咽癌中表达水平升高,可能参与了鼻咽癌的发生过程,与本研究结论一致。在与临床病理特征之间的关系分析中发现,miR-205相对表达量与临床分期、病理分级和颈淋巴结转移有关,在临床分期Ⅲ~Ⅳ期、未分化癌和发生颈淋巴结转移组中呈高表达,提示miR-205可能参与了鼻咽癌的进展及转移过程。
为进一步探讨miR-205在鼻咽癌增殖、侵袭、转移中的作用,利用miR-205模拟物、抑制物及对照序列转染CNE-2细胞。结果显示,miR-205 minic组细胞增殖能力显著高于minic-对照组和inhibitor-对照组,而miR-205 inhibitor组则低于minic-对照组和inhibitor-对照组,说明上调miR-205可促进CNE-2细胞增殖,下调miR-205则可抑制细胞增殖,提示miR-205参与了鼻咽癌细胞增殖过程。有研究[13]指出,上调miR-205可通过调控Cyclin D1、P21基因而实现对肿瘤细胞增殖的调控。划痕实验和Transwell小室实验进一步显示,miR-205 minic组细胞迁移率和侵袭细胞数显著高于miR-205 inhibitor组、minic-对照组和inhibitor-对照组,且miR-205 inhibitor组细胞迁移率均低于minic-对照组和inhibitor-对照组,说明上调miR-205可提高细胞迁移和侵袭能力,抑制miR-205则抑制细胞迁移及侵袭能力,进一步说明miR-205基因表达与鼻咽癌细胞迁移和侵袭能力有关。
综上所述,miR-205在鼻咽癌组织中呈高表达,可能在鼻咽癌发生中发挥癌基因功能,下调miR-205可减少鼻咽癌CNE-2细胞增殖、抑制细胞迁移和侵袭能力,有望为鼻咽癌基因治疗提供新的靶位。
[ 1 ] 杜云, 俞霞, 季明芳. EB病毒血清抗体水平与鼻咽癌临床分期相关性研究进展[J]. 中国肿瘤临床, 2016, 43(19):869-872.
[ 2 ] Xu C, Chen YP, Ma J. Clinical trials in nasopharyngeal carcinoma-past, present and future[J]. Chin Clin Oncol, 2016, 5(2):20-24.
[ 3 ] Chan JY. Surgical management of recurrent nasopharyngeal carcinoma[J]. Oral Oncol, 2014, 50(10):913-917.
[ 4 ] Chen J, Fu L, Zhang LY, et al. Tumor suppressor genes on frequently deleted chromosome 3p in nasopharyngeal carcinoma[J]. Chin J Cancer, 2012, 31(5):215-222.
[ 5 ] Wang J, Chen J, Sen S. MicroRNA as biomarkers and diagnostics[J]. J Cell Physiol, 2016, 231(1):25-30.
[ 6 ] Zhao BS, Liu SG, Wang TY, et al. Screening of microRNA in patients with esophageal cancer at same tumor node metastasis stage with different prognoses[J]. Asian Pac J Cancer Prev, 2013, 14(1):139-143.
[ 7 ] 郑国沛, 贾小婷, 彭聪, 等. miR-205 通过靶向调控TBX18 抑制神经胶质瘤细胞的侵袭能力[J]. 中国病理生理杂志, 2015, 31(7):1219-1224.
[ 8 ] 周君, 刘海玲, 陈亦乐, 等. VEGF和miR-205及靶蛋白Ezrin和Lamin A/C在卵巢癌中的表达及意义[J]. 中南大学学报(医学版), 2014, 39(2):142-150.
[ 9 ] Liao KM, Chao TB, Tian YF, et al. Overexpression of the PSAT1 gene in nasopharyngeal carcinoma is an indicator of poor prognosis[J]. J Cancer, 2016, 7(9):1088-1094.
[10] Hezova R, Kovarikova A, Srovnal J, et al. MiR-205 functions as a tumor suppressor in adenocarcinoma and an oncogene in squamous cell carcinoma of esophagus[J]. Tumour Biol, 2016, 37(6):8007-8018.
[11] Zhang C, Long F, Wan J, et al. MicroRNA-205 acts as a tumor suppressor in osteosarcoma via targeting RUNX2[J]. Oncol Rep, 2016, 35(6):3275-3284.
[12] 邓铃, 罗霞, 杨旸, 等. 鼻咽癌石蜡标本中筛选差异表达的miRNA[J]. 广东药学院学报, 2014, 30(4):497-500.
[13] Yu J, Chen Y, Qin L, et al. Effect of miR-205 on 3T3-L1 preadipocyte differentiation through targeting to glycogen synthase kinase 3 beta[J]. Biotechnol Lett, 2014, 36(6):1233-1243.
ExpressionofmiR-205innasopharyngealcarcinomatissuesanditseffectoncellproliferationandinvasion
GAOYing,XIELi*.
DepartmentofOtolaryngology,Ji′nanIronandSteelGroupCorporationHospitalinShandongProvince,Ji′nan250101,China
GAO Ying, Email: 2967939793@qq.com
ObjectiveTo investigate the expression of miR-205 in nasopharyngeal carcinoma (NPC) tissues and its effect on cell proliferation and invasion.MethodsFifty-seven patients with newly diagnosed NPC and 40 non-NPC patients who had accepted endoscopic surgery (as the control group) were selected. The expression of miR-205 in nasopharyngeal tissues in the two groups were detected by using real-time fluorescence quantitative polymerase chain reaction (PCR). The human NPC CNE-2 cells were cultured. According to the different transfectants, CNE-2 cells were divided into miR-205 minic group, minic-control group, miR-205 inhibitor group and inhibitor-control group. The expressions of miR-205 in different transfected groups were detected by real-time fluorescence quantitative PCR. The cell proliferation was detected by microculture tetrozolium (MTT) assay. The cell migration ability was detected by scratch test. The invasive ability was detected by Transwell method.ResultsThe relative expression of miR-205 in NPC tissues (1.85±0.17) was significantly higher than those in the control group (1.14±0.12) (t=25.099,P<0.05). The relative expression of miR-205 was related to clinical stage, pathological grade and cervical lymph node metastasis (P<0.05). The relative expression of miR-205 in miR-205 minic group (0.87±0.12) was significantly higher than those in miR-205 inhibitor group, minic-control group and inhibitor-control group [(0.34±0.09), (0.53±0.11) and (0.55±0.12)], and the relative expression of miR-205 in miR-205 inhibitor group was lower than those in the minic-control group and inhibitor-control group (P<0.01). The cell proliferations at 48 h, 72 h and 96 h in the miR-205 minic group were higher than in the minic-control group and inhibitor-control group, while those in the miR-205 inhibitor group were lower than in the minic-control group and inhibitor-control group (P<0.001). The cell migration rate and invasive cell numbers in the miR-205 minic group were higher than those in the miR-205 inhibitor group, minic-control group and inhibitor-control group, and the cell migration rate and invasive cell numbers in miR-205 inhibitor group were lower than those in the minic-control group and inhibitor-control group (P<0.001).ConclusionsMiR-205 was highly expressed in NPC tissues. Down-regulation expression of miR-205 could reduce the proliferation, invasion and migration of CNE-2 cells. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:328-332)
Nasopharyngeal carcinoma; miR-205; Cell proliferation; Invasive ability
2016-11-28)
(本文编辑 杨美琴)
国家自然科学基金(81372888)
山东省济南钢铁有限公司总医院耳鼻喉科 济南 250101;*山东省肿瘤医院耳鼻喉科 济南 250117
高英(Email: 2967939793@qq.com)
10.14166/j.issn.1671-2420.2017.05.005

