白细胞介素17A在肺炎链球菌急性中耳炎黏膜免疫中的作用△
徐江红 梁琼 刘向 李雯 戴文佳
·基础研究·
白细胞介素17A在肺炎链球菌急性中耳炎黏膜免疫中的作用△
徐江红 梁琼 刘向 李雯 戴文佳
目的探讨白细胞介素17A(IL-17A)在肺炎链球菌急性中耳炎(AOM)黏膜免疫中的作用。方法6~8周无特定病原体(SPF)级BALB/c小鼠,在感染前24 h腹腔注射200 μg IL-17A抗体中和体内的IL-17A,注射相同剂量的Ig2a抗体作为对照组(Ig2a),经鼓膜途径注射肺炎链球菌,感染后第5天取中耳灌洗液,酶联免疫吸附测定法(ELISA)检测IL-17A、CXCL2和CXCL5的水平。取中耳听泡,乙二胺四乙酸(EDTA)脱钙,常规石蜡切片,苏木素-伊红(HE)染色,评估中耳炎的严重程度。新型肺炎链球菌PsaA蛋白疫苗经鼻腔途径免疫小鼠,末次免疫后2周取小鼠的脾脏,制成细胞悬液,PsaA抗原刺激72 h,ELISA检测培养上清液IL-17A的水平;末次免疫后2周经鼓膜途径注射肺炎链球菌,攻毒后5 d取中耳灌洗液,ELISA检测IL-17A、CXCL2和CXCL5的水平。中耳攻毒后5 d取中耳黏膜,抽提RNA,反转录cDNA,荧光定量聚合酶链反应(PCR)检测IL-6、防御素β2和CXCL2 mRNA的表达水平。结果在固有免疫中,中和体内的IL-17A,感染肺炎链球菌后,中耳有更严重的炎症反应,且中耳IL-17A、CXCL2和CXCL5分泌减少;在适应性免疫中,新型肺炎链球菌PsaA蛋白疫苗在CTB黏膜佐剂作用下经鼻腔途径免疫后,脾上清液分泌了较高水平的IL-17A,中耳攻毒后中耳黏膜灌洗液中检测到较高水平IL-17A,相关细胞因子CXCL2、CXCL5水平增高,中耳黏膜IL-6、防御素β2、CXCL2 mRNA表达量明显增高。结论IL-17A在肺炎链球菌AOM黏膜免疫中起重要的保护作用,为AOM的治疗和新一代疫苗的设计及免疫策略的选择提供了实验依据。(中国眼耳鼻喉科杂志,2017,17:318-322,332)
白细胞介素17A;黏膜免疫;急性中耳炎;肺炎链球菌
急性中耳炎(acute otitis media,AOM)是儿童最常见的感染性疾病之一,发病率仅次于上呼吸道感染。国内没有确切的AOM发病率报道。据欧洲和美国等报道,80%的儿童在3岁之前至少发作过1次AOM。肺炎链球菌是AOM最常见的病原菌,30%~60%的AOM由肺炎链球菌引起[1-2]。肺炎链球菌主要通过咽鼓管黏膜途径感染中耳引起AOM,黏膜的固有免疫反应是防御的第一道防线,对于细菌的清除起重要作用,但是具体的清除机制目前仍不清楚。已有多项研究显示,在多种细菌的急性感染中,白细胞介素17A(interleukin-17A, IL-17A)发挥重要的防御作用,IL-17A具有强大的募集中性粒细胞到局部黏膜的能力,从而促进病原体的清除。IL-17A在肺炎链球菌AOM的固有免疫中是否也发挥重要作用,相关研究较少。疫苗也是预防AOM的有效手段,抗体一直被认为是肺炎链球菌感染性疾病的主要防御机制。但是近年有研究证实,疫苗诱发的抗体非依赖的、CD4+T细胞依赖的免疫反应加速了鼻咽部肺炎链球菌的清除,主要通过CD4+T细胞(Th17细胞)分泌的IL-17A发挥作用。IL-17A在肺炎链球菌AOM的适应性黏膜免疫保护中是否也发挥重要作用,尚无研究报道。前期我们已采用新型肺炎链球菌蛋白疫苗,以壳聚糖为黏膜佐剂,经鼻腔途径免疫小鼠,每周2次,连续3周;末次免疫后2周检测血清特异性免疫球蛋白G(immunoglobulin G, IgG)和黏膜特异性IgA抗体水平,发现均明显增高并且在末次免疫后2周中耳注射肺炎链球菌,小鼠中耳的炎症反应明显减弱[3],证实新型蛋白疫苗在黏膜佐剂作用下可以对AOM产生保护作用,但IL-17A在免疫保护中的作用并不明确。本研究的目的是探讨IL-17A 在肺炎链球菌AOM固有黏膜免疫和适应性黏膜免疫中的作用。
1 材料与方法
1.1 实验动物 无特定病原体(specific pathogen free, SPF)级雌性BALB/c小鼠,6~8周,体重16~18 g,购自上海西普尔-必凯实验动物有限公司。肺炎链球菌感染前饲养于复旦大学实验动物科学部SPF级实验室,肺炎链球菌感染后饲养于上海市公共卫生临床中心实验动物部生物安全2级实验室(ABSL-2级实验室)。所有实验小鼠在中耳感染前均在显微镜下确认无自发性中耳炎发生。所有动物实验均经复旦大学附属眼耳鼻喉科医院伦理委员会认可和批准。
1.2 菌珠、培养基及细菌培养 14型肺炎链球菌购自中国医学细菌保藏管理中心(产品编号:31226);肺炎链球菌液体培养基Todd-Hewitt Broth为Sigma公司产品,固体培养基哥伦比亚血琼脂平板为上海科玛嘉微生物技术有限公司产品。从-80 ℃冰箱中取出保存的菌种,挑取适量肺炎链球菌14型标准株菌液,接种于含0.5%酵母提取物的Todd-Hewitt Broth培养基中,置于含5% CO2的培养箱中培养过夜。然后按1∶200体积比转接继续培养至对数生长期,离心收集菌体,以无菌生理盐水洗涤2次,倍比稀释法菌落计数,以磷酸盐缓冲液(phosphate buffer saline, PBS)重悬至浓度为每毫升8×108菌落形成单位(colony-forming units,CFU)备用。
1.3 主要试剂 IL-17A中和抗体为R&D公司产品;Ig2a同型对照抗体为Biolegend公司产品; CXCL2、CXCL5 ELISA试剂盒为Abcam公司产品;IL-17A ELISA试剂盒为Biolegend公司产品;RNA提取试剂盒(RNeasy Micro Kit)为Qiagen公司产品;PrimeScriptTM RT反转录试剂盒和SYBRTMPremix Ex TaqTMRT-PCR试剂盒均购自Takara公司。
1.4 荧光定量聚合酶链反应引物 在 Genebank 上查询以下基因的序列,并根据此序列设计用 Primer 3.0 进行引物设计,由深圳华大基因股份有限公司合成。引物序列见表1。
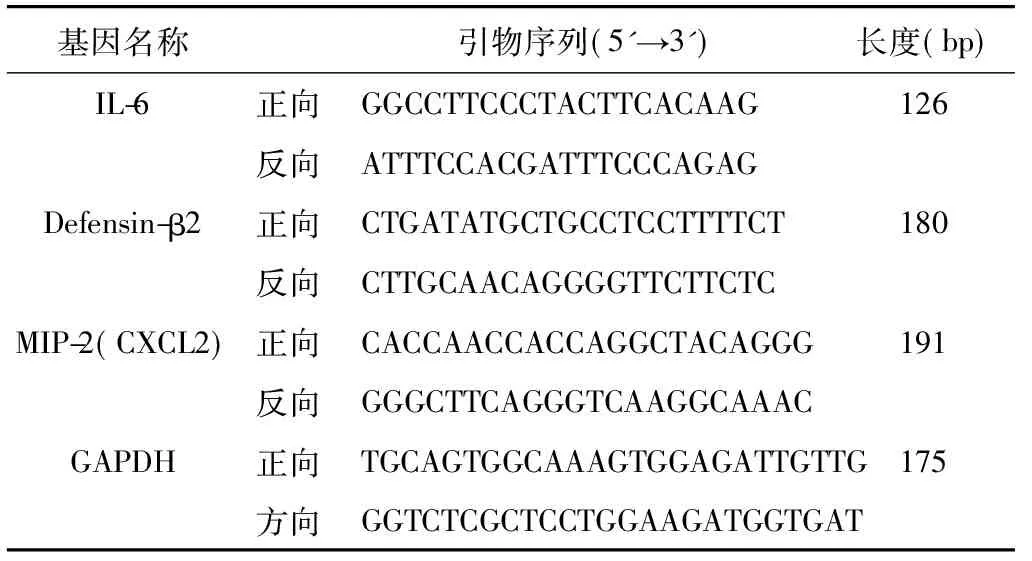
表1 qPCR检测的基因及相应的引物序列
1.5 小鼠中耳感染 据文献[4]报道方法,6~8周SPF级BALB/c小鼠在肺炎链球菌感染前24 h腹腔注射200 μg IL-17A抗体中和体内的IL-17A,注射相同剂量的Ig2a抗体作为对照组(Ig2a)。小鼠予氯胺酮(80 mg/kg)/甲苯噻嗪(6 mg/kg)腹腔注射轻度麻醉,在显微镜下用微量注射器经鼓膜前下方注射14型肺炎链球菌,每只耳5 μL(2×107CFU),对照组注射相同剂量PBS。实验共分6组:野生型BALB/c小鼠+肺炎链球菌感染组、野生型BALB/c小鼠+PBS组、Ig2a抗体BALB/c小鼠+肺炎链球菌感染组、Ig2a抗体BALB/c小鼠+PBS组、IL-17A抗体BALB/c小鼠+肺炎链球菌感染组、IL-17A抗体BALB/c小鼠+PBS组,每组12只。
1.6 中耳灌洗液收集及检测 在中耳感染后第5天取中耳灌洗液。具体方法:10 μL微量注射器吸取5 μL预冷的PBS,穿破鼓膜,注入中耳,回收灌洗液,反复灌洗20次;每只耳收集约100 μL灌洗液,按照试剂盒操作说明采用酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)检测中耳灌洗液中IL-17A、CXCL2、CXCL5水平。
1.7 中耳组织切片苏木素-伊红染色 中耳感染后第5天处死IL-17A抗体中和组和Ig2a抗体对照组小鼠。将动物断头后,去除皮肤,剪断双侧颞颌关节,去除下颌骨,暴露上腭,保留鼻咽部软组织。沿枕骨大孔剪开顶骨,去除脑组织以充分暴露颅底。剪除附着肌肉等软组织,完整取下包含双侧听泡的颅底,置于4%的多聚甲醛溶液中固定24 h;然后置于10%乙二胺四乙酸(EDTA)脱钙液中脱钙1个月左右;常规石蜡切片,苏木素-伊红(hematoxylin-eosin, HE)染色,评估中耳炎严重程度。以Image-Pro Plus 6.0软件分析单位面积(10 000 μm2)内中耳炎症细胞的数目。每组6只动物,每只动物观察5张切片,每张切片随机选择5个视野,取均数作为该动物的代表值。
1.8 小鼠黏膜免疫 6~8周BALB/c小鼠随机分为3组,每组10只,分别接受肺炎链球菌表面黏附素A (pneumococcal surface adhesion A, PsaA)蛋白免疫(PsaA组,15 μg PsaA蛋白),PsaA蛋白及CTB免疫 (PsaA/CTB组,15 μg PsaA/4 μgCTB), CTB免疫(CTB组,4 μg CTB);经鼻腔途径免疫,相同剂量和方法,每周免疫2次,连续3周。
1.9 标本收集及检测 末次免疫后2周取小鼠的脾脏,制成细胞悬液,PsaA抗原刺激72 h,方法同以前的实验[3]报道,按试剂盒说明ELISA检测培养上清液IL-17A水平。末次免疫后2周,经鼓膜途径(方法同前)注射肺炎链球菌,每只耳5 μL( 2×106CFU),攻毒后5 d取中耳灌洗液(方法同前),ELISA检测IL-17A、CXCL2和CXCL5水平。中耳攻毒后5 d,处死小鼠。打开听泡,取下整个听泡外侧壁,在显微镜下用显微镊剥离中耳黏膜,利用RNA提取试剂盒抽提总RNA,用超微量分光光度仪(NanoDrop2000,Thermo scientific)检测总RNA的纯度和含量。按照PrimeScriptTM RT反转录试剂盒说明,配置反转录体系,于聚合酶链反应(PCR)仪上进行反转录。所用条件为37 ℃ 15 min反转录,85 ℃ 5 s灭活。将反转录获得的cDNA按照荧光定量PCR试剂盒说明配置反应体系,于荧光定量PCR仪(FTC3000HT,Funglyn Biotech Incorporated)进行反应,以内参 GAPDH表达量为参照,采用2- △ △ Ct法进行相对定量分析IL-6、防御素β2、CXCL2 mRNA水平。

2 结果
2.1 IL-17A、CXCL2、CXCL5在肺炎链球菌感染后水平 中耳灌洗液中IL-17A的水平与Ig2a组或无抗体中和组相比显著下降,差异有统计学意义(P<0.01,图1A)。趋化因子CXCL2、CXCL5水平在所有肺炎链球菌感染组均比PBS组水平高,表明感染促进了趋化因子的分泌;但在IL-17A抗体中和组,感染后CXCL2、CXCL5的分泌水平明显低于Ig2a组或无抗体中和组感染后的水平,差异具有统计学意义(P<0.01,图1B、1C),与IL-17A的变化一致,提示CXCL2、CXCL5的分泌与IL-17A有关。
2.2 中耳炎症反应 病理组织学结果表明:IL-17A抗体中和组与Ig2a抗体组比较,在感染肺炎链球菌后有更严重的中耳炎反应,中耳炎症细胞数明显高于Ig2a抗体组(P<0.05,图2)。
2.3 黏膜免疫后脾上清液IL-17A水平 黏膜免疫后取小鼠的脾脏培养,抗原刺激后,PsaA、PsaA/CTB组均有较高水平的IL-17A产生,与CTB组相比差异显著,且PsaA/CTB组分泌的IL-17A水平明显高于PsaA组(图3),提示该免疫策略诱导了全身Th17细胞免疫应答,IL-17A可能在黏膜免疫中发挥作用。

图1. 中耳灌洗液中IL-17A、CXCL2、CXCL5水平 *示与另外2组比较,差异具有统计学意义(P<0.05)
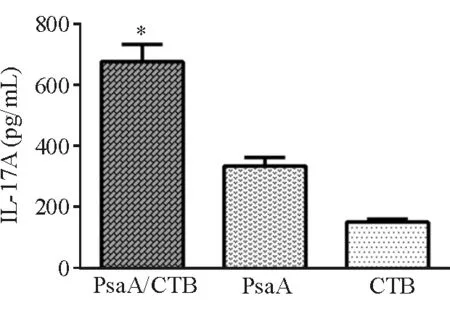
图3. 脾上清液IL-17A水平 *示与PsaA组比较,差异有统计学意义(P<0.05)
2.4 中耳IL-17A、CXCL2和CXCL5表达水平及相关因子表达分析 PsaA、PsaA/CTB组灌洗液中IL-17A、CXCL2和CXCL5水平均较对照组高,且PsaA/CTB组均高于PsaA组,差异有统计学意义(图4);荧光定量PCR检测中耳黏膜IL-6、防御素β2、CXCL2 mRNA表达水平,与CTB组比较,PsaA、PsaA/CTB组IL-6、防御素β2、CXCL2 mRNA表达量明显增高,差异有统计学意义(P<0.05),但PsaA与PsaA/CTB组之间无明显差异(P>0.05)(图5)。
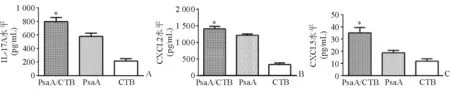
图4. 黏膜免疫并中耳攻毒后的中耳灌洗液中IL-17A、CXCL2、CXCL5水平 *示与PsaA组比较,差异有统计学意义(P<0.05)

图5. 中耳黏膜IL-6、防御素β2、CXCL2 mRNA 相对表达量 *示与CTB组比较,差异有统计学意义(P<0.05)
3 讨论
IL-17A 是Th17细胞分泌的主要效应因子,具有强烈的促进抗原呈递细胞、中性粒细胞募集的功能和促进上皮细胞增生、分化,保持上皮细胞完整性,维持上皮屏障作用的功能,其调节呼吸道抗感染固有免疫和免疫炎症反应的作用备受关注,被视为固有免疫和获得性免疫的桥梁[5]。有研究[6]表明,IL-17A已经至少对12种黏膜感染的病原体在黏膜表面的清除起重要作用,而且由于基因突变,缺乏Th17细胞的人群对肺炎链球菌、金黄色葡萄球菌及流感嗜血杆菌更易感。肺炎链球菌是鼻咽部寄殖菌,在机体免疫力低下时可通过咽鼓管途径引起中耳感染,导致AOM。有研究[7]表明,对于鼻咽部黏膜表面肺炎链球菌的清除,IL-17A起关键作用。在AOM动物模型中,也有研究[8]证实IL-17A通过募集中性粒细胞以及诱发凋亡,促进肺炎链球菌的清除。在固有免疫研究中,我们也观察到小鼠在中耳感染肺炎链球菌后中耳灌洗液中伴随着IL-17A表达增高以及趋化因子CXCL2、CXCL5分泌的增多,但是在IL-17A中和组,IL-17A以及CXCL2、CXCL5分泌明显减少,并且IL-17A中和组中耳有更严重的炎症反应,表明在体内IL-17A缺乏时更易感染AOM。
疫苗是预防肺炎链球菌感染性疾病的有效手段,目前在临床上应用的有2类肺炎链球菌疫苗,一类是多糖疫苗,另一类是多糖蛋白结合疫苗。由于其免疫效果受血清型限制,仅对部分血清型肺炎链球菌感染性疾病有效,而且出现血清型替代现象[9];另外,2类疫苗在临床上均采用肌内注射方式,对于通过黏膜途径感染的AOM保护能力有限。因此,近年来,以肺炎链球菌表面保守蛋白为基础的无血清型限制的新型肺炎链球菌疫苗成为研究热点,而且黏膜途径可能成为免疫新途径[10-11]。PsaA是一种相对分子质量为37 kD的肺炎链球菌表面锚定蛋白,是金属黏附脂蛋白家族中的一员,作为ABC转运系统的一部分参与Mn2+及Zn2+向肺炎链球菌的传输,介导肺炎链球菌对上呼吸道上皮细胞的黏附[12]。PsaA存在于所有临床分离的肺炎链球菌菌株中,且具有高度保守性[13]。多项动物实验研究均证实PsaA免疫对降低肺炎链球菌鼻咽部的寄居最为有效[14]。我们的前期研究也已证实PsaA蛋白疫苗经鼻腔途径免疫可以对AOM产生保护作用[3],因此PsaA可以作为一种无血清型限制的新型肺炎链球菌疫苗候选抗原。
目前有研究[15-16]认为肺炎链球菌疫苗获得性免疫保护作用机制主要有2种,对肺炎链球菌引起的败血症等侵袭性疾病主要通过抗体的产生发挥保护作用,对于肺炎链球菌黏膜定植的减少主要是通过抗体非依赖性的分泌IL-17A的Th17细胞发挥作用。而且有研究[17]表明,黏膜免疫中IL-17A对于黏膜分泌的特异性IgA抗体的产生也起重要作用。AOM是鼻咽部定植的肺炎链球菌通过咽鼓管途径引起,推测IL-17A在黏膜免疫疫苗预防AOM的保护中很可能也发挥主要作用。因此在获得性免疫研究中,我们采用PsaA蛋白疫苗,以霍乱毒素B(CTB)作为黏膜佐剂,经鼻腔黏膜免疫途径免疫小鼠。
黏膜免疫系统由2部分组成,即黏膜诱发部位和黏膜效应部位。鼻相关淋巴组织是上呼吸道黏膜诱发部位,而中耳黏膜是效应部位。黏膜免疫后,诱发部位完成抗原的摄取、呈递及免疫细胞的活化,活化的T、B细胞经过循环到达效应部位产生抗体或细胞因子发挥作用[18]。在本研究中,PsaA蛋白疫苗免疫后中耳灌洗液检测到IL-17A水平,且在CTB佐剂作用下IL-17A的水平更高,表明黏膜免疫后中耳有活化的Th17细胞产生,在感染后分泌IL-17A,从而清除中耳细菌。有研究[19]显示 IL-6与 IL-17A 的产生和维持相关,与上述报道相符。我们也发现在中耳黏膜中有 IL-6基因表达水平的上调。IL-17A发挥抗感染作用的机制之一就是促进固有免疫因子和趋化因子的产生。防御素β2是呼吸道固有免疫必不可少的因子,具有强烈的抗微生物活性以及趋化巨噬细胞和T细胞作用。有研究[20]显示IL-17A是防御素β2最强烈的刺激因子。在本研究中,也发现免疫后中耳黏膜防御素β2基因表达水平增高。CXCL2和CXCL5属于CXC类趋化因子,具有促进中性粒细胞聚集与活化功能。多项研究表明IL-17A可促进黏膜CXCL2和CXCL5的分泌。本研究中,也观察到在免疫的小鼠感染肺炎链球菌后中耳灌洗液中CXCL2和CXCL5升高,与IL-17A的分泌水平一致,而且中耳黏膜CXCL2表达水平增高。
黏膜免疫系统是不同于全身免疫系统的高度独立、具有独特功能的免疫系统,黏膜免疫在诱导局部黏膜免疫反应的同时也可诱发全身免疫应答。我们在免疫后也检测了小鼠脾细胞分泌的IL-17A水平,在PsaA/CTB组,IL-17A的水平明显高于PsaA组及CTB组,表明黏膜免疫活化了CD4+T细胞,诱导了全身细胞免疫应答的产生。
总之,目前的研究证实IL-17A不仅在小鼠肺炎链球菌AOM的自然防御中起重要作用,在疫苗的适应性黏膜免疫保护中也发挥着重要作用,促进了肺炎链球菌从中耳的清除,因此IL-17A很可能成为AOM潜在的治疗手段。本研究也为新一代肺炎链球菌疫苗的设计及免疫策略的选择提供了实验依据。
[ 1 ] De Antonio R, Yarzabal JP, Cruz JP, et al. Epidemiology of otitis media in children from developing countries: a systematic review[J]. Int J Pediatr Otorhinolaryngol,2016, 85: 65-74.
[ 2 ] Usonis V, Jackowska T, Petraitiene S, et al. Incidence of acute otitis media in children below 6 years of age seen in medical practices in five East European countries[J]. BMC Pediatr, 2016, 16(1): 108.
[ 3 ] Xu JH, Dai WJ, Chen B, et al. Mucosal immunization with PsaA protein, using chitosan as a delivery system, increases protection against acute otitis media and invasive infection byStreptococcuspneumoniae[J]. Scand J Immunol,2015, 81(3): 177-185.
[ 4 ] Liu J, Feng Y, Yang K, et al. Early production of IL-17 protects against acute pulmonary Pseudomonas aeruginosa infection in mice[J]. FEMS Immunol Med Microbiol, 2011, 61(2): 179-188.
[ 5 ] Stockinger B, Veldhoen M, Martin B. Th17 T cells: linking innate and adaptive immunity[J]. Semin Immunol, 2007, 19(6): 353-361.
[ 6 ] Milner JD, Brenchley JM, Laurence A, et al. Impaired TH17 cell differentiation in subjects with autosomal dominant hyper-IgE syndrome[J]. Nature, 2008, 452(7188): 773-776.
[ 7 ] Zhang Z, Clarke TB, Weiser JN. Cellular effectors mediating Th17-dependent clearance of pneumococcal colonization in mice[J]. J Clin Invest,2009,119(7):1899-1909
[ 8 ] Wang W, Zhou A, Zhang X, et al. Interleukin 17A promotes Pneumococcal clearance by recruiting neutrophils and inducing apoptosis through a p38 mitogen-activated protein kinase-dependent mechanism in acute otitis media[J]. Infect Immun,2014,82(6):2368-2377.
[ 9 ] Weinberger DM, Malley R, Lipsitch M. Serotype replacement in disease after pneumococcal vaccination[J]. Lancet,2012,378(9807):1962-1973.
[10] Daniels CC, Rogers PD, Shelton CM. A review of Pneumococcal vaccines: current polysaccharide vaccine recommendations and future protein antigens[J]. J Pediatr Pharmacol Ther,2016,21(1):27-35.
[11] Moffitt KL, Malley R. Next generation pneumococcal vaccines[J]. Curr Opin Immun,2011,23(3):407-413.
[12] Berry AM, Paton JC. Sequence heterogeneity of PsaA, a 37-kilodalton putative adhesin essential for virulence ofStreptococcuspneumoniae[J]. Infect Immun,1996,64(12):5255-5262.
[13] Morrison KE, Lake D, Crook J, et al. Confirmation of psaA in all 90 serotypes of Streptococcus pneumoniae by PCR and potential of this assay for identification and diagnosis[J]. J Clin Microbiol, 2000, 38(1): 434-437.
[14] Rajam G, Anderton JM, Carlone GM, et al. Pneumococcal surface adhesin A (PsaA): a review[J]. Crit Rev Microbiol,2008,34(3/4):131-142.
[15] Li Y, Gierahn T, Thompson CM, et al. Distinct effects on diversifying selection by two mechanisms of immunity against Streptococcus pneumoniae[J]. PLoS Pathog,2012,8(11):e1002989.[16] Cohen J M, Khandavilli S, Camberlein E, et al. Protective contributions against invasive Streptococcus pneumoniae pneumonia of antibody and Th17-cell responses to nasopharyngeal colonisation[J]. PloS One,2011,6(10):e25558.
[17] Liu Y, Wang H, Zhang S, et al. Mucosal immunization with recombinant fusion protein DnaJ-△A146Ply enhances cross-protective immunity against Streptococcus pneumoniae infection in mice via interleukin 17A[J]. Infect Immun,2014,82(4):1666-1675.
[18] Suenaga S, Kodama S, Ueyama S, et al. Mucosal immunity of the middle ear: analysis at the single cell level[J]. Laryngoscope,2001,111(2):290-296.
[19] Mcgeachy MJ, Bak-Jensen KS, Chen Y, et al. TGF-β and IL-6 drive the production of IL-17 and IL-10 by T cells and restrain TH-17 cell-mediated pathology[J]. Nat Immunol,2007,8(12):1390-1397.
[20] Chang SH, Dong C. Signaling of interleukin-17 family cytokines in immunity and inflammation[J]. Cell Signal,2011,23(7):1069-1075.
Roleofinterleukin17Ainmucosalimmunityagainstpneumococcalacuteotitismedia
XUJiang-hong,LIANGQiong,LIUXiang,LIWen,DAIWen-jia.
DepartmentofOtolaryngology,EyeEarNoseandThroatHospitalofFudanUniversity,Shanghai200031,China
DAI Wen-jia, Email: daiwenjia@126.com
ObjectiveTo explore the role of interleukin-17A (IL-17A) in mucosal immunity against pneumococcal acute otitis media (AOM).MethodsTwenty-four hours before infection withStreptococcuspneumoniae(SP) 200 μg anti-murine IL-17A was administered intraperitoneally in BALB/c mice. As a control, 200 μg isotype matched rat IgG2a was used. Then, AOM in BALB/c mice was induced by the tympanic route. The degree of the inflammation in the middle ear was evaluated by hematoxylin-eosin (HE) staining. The levels of CXCL5, CXCL2 and IL-17A in the SP-infected mice middle ear lavages (MEL) were measured by enzyme-linked immunosorbent assay (ELISA). PsaA protein was prepared as a new generation pneumococcal vaccine. BALB/c mice were immunized intranasally with PsaA/CTB, PsaA and CTB twice a week for 3 consecutive weeks. IL-17A level in splenocytes two weeks following the last immunization was determined by ELISA. The levels of IL-17A and related cytokine CXCL2, CXCL5 in MEL were also detected after challenge with type 14 SP following immunization. The exprssions of IL-6, defensin β2, CXCL2 mRNA in middle ear mucosa were detected by real-time reverse transcriptase polymerase chain reaction (RT-PCR).ResultsAfter infection, the anti-IL-17-treated mice demonstrated a more severe otitis media compared with the IgG2a-treated mice. Compared with the IgG2a-treated SP-infected mice, the levels of CXCL5, CXCL2 and IL-17A in the anti-IL-17-treated SP-infected mice were significantly lower. IL-17A level in spleen lymphocytes of mice immunized with PsaA/CTB was higher than that with PsaA alone. The higher level of IL-17A and related cytokine CXCL2, CXCL5 in MEL were also detected after challenge with type 14 SP following PsaA/CTB immunization. The IL-6, defensin β2, CXCL2 mRNA expression was also significantly higher in the middle ear mucosa.ConclusionsIL-17A plays an important protective role in mucosal immunity of pneumococcal AOM and provides the experimental basis for the treatment of AOM and the design of a new generation of vaccine and choice of immune strategy. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:318-322,332)
Interleukin-17A; Mucosal immunity; Acute otitis media;Streptococcuspneumoniae
2016-12-27)
(本文编辑 杨美琴)
国家自然科学基金(81000406,81200736)
复旦大学附属眼耳鼻喉科医院耳鼻喉科 卫生部听觉医学重点实验室 上海 200031
戴文佳(Email: daiwenjia@126.com)
10.14166/j.issn.1671-2420.2017.05.003

