分泌性中耳炎患者自然杀伤细胞比例、白介素4和干扰素γ表达水平的变化分析
廖兴春
·临床研究·
分泌性中耳炎患者自然杀伤细胞比例、白介素4和干扰素γ表达水平的变化分析
廖兴春
目的探讨分泌性中耳炎(SOM)患者自然杀伤(NK)细胞比例、白介素4(IL-4)、干扰素γ(IFN-γ)表达水平的变化及意义。方法选取2014年2月~2016年3月在我院治疗的SOM 患者91例(观察组),同时选取100例健康志愿者作为对照组,检测2组NK细胞比例、IL-4、IFN-γ水平。结果观察组外周血NK细胞为(16.80±7.10)%,明显低于对照组(P<0.05);观察组IL-4和IFN-γ分别为(310.01±50.81)pg/L和(1 904.66±150.12)pg/L,明显高于对照组(P<0.05)。急性SOM患者外周血NK细胞比例为(18.20±5.11)%,明显高于慢性SOM患者(P<0.05),而IL-4和IFN-γ分别为(260.22±40.13)pg/L和(1 705.81±150.43)pg/L,明显低于慢性SOM患者(P<0.05)。病程≥3个月的患者外周血NK细胞为(14.81±4.10)%,明显高于病程<1个月和1~3个月患者(P<0.05),IL-4和IFN-γ分别为(352.14±60.21)pg/L和(2 081.88±190.16)pg/L,明显高于病程<1个月和1~3个月患者(P<0.05)。观察组患者中耳积液IFN-γ为(2 109.41±142.60)pg/L,明显高于外周血(P<0.05)。结论SOM 患者NK细胞比例低,IL-4和IFN-γ高表达,可能在疾病的发病过程中发挥一定的作用。(中国眼耳鼻喉科杂志,2017,17:342-344, 350)
分泌性中耳炎;自然杀伤细胞;白介素4;干扰素γ;外周血;中耳积液
分泌性中耳炎(secretory otitis media, SOM)是临床上较为常见的耳鼻喉科疾病。有研究[1]显示SOM 的发病率可达123/10万人以上。疾病长期发展,可以导致患者听力功能受损,严重者会导致远期听功能丧失[2]。对于SOM 发病过程中相关生物学机制的研究,可以为揭示其发病机制提供参考,并为临床上的综合治疗提供理论依据。白介素4(interleukin-4, IL-4)及干扰素γ(interferon-γ,IFN-γ)是反映Th1/Th2细胞免疫平衡的重要细胞因子,其升高可以通过加剧自身免疫性紊乱、炎症损伤等,促进SOM 病情的进展[3-5]。本研究选取2014年2月~2016年3月在我院治疗的SOM 患者91例,探讨NK细胞的比例变化及IL-4、IFN-γ在SOM患者血清、局部分泌物中的表达。
1 资料与方法
1.1 一般资料 SOM 患者91例(观察组),年龄20~38岁;男性57例、女性34例。纳入标准:①经电耳镜、声导抗等确诊为SOM;②均为初次治疗,病程>1个月;③患者及家属知情同意并签署同意书。排除标准:①有变应性鼻炎、湿疹等过敏性疾病史;②合并恶性肿瘤、糖尿病、结核、病毒性肝炎等疾病;③近期服用过免疫抑制剂。同时选取100例健康志愿者作为对照组,年龄19~40岁,男性60例、女性40例。2组受试者性别、年龄等差异均无统计学意义(P>0.05)(表1)。

表1 2组一般资料比较
1.2 检测方法 清晨采集空腹静脉血,按照10 000 r/min的速度进行离心,-20 ℃保存待测。采集标本后1周内检测IL-4、IFN-γ水平。采用瑞士罗氏全自动生化分析仪E170模块进行检测。检测试剂盒购自上海泰康生物科技有限公司。具体检测方法参照试剂盒说明书,试剂盒内配有质控血清或质控标准品,所有操作严格按照操作说明完成。
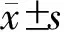
2 结果
2.1 2组外周血NK细胞、IL-4、IFN-γ比较 观察组外周血NK细胞比例明显低于对照组(P<0.05),而IL-4和IFN-γ明显高于对照组(P<0.05)(表2)。
2.2 观察组急慢性患者外周血NK细胞、IL-4、IFN-γ比较 以病程≥3个月为慢性,<3个月为急性。急性患者外周血NK细胞比例明显高于慢性患者,而IL-4和IFN-γ水平明显低于慢性患者(P<0.05)(表3)。
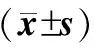
表2 2组外周血NK细胞、IL-4和IFN-γ比较

表3 观察组急、慢性患者外周血NK细胞、IL-4、IFN-γ比较
2.3 观察组不同病程患者外周血NK细胞、IL-4、IFN-γ比较 病程≥3个月患者外周血NK细胞比例明显高于病程<1个月和1~3个月患者(P<0.05),而IL-4和IFN-γ明显高于病程<1个月和1~3个月患者(P<0.05)(表4)。
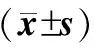
表4 不同病程患者外周血NK细胞、IL-4、IFN-γ比较
注:a示与<1个月组比较,差异有统计学意义(P<0.05);b示与1~3个月组比较,差异有统计学意义(P<0.05)
2.4 不同年龄段患者外周血NK细胞、IL-4、IFN-γ比较 20~25岁、26~30岁和>30岁组患者外周血NK细胞、IL-4和IFN-γ分别为(16.83±6.22)%、(305.82±43.28)pg/L和(1 895.20±132.48)pg/L,(16.73±7.01)%、(312.38±50.10)pg/L和(1 913.22±140.01)pg/L、(16.70±6.22)%、(311.19±52.43)pg/L和(1 993.22±147.22)pg/L,差异均无统计学意义(F=1.894、2.193和3.011,P值均>0.05)。
2.5 观察组外周血与中耳积液IL-4和IFN-γ比较 观察组患者外周血与中耳积液IL-4差异无统计学意义(P>0.05),而中耳积液IFN-γ水平明显高于外周血(P<0.05)(表5)。
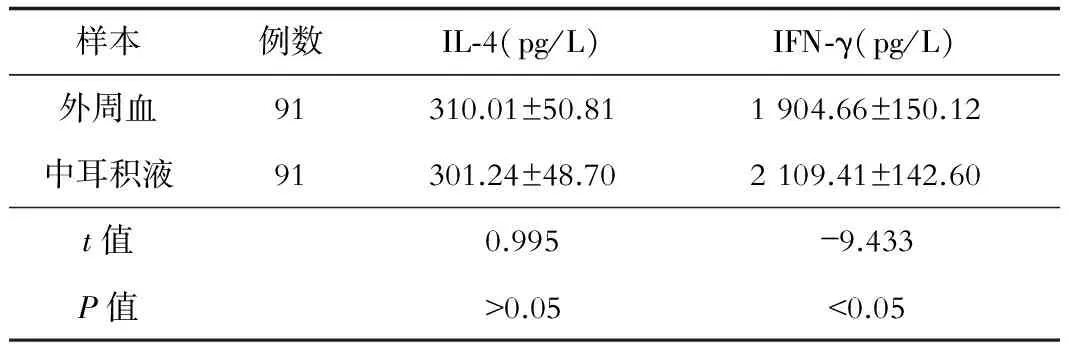
表5 观察组外周血与中耳积液IL-4和IFN-γ比较
3 讨论
自身免疫功能紊乱、遗传因素及感染等,均可以促进SOM的发生、发展,特别是在具有感染性疾病史、免疫功能下降的人群中,SOM的发病率更高,可较普通对照人群上升3~4倍[6]。临床上SOM 病情的进展,严重影响了患者的生活质量。一项汇集了119例样本量的临床前瞻性研究显示,现阶段临床上抗感染等综合措施治疗SOM 的总有效率不足35%,且治疗后的复发率较高,病情缓解率也不足40%,临床治疗具有一定的局限性[7-8]。
T细胞免疫在调节局部组织损伤、免疫复合物沉积及氧化应激损伤等方面均发挥一定的作用,Th1/Th2细胞可以通过分泌相应的细胞因子,参与疾病的发生、发展过程中。IL-4是Th2细胞分泌的炎症因子,其羧基末端的多重巯基结构,可以通过诱导下游单核细胞、巨噬细胞等浸润或者损伤咽鼓管,进而加剧SOM 患者听功能的减退[9- 10];IFN-γ是Th1细胞分泌的炎症因子,IFN-γ上升可以加剧下游NK细胞对于咽鼓管上皮细胞的吞噬或者促凋亡作用,并通过加剧局部缺血-再灌注损伤,进而影响到咽鼓管的功能[11-13]。
本研究发现,观察组患者血清中NK细胞比例明显下降,低于健康对照组,而IFN-γ及IL-4等细胞因子表达明显上升,高于对照组,差异具有统计学意义,提示IFN-γ及IL-4等可能参与了SOM 的发病过程。IFN-γ及IL-4等上升,可以加剧局部组织中炎症细胞的浸润,促进单核细胞诱导的组织损伤,进而促进病情进展。Sylvester等[14-15]收集分析了74例急性SOM 的临床资料,发现在病例组患者中,IFN-γ及IL-4等的表达可较普通对照人群上升3~4倍,且患者的病情越重,IFN-γ及IL-4等的表达越高,这与本研究的结论较为一致。在急性发病的患者中,NK细胞比例明显上升,NK的上升可以发挥其对于下游抗原呈递细胞或者树突细胞等的上调作用,进而提高机体的细胞免疫应答功能,而IFN-γ及IL-4等细胞炎症因子的表达却明显低于慢性组,主要考虑在急性发病早期,血清中IFN-γ及IL-4等细胞炎症因子的分泌可能存在一定延迟。但Sylvester等[14]在急性发病的患者中发现,急性期SOM 患者血清中IFN-γ及IL-4的表达均明显高于慢性组。这与本研究结论不完全一致,考虑临床病例入组、排除标准的偏倚,检测试剂盒的不同等,可能导致最终结论的差别。另外,在不同年龄阶段的患者中,并未发现IFN-γ及IL-4的表达差异,而在不同病程中,表达差异较为明显,且患者的病程越长,IFN-γ及IL-4的表达越高,差异性趋势较为明显。表明病程越差患者体内的炎症反应越严重,NK细胞免疫功能越差。最后,本研究并未发现观察组患者中耳积液IL-4的表达差异,而IFN-γ可有一定程度的上升,主要考虑与局部咽鼓管腺体分泌亢进有关。
综上所述,在SOM 患者血清中,NK细胞表达下降,而IFN-γ及IL-4等细胞炎症因子表达明显上升。同时局部中耳分泌物中的IFN-γ也呈现上升趋势。在临床治疗过程中可以通过随访相关指标的变化,进而评估临床效果。特别是对于治疗后病情缓解程度不高的患者,此时血清学指标的参考价值更高。但本研究仍然存在一定的局限性:①对于IFN-γ及IL-4等指标与SOM 患者病情严重程度间的关系分析不足;②对于IFN-γ及IL-4等指标的诊断学价值分析不足。
[ 1 ] Pumarola F, ISDL Cueva, Sistiaga-Hernando A, et al. Etiología bacteriana de la otitis media aguda en Espaa en la era de la vacuna neumocócica conjugada[J]. Anales de Pediatría,2016,85(5):224-231.
[ 2 ] Kim HJ, Kim SY, Kwon JY, et al. Identification of potential novel biomarkers and signaling pathways related to otitis media induced by diesel exhaust particles using transcriptomic analysis in an in vivo system[J]. PLoS One,2016,11(11):6044-6051.
[ 3 ] 甄丽红,苏法仁,丁静华,等. 综合疗法治疗成人分泌性中耳炎分析[J]. 中华耳科学杂志,2015,24(3):508-510.
[ 4 ] 迟作华,刘振,肖平. NK细胞及IL-2、IL-4、IFN-γ在上呼吸道感染诱发急性分泌性中耳炎患者的表达[J]. 中国实验诊断学,2014,22(6):973-975.
[ 5 ] 何光耀,唐安洲,谭颂华. 分泌性中耳炎中细胞因子的研究进展[J]. 广西医科大学学报,2012,32(4):650-652.
[ 6 ] Neff BA, Voss SG, Carlson ML, et al. Treatment of eosinophilic otitis media with pegylated interferon-α 2a and 2b[J]. Laryngoscope,2016,22(5):90-92.
[ 7 ] Son MJ, Choi S, Kim Y, et al. Herbal medicines for the treatment of otitis media with effusion: a systematic review of randomised controlled trials[J]. BMJ Open,2016,6(11):50-53.
[ 8 ] 万学梅,杨军,贾欢. 儿童分泌性中耳炎的手术疗效比较、术后复发因素及对策[J]. 中华耳鼻咽喉头颈外科杂志,2014,49(11):964-967.
[ 9 ] 刘振,王跃健,肖平,等. 流式细胞术微球阵列法检测多种细胞因子在分泌性中耳炎患者中的表达[J]. 中华耳科学杂志,2011,32(4):448-450.
[10] 马慧琴,张治军. 分泌性中耳炎相关细胞因子免疫机制研究进展[J]. 山东大学耳鼻喉眼学报,2012,24(4):78-81.
[11] 秦彩虹,赵守琴,杨琳,等. 干扰素γ及白细胞介素4在慢性分泌性中耳炎患者中耳积液及外周血中的表达及意义[J]. 中华医学杂志,2013,93(20):1559-1562.
[12] 舒艳,罗浩,姚红兵. 儿童分泌性中耳炎致骨导听力下降的临床特征分析[J]. 中华耳科学杂志,2011,25(1):24-27.
[13] 黄家军, 王琼莲, 李智群, 等. 分泌性中耳炎患者外周血和中耳积液中 IFN-γ 和 IL-4 的检测及意义[J]. 中国实验诊断学, 2015 ,19(11): 1844-1846.
[14] Sylvester MJ, Sanghvi S, Patel V M, et al. Malignant otitis externa hospitalizations: analysis of patient characteristics[J]. Laryngoscope,2016,25(6):67-69.
[15] 马翔宇. 分泌性中耳炎患儿手术治疗前后炎性细胞因子的变化及其临床意义[J]. 中国全科医学,2014,22(9):1017-1020.
Expressionandsignificanceofnaturekillercells,interleukin-4andinterferon-γinsecretoryotitismedia
LIAOXing-chun.
DepartmentofOtorhinolaryngology,theSecondPeople’sHospitalofNeijianginSichuanProvince,Neijing641000,China
LIAO Xing-chun, Email: 330792417@qq.com
ObjectiveTo investigate the expression and significance of nature killer (NK) cells, interleukin-4(IL-4), interferon-γ (IFN-γ) in peripheral blood and middle ear effusion of secretory otitis media (SOM) patients.MethodsNinety-one cases of SOM treated from February 2014 to March 2016 were selected as the observation group. At the same time, 100 healthy volunteers were selected as the control group. The expression of NK cells, IL-4 and IFN-γ in the two groups were detected.ResultsPeripheral blood NK cells in the observation group were (16.80±7.10)%, significantly lower than those in the control group (P< 0.05). IL-4 and IFN-γ in the observation group were (310.01±50.81) pg/L and (1 904.66±150.12) pg/L, all significantly higher than those in the control group (P< 0.05). NK cells in the peripheral blood of patients with acute SOM were (18.20±5.11)%, significantly higher than those of chronic SOM patients (P<0.05), while IL-4 and IFN-γ were (260.22±40.13) pg/L and (1 705.81±150.43) pg/L, significantly lower than those in chronic SOM patients (P< 0.05). NK cells in the peripheral blood of patients with course ≥3 months were (14.81±4.10)%, significantly higher than course <1 month and 1~3 months patients (P< 0.05); IL-4 and IFN- γ were (352.14±60.21) pg/L and (2 081.88±190.16) pg/L, significantly higher than the course < 1 month and 1~3 months patients (P< 0.05). The IFN-γ of middle ear effusion in the observation group was (2 109.41±142.60) pg/L, significantly higher than that in the peripheral blood (P<0.05).ConclusionsSOM shows low expression of NK cells and high expression of IL-4 and IFN-γ, and may play a role in the pathogenesis of the disease. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:342-344, 350)
Secretory otitis media; Nature killer cell; Interleukin-4; Interferon-γ; Peripheral blood; Middle ear effusion
2016-12-05)
(本文编辑 杨美琴)
四川省内江市第二人民医院耳鼻喉科 内江 641000
廖兴春(Email: 330792417@qq.com)
10.14166/j.issn.1671-2420.2017.05.008

