人Müller细胞来源的外泌体对脂多糖刺激视网膜色素上皮细胞产生炎症因子的影响△
章淑杰 张荣 张雪瑾 吴继红
·基础研究·
人Müller细胞来源的外泌体对脂多糖刺激视网膜色素上皮细胞产生炎症因子的影响△
章淑杰 张荣 张雪瑾 吴继红
目的研究人原代Müller细胞来源的外泌体(EXO)对脂多糖(LPS)刺激人视网膜色素上皮(RPE)细胞产生炎症因子的影响。方法原代纯化培养人Müller和RPE细胞,通过免疫荧光鉴定RPE细胞,用试剂盒提取得到Müller细胞来源的EXO并通过透射电镜观察和Western印迹法进行鉴定。在无EXO培养基培养人RPE细胞后,分别采用100 ng/mL LPS刺激,不加或加入EXO(50 μg/mL),以不含EXO和LPS培养细胞为对照组,分别通过酶联免疫吸附试验(ELISA)测定和实时反转录聚合酶链反应(RT-PCR)研究RPE细胞产生炎症因子的变化。结果人Müller细胞来源的提取物经透射电镜观察为圆形或半圆形囊泡,直径为30~100 nm,表达EXO特有标志物CD63和Flotillin-1。LPS组上清液中白介素1β(IL-1β)、IL-6、IL-8和肿瘤坏死因子α(TNF-α)的浓度分别为(333.89±41.51)、(404.67±13.88)、(1 557.11±317.08)、(466.78±39.34)μg/mL,EXO+LPS组分别为(214.11±18.14)、(318.12±34.73)、(1 170.37±244.15)、(319.73±41.39)μg/mL,2组比较差异有统计学意义(IL-1β:P<0.01;IL-6、IL-8:P<0.05;TNF-α:P<0.001)。与LPS组相比,EXO+LPS组的相关基因表达受到抑制,其中IL-1β基因表达差异有统计学意义(P<0.05),IL-8、CCL20和TNF-α差异有统计学意义(P<0.001),CCL2与IL-6则组间差异无统计学意义(P>0.05)。结论成功获得Müller来源的EXO,其对LPS刺激RPE细胞产生炎症因子具有一定的调节作用。(中国眼耳鼻喉科杂志,2017,17:323-327)
外泌体;视网膜色素上皮;炎症因子
葡萄膜炎是一种自身免疫性和(或)自身炎症反应性疾病,是常见的眼科疾病[1-2]。视网膜局部炎症及免疫反应的失控与葡萄膜炎的发生互为因果、相互促进,现在临床上采用的诸多治疗策略都旨在打破这一恶性循环。在其发病机制中,视网膜色素上皮(retinal pigment epithelium,RPE)的免疫稳态维持作用损伤起到了重要作用[3-4]。近来研究[5-6]表明,葡萄膜炎是视网膜细胞和免疫细胞相互作用的结果,Müller细胞作为视网膜主要的胶质细胞,对葡萄膜炎的免疫病理学和视网膜生理学功能的调节具有重要作用。
外泌体(exosomes, EXO)是Johnstone等[7]于1987年研究网织红细胞向成熟红细胞转化时被首次发现,其直径为30~100 nm,密度为1.13~1.19 g/mL,是由脂质双分子层包裹的囊泡结构。随后发现大多数细胞(B细胞、T细胞、肿瘤细胞、肥大细胞、树突细胞、神经元和星形胶质细胞等)都可以产生EXO,其广泛存在于人体体液中[8-9]。根据细胞来源的不同,EXO有着不同的功能,其中包括免疫调节功能[10]。
目前广泛使用的内毒素诱导的葡萄膜炎(endotoxin induced uveitis, EIU)动物模型与细胞凋亡、炎性细胞因子等因素相关, 具有炎症发生速度快、病程短、操作简单、重复性和稳定性较好、易于观察等特点, 是一种研究葡萄膜炎发病机制及其预防、治疗等的较好动物模型, 受到国内外的广泛关注[11]。基于此模型研究的一些免疫疗法已经用于临床葡萄膜炎治疗。此次研究中,我们采用脂多糖(lipopolysaccharide, LPS)刺激RPE细胞模拟EIU模型,提取并鉴定人Müller细胞分泌的EXO,但其是否对RPE细胞的免疫稳态具有一定的调节作用还不清楚。本研究主要探讨人Müller细胞来源的EXO对LPS刺激RPE细胞模拟EIU模型中RPE细胞分泌炎症因子的影响,以期找到对其免疫学功能的调节作用,为葡萄膜炎治疗提供新思路。
1 材料与方法
1.1 材料 DMEM/F12细胞培养液(Gibco,美国)、胎牛血清(fetal bovine serum,FBS;Gibco,美国)、胰蛋白酶(Gibco,美国)、D-Hanks液(Gibco,美国)、BCA法蛋白测定试剂盒(海门碧云天,中国)、ExoQuick-TCEXO提取试剂盒(SBI,美国)、兔抗-CD63(Abcam,美国)、兔抗-Flotillin-1(Abcam,美国)、鼠抗-actin(Abcam,美国)、鼠抗-RPE65(Novus Biologicals,美国)、羊抗兔二抗和驴抗鼠二抗(Abcam,美国)、荧光二抗(Invitrogen,美国)、hoechst33258(Invitrogen,美国)、ECL发光液(Thermo,美国)、LPS(E.coli,O111:B3)(Sigma-Aldrich,美国)、白细胞介素1β (interleukin-1β, IL-1β)、IL-6、IL-8和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测试剂盒(eBioscience,美国)、实时反转录聚合酶链反应(real-time reverse transcriptional polymerase chain reaction, RT-PCR)引物由生工合成(表1)、0.22 μm过滤器(Millpore,德国)、H-7650透射电子显微镜(Hitachi,日本)、化学发光成像分析仪(Kodak,美国)、SP8共聚焦荧光显微镜(Leika,德国)、Synergy H1全自动微孔板检测仪(Biotek,美国)、ViiA7实时荧光定量PCR仪(ABI,美国)。
1.2 方法
1.2.1 原代RPE细胞纯化培养 取本院眼库的捐献眼球,用剪刀在角巩膜缘后5 mm开始,环形去除虹膜和晶状体,剪除眼球前节;然后把眼球的视神经提起,使得眼前节向下;将玻璃体从环口中脱下,用镊子反复夹去玻璃体,整个玻璃体连同基底部视网膜会同时脱下来,将松动的视网膜从视神经根部剪除干净。RPE-脉络膜-巩膜(RPE面置上)平铺于D-Hanks液,表面滴加0.25%胰蛋白酶,37 ℃继续消化30 min;随后用含血清的DMEM-F12培养液终止,经移液器轻轻吹打,使RPE细胞脱落,离心细胞悬液(1 000转/min,5 min),弃去上清液。以2.5×104/mL密度接种于培养瓶。随后显微镜下观察RPE原代细胞,其为大小不一、内含较多色素颗粒的圆形细胞。原代细胞培养贴壁后3 d,增殖速度明显加快,至4~5 d即可基本融合。细胞质内色素颗粒则随传代次数增多而逐渐减少。
1.2.2 原代RPE细胞鉴定 取2~3代培养人RPE细胞,按照5×103/mL接种于提前放置2 cm×2 cm载玻片的培养皿中,培养3~5 d,取出载玻片进行免疫荧光鉴定。先用4%冷的多聚甲醛固定10 min后,磷酸盐缓冲液(phosphate-buffered saline,PBS)洗3遍。随后用0.2%Triton X-100通透10 min,PBS洗3遍。采用与二抗相同宿主的血清封闭30 min,PBS洗3遍。一抗4℃湿盒内过夜,PBS洗3遍。二抗置室温2 h(避光),PBS洗3遍。最好用4′,6-联脒-2-苯基吲哚二盐酸盐(4′,6-diamidino-2-phenylindole dihydrochloride, DAPI)染核3 min,PBS洗3遍后,封片直接照荧光。
1.2.3 人Müller细胞来源的EXO提取 传代生长的人Müller细胞,长至培养皿底板面积的60%左右,弃培养液,PBS洗3次;加入新的无血清DMEM-F12细胞培养液,培养24 h后,收集条件培养基10 mL,离心弃沉淀物后,使用22 μm 微孔滤膜(Millipore)过滤2次。用ExoQuick-TC(SBI)试剂盒法从人Müller细胞培养上清液分离出EXO,并用透射电镜观察其形态特征。
1.2.4 EXO鉴定 将抽提到的EXO,采用BCA法进行蛋白定量,随后通过Western印迹法进行EXO特异性抗原分子CD63和Flotillin-1鉴定。
1.2.5 人原代 RPE细胞的培养及处理 取人原代RPE细胞,以含1.5 g/L 碳酸氢钠、15% FBS的DMEM-F12培养基于37 ℃、5%CO2的温湿培养箱中培养,3~4 d传代1次。取生长状态良好的3代细胞随机分3组:空白对照组(培养基中不含LPS),LPS组(培养基中含LPS 100 ng/mL)和EXO+LPS组(培养基中含LPS 100 ng/mL、EXO 50 μg/mL)。各实验组以去EXO血清培养RPE细胞,24 h后收集细胞上清液,ELISA检测炎症因子IL-1β、IL-6、IL-8和TNF-α蛋白浓度。收集细胞,抽提mRNA,反转录后通过RT-PCR方法检测IL-1β、IL-8、CCL2、CCL20、 IL-6、TNF-α和GAPDH基因表达变化。
1.2.6 ELISA检测炎症因子的蛋白 按照ELISA试剂盒说明书检测各组细胞上清液中IL-1β、IL-6、IL-8和TNF-α蛋白浓度。细胞培养过程中均使用去热源的耗材。
1.2.7 RT-PCR方法检测相关基因的表达 按照Takara试剂盒说明书,收集细胞,抽提mRNA,反转录后通过RT-PCR方法检测IL-1β、IL-8、CCL2、CCL20、IL-6、TNF-a和GAPDH等基因表达变化。细胞培养过程中均使用去热源的耗材(引物序列见表1)。

表1 用于RT-PCR实验的引物序列
1.2.8 统计学处理 以上实验重复3次,RT-PCR结果采用2-ΔΔCt的计算方式进行运算,所有数据应用GraphPad Prism 5 统计软件分析,用均数±标准差表示,P<0.05为有统计学意义。2组间均数的比较采用t检验。
2 结果
2.1 人原代RPE细胞鉴定结果 人原代RPE细胞表达标志性蛋白RPE-65(图1)。
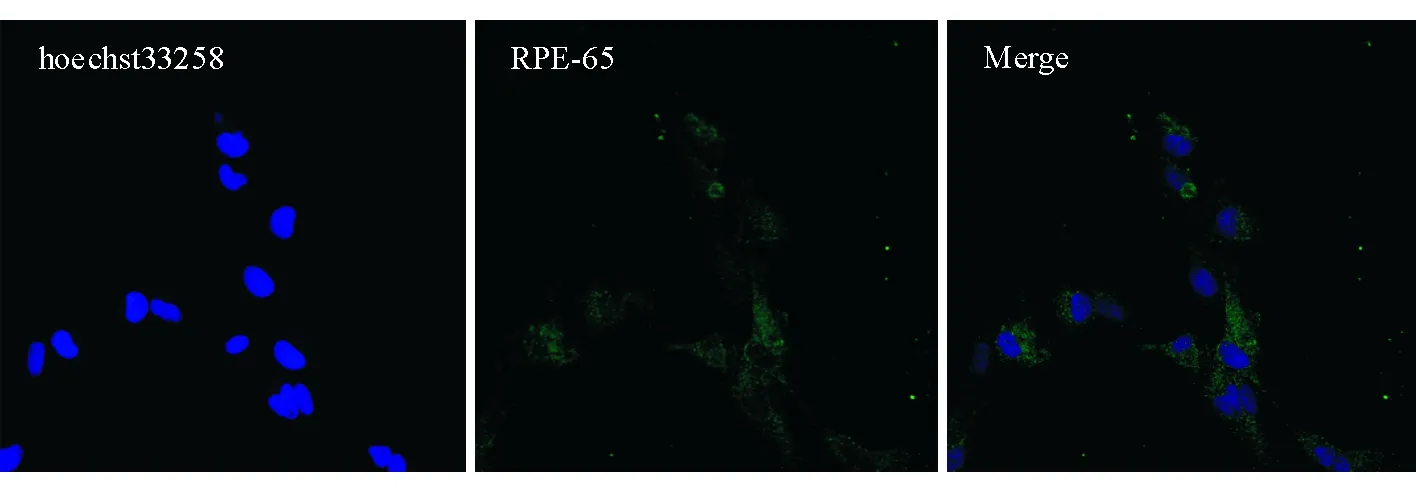
图1. 人原代RPE细胞免疫荧光结果 纯化得到的P3代人RPE细胞表达特异性标志物RPE-65(×400)
2.2 EXO形态特征 透射电镜下,人原代Müller细胞来源的EXO呈圆形或者椭圆形,直径为30~100 nm,具有囊泡样特征(图2)。
2.3 EXO标志物CD63以及Flotillin-1蛋白表达情况 蛋白免疫印迹实验结果显示,人原代Müller细胞来源的EXO表达CD63以及Flotillin-1蛋白,而新鲜培养基中(即空白对照组)不表达(图3)。
2.4 人Müller细胞来源的EXO对RPE细胞炎症因子表达的影响 各实验组上清液检测结果显示:LPS组上清液中IL-1β、IL-6、IL-8和TNF-α的浓度为(333.89±41.51)、(404.67±13.88)、(1 557.11±317.08)、(466.78±39.34)μg/mL,EXO+LPS组为(214.11±18.14)、(318.12±34.73)、(1 170.37±244.15)、(319.73±41.39)μg/mL,2组比较差异有统计学意义(IL-1β:P<0.01;IL-6、IL-8:P<0.05;TNF-α:P<0.001)。与LPS组相比,EXO+LPS组产生的炎症因子明显下调,表明人Müller细胞来源的EXO对LPS刺激的RPE细胞产生炎症因子具有一定的抑制作用,可以减少炎性因子的产生(图4)。
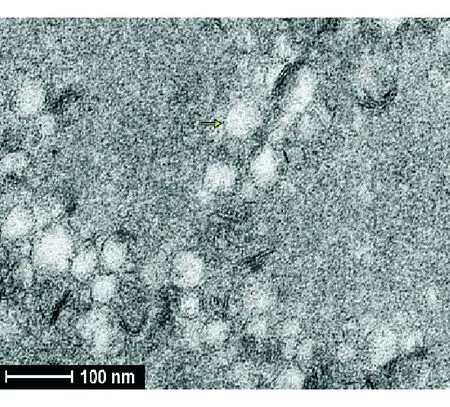
图2. 透射电镜观察:EXO形态为典型的圆形或椭圆形,直径为30~100 nm
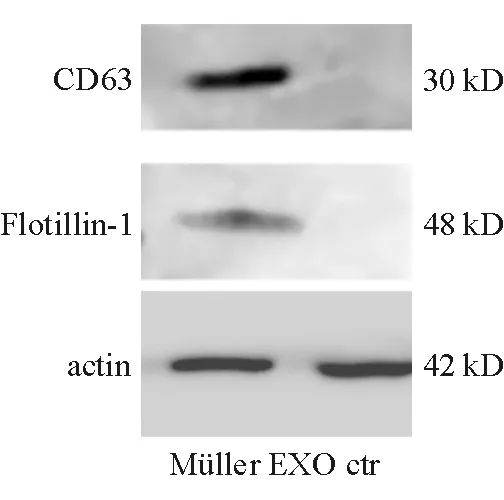
图3. 人原代Müller细胞来源的EXO表达CD63以及Flotillin-1蛋白
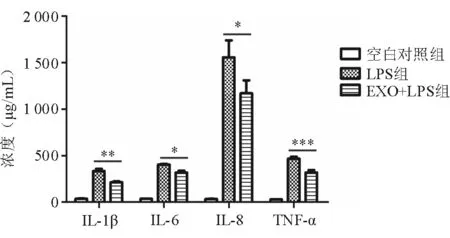
图4. EXO作用于经LPS刺激的人RPE细胞24 h后,上清液中IL-1β、IL-6、IL-8和TNF-α的浓度变化 组间相比,*表示P<0.05,**表示P<0.01,***表示P<0.001
2.5 人Müller细胞来源的EXO对RPE细胞相关基因表达水平的影响 各实验组抽提mRNA反转录得到cDNA后,应用生工合成引物(表1),通过RT-PCR检测分析结果显示:与LPS组相比,EXO+LPS组的相关基因表达受到抑制,其中IL-1β基因表达差异有统计学意义(P<0.05),IL-8、CCL20和TNF-a差异有统计学意义(P<0.001),CCL2与IL-6则组间差异无统计学意义。表明人Müller细胞来源的EXO对LPS刺激RPE细胞的活化和基因表达具有一定的抑制作用,同时对活化指标CCL2、CCL20的表达也有一定的调节作用(图5)。
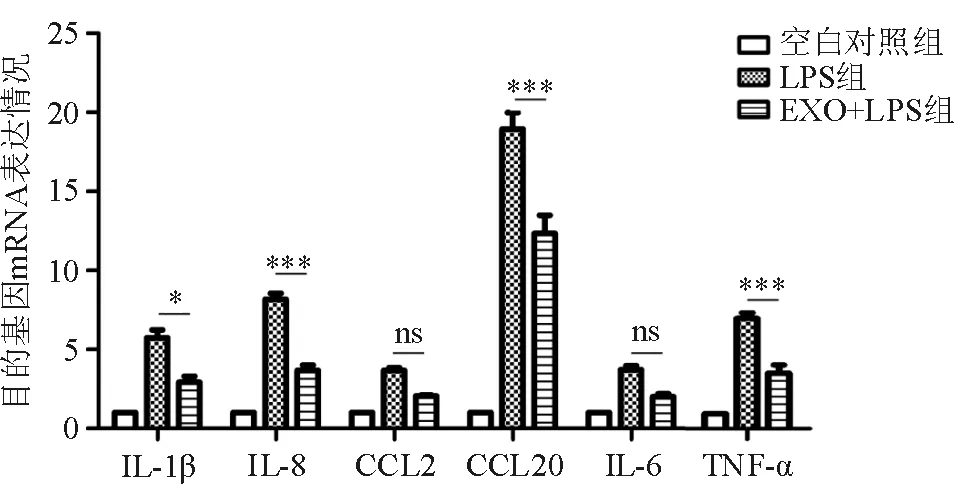
图5. EXO作用于经LPS刺激的人RPE细胞24 h后相关基因的表达变化 组间相比,*表示P<0.05,**表示P<0.01,***表示P<0.001,ns表示差异无统计学意义
3 讨论
在葡萄膜炎发病机制中,视网膜相关细胞以及相互免疫应答在其中起到一定的作用,RPE细胞为视网膜10层结构中的最外层,具有视细胞外节的吞噬和消化,脉络膜-视网膜屏障及营养、代谢产物的输送,黑色素的合成及过氧化脂质的生成、泵与黏着作用,维生素A的代谢,自我维持等多种生理功能。RPE细胞可分泌多种细胞因子,包括IL-1、IL-6、色素上皮衍生因子(pigment epithelium-derived factor, PEDF)、核黄素转运因子1(RFT-1)、纤维蛋白相关抗原(FRa)、成纤维细胞生长因子(fibroblast growth factor,FGF)、TNF-α、干扰素γ(interferon-γ,IFN-γ)、粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)等,在RPE细胞参与的多种疾病过程中发挥重要作用[12]。此外,RPE细胞具有重要的免疫学表型和功能,例如表达Toll样受体、补体成分、MHC-Ⅰ、MHC-Ⅱ分子,能诱导表达HLA-Ⅱ类抗原,并且还能产生许多促炎性的细胞因子。在视网膜炎病理进程中,RPE细胞的激活损伤起到了重要作用[13-15]。视网膜Müller细胞作为视网膜中的主要胶质细胞,在整个葡萄膜炎的免疫病理进程中发挥重要作用。我们的研究旨在进一步探讨Müller细胞来源的EXO对LPS刺激RPE细胞产生炎症因子的影响,着眼Müller细胞来源的EXO对RPE的激活以及分泌炎症相关因子的能力研究。经过人原代RPE细胞的纯化培养和鉴定,我们采用第3代RPE细胞进行实验,并且通过免疫荧光发现3代之内的RPE细胞均呈RPE-65阳性。
相关研究报道,EXO可携带多种微小RNA及蛋白活性因子在细胞间稳定存在并传递信息,对疾病的生理、病理过程发挥重要的生物学作用[16],越来越多的研究表明EXO具有调控炎症的作用;但是有关EXO影响RPE细胞活化以及分泌炎症因子的研究目前暂未见报道。我们的研究结果显示,成功获取的Müller细胞来源的EXO作用于LPS刺激的RPE细胞24 h后,可以显著抑制IL-1β、 IL-6、IL-8和TNF-α蛋白的分泌,与LPS组相比,EXO+LPS组产生的炎症因子明显减少。与LPS组相比,EXO+LPS组的炎症和RPE细胞活化相关的基因表达均受到一定的抑制,表明人Müller细胞来源的EXO对LPS刺激RPE细胞的炎症和细胞活化基因表达具有一定的抑制作用。
本实验结果有助于为临床干扰视网膜炎症病理生理过程中,炎性细胞因子分泌失调的研究提供新的线索。在我们的后续研究中,将进一步深入探讨其作用机制。
[ 1 ] Nussenblatt RB. The natural history of uveitis[J]. Int Ophthalmol, 1990, 14(5/6):303-308.
[ 2 ] 杨培增. 我国葡萄膜炎领域研究现状及未来发展方向[J]. 中华眼科杂志, 2015,51(10):721-725.
[ 3 ] Hou S, Kijlstra A, Yang P. Molecular genetic advances in uveitis[J]. Prog Mol Biol Transl Sci, 2015, 134:283-298.
[ 4 ] Perez VL, Caspi RR. Immune mechanisms in inflammatory and degenerative eye disease[J]. Trends Immunol, 2015, 36(6):354-363.
[ 5 ] Deeg CA, Amann BA, Lutz K, et al. Aquaporin 11, a regulator of water efflux at retinal Müller glial cell surface decreases concomitant with immune-mediated gliosis[J]. J Neuroinflammation, 2016, 13(1):89.
[ 6 ] Llorenç V, Mesquida M, Molins B, et al. Bacillus calmette-guérin infection and cytotoxicity in the retinal pigment epithelium[J]. Ocul Immunol Inflamm, 2016, 23:1-7.
[ 7 ] Johnstone RM, Adam M, Hammond JR, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes)[J]. J Biol Chem, 1987, 262(19):9412-9420.
[ 8 ] Keller S, Sanderson MP, Stoeck A, et al. Exosomes: from biogenesis and secretion to biological function[J]. Immunol Lett, 2006, 107(2):102-108.
[ 9 ] Bang C, Thum T. Exosomes: new players in cell-cell communication[J]. Int J Biochem Cell Biol, 2012,44(11):2060-2064.
[10] Desdín-Micó G, Mittelbrunn M. Role of exosomes in the protection of cellular homeostasis[J]. Cell Adh Migr, 2017,11(2):127-134.
[11] Göncü T, Ogˇuz E, Sezen H, et al. Anti-inflammatory effect of lycopene on endotoxin-induced uveitis in rats[J]. Arq Bras Oftalmol, 2016,79(6):357-362.
[12] 黄大蕊,王桂云. 视网膜色素上皮细胞的损伤因素与治疗进展[J]. 中华实验眼科杂志,2014,32(1):88-93.
[13] Kaestel CG, Lovato P, Ødum N, et al. The immune privilege of the eye: human retinal pigment epithelial cells selectively modulate T-cell activation in vitro[J]. Curr Eye Res, 2005, 30(5):375-383.
[14] Bazan NG. Neurotrophins induce neuroprotective signaling in the retinal pigment epithelial cell by activating the synthesis of the anti-inflammatory and anti-apoptotic neuroprotectin D1[J]. Adv Exp Med Biol, 2008, 613:39-44.
[15] Zhang S, Yu N, Zhang R, et al. Interleukin-17A Induces IL-1β secretion from RPE cells via the NLRP3 inflammasome[J]. Invest Ophthalmol Vis Sci, 2016, 57(2):312-319.
[16] Maas SL, Breakefield XO, Weaver AM. Extracellular vesicles: unique intercellular delivery vehicles[J]. Trends Cell Biol, 2017,27(3):172-188.
EffectofexosomesderivedfromhumanMüllercellsonsecretionofinflammatoryfactorsfromretinalpigmentepitheliumcellsinducedbylipopolysaccharide
ZHANGShu-jie,ZHANGRong,ZHANGXue-jin,WUJi-hong.
EyeInstitute,EyeEarNoseandThroatHospitalofFudanUniversity,Shanghai200031,China
WU Ji-hong, Email: jihongwu@fudan.edu.cn
ObjectiveTo study the effect of exosomes(EXO) derived from primary human Müller cells on lipopolysaccharide (LPS) stimulating human retinal pigment epithelium (RPE) cells to produce inflammatory factors.MethodsExosomes extracted from primarily cultured and purified Müller cells by kit were observed by transmission electron microscopy (TEM) and appraised by Western blot. Human primary RPE cells were identified by using immunofluorescence(IF). Human RPE cells were cultured with or without EXO (50 μg/mL) after LPS(100 ng/mL) stimulation, without EXO and LPS as the control group. Inflammatory cytokines produced by RPE cells were detected by using enzyme-linked immunosorbent assay and real-time polymerase chain reaction.ResultsCircular or semicircular vesicles were observed by TEM, and the diameters were 30~100 nm. The specific markers CD63 and Flotillin-1 were detected in the EXO. The concentrations of interleukin-1β (IL-1β), IL-6、IL-8 and tumor necrosis factor-α(TNF-α) in the supernatant of LPS group [(333.89±41.51), (404.67±13.88), (1 557.11±317.08), (466.78±39.34) pg/mL] and EXO+LPS group [(214.11±18.14), (318.12±34.73), (1 170.37±244.15), (319.73±41.39) pg/mL] were compared and the differences were significant respectively (IL-1β:P<0.01; IL-6, IL-8:P<0.05; TNF-α:P<0.001). Compared with LPS group, the related gene expression was inhibited in EXO+LPS group. IL-1β gene differentially expressed significantly (P<0.05), IL-8, CCL20 and TNF-α genes were significantly different (P<0.001), while CCL2 and IL-6 genes were not significantly different between the two groups (P>0.05).ConclusionsEXO were derived from Müller cells successfully. EXO from Müller cells has effect on LPS stimulating RPE cells to produce inflammatory factors. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:323-327)
Exosomes; Retinal pigment epithelium; Inflammatory factors
△国家自然科学基金(81200675,81470624)
2016-12-22)
(本文编辑 诸静英)
复旦大学附属眼耳鼻喉科医院眼科研究院 上海视觉损伤与修复重点实验室 卫生部近视眼重点实验室 上海 200031
吴继红(Email: jihongwu@fudan.edu.cn)
10.14166/j.issn.1671-2420.2017.05.004

