提取时间等因素对果脯类食品甜蜜素测定结果的影响
□忻 琦
(浙江经贸职业技术学院 浙江 杭州 310018)
提取时间等因素对果脯类食品甜蜜素测定结果的影响
□忻 琦
(浙江经贸职业技术学院 浙江 杭州 310018)
利用气相色谱法,通过超时浸渍、超时超声和加碱中和对果脯样品中甜蜜素含量的样品前处理进行实验,结果表明超时浸渍、超声和加碱中和对果脯中甜蜜素提取结果有显著的影响。对果脯类粘稠复杂的食品进行甜蜜素提取时可通过超时浸渍、超时超声和加碱中和来提高甜蜜素提取率。
果脯类食品;甜蜜素提取;提取时间;影响
环己基氨基磺酸钠(Sodium Cyclamate)俗称甜蜜素[1],是一种比较常见的非营养添加甜味剂,甜度约为蔗糖的40~50倍[2],是我国常用的甜味添加剂之一。口服甜蜜素不会在体内形成积累,但是过量摄入会对人体的肝脏和神经系统造成危害。
随着科学技术的进步、设备精密度的提高,在甜蜜素的测定方面,一些学者和专业技术人员进行了大量的技术探讨,其中关于气相色谱仪条件优化的研究[3]探讨较多,对食品中甜蜜素测定效率的提高做出了很多贡献,但对食品前处理过程的优化较少。我国食品中甜蜜素的测定广泛采用气相色谱法,然而根据国标(GB5009.97-2016)[2]对于果脯、蜜饯、凉果等试样制备的过程复杂繁琐,准确率和效率低[2,5],对于甜蜜素试样前处理的优化需要进一步探讨,尤其提取时间方面的优化。
1 材料与方法
1.1 仪器与试剂
仪器:Agilent 7890A型气相色谱仪带自动进样器配备氢火焰离子化检测器(美国安捷伦柯基有限公司);色谱柱:HP-5(30m*320μm*0.25μm)。
标准物质:食品甜味剂环己基氨基磺酸钠标准溶液(GBW(E)100027)。
试剂:亚硝酸钠(AR,沪试);硫酸(AR,98%,沪试);氯化钠(AR,沪试);氢氧化钠(AR,沪试);丙酮(AR,沪试);正庚烷(GCS,沃凯)。
实验食品样品为:华味亨,吃不厌话梅。
1.2 试剂配制
1.2.1 试剂配制。氢氧化钠溶液(10g/L):称取50g氢氧化钠,溶于水,转移至容量瓶并稀释至500mL,混匀。
硫酸溶液(200g/L):称取54g硫酸,小心缓缓加入300mL水,转移至容量瓶并稀释至500mL,混匀。
亚硝酸钠溶液(50g/L):称取25g氢氧化钠,溶于水,转移至容量瓶并稀释至500mL,混匀。
1.2.2 标准溶液配制。环己基氨基磺酸钠(5.00mg/mL):精确称取0.5612g环己基氨基磺酸钠标准品,用水溶解并定容至100mL,混匀,此溶液1.00m相当于环己基氨基磺酸5.00mg(环己基氨基磺酸钠与环己基氨基磺酸的换算系数为0.8 909)。
环己基氨基磺酸标准使用液(1.00mg/mL):准确移取20.0mL环己基氨基磺酸标准储配液用水稀释定容至100mL,混匀。
1.2.3 样品制备。按照国标,果脯蜜饯属于低脂、低蛋白样品。样品从包装中取出,用剪刀剪开去核、剪碎,集中于研磨皿中。捣碎,研磨至粘稠糊状,并充分混匀。
1.3 实验方法
由于果脯样品粘稠复杂的性质,研磨果脯样品非常费时费力,且效果很差。而制作果脯的过程中,原材料经过超长时间的浸润,甜蜜素等添加剂已经深入样品中,想要完全提取出来非常不易。针对果脯样品难以提取的特性,本文采用国标法、超时浸渍法和超时超声法分别对同一批样品进行提取,并上机测试相应试样提取出的甜蜜素的浓度,比较各方法的效果,并分析是否可用于实际的甜蜜素测试工作中。
除此之外,实验分析发现,果脯样品在加水提取的过程中,呈很强的酸性。由于甜蜜素在酸性条件下会缓慢分解,本文还通过对比不加碱中和和加碱中和两组试样测得的甜蜜素浓度,来进一步分析加碱中和的必要性。
1.3.1 国标标准样品前处理。称取5.0g左右打碎混匀样品于50mL离心管中,加30mL水,振摇,超声提取 20min,混匀,离心(3 000r/min)10min,过滤,用水分次洗涤残渣,收集滤液并定容至50mL,混匀备用。[2]
1.3.2 超时浸渍样品前处理。称取5.0g左右打碎混匀样品于50mL离心管中,加30mL水,振摇,置于18℃环境下,分别浸渍 8、16、24、32h,超声提取20min,混匀,离心(3 000r/min)10min,过滤,用水分次洗涤残渣,收集滤液并定容至50mL,混匀备用。
1.3.3 超时超声提取样品前处理。称取5.0g左右打碎混匀样品于50mL离心管中,加30mL水,振摇,分别超声提取 20min、1h、2h、4h,混匀,离心(3 000r/min)10min,过滤,用水分次洗涤残渣,收集滤液并定容至50mL,混匀备用。
1.3.4 加碱中和样品前处理。称取5.0g左右打碎混匀样品于50mL离心管中,加30mL水和0.5mL 10g/mL的NaOH溶液,振摇,超声提取20min,混匀,离心(3 000r/min)10min,过滤,用水分次洗涤残渣,收集滤液并定容至50mL,混匀备用。
1.3.5 加碱中和超时浸渍样品前处理。称取5.0g左右打碎混匀样品于50mL离心管中,加30mL水和0.5mL 10g/mL的NaOH溶液,振摇,置于18℃环境下,分别浸渍 8、16、24、32h,超声提取 20min,混匀,离心(3 000r/min)10min,过滤,用水分次洗涤残渣,收集滤液并定容至50mL,混匀备用。
1.3.6 加碱中和超时超声提取样品前处理。称取5.0g左右打碎混匀样品于50mL离心管中,加30mL水和0.5mL 10g/mL的NaOH溶液,振摇,超声提取20min、1h、2h、4h,混匀,离心(3 000r/min)10min,过滤,用水分次洗涤残渣,收集滤液并定容至50mL,混匀备用。
1.3.7 酸性对甜蜜素分解影响的实验。通过比较两组标准物质(初始浓度0.20mg/mL),一组加硫酸调节pH值低于1,另一组保持中性,同时放在25℃室温下,于 0、4、8、16、24 时后进行衍生化,测定其中甜蜜素含量,制甜蜜素浓度关于时间的曲线图。
1.3.8 超时浸渍对甜蜜素提取影响的实验。通过比较两组果脯样品,一组试样采取不加碱超时浸渍处理,一组采用加碱超时浸渍处理。两组在浸渍过程中,保存于18℃环境中。分别于浸渍8、16、24、32h后进行衍生化并上机测试,同时以一组国标法测定结果为参照,结果绘制甜蜜素浓度关于时间的曲线图。
1.3.9 超时超声对甜蜜素提取影响的实验。通过比较两组果脯样品,一组试样采取不加碱超时超声处理,一组采用加碱超时超声处理。两组在超声过程中,使用循环水维持水温不变。分别于超时20min(国标法)[2]和1、2、4个小时后进行衍生化并上机测试,结果绘制甜蜜素浓度关于时间的曲线图。
1.3.10 衍生化。准确移取10mL已制备好的试样溶液,预冰浴10min;保持冰浴并加入2.5mL硫酸溶液,2.5mL亚硝酸钠溶液,盖紧盖子,立即震荡,然后加入5.0mL正庚烷并迅速盖紧盖子,摇匀;继续冰浴30min,期间震荡5次;加入2.5g氯化钠,盖紧盖子后在漩涡混合器上震动1min;静置20min后备用。
1.4 测定
分别用自动进样器注入1μL经衍生化处理的标准系列各浓度上清液入气相色谱仪中,可测得不同浓度被测物的响应值峰,以浓度为横坐标,以环己醇亚硝酸酯和环己醇[6]两峰面积之和为纵坐标,绘制标准曲线。
在完全相同的条件下进样1μL经衍生化的试样上清液,保留时间定性,测得峰面积,根据标准曲线得到样液中的组份浓度,平行测定两次。
1.4.1 色谱条件。进样口:210℃,分流比2:1,隔垫吹扫流量30mL/min;
色谱柱:载气为氮气,1.2mL/min;
柱温箱程序升温:初始温度50℃;以10℃/min升温到180℃,保持2min;以8℃/min升温到210℃,保持5分钟;尾吹流量30mL/min;
检测器:温度300℃,氢气30mL/min,空气300mL/min。
1.4.2 分析结果的表述。试样中环己基氨基磺酸含量按下式计算:
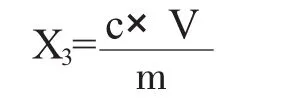
X3——试样中环己基氨基磺酸的含量,单位为毫克每千克(mg/kg);
c——由标准曲线计算出的试样溶液中环己基氨基磺酸的浓度,单位为微克每毫升(μg/mL);
V——试样的定容体积,单位为毫升(mL),本实验为50mL;
m——试样的质量,单位为克(g)。
2 结果分析
2.1 色谱图
在实验条件下进行气相色谱分析得到部分色谱图如下图1~5所示:
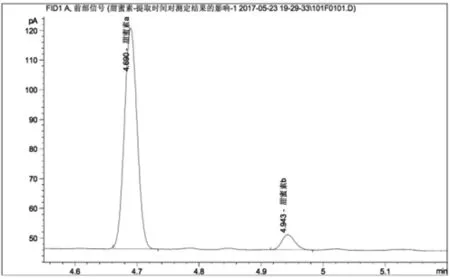
图1 国标标准法测定果脯中甜蜜素含量的色谱图
图1为用国标标准方法测定的果脯甜蜜素含量的色谱图,其中甜蜜素a、b分别代表环己醇亚硝酸酯和环己醇,对应的保留时间分别为4'41"和4'57"。其基线稳定,杂峰数量极小,甜蜜素衍生化两组分出峰良好。测定甜蜜素含量为0.190mg/mL。
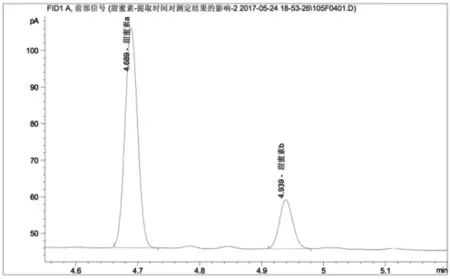
图2 超时浸渍法测定果脯中甜蜜素含量的色谱图
图2为在国标基础上,未加碱中和超时浸渍32h的色谱图,其中甜蜜素a、b分别代表环己醇亚硝酸酯和环己醇,对应的保留时间分别为4'41"和4'57"。其基线稳定,杂峰数量极小,甜蜜素衍生化两组分出峰良好。测定甜蜜素含量为0.175mg/mL。
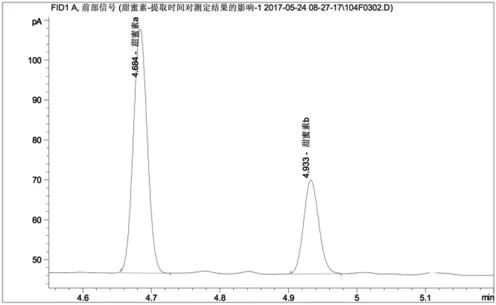
图3 超时超声法测定果脯中甜蜜素含量的色谱图
图3为在国标基础上,未加碱中和超时超声提取4h的色谱图,其中甜蜜素a、b分别代表环己醇亚硝酸酯和环己醇,对应的保留时间分别为4'41"和4'57"。其基线稳定,杂峰数量极小,甜蜜素衍生化两组分出峰良好。测定甜蜜素含量为0.204mg/mL。
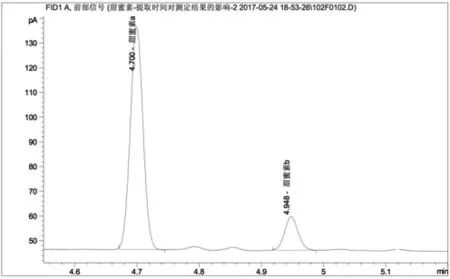
图4 加碱超时浸渍法测定果脯中甜蜜素含量的色谱图
图4为在国标基础上,加碱中和并超时浸渍32小时的色谱图,其中甜蜜素a、b分别代表环己醇亚硝酸酯和环己醇,对应的保留时间分别为4'42"和4'57"。其基线稳定,杂峰数量极小,甜蜜素衍生化两组分出峰良好。测定甜蜜素含量为0.248mg/mL。
图5为在国标基础上,加碱中和并超时超声提取4小时的色谱图,其中甜蜜素a、b分别代表环己醇亚硝酸酯和环己醇,对应的保留时间分别为4'42"和4'57"。其基线稳定,杂峰数量极小,甜蜜素衍生化两组分出峰良好。测定甜蜜素含量为0.213mg/mL。
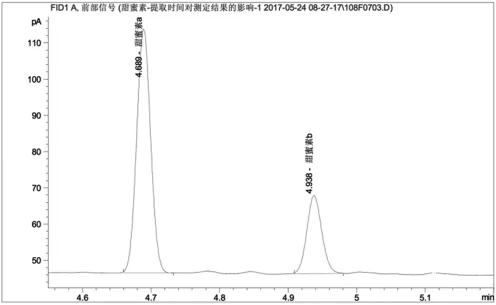
图5 加碱超时超声提取法测定果脯中甜蜜素含量的色谱图
2.2 不同因素的影响分析
2.2.1 加碱中和。甜蜜素在酸性环境下会缓慢分解,且这种分解只能发生在衍生化之前。这种分解会造成甜蜜素测定结果偏低,如果分解时间过长,会造成比较大的影响。在样品前处理过程中加碱中和酸性能有效抑制这种分解。
本实验通过超长时间对比甜蜜素在中性和酸性环境下久置,不同时间下浓度的变化,研究甜蜜素在酸性条件的分解情况。本实验结果显示,甜蜜素在酸性条件下会分解,但是比较缓慢,如图6所示24h只分解了10%,因此,从果脯中提取甜蜜素前处理时间比较长时,应进行加碱中和,以确保提取效果。
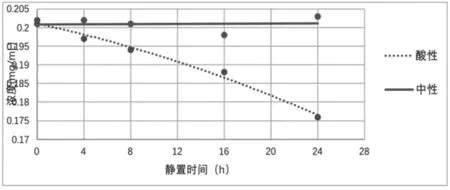
图6 酸性条件下甜蜜素分解情况
孙靖茹的研究也发现[7],在液相色谱法测定甜蜜素的过程中,因为本身流动相为弱碱性,所以某些情况下酸碱性可能会造成保留时间不一致。加碱中和也可以保持各样品保留时间的一致性。
2.2.2 超时浸渍。浸渍是一种常用的提取办法,对于果脯来说,是腌制的逆过程。浸渍的优点是操作简单,样品打碎研磨后泡在水中就可以了,只要容器没有限制,可以非常大批量的制备样品。但是浸渍的缺点也很明显,浸渍过程比较缓慢,而且由于果脯本身酸性比较强,浸渍过程中甜蜜素可能会分解。
如下图7所示,本实验结果表明,在加碱抑制甜蜜素分解的情况下,浸渍超过24h后,含量已经高出24.5%;浸渍超过32h后,甜蜜素的含量可高出25.6%。而不加碱组的浓度在浸渍超过24h后,因为甜蜜素分解的含量开始下降。这说明超时浸渍在提取果脯中的甜蜜素有显著影响。
2.2.3 超时超声提取。超声提取是一种非常实用而有效的快速提取方法,然而对于果脯等粘稠且复杂的样品来说,国标的超声提取20min是远远不够的。
本实验结果如下图8所示,加碱的试样对超声灵敏度要高于不加碱的试样。4h的超时超声后,不加碱的试样的浓度提高了7.9%,加碱的试样则为10.9%。说明超声的确能有效提取果脯中的甜蜜素,但是4h的超声仍然无法比较完全提取出浸润在样品中的甜蜜素。
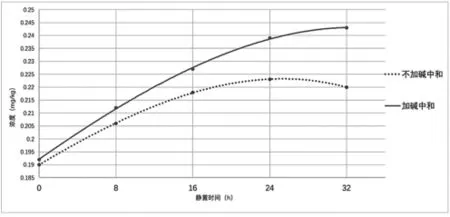
图7 超时浸渍法测定果脯中甜蜜素含量结果

图8 超时超声法测定果脯中甜蜜素含量结果
简单的超声效果非常有限,图8中可以看出,即使超声超时到4个小时,仍然只提高了10.9%的浓度。而1小时左右,浓度关于超声时间曲线的斜率是骤降的,说明超声提取的效果已接近极限,想要尽可能完全提取果脯试样中的甜蜜素,超声时间应加长。
白艳玲[8]等的研究中,也同时采用了超声和浸渍两种方法,得出了一些食品样品经过浸渍2h后超声30min可以达到超声平衡的结论。
结束语
加碱中和、超时浸渍和超时超声都对果脯中甜蜜素的提取有显著影响。其中超时浸渍方法可以更完全地提取果脯中的甜蜜素;超时超声方法可以更快的提取果脯中的甜蜜素;加碱中和的方法则可以抑制超长时间浸泡下甜蜜素的分解并有助于食品样品解构,使样品更加均匀而不黏连。
在处理类似于果脯一类的粘稠复杂的食品样品过程中,前处理阶段超时处理必不可少,并配套加碱中和。样品前处理中延长超声时间,并合理加入8~16h的浸渍时间,会更有助于提高甜蜜素检测的准确性。
[1]中华人民共和国国家卫生和计划生育委员会.GB 1886.37-2015食品安全国家标准 食品添加剂 环己基氨基磺酸钠(又名甜蜜素)[S].北京:中国标准出版社,2015.
[2]中华人民共和国国家卫生和计划生育委员会.GB 5009.97-2016食品安全国家标准 食品中环己基氨基磺酸钠的测定[S].北京:中国标准出版社,2016.
[3]程水连,王泽科,祝正辉.气相色谱外标法测定食品中甜蜜素含量方法的改进[J].食品与机械,2013,29(2):85~87.
[4]徐嘉,王学连,杨晓燕,等.GCMS检测食品中的甜蜜素[J].广州化工,2016,44(12):124~126.
[5]向仲朝,罗赟.高效液相色谱测定食品中环己基氨基磺酸钠的提取方法研究[J].现代预防医学,2012,39(11):2822~2823,2828.
[6]史玉坤,喻利娟.甜蜜素衍生产物的色谱/质谱确定[J].中国卫生检验杂志,2006,16(5):617~618.
[7]孙靖茹,董倩.酸碱性对液相色谱串联质谱法测定酒类中甜蜜素的影响[J].酿酒,2017,44(3):38~40.
[8]白艳玲,王丽玲.超声提取气相色谱法快速测定食品中甜蜜素含量的研究[J].中国热带医学,2004,4(2):190~191.
1004-7026(2017)16-0074-04
O657.71;TS207.3
A
10.16675/j.cnki.cn14-1065/f.2017.16.050
忻琦(1993.9-),本科,实验助理,研究方向:化学检测。

