异槲皮苷对HepG2细胞中Raf/MEK/ERK信号通路的干预作用
蒋国君,刘天旭,黄桂红,巫 亭,陶丽群,朱钊铭
(桂林医学院1.临桂临床医学院,2.第二附属医院药学部,广西 桂林 541199)
异槲皮苷对HepG2细胞中Raf/MEK/ERK信号通路的干预作用
蒋国君1,刘天旭1,黄桂红2,巫 亭1,陶丽群2,朱钊铭2
(桂林医学院1.临桂临床医学院,2.第二附属医院药学部,广西 桂林 541199)
目的研究异槲皮苷对HepG2细胞中Raf/MEK/ERK信号通路的干预作用。方法采用异槲皮苷(0、40、80、160、320 μmol·L-1)作用于HepG2细胞,MTT法检测异槲皮苷对HepG2细胞增殖的影响;倒置显微镜下观察24、48 h后,细胞形态及生长情况;流式细胞术检测异槲皮苷(0、40、80、160 μmol·L-1)作用HepG2细胞48 h后细胞周期情况;荧光定量PCR及Western blot检测异槲皮苷作用HepG2细胞后Ras、Raf、MEK、ERK mRNA及相关蛋白的表达。结果MTT检测发现异槲皮苷对HepG2细胞生长有明显抑制作用,且与异槲皮苷的浓度及作用时间呈正相关;不同浓度的异槲皮苷作用HepG2细胞24、48 h后,倒置显微镜下观察发现随着浓度的增高及作用时间的延长,细胞生存数量逐渐减少,且细胞形态发生明显变化;流式细胞术检测发现随着异槲皮苷浓度的增高,细胞被阻滞在G1期的数量逐渐增加;荧光定量PCR及Western blot结果均表明,与空白组相比,异槲皮苷(80 μmol·L-1)作用HepG2细胞后Ras、Raf、MEK、ERK mRNA及其相关蛋白的表达均明显降低(P<0.05),差异有统计学意义。结论异槲皮苷有诱导HepG2细胞凋亡的作用,其作用机制可能与对Raf/MEK/ERK信号通路中相关因子的干预有关。
异槲皮苷;诱导;HepG2细胞;Raf/MEK/ERK;信号通路;凋亡
肝癌是一种常见的世界性恶性肿瘤,发病率与病死率极高,危害性极大。目前,临床上针对肝癌的治疗手段主要包括外科手术、化疗、放疗以及肝移植等,这些治疗手段都有明显缺陷,如预后差、副作用大[1]。因此,肝癌病人迫切需要寻找具有有效抗癌作用的新型治疗药物。异槲皮苷存在于大量的中草药、植物及食物当中,具有抗氧化、降血压、抗炎、抗肿瘤及抗恶性细胞增殖的作用[2-6]。课题组前期研究发现异槲皮苷具有诱导癌细胞凋亡的功能,但其具体的分子机制尚未完全明确。本实验拟从细胞水平探讨异槲皮苷对肝癌细胞抑制作用的分子机制,为异槲皮苷治疗肝癌的研究提供新的理论依据。
1 材料与方法
1.1材料人肝癌HepG2细胞购自中科院上海细胞研究所;异槲皮苷购自Spring&autumn公司(纯度≥98%,批号:482-35-9);Ras、Raf、p-Raf、MEK、p-MEK、ERK、p-ERK、β-actin抗体购自Abcam公司;荧光定量PCR试剂(批号:RR420A)、TRIzol(批号:9108)购自日本TaKaRa公司;血清(胎牛)购自ExCell Bio公司(批号:11E074);DMEM培养基购于Gibco公司(批号:8114351);Ras、Raf、MEK、ERK、β-actin上下游引物和探针由InvitrogenTM公司设计并合成。
1.2方法
1.2.1MTT检测异槲皮苷对HepG2细胞增殖的影响 取对数生长期细胞,接种于96孔板中(每孔2×103个细胞),置37℃、5% CO2条件下培养24 h后,吸弃上清,用培养基将异槲皮苷按下列浓度稀释,制成0、40、80、160、320 μmol·L-1,每组设6个复孔,分别培养24、48、72 h,在检测前4 h,每孔加入制备好的MTT溶液20 μL,置37℃、含5% CO2的饱和湿度培养箱避光继续孵育,4 h后弃去各孔上清液,加入100 μL DMSO,振荡10 min后,将96孔板置于酶标仪450 nm波长下检测,测定各孔OD值。实验重复3次,取平均值,按公式分析实验结果:细胞生长抑制率IR/%=(OD药物组- OD0组)/(OD空白组-OD0组)×100%,求出半数致死率IC50。
1.2.2细胞形态学观察 取对数生长期细胞,以每孔1×106个细胞接种于6孔板中,置37℃、5% CO2条件下培养24 h后,吸弃上清,用培养基将异槲皮苷按下列浓度稀释,制成0、40、80、160、320 μmol·L-1,分别培养24、48 h后,置于倒置显微镜下观察细胞形态及生长情况。
1.2.3流式细胞数检测细胞周期 取对数生长期细胞,以每孔1×106个细胞接种于6孔板中,置37℃、5% CO2条件下培养24 h后,分别加入异槲皮苷,使其终浓度为0、40、80、160 μmol·L-1,培养48 h后,用0.25%胰酶收集细胞,1 000 r·min-1离心5 min,弃上清,加入预冷的0.1 mol·L-1PBS洗涤1次,以1 000 r·min-1离心5 min,弃上清后,使用1 mL PBS重悬,加入2 mL预冷的无水乙醇固定30 min。上机前收集所有固定标本,离心弃上清,用PBS清洗1次,加入PI染液,室温下避光染色30 min,采用流式细胞仪进行细胞周期检测。
1.2.4荧光定量PCR检测Ras、Raf、MEK、ERK相关基因mRNA表达 取对数生长期细胞,以每孔1×106个细胞接种于6孔板中,置37℃、5% CO2条件下培养24 h后,分别加入异槲皮苷及空白培养基,继续培养48 h后收集细胞。TRIzol一步抽提法提取总RNA,取1 μg总RNA逆转录成cDNA,采用15 μL反应体系进行PCR扩增。引物序列如下:Ras上游引物: 5′-GGCAAGAGTGCCTTGACGAT-3′, 下游引物: 5′-TTGACCTGCTGTGTCGAGAA-3′; Raf上游引物:5′-CTCCTTGAATCGGGCTGGTT-3′, 下游引物: 5′-TGGACAGGAAACGCACCATA-3′; MEK上游引物: 5′-TGTGAAGGCGCTGTACTACC-3′, 下游引物: 5′-CAGGATGTTGGAGGGCTTGA-3′; ERK: 上游引物5′-GGCTGTTCCCAAATGCTGAC-3′, 下游引物:5′-TTGAATGGTGCTTCGGCGAT-3′; 内参β-actin作为对照, 上游引物: 5′-CCACTCCTCCACCTTTGAC-3′, 下游引物: 5′-ACCCTGTTGCTGTAGCCA-3′。反应体系包括SYBR 7.5 μL,H2O 6.9 μL,cDNA 0.2 μL,引物0.4 μL。反应条件为:95℃,30 s;95℃,5 s→60℃,30 s,40个循环;65℃→95℃,5 s,0.5℃/循环。
1.2.5Western blot检测Ras、Raf、MEK、ERK相关蛋白的表达 细胞培养及干预作用同上,作用48 h后收集细胞,提取2组细胞的总蛋白,并用BCA法测定蛋白浓度,加热变性后-20℃保存。取各组细胞的总蛋白质70 μg进行SDS-PAGE凝胶电泳,将分离后的蛋白质电转移到PVDF膜,封闭液封闭滤膜4 h,加入适量一抗(Ras:1 ∶50 000,Raf:1 ∶5 000,p-Raf:1 ∶5 000,MEK:1 ∶20 000,p-MEK:1 ∶20 000,ERK:1 ∶10 000,p-ERK:1 ∶10 000,β-actin:1 ∶1 000)4℃过夜,TBST洗膜3次,每次10 min,二抗(1 ∶5 000)室温孵育2 h,TBST洗膜3次,每次10 min,按1 ∶1加入AB发光液,在Bio-Rad的化学发光成像仪上成像,用图像分析软件对条带的灰度值进行分析,分析出Ras、Raf、MEK、ERK相关蛋白的表达。

2 结果
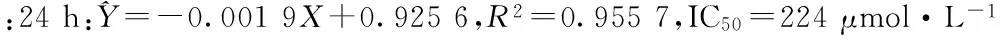
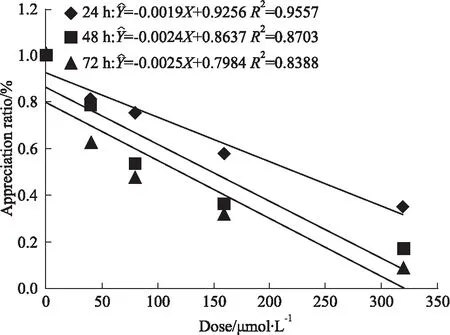
Fig 1 The growth effect of HepG2 cells treated with isoquercitrin
2.2异槲皮苷对HepG2细胞形态的影响如Fig 2所示,倒置显微镜下观察发现,当异槲皮苷作用细胞时间一定时,随着药物浓度的升高,细胞形态发生变化,与空白组相比,随着浓度的升高,可见形态发生变化的细胞数量逐渐增多,且存活的细胞数量逐渐减少,即贴壁的长梭形细胞减少,而悬浮的圆形细胞逐渐增多;当药物浓度一定时,随着异槲皮苷作用时间的延长,可见的形态发生变化的细胞数量也逐渐增多,且存活的细胞数量逐渐减少。
2.3异槲皮苷对HepG2细胞周期的影响Fig 3流式细胞仪检测细胞周期结果显示,与空白对照组相比,随着药物浓度的增加,细胞周期被阻滞在G1期的细胞百分比值逐渐增加(P<0.05),差异有统计学意义。
2.4异槲皮苷对HepG2细胞中Ras、Raf、MEK、ERKmRNA表达的影响Fig 4荧光定量PCR结果显示,与空白组相比,异槲皮苷组Ras、Raf、MEK、ERK mRNA表达明显降低(P<0.05,P<0.01),差异有统计学意义。
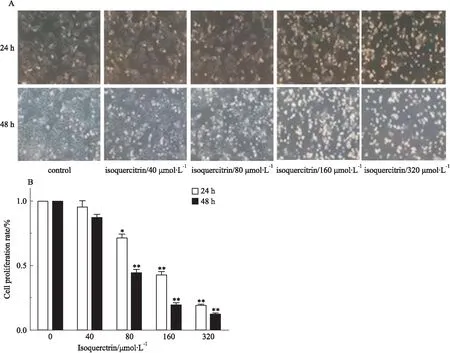
Fig2IsoquercitrininhibitsHepG2cellproliferationobservedbyinvertedmicroscopy(n=3)
A: The morphological changes of HepG2 cells treated with 0, 40, 80, 160 or 320 μmol·L-1of isoquercitrin after 24 h or 48 h were observed by inverted microscopy; B: Percentage of cell proliferation after isoquercitrin(0, 40, 80, 160 or 320 μmol·L-1) treated HepG2 cells for 24 and 48 h.*P<0.05,**P<0.01vscontrol
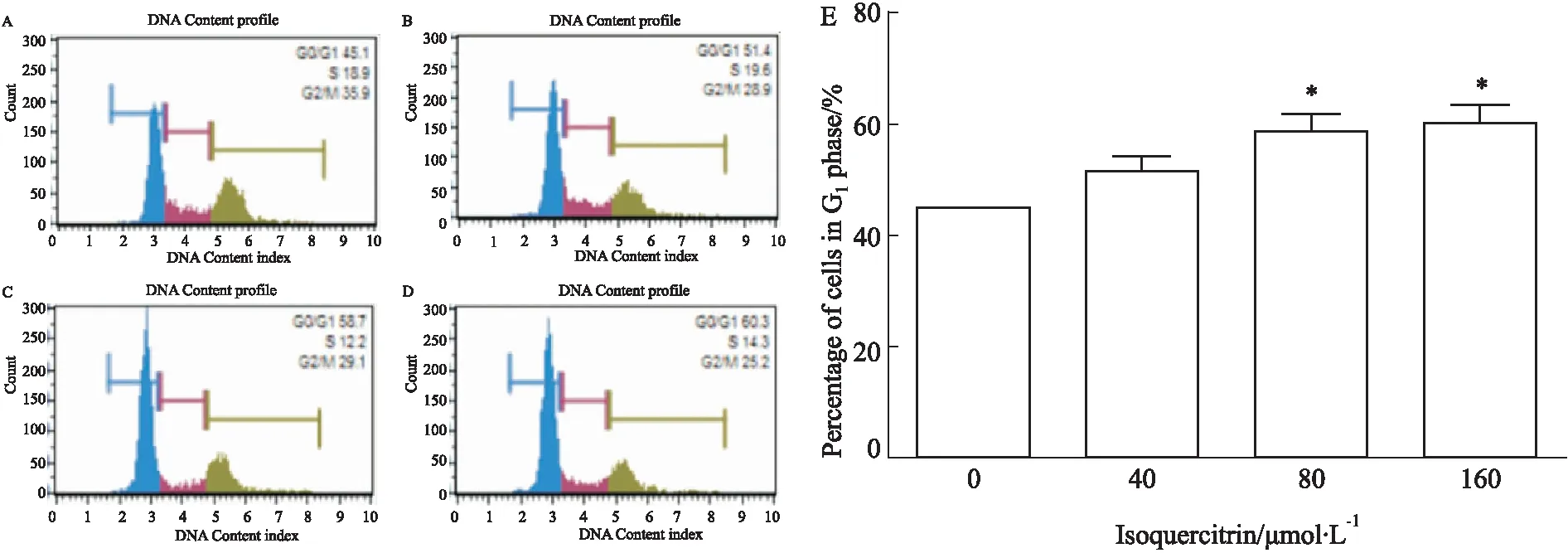
Fig 3 Effect of isoquercitrin on cell cycle distribution in HepG2 cells(n=3)
A: Control; B: Isoquercitrin 40 μmol·L-1; C: Isoquercitrin 80 μmol·L-1; D: Isoquercitrin 160 μmol·L-1; E: Isoquercitrin(0, 40, 80, 160 μmol·L-1) blocks HepG2 cell cycle in the G1phase.*P<0.05vscontrol
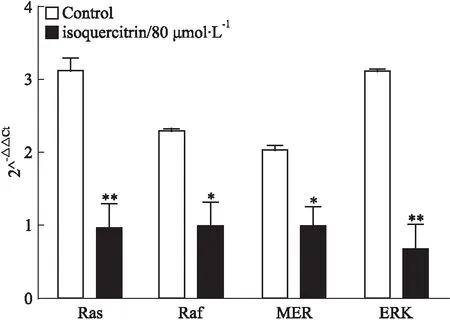
Fig 4 Isoquercitrin inhibits Ras, Raf, MEK,ERK mRNA expression levels in HepG2 cells(n=3)
*P<0.05,**P<0.01vscontrol
2.5异槲皮苷对HepG2细胞中Ras、Raf、MEK、ERK及相关蛋白表达的影响Fig 5 Western blot结果显示,与空白组相比,异槲皮苷组Ras、p-Raf/Raf、p-MEK/MEK、p-ERK1/ERK1蛋白表达的相对比值明显降低,表明异槲皮苷对HepG2细胞中Ras、Raf、MEK、ERK相关蛋白的表达具有下调作用(P<0.05,P<0.01),差异有统计学意义。
3 讨论
中草药因其资源丰富、毒副作用小、能够调节机体代谢等优点已成为国内外关注的焦点,中草药抗肿瘤治疗也越来越受到人们的关注[7]。异槲皮苷可以从多种中草药中提取,如鬼针草、荷叶、红景天以及桑叶等,也可化学合成制得[8-10]。因其广泛的生物活性,如抗氧化、改善心肌功能、抗肿瘤、调节血压、降血脂等作用而备受关注,本课题前期研究也发现异槲皮苷具有诱导癌细胞凋亡的功能。
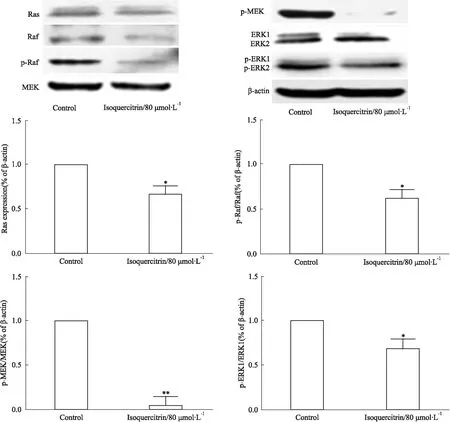
Fig 5 Isoquercitrin inhibits protein expression levels of Ras, Raf, MEK, ERK in HepG2 cells(±s,n=3)
*P<0.05,**P<0.01vscontrol
Ras是小分子量G蛋白家族成员之一,参与细胞的生长、增殖及分化,还影响细胞的生长形态发生及凋亡,活化的受体酪氨酸激酶能够激活Ras蛋白,发生蛋白激酶的级联反应,从而传送到细胞核,这条通路可以由生长因子、细胞因子、射线、渗透压以及体液流过细胞表面时产生的切应力等多种因素激活,被称为丝裂原活化蛋白激酶(mitogenic activated protein kinase,MAPK)通路[11]。MAPK系统还包括ERK、MEK及Raf 3种因子,Raf是MAPK级联反应的第1个分子,它的活化可引发蛋白质磷酸化级联反应,而MEK可以使位于其下游的苏氨酸和酪氨酸残基磷酸化而激活,即Raf作用于MEK,使之磷酸化而活化,活化的MEK再作用于属于MAPK家族的ERK,使其磷酸化而活化,从而介导炎症及恶性细胞增殖[12]。且已有研究报道显示,肝癌患者Raf 及其下游基因 MEK、ERK 的表达均上调,Raf存在过度表达现象,肝癌患者Raf水平明显高于正常人的表达水平[13]。
本实验发现, 异槲皮苷对HepG2细胞的具有抑制作用,且随着药物浓度的增加及作用时间的延长,抑制作用逐渐增强。异槲皮苷作用HepG2细胞48 h后, 倒置显微镜下观察到HepG2的典型凋亡细胞,且随着药物浓度的增加,被阻滞在G1期的细胞百分比值逐渐增大。RT-PCR 和 Western blot 实验显示,与空白对照组相比,异槲皮苷能够明显降低ERK、MEK、Raf、Ras mRNA表达,并使ERK1、p-ERK1、p-MEK、Raf、p-Raf 及Ras蛋白表达降低,差异均具有统计学意义。提示异槲皮苷治疗肝癌的机制与诱导肝癌细胞凋亡有关,其中,通过MAPK信号转导下调Ras、Raf、MEK、ERK mRNA及相关蛋白的表达可能是异槲皮苷诱导肝癌细胞凋亡的重要机制之一。本实验显示异槲皮苷具有较好的诱导肝癌细胞凋亡的作用,在治疗肝癌方面具有较好的应用前景。
(致谢:本实验在桂林医学院附属医院肝脏疾病研究室完成。)
[1] Van Meer S, de Man R A, Siersema P D, et al. Surveillance for hepatocellular carcinoma in chronic liver disease: evidence and controversies[J].WorldJGastroenterol, 2013,19(40):6744-56.
[2] Wu P, Li F, Zhang J, et al. Phytochemical compositions of extract from peel of hawthorn fruit, and its antioxidant capacity, cell growth inhibition, and acetylcholinesterase inhibitory activity[J].BMCComplementAlternMed, 2017,17(1):151.
[3] Li H, Liu Y, Yi Y, et al. Purification of quercetin-3-O-sophoroside and isoquercitrin from Poacynum hendersonii, leaves using macroporous resins followed by Sephadex LH-20 column chromatography[J].JChromatogrBAnalytTechnolBiomedLifeSci, 2017,1048:56-63.
[4] Ge L, Chen A, Pei J, et al. Enhancing the thermostability of α-L-rhamnosidase from Aspergillus terreus and the enzymatic conversion of rutin to isoquercitrin by adding sorbitol[J].BMCBiotechnol, 2017,17(1):21.
[5] Dawbaa S, Aybaster Ö, Demir C. Ultrasensitive determination of DNA oxidation products by gas chromatography-tandem mass spectrometry and the role of antioxidants in the prevention of oxidative damage[J].JChromatogrBAnalytTechnolBiomedLifeSci, 2017,1051:84-91.
[6] Chen Q, Li P, Li P, et al. Isoquercitrin inhibits the progression of pancreatic cancerinvivoandinvitroby regulating opioid receptors and the mitogen-activated protein kinase signalling pathway[J].OncolRep, 2015,33(2):840-8.
[7] 刘慧颖,姜长涛,冯 娟,等.丹参酮类化合物研究进展[J].中国药理学通报,2016,32(12):1643-7.
[7] Liu H Y, Jiang C T, Feng J, et al. Research progress of tanshinones[J].ChinPharmacolBull,2016,32(12):1643-7.
[8] Baby B, Antony P, Al Halabi W, et al. Structural insights into the polypharmacological activity of quercetin on serine/threonine kinases[J].DrugDesDevelTher, 2016,10:3109-23.
[9] 马天翔, 史 宁, 陈 乾,等. 红景天中8种成分体外抗氧化作用的比较[J]. 中国药理学通报, 2012,28(9):1224-8.
[9] Ma T X, Shi N, Chen Q, et al. Comparison on the antioxidant activity of eight components from Rhodiolainvitro[J].ChinPharmacolBull, 2012,28(9):1224-8.
[10] de Freitas M M, Fontes P R, Souza P M, et al. Extracts of Morus nigra L. leaves standardized in chlorogenic acid, rutin and isoquercitrin: tyrosinase inhibition and cytotoxicity[J].PLoSOne, 2016,11(9):e0163130.
[11] Xie W, Wang M, Chen C, et al. Hepatoprotective effect of isoquercitrin against acetaminophen-induced liver injury[J].LifeSci, 2016,152:180-9.
[12] Wang Y, Nie H, Zhao X, et al. Bicyclol induces cell cycle arrest and autophagy in HepG2 human hepatocellular carcinoma cells through the PI3K/AKT and Ras/Raf/MEK/ERK pathways[J].BMCCancer, 2016,16(1):742.
[13] Deming D, Geiger P, Chen H, et al. ZM336372, a Raf-1 activator, causes suppression of proliferation in a human hepatocellular carcinoma cell line[J].JGastrointestSurg, 2008,12(5):852-7.
TheinhibitoryeffectofisoquercitrinonRaf/MEK/ERKsignalingpathwayinHepG2cells
JIANG Guo-jun1, LIU Tian-xu1, HUANG Gui-hong2, WU Ting1, TAO Li-qun2, ZHU Zhao-ming2
(1.LinguiClinicalCollege,GuilinMedicalUniversity,GuilinGuangxi541199,China;2.DeptofPharmacy,theSecondAffiliatedHospitalofGuilinMedicalUniversity,GuilinGuangxi541199,China)
AimTo study the inhibitory effect of isoquercitrin on Raf/MEK/ERK signaling pathway in HepG2 cells.MethodsMTT was used to detect the proliferation of human liver cancer HepG2 cells after the treatment of isoquercitrin. The morphology and growth of cells were observed under inverted microscope after the different concentrations of isoquercitrin(0, 40, 80, 160, 320 μmol·L-1) to treat HepG2 cells for 24 and 48 h. Cell cycle was assessed by flow cytometry. Ras, Raf, MEK, ERK expression was assayed by Western blot, and mRNA expression was detected by quantitative fluorescence PCR.ResultsIsoquercitrin could inhibit the growth of HepG2 cells in a concentration-and time-dependent manner. Typical morphological changes of apoptosis were observed by inverted microscopy after HepG2 cells were treated with different concentrations of of isoquercitrin for 24 h or 48 h. The cell cycle assay showed that with the increasing concentration of isoquerditrin, the number of cells that was arrested in G1phase gradually increased. Compared with the blank group, the expressions of Ras, Raf, MEK, ERK mRNA were down-regulated, and related proteins expression were also down-regulated(P<0.05), and these results had statistical significance.ConclusionIsoquercitrin can induce the apoptosis of HepG2 cells, which may be related to the Raf/MEK/ERK signaling pathway.
isoquercitrin; induce; HepG2 cells; Raf/MEK/ERK; signaling pathway; apoptosis
10.3969/j.issn.1001-1978.2017.10.011
A
:1001-1978(2017)10-1382-06
R284.1;R329.24;R329.25;R735.702.2
时间:2017-9-5 9:26 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170905.0925.022.html
2017-05-29,
2017-07-03
国家自然科学基金资助项目(No 81260661);广西自然科学基金资助项目(No 2012GXNSFAA053079);桂林市科学研究与技术开发计划项目面上项目(No 20140120-1-9;No 20170109-47);广西肝损伤与修复分子医学重点实验室子课题资助项目(No 15-140-46-14)
蒋国君(1990-),女,硕士生,研究方向:临床药学与应用,E-mail:784684807@qq.com; 黄桂红(1972-),女,硕士,教授,硕士生导师,研究方向:糖尿病及哮喘药物,通讯作者,E-mail:huangguihong120@126.com

