白酒酿造过程酒醅中尿素的控制与减少
孟庆达,周新虎,陈翔,堵国成, 4,陈坚, 5,方芳*
1(江南大学 生物工程学院,江苏 无锡, 214122) 2(工业生物技术教育部重点实验室,江苏 无锡, 214122) 3(江苏洋河酒厂股份有限公司,江苏 宿迁, 223800) 4(糖化学与生物技术教育部重点实验室,江苏 无锡, 214122) 5(粮食发酵工艺与技术国家工程实验室,江苏 无锡, 214122)
白酒酿造过程酒醅中尿素的控制与减少
孟庆达1, 2,周新虎3,陈翔3,堵国成1, 2, 4,陈坚1, 2, 5,方芳1, 2*
1(江南大学 生物工程学院,江苏 无锡, 214122) 2(工业生物技术教育部重点实验室,江苏 无锡, 214122) 3(江苏洋河酒厂股份有限公司,江苏 宿迁, 223800) 4(糖化学与生物技术教育部重点实验室,江苏 无锡, 214122) 5(粮食发酵工艺与技术国家工程实验室,江苏 无锡, 214122)
尿素是白酒酿造过程酒醅中含有的氨基甲酸乙酯的主要前体之一,对浓香型白酒中氨基甲酸乙酯含量影响较大,通过降低酒醅中尿素含量可以控制或减少白酒中氨基甲酸乙酯的含量。采用产脲酶菌株或其粗酶与酒醅混合,可在发酵过程中降低尿素含量。 从大曲中筛选到3株产脲酶的腐生葡萄球菌(Staphylococcussaprophyticus,S.saprophyticus)在酒醅固态发酵中去除尿素效果不显著,产酸性脲酶的罗伊氏乳杆菌(Lactobacillusreuteri,L.reuteri)全细胞及其粗酶对酒醅中尿素均有很好的去除效果。通过与商品脲酶比较,罗伊氏乳杆菌所产脲酶粗酶对酒醅中尿素去除效果更佳,尿素去除率可达100%。当罗伊氏乳杆菌添加量高于107CFU/g酒醅时,尿素去除率在97.3% 以上,粗酶加入量高于25 U/kg酒醅时,尿素去除率在77.4% 以上。罗伊氏乳杆菌能较好地去除白酒酒醅中尿素。
白酒;氨基甲酸乙酯;尿素;脲酶;罗伊氏乳杆菌;腐生葡萄球菌
氨基甲酸乙酯(ethyl carbamate, EC)是许多发酵食品中普遍存在的2A类致癌物质[1],可导致肺癌、淋巴癌、肝癌等疾病[2]。其形成途径主要是由相关前体物质在食品发酵或贮藏过程中反应生成。EC前体物质有尿素、乙醇、氰化物、氨甲酰磷酸、瓜氨酸等[3]。研究发现,酒精饮料中氨基甲酸乙酯[4-5]的主要前体有2种:第1种是氰化物[6-7],第2种是与尿素循环有关的物质,如尿素、精氨酸、瓜氨酸等[8]。在黄酒和清酒中,尿素是最主要的EC前体物质,对EC含量影响较大,相关方面的研究较多[9-11]。OUGH[12]早在1976年就证明尿素与乙醇溶液于室温下反应72 h即可生成EC,同时也发现葡萄汁发酵过程中EC的主要来源是由精氨酸分解而来的尿素[13]。前期研究表明,以五粮为原料生产的白酒,酒醅中含有的氨基甲酸乙酯主要前体有尿素和瓜氨酸。二者在蒸酒过程和储酒过程可与体系中存在的乙醇反应生成氨基甲酸乙酯[14]。其中尿素与氨基甲酸乙酯的变化趋势基本同步,二者具有一定的相互关系[15-16]。为了降低酒精饮料中尿素含量,从而减少EC的产生,科研工作者尝试了许多方法,其中包括使用酸性脲酶降解尿素[17-19]、调控氮代谢获得不积累或少积累尿素的酿酒酵母[3, 20-22]、对原料进行精加工[10, 23]等。目前,对于白酒发酵中尿素抑制策略的研究还较少。由于白酒是我国特有的传统酒种,这类问题还需要我国科研工作者的自主研究才能解决[7]。
白酒酿造工艺复杂[24],涉及到许多关键的原料处理过程。酿造原料如小麦、玉米、大米、高粱、糯米等均含有一定量尿素[14],原料处理过程中一般无法将尿素去除,工艺改变则会对酿造产品产生影响。酒醅中尿素主要由原料带入[14, 25]。在发酵过程中,随着乙醇的生成,尿素与乙醇缓慢反应[12, 26-27],生成EC。酒醅蒸馏出酒时,不但会加快尿素与乙醇反应生成EC[23, 28-29],还会使更多的EC进入原酒中[30-31],增加白酒中EC含量。由于EC性质稳定,在白酒中直接去除较难实现,适用于黄酒、清酒、葡萄酒等低度酒的方法[32-33]不适用于白酒。通过在蒸酒和储酒前降低其前体尿素的含量来减少EC产生的方法较为可行。杨宇清等[34]应用食品级脲酶降解黄酒中尿素,效果显著,有效降低了尿素在黄酒煎酒灭菌和贮存过程中对EC生成的影响。由于白酒与黄酒发酵方式和发酵体系的较大差异,应用酶法在白酒酿造过程中降低尿素含量仍需要新的探索。
本研究以浓香型白酒的窖内发酵过程为研究对象,以降低酒醅中尿素的含量为目的,利用脲酶在白酒发酵过程中将尿素去除。通过比较不同来源的产脲酶微生物菌株或粗酶的作用,对全细胞和脲酶去除固态发酵酒醅中尿素进行探究,选出降低尿素效果较好的菌株或脲酶。运用酶法降低尿素,进而减少EC的产生,安全高效,为降低白酒中有害物质氨基甲酸乙酯的研究提供参考。
1 材料与方法
1.1材料
1.1.1 菌种
StaphylococcussaprophyticusM3,StaphylococcussaprophyticusM26,StaphylococcussaprophyticusM39(本研究);LactobacillusreuteriCICC6124 (购买于中国工业微生物菌种保藏中心)。
1.1.2 培养基
富集培养基(g/L):葡萄糖 20,CH3COONa 2,KH2PO42,NaCl 5,尿素20,用HCl(1.5 mol/L)调节pH至4.0。
筛选培养基(g/L):葡萄糖20,蛋白胨10,酵母提取物5,KH2PO42,NaCl 5,CH3COONa 2,尿素 20,溴百里酚蓝(终浓度0.005 g/L),琼脂 20,pH 5.5。
发酵培养基(g/L):葡萄糖20,蛋白胨10,酵母提取物5,KH2PO42,NaCl 5,CH3COONa 2,MnSO4·4H2O 0.05,NiSO4·H2O 0.05,pH 6.8。
MRS培养基(g/L):葡萄糖20,蛋白胨10,牛肉浸膏8,酵母提取物4,吐温80 1,C6H5O7(NH4)32, K2HPO42,CH3COONa 5,MgSO4·7H2O 2,MnSO4·4H2O 0.05,山梨醇单油酸酯1 mL。
1.1.3 其他原料
高温大曲和入窖酒醅,取自江苏洋河酒厂股份有限公司。
1.2试剂及仪器
主要试剂:9-羟基占顿醇(≥99.0%),色谱纯,Sigma-Aldrich公司;商品脲酶、溶菌酶,上海生工股份有限公司;尿素,上海生工股份有限公司;浓盐酸、浓硫酸、甲醇(色谱纯)、乙腈(色谱纯)、无水硫酸钠(分析纯),上海国药集团试剂公司。
仪器设备: MP-FastPrep样品处理系统,美国MP;Sonic超声破碎仪,南京新辰生物科技有限公司;高效液相色谱仪(Agilent-1260),美国安捷伦公司;紫外分光光度计,日本岛津公司;台式高速离心机,德国Eppendorf公司。
1.3方法
1.3.1 产脲酶菌株的分离
采用改良的筛选产酸性脲酶菌株的方法[17]。将大曲和无菌生理盐水混合后接种富集培养基30 ℃培养24 h。稀释涂布筛选培养基30 ℃培养48 h。选取阳性菌株接入发酵培养基30 ℃培养24 h,测定脲酶活性。
1.3.2 菌株属种鉴定
提取微生物的基因组,用细菌16S rDNA的通用引物27F、1492R扩增得到的产物送上海生工进行测序。将16S rDNA序列在NCBI(GenBank)数据库中进行BLAST比对分析鉴定。
1.3.3 菌悬液和脲酶粗酶液制备
菌悬液制备:将罗伊氏乳杆菌纯培养物划线接种在MRS固体培养基上,30 ℃厌氧培养48 h,挑取单菌落接入MRS液体培养基,30 ℃厌氧培养72 h,将菌液8 000 r/min离心2 min,去除上清液,用无菌生理盐水重新悬浮至OD600为10左右,备用。将3株腐生葡萄球菌纯培养物分别划线接种在固体发酵培养基上30 ℃培养24 h,挑取单菌落接入液体发酵培养基,30 ℃ 220 r/min摇床培养24 h,将菌液8 000 r/min离心2 min,去除上清液,用无菌生理盐水重新悬浮至OD600为10左右,备用。菌悬液可用无菌生理盐水稀释至5×105~5×109CFU/mL。
脲酶粗酶液制备:罗伊氏乳杆菌在液体MRS培养基中培养72 h后,用PBS缓冲液(pH 7.0)洗涤3次,重新悬浮,加入终质量浓度为5 mg/mL的溶菌酶后30 ℃水浴处理1 h,超声破碎20 min,4 ℃ 15 000 r/min离心10 min,取上清液作为脲酶粗酶液。腐生葡萄球菌在液体发酵培养基中培养24 h后,细胞破壁取上清液作为脲酶粗酶液。以脲酶粗酶液为母液,4 ℃保存备用。商品脲酶购买于上海生工股份有限公司(编号A003885),用PBS缓冲液溶解并稀释至相应浓度。脲酶粗酶液用PBS缓冲液稀释至30~500 U/L。
1.3.4 模拟窖内发酵
固态发酵:取300 g即将入窖的酒醅(现取现用,如果在-30 ℃保存一段时间后,需要按工厂工艺重新添加大曲),添加60 mL相应浓度的纯菌液或粗酶液,搅拌均匀,分装至三角瓶中,用发酵栓封口。以添加等体积无菌水的入窖酒醅作对照,无添加的入窖酒醅为空白对照,30 ℃发酵70 d。模拟发酵实验流程如图1所示。
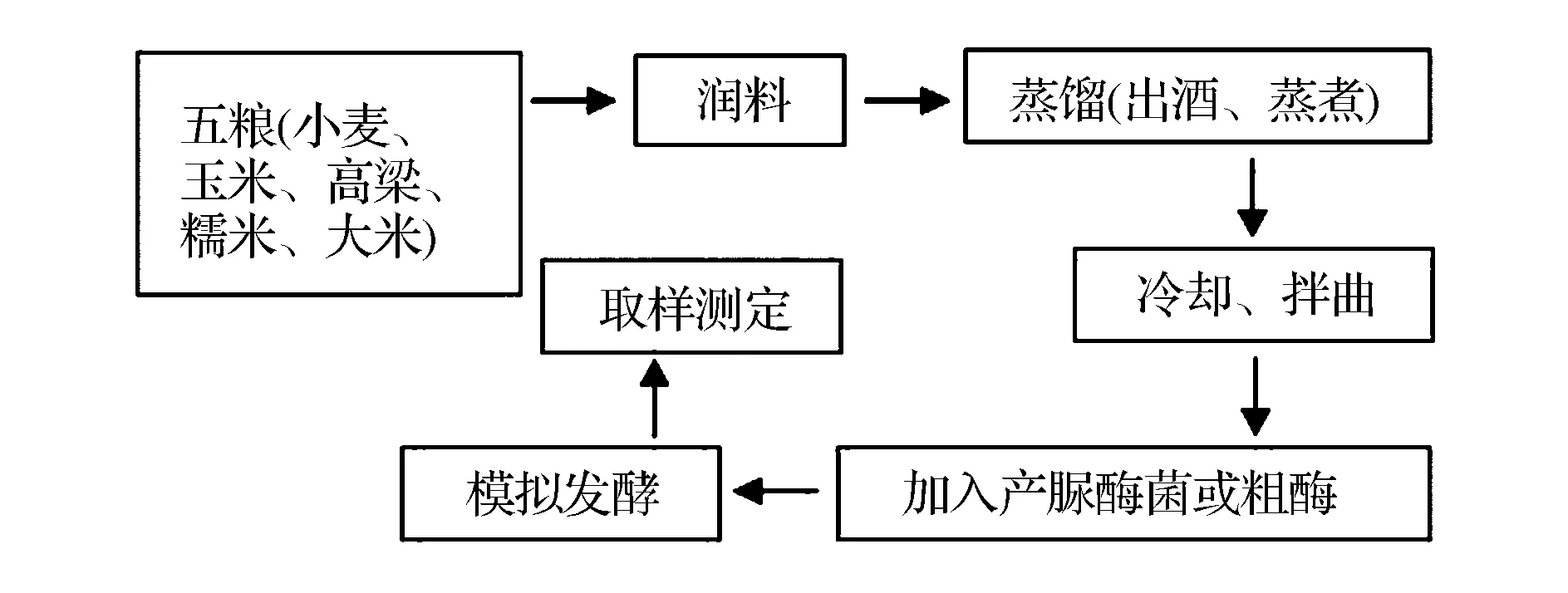
图1 模拟窖内发酵实验示意图Fig.1 The schematic diagram of simulating the alcoholic fermentation in pits
1.4分析检测
1.4.1 脲酶活性测定
脲酶活性测定采用Berthelot reaction比色法[35],即:取1 mL粗酶液和1 mL超纯水,各加入1 mL 40 g的尿素溶液。37 ℃恒温水浴反应15 min后加入1 mL 100 g/L三氯乙酸终止反应,振荡混匀。分别加入1 mL的显色剂I和1 mL显色剂II,混匀后于37 ℃水浴20 min。显色反应结束后用超纯水定容至10 mL,于分光光度计625 nm处测定吸光值。
显色剂I:将30 g苯酚和1.25 g亚硝基铁氰化钠溶于超纯水,定容至500 mL;
显色剂II:将26.25 g氢氧化钠和15 mL次氯酸钠溶于超纯水,定容至500 mL;
终止剂:称取50 g三氯乙酸溶于超纯水,定容至500 mL;
酶活定义:在常压、37 ℃、pH 7.0的条件下,每分钟分解尿素生成1 μmol氨所需的酶量为1个酶活力单位(U)。

(1)
式中:ΔOD625,样品与空白对照吸光值之差,nm;n,酶液稀释倍数;k,标准曲线斜率倒数;15,反应时间,min。
1.4.2 尿素测定
采用HPLC-FLD测定尿素含量[36-37]。取固态发酵酒醅20 g,加入30 mL无菌水,混匀,超声20 min,离心取上清液测定尿素含量。
测定所需试剂:
占顿醇:称取0.198 g 9-羟基占顿醇溶于50 mL甲醇(0.02 mol/L), 4 ℃避光保存。
盐酸溶液:浓盐酸用超纯水稀释成1.5 mol/L。
流动相A:1.640 g无水乙酸钠溶于1 000 mL纯水,浓度为0.02 mol/L,用体积分数1%乙酸溶液调节pH至7.2,溶液用0.22 μm水系滤膜过滤。
流动相B:乙腈(HPLC)。
衍生化反应:取待测样品400 μL,加600 μL占顿醇溶液,加100 μL盐酸溶液,混匀后,暗反应30 min。反应后溶液过0.22 μm有机滤膜,HPLC进样测定。
色谱条件:色谱柱为 Gemini-NX 5u C18(250 mm×4.6 mm);柱温35 ℃;流速设定为1 mL/min;流动相A为0.02 mol/L乙酸钠溶液,流动相B为乙腈,流动相C为纯水。
2 结果分析
2.1产脲酶菌株的分离筛选及鉴定
从大曲中分离到204株菌,通过筛选获得3株有脲酶活性的菌株。通过分子生物学鉴定,确定3株菌均是腐生葡萄球菌,系统发育进化树如图2所示。

图2 菌株M3、M26和M39基于16S rDNA的系统进化树Fig.2 The evolutionary tree of strains M3, M26 and M39 build based on their 16S rDNA
2.2产脲酶菌株及其粗酶对酒醅中尿素的降解
将产脲酶的3株腐生葡萄球菌和罗伊氏乳杆菌及其粗酶分别添加到酒醅中进行固态发酵,考察其对发酵过程酒醅中尿素的降低效果。分别取发酵15 d和70 d酒醅样品测定尿素含量,作用效果如图3所示。罗伊氏乳杆菌去除尿素效果显著(图3a),发酵15 d即可将酒醅中尿素去除,去除率达100%。发酵终点时(70 d),酒醅中有少量尿素生成,可能是在发酵中后期由酿酒酵母代谢产生。3株腐生葡萄球菌在发酵终点时对酒醅中尿素去除率为15%~23%(图3a)。腐生葡萄球菌在模拟窖内发酵时期对尿素的降解效果不如罗伊氏乳杆菌,M39是去除尿素效果最好的菌,发酵终点时酒醅中尿素去除率为23.2%。添加菌株产的脲酶粗酶液的酒醅中尿素去除效果与菌株类似:罗伊氏乳杆菌的粗酶对酒醅中尿素降低效果非常显著,在发酵前期尿素去除率达100%(图3b)。发酵至70 d,酒醅尿素含量没有明显增加。腐生葡萄球菌所产脲酶粗酶在窖内发酵时对尿素去除率不如罗伊氏乳杆菌所产脲酶粗酶,其中M3所产脲酶去除尿素效果最好,发酵终点时尿素去除率为15.43%。3株腐生葡萄球菌虽来源于大曲,但其所产脲酶对酒醅中尿素的去除效果不显著。罗伊氏乳杆菌所产脲酶曾被用于黄酒中尿素的去除,效果显著,其在酒醅中的尿素降低效果亦是如此。由此可见,在模拟发酵条件下,罗伊氏乳杆菌所产脲酶比3株腐生葡萄球菌更适合于酒醅中尿素的去除。

a-酒醅中添加菌液;b-酒醅中添加脲酶粗酶;对照-起始,即发酵0 d对照;对照-终点,即发酵15 d或70 d对照;M3-腐生葡萄球菌M3;M26-腐生葡萄球菌M26;M39-腐生葡萄球菌M39图3 不同产脲酶菌株或脲酶粗酶降解酒醅中尿素效果对比Fig.3 Degradation of urea in fermented grains by bacteria and their urease
2.3罗伊氏乳杆菌脲酶与商品脲酶降解酒醅中尿素的对比
将罗伊氏乳杆菌及其所产脲酶粗酶分别与商品脲酶进行了降解酒醅中尿素效果的比较。在酒醅中脲酶含量为200 U/kg酒醅的条件下,发酵15 d,罗伊氏乳杆菌全细胞及其脲酶粗酶对酒醅中尿素降解率达100%,而商品脲酶无明显降解效果(图4)。将加入酒醅的商品脲酶含量增加至10 000 U/kg酒醅时,尿素去除率为35.2%。由此说明,罗伊氏乳杆菌所产脲酶在模拟发酵中降低酒醅尿素时,性能优于商品脲酶。
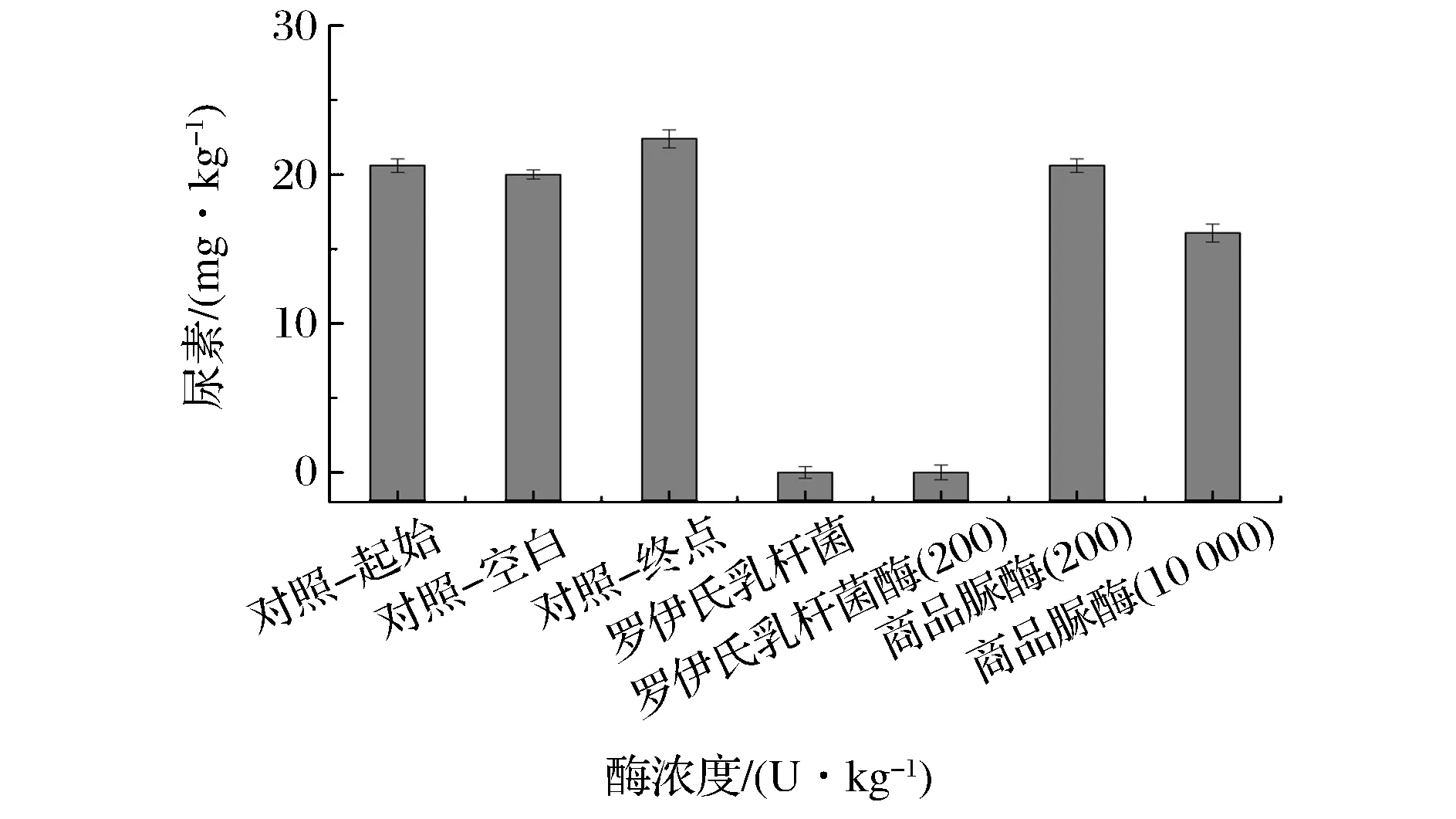
对照-起始,即发酵0 d对照;对照-终点,即发酵15 d对照;对照-空白,即发酵15 d空白对照;200-酶浓度200 U/kg;10 000-酶浓度10 000 U/kg图4 商品脲酶或罗伊氏乳杆菌产脲酶对酒醅中尿素降解效果比较Fig.4 Degradation of urea in fermenting grains by urease or Lactobacillus reuteri
2.4罗伊氏乳杆菌菌浓和脲酶粗酶对酒醅中尿素含量的影响
添加不同浓度的罗伊氏乳杆菌菌液和粗酶液于酒醅,固态发酵15 d,取样测定尿素含量,结果如图5所示。

a-酒醅中添加不同酶液;b-酒醅中添加不同菌液;对照-起始,即发0 d对照;对照-终点,即发酵15 d对照;对照-空白,即发酵15 d空白对照图5 脲酶添加量和菌浓对酒醅中尿素降解效果的影响Fig.5 Effect of urease activity and bacteria concertation on urea degradation in fermented grains
接菌量在107CFU/g酒醅及以上时,酒醅中尿素基本能完全去除,接菌量在106CFU/g酒醅时,尿素去除率为34.05%。接菌量过低,尿素去除效果较差,过高可能会对发酵产生更多影响,所以,罗伊氏乳杆菌在模拟发酵中对酒醅中尿素去除的最佳接种浓度为107CFU/g酒醅。当加酶量为12.5 U/kg酒醅时,酒醅中尿素去除率达56%,当加酶量达到50 U/kg酒醅时,酒醅中尿素基本能完全去除。所以,罗伊氏乳杆菌粗酶在模拟发酵中去除酒醅中尿素的最佳浓度为50 U/kg酒醅。
对比图5中菌浓度和粗酶,根据制备粗酶时菌悬液浓度进行换算,酶浓度50 U/kg酒醅相当于菌浓度5×108CFU/g酒醅。由图5尿素去除效果可以看出,罗伊氏乳杆菌全细胞比粗酶降低酒醅中尿素效率更高。这可能是因为微生物细胞能够持续不断合成脲酶或者对脲酶具有一定的保护作用,脲酶活性相对稳定,促进酒醅中更多尿素的分解。
3 讨论
本论文以降低酒醅中尿素为目的,利用产脲酶菌全细胞或粗酶减少酒醅中的尿素含量。考虑到外源菌株可能对白酒发酵体系产生干扰,产脲酶菌优先从大曲中筛选分离。将筛选到的3株产脲酶腐生葡萄球菌与已知产酸性脲酶的罗伊氏乳杆菌分别添加到酒醅中进行固态发酵,对比尿素去除效果。罗伊氏乳杆菌所产脲酶对酒醅中尿素具有很好的去除效果,去除率在89%以上;从大曲中筛选的3株腐生葡萄球菌,其所产脲酶在酒醅中没有显著降低尿素。对比罗伊氏乳杆菌和腐生葡萄球菌M39所产脲酶的pH稳定性发现,前者所产脲酶最适pH低于后者。酒醅是酸性体系,腐生葡萄球菌所产脲酶很可能无法耐受酒醅中酸性环境而很快失活,导致无法降低尿素。把罗伊氏乳杆菌所产脲酶与商品脲酶进行对比,发现罗伊氏乳杆菌粗酶降解尿素效果优于商品脲酶。对比酒醅中添加的产脲酶菌浓度和粗酶浓度,全细胞比粗酶去除酒醅中尿素的效率更高,可能是因为细胞对脲酶具有一定的保护作用或者细胞持续产生更多的脲酶。由于白酒发酵的复杂性和特殊性,应用大曲来源的产脲酶菌去除尿素较合适,但去除效果不佳。后面的研究还可继续从大曲中筛选与罗伊氏乳杆菌所产脲酶性能相近的菌株。罗伊氏乳杆菌不是来源于大曲的菌株,其所产脲酶曾被用于黄酒中尿素去除。由于黄酒是液态发酵,白酒为固态发酵,并且向黄酒中添加脲酶是在发酵结束时,因此本论文将脲酶应用于白酒固态发酵是一种全新的尝试。罗伊氏乳杆菌是否对白酒的品质产生影响,仍需要进一步验证和改进,使其尽快适用于白酒的工业化生产。目前对于白酒中EC的降低策略鲜有报道,本研究通过降低EC前体物质含量从而减少EC的生成,为降低白酒中EC的研究提供参考。
[1] KIM Y G,LYU J,KIM M K,et al. Effect of citrulline,urea,ethanol,and urease on the formation of ethyl carbamate in soybean paste model system[J].Food Chemistry,2015,189(1):74-79.
[2] BELAND F A,BENSON R W,MELLICK P W,et al.Effect of ethanol on the tumorigenicity of urethane (ethyl carbamate) in B6C3F1mice[J].Food and Chemical Toxicology,2005,43(1):1-19.
[3] ZHANG Wei-ping,ZHAO Xin-rui,DU Guo-cheng,et al.Nitrogen catabolite repression inSaccharomycescerevisiaeand its effect on safety of fermented foods[J].Chinese Journal of Appplied Environmental Biology,2012,18(5):862-872.
[4] 陆建.酒精饮料中的氨基甲酸乙酯[J].江苏食品与发酵,1994(3):27-29.
[5] LOFROTH G,GEJVALL T.Diethl pyrocarbonate:formation of urethan in treated beverages[J].Sciense,1971,174(4015):1248-1250.
[6] WEBER J V,SHARYPOV V I.Ethyl carbamate in foods and beverages:a review[J].Environmental Chemistry Letters,2008,7(3):233-247.
[7] 王欢,胡峰,胡剑锋,等.白酒中氨基甲酸乙酯的研究进展[J].酿酒科技,2014(9):88-91.
[8] ZHAO Xin-rui,DU Guo-cheng,ZOU Hui-jun,et al.Progress in preventing the accumulation of ethyl carbamate in alcoholic beverages[J].Trends in Food Science and Technology,2013,32(2):97-107.
[9] 林文浩,林峰,周建弟.黄酒中氨基甲酸乙酯和尿素的处理方法与工艺条件[J].酿酒科技,2013(8):40-43.
[10] 王晓娟,王德良,傅力,等.降低发酵酒中尿素含量的研究进展[J].酿酒科技,2009(2):93-95.
[11] WU Ping-gu,CAI Cheng-gang,SHEN Xiang-hong,et al.Formation of ethyl carbamate and changes during fermentation and storage of yellow rice wine[J].Food Chemistry,2014,152:108-112.
[12] OUGH C S. Ethyl carbamate in fermented beverages and foods.I.Naturally occurring ethyl carbamate[J]. Journal of Agricultural and Food Chemistry, 1976, 24(2): 323-328.
[13] OUGH C S,CROWELL E A,MOONEY L A.Formation of ethyl carbamate precursors during grape juice (chardonnay) fermentation.I.Addition of amino acids,urea,and ammonia:effects of fortification on intracellularand extracellular precursors.[J].American Journal of Enology and Viticulture,1988,39(3):243-249.
[14] 仇钰莹,方芳,周新虎,等.酒醅中精氨酸利用菌株的分离筛选及其对浓香型白酒中瓜氨酸积累的影响[J].微生物学报,2016,56(10):1 638-1 646.
[15] 范文来,徐岩,史斌斌.酒醅发酵过程中氨基甲酸乙酯与尿素的变化[J].食品工业科技,2012,33(23):171-174.
[16] 曾婷婷,吴生文,林培.特香型酒醅发酵过程中氨基甲酸乙酯和尿素变化规律的研究[J]. 酿酒,2015,42(6):77-79.
[17] 王松华,田亚平.产酸性脲酶菌株的筛选、鉴定及其脲酶的应用初探[J].生物技术通报,2008,24(6):175-178.
[18] 周建弟,丁关海,郑志强.酸性脲酶分解黄酒中尿素特性的研究[J].中国酿造,2006,25(11):45-47.
[19] ANDRICH L,ESTI M,MORESI M.Urea degradation in some white wines by immobilized acid urease in a stirred bioreactor[J].Journal of Agricultural and Food Chemistry,2010,58(11):6 747-6 853.
[20] DAHABIEH M S,HUSNIK J I,VUUREN H J,et al.Functional enhancement of sake yeast strains to minimize the production of ethyl carbamate in sake wine[J].Journal of Applied Microbiology,2010,109(3):963-973.
[21] KATSUHIKO K,KAOKO O M,KATSUYA G,et al.Mutant isolation of non-urea producing sake yeast by positive selection[J].Journal of Fermentation and Bioengineering,1993,75(5):359-363.
[22] JOANA C,JOHN I H,DEBRA L I,et al.Metabolic engineering ofSaccharomycescerevisiaeto minimize the production of ethyl carbamate in wine[J].American Journal of Enology and Viticulture,2006,2(57):113-124.
[23] 许宏贤,段钢.酒中氨基甲酸乙酯及尿素的研究进展[J].酿酒科技,2012(6):92-95.
[24] 钟玉叶,崔如生.洋河酒厂的多粮工艺创新[J].酿酒,2007,34(5):28-32.
[25] 李加友,陆筑凤,吴丹,等.发酵食品中氨基甲酸乙酯的形成与控制[J].食品科技,2013,38(6):310-312.
[26] DELLEDONNE D,RIVETTI F,ROMANO U.Developments in the production and application of dimethylcarbonate[J].Applied Catalysis A:General,2001,221(1):241-251.
[27] WANG Dong-peng,YANG Bo-lun,ZHAI Xiao-wei,et al.Synthesis of diethyl carbonate by catalytic alcoholysis of urea[J].Fuel Processing Technology,2007,88(8):807-812.
[28] 张顺荣,范文来,徐岩.不同香型白酒中氨基甲酸乙酯的研究与风险评估[J].食品与发酵工业,2016,42(5):198-202.
[29] ZIMMERLI B,ACHLATTER J.Ethyl carbamate:analytical methodology,occurrence,formation,biological activity and risk assessment[J].Mutation Research:Genetic Toxicology,1991,259(3-4):325-350.
[30] IFFKIN H L,WILSON R,HOWIE D,et al.Ethyl carbamate formation in the production of pot still whisky[J].Journal of the Institute of Brewing,1989,95(2):115-119.
[31] AYLOTT R,COCHRANE G,LEONARD M,et al.Ethyl carbamate formation in grain-based spirits:Part I:Post distillation ethyl carbamate formation in maturing grain whisky[J].Journal of the Institute of Brewing,1990,96(4):213-221.
[32] LUCIA A,MARCO E,MAURO M.Urea degradation in model wine solutions by free or immobilized acid urease in a stirred bioreactor[J].Journal of Agricultural and Food Chemistry,2009,57(9):3 533-3 542.
[33] 周建立,康振,刘庆涛,等.重组酸性脲酶对黄酒中尿素和氨基甲酸乙酯的降解应用[J].生物工程学报,2016,32(1):74-83.
[34] 杨宇清,堵国成,陈坚,等.一种高效制备食品级酸性脲酶的方法及应用:中国,10524588.6[P].2014-02-12.
[35] WEATHERBURN W M.Phenol-hypochlorite reaction for determination of ammonia[J].Analytical Chemistry,1967,39(8):971-974.
[36] 申世刚,李国辉,钟其项,等.高效液相色谱-荧光检测器法测定白酒中尿素含量方法研究[J].酿酒科技,2015(3):111-114.
[37] 邢江涛,钟其顶,熊正河,等.高效液相色谱-荧光检测器法测定黄酒中尿素含量[J].酿酒科技,2011(3):104-106.
ReductionofureainfermentedgrainsduringChineseliquorbrewingprocess
MENG Qing-da1, 2, ZHOU Xin-hu3, CHEN Xiang3,DU Guo-cheng1, 2, 4, CHEN Jian1, 2, 5, FANG Fang1, 2*
1(School of Biotechnology, Jiangnan University, Wuxi 214122, China) 2(Key Laboratory of Industrial Biotechnology, Ministry of Education, Wuxi 214122, China) 3(Jiangsu Yanghe Distillery Co.LTD., Suqian 223800, China) 4(Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Wuxi 214122, China) 5 (National Engineering Laboratory for Cereal Fermentation Technology, Wuxi 214122, China)
Urea is one of the main precursors of ethyl carbamate in Chinese liquor fermentation process. It has a significant effect on the formation of ethyl carbamate in Chinese Luzhou-flavor spirits. By reducing the urea content in fermented grains, the content of ethyl carbamate in Chinese liquor could be reduced. Urease-producing strains or crude urease were mixed with fermented grains to reduce the content of urea during fermentation. Three urease-producing strains were isolated fromDaqu, characterized asStaphylococcussaprophyticus. But addition ofStaphylococcussaprophyticusstrains had no significant effect on urea decrease in the solid-state fermentation, while addition ofLactobacillusreuterior the crude urease thereof eliminated urea in fermented grains. Compared with commercial urease, urease produced byLactobacillusreuterishowed better removal effect for urea in fermented grains with removal rate of 100%. WhenLactobacillusreuteriat a concentration higher than 107CFU/g was added into fermented grains, the removal rate of urea was higher than 97.3%. The removal rate of urea was higher than 77.4% when the amount of crude urease at a concentration higher than 25 U/kg was added into fermented grains. Therefore,Lactobacillusreuterihas better removal effect for urea in white wine fermented grains.
Chinese liquor; ethyl carbamate; urea; urease;Lactobacillusreuteri;Staphylococcussaprophyticus
10.13995/j.cnki.11-1802/ts.013879
硕士研究生(方芳副教授为通讯作者,E-mail:ffang@jiangnan.edu.cn)。
国家自然科学基金(31371821);广东省科技计划项目(2015B020205002)
2017-01-12,改回日期:2017-03-18

