金银花过氧化物酶抑制动力学研究
罗 磊
董金龙1,2
朱文学1,2
薛依涵1,2
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 河南省农产品干燥装备工程技术研究中心,河南 洛阳 471023)
金银花过氧化物酶抑制动力学研究
罗 磊1,2
董金龙1,2
朱文学1,2
薛依涵1,2
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 河南省农产品干燥装备工程技术研究中心,河南 洛阳 471023)
为分离纯化金银花过氧化物酶,对其酶学性质及抑制动力学进行研究,将三相法纯化所得金银花过氧化物酶,经DEAE纤维素DE-52离子交换层析分离,得到2种金银花过氧化物酶HSPⅠ和HSPⅡ,其比活力分别为3 312.3,564.8 U/mg。HSPⅠ反应动力学分析表明金银花过氧化物酶的双底物酶促反应类型为乒乓机制。抑制动力学研究表明柠檬酸、偏重亚硫酸钠对金银花过氧化物酶的抑制类型为不可逆抑制。L-半胱氨酸对金银花过氧化物酶的抑制类型为可逆抑制,可逆抑制类型为竞争性可逆抑制。L-半胱氨酸抑制常数KI为0.053 mmol/L。
金银花;过氧化物酶;纯化;抑制动力学
金银花为忍冬属植物干燥的花蕾或初开的花,含有挥发油、有机酸、黄酮环烯醚萜、皂苷等成分[1-3],具有抗氧化、抗菌、抗病毒[4-5]等作用。作为一种“药食同源”植物被广泛应用于食品、保健品等生产[6-8]。新鲜金银花不耐贮藏,采摘后需及时加工处理,且金银花质地较嫩,处理不当易发生褐变,造成功效成分降解,导致产品品质下降[9]1-5。研究[9]5-10[10]表明,植物酶促褐变是在多酚氧化酶和过氧化物酶等相关酶的作用下,酚类物质氧化为醌,醌类物质聚合形成褐色素引起的。邓波等[11]分离纯化了藕带过氧化物酶,并对其酶学性质进行了研究。夏炳乐[12]17-19从烟草中分离出了过氧化物酶TOP Ⅰ和TOP Ⅱ,并对其酶学性质及TOP Ⅰ的二级结构进行了研究。刘彩霞[13]1-4研究表明木素过氧化物酶的双底物反应机制为乒乓反应机制。Perez等[14]对鹰爪豆过氧化物酶进行了纯化,并研究了其二级结构和三级结构稳定性。
目前金银花过氧化物酶的相关研究尚不充分。刘娜娜[15]1-2对金银花过氧化物酶进行了纯化及酶学性质研究。在金银花过氧化物酶双底物反应机制及抑制动力学方面尚缺乏基础研究。由于金银花褐变过程代谢途径复杂[16-17],因此分离纯化与褐变相关的酶,并进行酶学性质及抑制动力学研究,是控制褐变强度及阐明褐变代谢机理的有效途径。本试验在对金银花过氧化物酶提取纯化的基础上,选择抑制剂柠檬酸、L-半胱氨酸、偏重亚硫酸钠,研究其对金银花过氧化物酶抑制效应,并对抑制动力学及双底物反应机制进行研究,为抑制金银花加工过程中褐变发生提供理论基础。
1 材料与方法
1.1 材料与试剂
磷酸二氢钠、磷酸二氢钾、硫酸铵、氢氧化钠、愈创木酚、过氧化氢、磷酸、盐酸、叔丁醇、无水乙醇、考马斯亮蓝G-250、考马斯亮蓝R-250、牛血清白蛋白、三羟甲基氨基甲烷、丙烯酰胺、甲叉双丙稀酰胺、甘氨酸、溴酚蓝、甘油、四甲基乙二胺、过硫酸铵:分析纯。
1.2 仪器与设备
搅拌机:HR2850型,飞利浦电子公司;
pH计:PHS-3C型,上海越平科学仪器有限公司;
紫外-可见分光光度计:UV2400型,上海舜宇恒平科学仪器有限公司;
台式高速冷冻离心机:H1850R型,湘仪离心机仪器有限公司;
电泳仪:DYCZ-24DN型,北京六一仪器厂;
玻璃层析柱:1.6 cm×7 cm,上海方畦仪器有限公司;
恒流泵:HL-2型,上海沪西分析仪器厂有限公司;
梯度混合器:TH-500型,上海沪西分析仪器厂有限公司;
电脑紫外检测仪:HD-5型,上海沪西分析仪器厂有限公司。
1.3 试验方法
1.3.1 金银花过氧化物酶的提取纯化 称取一定量新鲜无损金银花,按照料液比1∶7 (g/mL)加入4 ℃ pH 6的磷酸盐缓冲液打浆2 min,打浆后,提取液于9 000 r/min冷冻(4 ℃)离心15 min,收集上清液即为粗酶液。
粗酶液的初步纯化采用三相分离法[18-20]。基于前期试验,在pH 5.6,硫酸铵质量分数39.49%,叔丁醇与提取液体积比为1.38的条件下进行。粗酶液在100 r/min搅拌条件下缓慢加入硫酸铵,至硫酸铵质量分数为39.49%,待硫酸铵固体充分溶解之后用1 mol/L HCl或NaOH溶液调节混合液的pH至5.6,加入叔丁醇,继续搅拌10 min,在4 ℃环境中静置1 h,再在4 000 r/min离心10 min。离心之后可以观察到混合液分为明显的三相(即上层的有机相,中间层和下层的水相)。用吸管吸除上层的有机相和下层水相,中间层用1 mL pH 6的磷酸盐缓冲液溶解,透析除去盐和有机溶剂,冻干备用。
将冻干粉溶于20 mmol/L,pH 7.5的Tris-HCl缓冲液,经10 000 r/min冷冻(4 ℃)离心20 min后,上样于经预平衡的DEAE纤维素DE-52层析柱,用平衡缓冲液洗脱至基线稳定后,用pH 7.5的Tris-HCl缓冲液配制的NaCl溶液进行梯度洗脱。NaCl浓度0~1 mol/L,流速1.8 mL/min,每5 mL收集一管,分别测定每管酶活与蛋白含量,收集酶活性峰,透析脱盐后冻干备用。
1.3.2 聚丙烯酰胺凝胶电泳(PAGE) 对提取纯化的金银花过氧化物酶进行聚丙烯酰胺凝胶电泳分析[15]23,分离胶浓度10%,浓缩胶浓度5%。
1.3.3 酶活力测定 根据文献[15]18,在比色杯中,以愈创木酚为反应底物,反应体系包括2.95 mL 18 mmol/L愈创木酚,1 mmol/L H2O2(pH 5磷酸缓冲液配制),0.05 mL酶液。盖上盖子在比色皿中迅速混合均匀,在30 ℃下测定470 nm处测吸光度值,每隔20 s计1次数,以吸光度值每分钟变化0.01为1个酶活单位。
1.3.4 底物浓度对金银花过氧化物酶酶促反应速率的影响
在酶活测定反应体系中,固定愈创木酚浓度12 mmol/L,分别在过氧化氢浓度为0.062 5,0.125 0,0.187 5,0.250 0,0.312 5,0.437 5,0.500 0,1.000 0,2.000 0,3.000 0,4.000 0,5.000 0,6.000 0 mmol/L条件下测酶活,测定不同过氧化氢浓度对金银花过氧化物酶酶促反应速率的影响;固定过氧化氢浓度1 mmol/L,分别在愈创木酚浓度为0.4,0.6,0.8,1.0,2.0,3.0,4.0,5.0,6.0,12.0,24.0,48.0,96.0 mmol/L条件下测酶活,测定不同愈创木酚浓度对金银花过氧化物酶酶促反应速率的影响。
1.3.5 金银花过氧化物酶双底物反应类型 分别固定愈创木酚浓度为2,4,6 mmol/L,在H2O2浓度为0.2,0.4,0.6,0.8,1.0 mmol/L条件下测得酶促反应速率;分别固定H2O2浓度为0.4,0.6,0.8 mmol/L,愈创木酚浓度为1,2,3,4,5 mmol/L条件下测得酶促反应速率。通过Lineweaver-Burk双倒数作图,根据双倒数动力学图区分双底物反应的乒乓机制和序列机制[21]363-367。
1.3.6 不同抑制剂的抑制效应 向酶反应体系中分别加入0.05 mL不同种类及不同浓度的抑制剂[分别为L-半胱氨酸(0.1,0.2,0.3,0.4,0.5 mmol/L),柠檬酸(2,4,6,8,10 mmol/L),偏重亚硫酸钠(0.02,0.04,0.06,0.08,0.1 mmol/L)],混合均匀后,加入0.05 mL酶液,测定不同条件下酶活。通过计算不同抑制剂的半抑制浓度和迟滞时间[22-23],判断抑制剂的抑制效果。
1.3.7 不同抑制剂的抑制作用类型 向酶反应体系中加入0.05 mL不同浓度L-半胱氨酸(0.1.2,0.3,0.4,0.5 mmol/L)、柠檬酸(2,4,6,8,10 mmol/L)、偏重亚硫酸钠(0.02,0.04,0.06,0.08,0.1 mmol/L),分别加入0.05 mL不同质量浓度的金银花过氧化物酶(0.1,0.2,0.3,0.4 g/L),测定酶活,分析在不同抑制剂条件下酶浓度与酶活性的关系,判断不同抑制剂的抑制类型[24]。
1.3.8 可逆抑制剂的抑制动力学 根据1.3.7对不同抑制剂抑制类型的判断,选择对具有可逆性抑制的抑制剂进行抑制动力学研究,向酶反应体系中加入0.05 mL不同浓度抑制剂,固定H2O2浓度,在不同愈创木酚浓度(2,4,6,8,10 mmol/L)下测定酶促反应的速率,通过Lineweaver-Burk双倒数作图判断不同抑制剂可逆抑制类型。通过米氏方程的斜率和纵轴截距对抑制剂浓度二次作图,所得两条直线的横轴截距分别为抑制剂对游离酶的抑制常数KI和对酶—底物络合物的抑制常数KIS[25-27]。
H2O2浓度测定用经草酸钠标定的高锰酸钾溶液进行滴定。产物浓度[28]以愈创木酚氧化产物四联甲氧基连酚的消光系数ε470=26.6 mL/(mmol·cm)计算。
2 结果与分析
2.1 金银花过氧化物酶的DEAE纤维素DE-52离子交换层析
将三相法初步纯化的金银花过氧化物酶经DEAE纤维素DE-52进行离子交换层析,由图1、2可知,用0~1 mol/L的NaCl进行梯度洗脱,可以得到4个洗脱峰。分别测定各洗脱峰的酶活和蛋白含量,结果表明前2个洗脱峰未表现出过氧化物酶酶活,第3、4洗脱峰有过氧化物酶活性,分别为HSPⅠ(honeysuckle peroxidaseⅠ)和HSPⅡ(honeysuckle peroxidaseⅡ),出现第3、4洗脱峰时的NaCl浓度分别为0.215,0.291 mol/L。将第3、4个峰对应的洗脱液试管分别合并,由酶活和蛋白含量计算出HSP Ⅰ比活力为3 312.3 U/mg,HSPⅡ比活力为564.8 U/mg。所得HSPⅡ低于上样所用三相法得到的比活力为1 021.6 U/mg的酶,可能是离子交换层析通过所带电荷不同将蛋白组分分离,第4洗脱峰可能含有较多带电相同的杂蛋白,因此选择第3洗脱峰所得活性较高的HSPⅠ进行抑制动力学研究。

图1 金银花过氧化物酶洗脱曲线

1. 三相分离法纯化金银花过氧化物酶 2. 离子交换层析纯化金银花过氧化物酶
图2 金银花过氧化物酶聚丙烯酰胺凝胶电泳
Figure 2 PAGE ofLoniceraJaponicaThunbPeroxidase
2.2 底物浓度对金银花过氧化物酶酶促反应速率的影响
由图3、4可知,当愈创木酚浓度固定,过氧化氢浓度在0.062 5~1.000 0 mmol/L时,酶促反应速率随底物浓度增大而增大;当过氧化氢浓度>1.000 0 mmol/L时,反应速率趋于稳定。固定过氧化氢浓度,愈创木酚浓度在0.4~96.0 mmol/L时,反应速率随底物浓度增大而增大,当愈创木酚浓度>96.0 mmol/L时,反应速率趋于稳定。根据中间反应复合物学说[21]351,当酶浓度一定、底物浓度较小时,反应速率与底物浓度有关,随着底物浓度的增大,酶—底物中间复合物生成增多,反应速率取决于酶—底物中间复合物浓度;当底物浓度继续增加时,溶液中酶处于饱和状态,即使增加底物浓度,也无法生成更多的酶—底物中间复合物,反应速率达到最大值。

图3 过氧化氢浓度对酶促反应速率的影响

图4 愈创木酚浓度对酶促反应速率的影响
2.3 金银花过氧化物酶双底物反应类型
双底物酶促反应按动力学机制可分为序列反应和乒乓反应[21]363-367。这2种反应可以通过Lineweaver-Burk双倒数作图区分。在乒乓机制中,将一种底物固定在几个不同浓度,用另一种底物浓度与反应速率作图,可以得到1组平行线,在序列反应机制中,可以得到1组相交直线。由图5可知,固定几个不同的愈创木酚浓度,过氧化氢浓度与反应速率的双倒数曲线相互平行。固定几个不同的过氧化氢浓度,愈创木酚浓度与反应速率的双倒数曲线相互平行。说明在反应动力学方面金银花过氧化物酶的双底物酶促反应类型为乒乓机制。与烟草过氧化物酶[12]17-19和木素过氧化物酶[13]1-4双底物反应类型类似。
2.4 不同抑制剂的抑制效应
2.4.1L-半胱氨酸对金银花过氧化物酶的抑制效应 由图6可知,L-半胱氨酸浓度在0.1~0.5 mmol/L时,L-半胱氨酸对金银花过氧化物酶抑制作用表现在迟滞时间的延长与酶相对活性的下降,对酶活性的抑制作用随抑制剂浓度增大而增强。酶的相对活性由79.1%下降到49.6%,迟滞时间由10.9 s上升到30.3 s,可能是L-半胱氨酸的存在使底物较难与酶活性位点结合,导致酶促反应迟滞时间延长,酶催化活性降低。
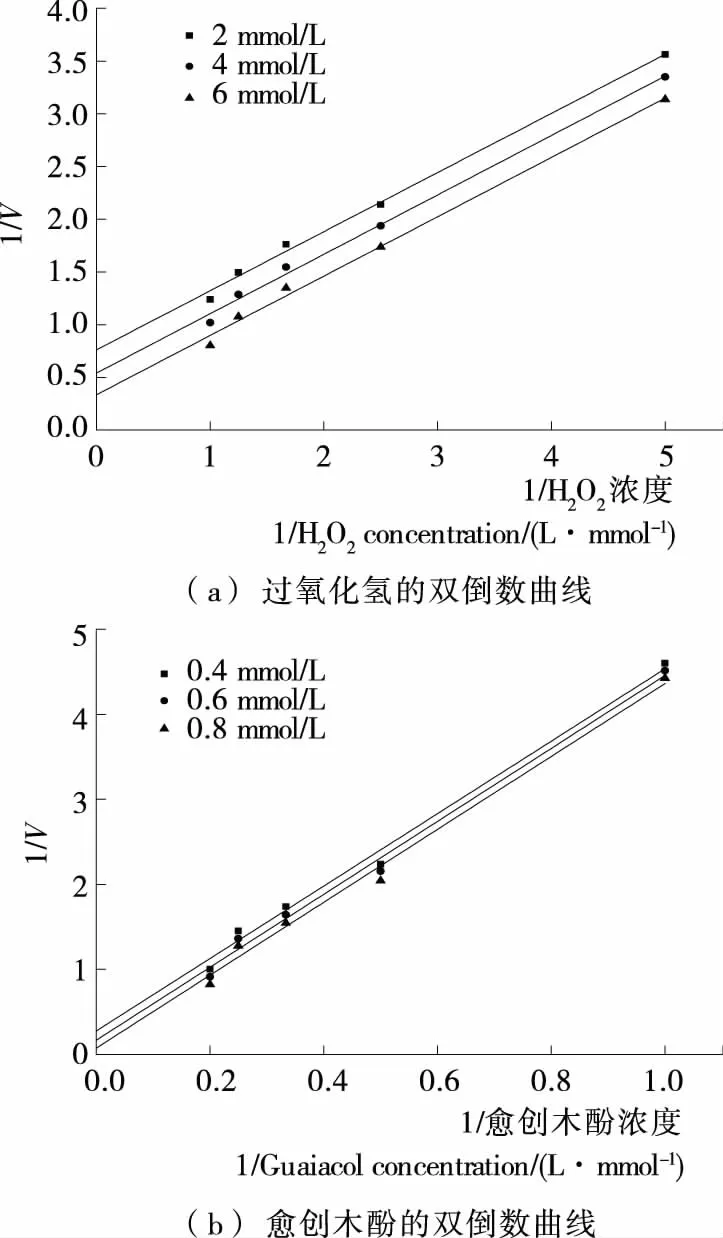
图5 金银花过氧化物酶双底物反应类型
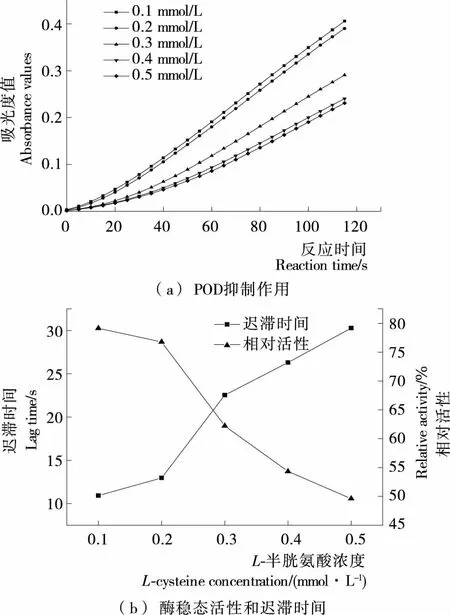
图6 L-半胱氨酸对金银花过氧化物酶抑制作用
2.4.2 柠檬酸对金银花过氧化物酶的抑制效应 由图7可知,柠檬酸浓度在2~10 mmol/L时,柠檬酸对金银花过氧化物酶的抑制作用逐渐增强,酶的相对活性由87.1%下降到70.1%,迟滞时间由8.4 s上升到18.3 s。柠檬酸在对金银花过氧化物酶的抑制作用一方面使酶的活性下降,另一方面延长了酶发挥作用的时间。在相同浓度条件下,与L-半胱氨酸相比,柠檬酸对金银花过氧化物酶抑制作用较弱。

图7 柠檬酸对金银花过氧化物酶抑制作用
2.4.3 偏重亚硫酸钠对金银花过氧化物酶的抑制效应 由图8可知,偏重亚硫酸钠对金银花过氧化物酶抑制作用表现在迟滞时间的延长与酶相对活性的下降。偏重亚硫酸钠浓度在0.02~0.10 mmol/L时,酶的相对活性由55.5%下降到28.3%,迟滞时间由15.8 s上升到21.6 s。在相同浓度条件下,偏重亚硫酸钠较柠檬酸和L-半胱氨酸表现出较强的抑制作用,原因可能是亚硫酸盐能够与酶蛋白键联,修饰了酶蛋白使其活性降低[29]。
2.5 不同抑制剂的抑制作用类型
向酶反应体系中加入一定量抑制剂,在不同浓度抑制剂条件下,用酶浓度对反应初速率作图,通过抑制剂浓度与酶量的关系,可以判断抑制剂作用于酶的抑制类型是可逆抑制还是不可逆抑制[25]。由图9可知,在不同浓度L-半胱氨酸条件下,酶活力与酶量是一组斜率不同的直线,说明L-半胱氨酸对金银花过氧化物酶的抑制为可逆性抑制;在不同浓度柠檬酸和偏重亚硫酸钠条件下,酶活力与酶量是一组平行直线,说明柠檬酸和偏重亚硫酸钠对金银花过氧化物酶的抑制为不可逆抑制。

图8 偏重亚硫酸钠对金银花过氧化物酶抑制作用
2.6L-半胱氨酸对金银花过氧化物酶的可逆抑制动力学
由图10可知,在不同L-半胱氨酸浓度条件下,以酶促反应速率对底物浓度通过双倒数作图,双倒数曲线相交于纵轴,直线的斜率随抑制剂浓度的增大而增加,直线与纵轴截距不随抑制剂浓度的增加而变化,即最大反应速率Vmax不变,米氏常数Km随抑制剂浓度的增大而增加,这是竞争性抑制的特点,说明L-半胱氨酸只能与金银花过氧化物酶结合,不能与酶—底物复合物结合。通过将抑制剂浓度与一次作图的斜率和截距分别二次作图可以得到酶抑制剂复合物的解离常数KI与酶底物抑制剂复合物的解离常数KIS,由图11可知,抑制常数KI为0.053 mmol/L,KIS为0,即L-半胱氨酸不能与酶—底物复合物结合。
3 结论
(1) 将三相法提取纯化的金银花过氧化物酶经DEAE纤维素DE-52离子交换层析分离得到2种金银花过氧化物酶HSP Ⅰ和HSP Ⅱ,其比活力为分别为3 312.3,564.8 U/mg。酶学性质及抑制动力学研究表明:当愈创木酚浓度固定,过氧化氢浓度在0.062 5~1.000 0 mmol/L时,酶促反应速率随底物浓度增大而增大。当过氧化氢浓度>1.000 0 mmol/L时,反应速率趋于稳定。固定过氧化氢浓度,愈创木酚浓度在0.4~96 mmol/L时,酶促反应速率随底物浓度增大而增大,当愈创木酚浓度>96 mmol/L时,反应速率趋于稳定。金银花过氧化物酶的双底物酶促反应类型为乒乓机制。柠檬酸、偏重亚硫酸钠对金银花过氧化物酶的抑制类型为不可逆抑制。L-半胱氨酸对金银花过氧化物酶的抑制类型为可逆抑制,可逆抑制类型为竞争性可逆抑制。L-半胱氨酸抑制常数KI为0.053 mmol/L。

图9 在不同浓度抑制剂下酶活力和酶量的关系

图10 L-半胱氨酸对金银花过氧化物酶抑制作用的双倒数曲线
Figure 10 Lineweaver-Burk plots for inhibition ofL-cysteine onLoniceraJaponicaThunbPeroxidase
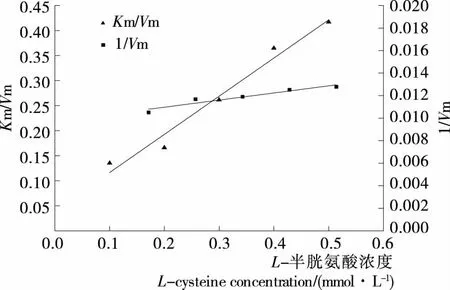
图11 L-半胱氨酸浓度与Lineweaver-Burk曲线纵轴截距和斜率的关系
Figure 11 Effect of concentration ofL-cysteine on intercept and slope of Lineweaver-Burk plots
(2) 本试验通过三相分离纯化与离子交换柱层析相结合的方法对金银花过氧化物酶进行纯化,同时对金银花过氧化物酶的双底物酶促反应类型和抑制动力学进行了研究,对当前金银花过氧化物酶的研究起到补充作用。
(3) 本试验只对酶学性质和抑制动力学进行了研究,对金银花过氧化物酶的蛋白质结构等尚缺乏研究。
[1] 赵国玲, 刘佳佳. 金银花化学成分及药理研究进展[J]. 中药材, 2002(10): 762-763.
[2] 宋亚玲, 倪付勇, 赵祎武, 等. 金银花化学成分研究进展[J]. 中草药, 2014(24): 3 656-3 664.
[3] 蒋燕山, 李加兴, 陈双平. 金银花饮料生产工艺研究[J]. 食品与机械, 2004, 20(2): 25-26.
[4] ATIQUR Rahman, SUN Chul Kang. In vitro control of food-borne and food spoilage bacteria by essential oil and ethanol extracts of Lonicera japonica Thunb[J]. Food Chemistry, 2009, 116(3): 670-675.
[5] 陆俊, 秦培祯, 韩雪, 等. 金莲花润喉袋泡茶配方优化研究[J]. 食品与机械, 2014, 30(5): 271-275.
[6] 王亚丹, 杨建波, 戴忠, 等. 中药金银花的研究进展[J]. 药物分析杂志, 2014(11): 1 928-1 935.
[7] 毛迪锐, 王蕾, 张海悦. 清咽利喉口喷液的研制[J]. 食品与机械, 2009, 25(5): 170-171, 177.
[8] 邓腾. 无糖凉茶植物饮料的研制[J]. 食品与机械, 2013, 29(4): 210-213.
[9] 侯爽爽. 金银花热风干燥过程中颜色劣变机理及抑制研究[D]. 洛阳: 河南科技大学, 2011.
[10] PALMA-OROZCO G, ORTIZ-MORENO A, DORANTES-ALVAREZ L, et al. Purification and partial biochemical characterization of polyphenol oxidase from mamey(Pouteria sapota) [J]. Phytochemistry, 2011, 72(1): 82-88.
[11] 邓波, 邓放明. 藕带过氧化物酶的分离纯化及酶学性质[J]. 食品与机械, 2016, 32(2): 20-23.
[12] 夏炳乐. 烟草过氧化物酶的分离纯化、结构及其光谱特性的研究[D]. 合肥: 中国科学技术大学, 2002.
[13] 刘彩霞. 木素过氧化物酶的双底物反应机制及其活性中心的催化性能[D]. 济南: 山东大学, 2005.
[14] PEREZ G P, HIDALGO C N, ARELLANO J B, et al. Purification and structural stability of white Spanish broom (Cytisus multiflorus) peroxidase[J]. International Journal of Biological Macromolecules, 2015, 72: 718-723.
[15] 刘娜娜. 金银花中多酚氧化酶和过氧化物酶的分离纯化及特性研究[D]. 合肥: 安徽农业大学, 2013.
[16] 郝英超. 金银花褐变过程酚类物质代谢机理研究[D]. 洛阳: 河南科技大学, 2013: 3-10.
[17] 侯爽爽. 金银花热风干燥过程中颜色劣变机理及抑制研究[D]. 洛阳: 河南科技大学, 2011: 1-10.
[18] DENNISON C, LOVRIEN R. Three Phase Partitioning: Concentration and Purification of Proteins[J]. Protein Expression and Purification, 1997, 11(2): 149-161.
[19] SAGU S T, NSO E J, HOMANN T, et al. Extraction and purification of beta-amylase from stems of Abrus precatorius by three phase partitioning[J]. Food Chemistry, 2015, 183: 144-153.
[20] VEAL M D, RATHOD V K, Three phase partitioning a novel technique for purification of peroxidase from orange peels (Citrus sinenses)[J]. Food and Bioproducts Processing, 2015, 94: 284-289.
[21] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社, 2009.
[22] ALIJANIANZADEH Mahdi, SABOURY Ali Akbar , GANJALI Mohammad Reza, et al. The inhibitory effect of ethylenediamine on mushroom tyrosinase[J]. Internati Onal Journal of Biological Macromolecules, 2012, 50(3): 573-577.
[23] FANGE D, LOVMAR M , PAVLOV M Y , EHRENBERG M. Identification of enzyme inhibitory mechanisms from steady-state kinetics[J]. Biochimie, 2011, 93(9): 1 623-1 629.
[24] 易晶晶, 欧仕益, 董颖妍, 等. 对香豆酸、阿魏酸和低聚糖阿魏酸酯对酪氨酸酶的抑制效果[J]. 食品与机械, 2016, 32(11): 9-12, 63.
[25] 罗磊, 周燕燕, 朱文学, 等. 金银花多酚氧化酶特异性与抑制剂动力学研究[J]. 农业机械学报, 2014, 45(7): 202-208.
[26] 穆燕. 千日红酪氨酸酶抑制剂的分离纯化及其抑制机理研究[D]. 广州: 华南理工大学, 2012: 61-62.
[27] SI Yue-xiu, JI Sun-young, WEI Wang, et al. Effects of boldine on tyrosinase: Inhibition kinetics and computational simulation[J]. Process Biochemistry, 2013, 48(1): 152-161.
[28] 徐芝勇. 大豆过氧化物酶的酶学特性与应用研究[D]. 杭州: 浙江大学, 2006: 31-32.
[29] 黄浩. 马铃薯多酚氧化酶性质及抑制剂作用机理的研究[D]. 厦门: 厦门大学, 2006: 105.
Study on inhibition kinetics of peroxidase from Lonicera Japonica Thunb
LUOLei1,2
DONGJin-long1,2
ZHUWen-xue1,2
XUEYi-han1,2
(1.CollegeofFoodandBioengineering,HenanUniversityofScienceandTechnology,Luoyang,Henan471023,China; 2.HenanAgriculturalProductsDryingEquipmentEngineeringTechnologyResearchCenter,Luoyang,Henan471023,China)
In order to purify honeysuckle peroxides and study the enzymatic properties and inhibition kinetics,DEAE cellulose DE-52 ion exchange chromatography was used for purification of peroxidase from Lonicera Japonica Thunb prepared preliminarily by three-phase partitioning. Two kinds of peroxidase, HSPⅠ(honeysuckle peroxidaseⅠ)and HSPⅡ(honeysuckle peroxidaseⅡ), were purified,the specific activity were 3 312.3 U/mg and 564.8 U/mg respectively. The double substrate enzymatic reaction type was PingPong reaction analyzed by the reaction kinetics. Citric acid, Sodium metabisulfite showed irreversible inhibition toLoniceraJaponicaThunbperoxidase,L-cysteine showed reversible inhibition, andL-cysteine was a competitive inhibitor that the inhibition constantKIwas 0.053 mmol/L.
LoniceraJaponicaThunb; peroxidase; purification; Inhibition kinetics
国家自然科学基金联合基金项目(编号:U1304330);河南省高校科技创新团队计划(编号:17IRTSTHN016)
罗磊,男,河南科技大学教授,博士。
朱文学(1967—),男,河南科技大学教授,博士。 E-mail:zwx@haust.edu.cn
2017—05—06
10.13652/j.issn.1003-5788.2017.07.026

