线粒体自噬与癌症关系的研究进展
李旭卉,吴习习,张 凯,罗海霞,李 敏
(宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点实验室(宁夏大学),宁夏银川 750021)
线粒体自噬与癌症关系的研究进展
李旭卉,吴习习,张 凯,罗海霞,李 敏*
(宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点实验室(宁夏大学),宁夏银川 750021)
线粒体自噬是选择性自噬的一种,线粒体通过自噬途径被选择性清除。线粒体自噬对于细胞内环境稳定来说十分关键,细胞利用线粒体自噬机制消除功能障碍的线粒体或减少线粒体数量等来适应应激,维持胞内内环境的稳定。因此,对于线粒体自噬的分子机制以及生理作用的研究具有重要的生物学意义。细胞可通过多种分子机制介导线粒体自噬,如PINK1/Parkin、Nix和FUNDC1途径。线粒体自噬调控机制的失调或障碍与人类多种疾病的发病密切相关,有研究发现在多种癌症中存在着不同水平的线粒体自噬,包括直肠癌、肺癌、乳腺癌等,从而也反映了线粒体自噬与癌症的密切关系。论文介绍了线粒体自噬作用和过程的最新研究进展,并着重总结自噬与癌症的关系。
线粒体自噬;PINK1;癌症
线粒体是细胞氧化磷酸化的主要场所,其生成的ATP是细胞生命活动的主要能量来源,但当线粒体受损后可导致活性氧(reactive oxygen species,ROS) 或者细胞凋亡因子的释放,从而造成细胞损伤或细胞凋亡。因此,及时清除这些受损线粒体,对维持线粒体的正常功能与数量就显得尤为重要,而这一过程通常由线粒体自噬(mitophagy) 来完成。
肿瘤是临床上的常见病与多发病,严重威胁着人类健康。自由基与肿瘤之间的关系密切,特别是ROS,它会攻击线粒体DNA(mtDNA)影响氧化磷酸化过程。大部分肿瘤组织如肺癌、乳腺癌、肝癌、胃癌和淋巴瘤等,都发现mtDNA突变[1]。除了ROS可引起肿瘤发生,Ras基因家族也在肿瘤的形成过程中扮演着重要角色。Ras基因家族与人类肿瘤相关的基因有3种,即HRAS、KRAS和RAS,其中KRAS对人类癌症影响最大[2]。KRAS基因就像体内一个“开关”,它在肿瘤细胞生长以及血管生成等过程的信号传导通路中起着重要调控作用,正常KRAS基因可抑制肿瘤细胞生长,而一旦发生突变,它就会持续刺激细胞肿瘤生长,打乱生长规律,从而导致KRAS基因与一些肿瘤的发病机理和预防相关,主要以结直肠癌、肺癌和胰腺癌的突变率比较高。
线粒体自噬与肿瘤发病有着直接或者间接的关系,在肿瘤细胞中具有关键性的控制作用[3]。本文主要根据近年的文献资料,阐述线粒体自噬的基本过程及其在癌症中所起的作用,并对线粒体自噬作为癌症临床治疗的潜在可能进行阐述。
1 线粒体自噬
细胞自噬(autophagy)是细胞依赖溶酶体对蛋白和细胞器进行降解的一条重要途径,近年的研究表明,细胞通常利用自噬机制选择性地清除受损伤或不需要的线粒体,以保障线粒体的质量与数量,这一过程被称为线粒体自噬[4]。按照自噬对降解对象是否具有选择性可分为选择性自噬和非选择性自噬,线粒体自噬就是选择性自噬的一种。线粒体自噬的发现始于电子显微镜对胰高血糖素处理后的大鼠肝脏的观察,结果发现很多被膜结构包裹的线粒体,并且这些线粒体随后会被溶酶体降解掉。线粒体自噬的概念由Lemasters于2005年正式提出[4-6]。在营养缺乏、ROS簇聚、细胞衰老等外界刺激的作用下,细胞内的线粒体会发生去极化并出现损伤,被特异性地包裹进双层膜结构的自噬体中与溶酶体融合,从而将损伤线粒体降解,维持细胞内环境的稳定,具体过程如图1所示,首先受损伤的线粒体被招募在隔离膜周围,随着隔离膜的不断延伸闭合形成自噬体,将线粒体包裹在其中,自噬体与溶酶体融合后清除被包裹的线粒体。
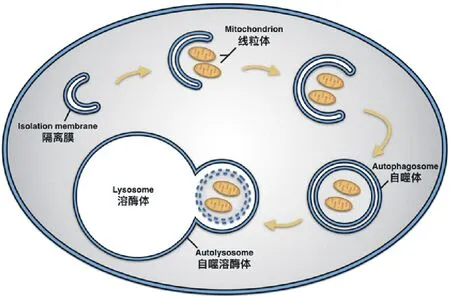
图1 线粒体自噬选择性清除线粒体的过程
2 线粒体自噬机制
线粒体自噬是一个复杂的生理过程,其分子机制涉及Atg、BNIP3和Nix、Parkin、FUNDC1等多种蛋白。饥饿、氧化胁迫、低氧、去极化等多种因素都可引发线粒体自噬。在酵母线粒体自噬过程中,Atg32通过Atg11与Atg8相互作用,引发线粒体自噬[7],而在哺乳动物细胞中线粒体自噬可由PINK1/Parkin、Nix和BNIP3、FUNDC1介导线粒体自噬途径。
2.1 PINK1/Parkin介导的线粒体自噬
PINK1-Parkin是细胞的“分子开关”,决定着细胞应对不同胁迫因素时的命运[8]。Parkin蛋白位于胞浆中,是一种E3泛素连接酶,而PINK1(PTEN-induced putative kinase 1)是一种丝氨酸/苏氨酸激酶[6]。当线粒体受到损伤后,其膜电位降低,PINK1量聚集在线粒体外模上(OMM),磷酸化线粒体蛋白上的泛素来募集线粒体自噬受体,例如OPTN和NDP52[9-10]。它们可直接与自噬体上的LC3(microtubule-associated proteins 1A/1B Light Chain 3)相连,使受损的线粒体被自噬溶酶体特异性降解[11]。同时,PINK1还可募集Parkin使其定位在受损的线粒体上,加强其E3泛素连接酶的活性,使线粒体蛋白泛素化包括VDAC1(voltage-dependent anion selective channel protein 1)、MARF(mitochondrial assembly regulatory factor)和MIF2(mitofusin2),MIF1(mitofusin1)[12],并且这些特定线粒体蛋白的泛素化又可增强PINK1磷酸化线粒体蛋白上的泛素来募集线粒体自噬受体,介导线粒体自噬。当VDAC1发生泛素化,p62/SQSTM1在线粒体表面募集,随后p62/SQSTM1与吞噬膜表面的LC3相结合,线粒体自噬启动,这一过程得到了普遍认可[13]。p62/SQSTM1仅对于线粒体聚集是必需的,该途径受线粒体基质中PINK1的降解调节(图2A)[14]。
2.2 Nix和BNIP3介导的线粒体自噬
线粒体自噬除了清除功能障碍的线粒体外还可通过减少线粒体数量来保障细胞在低氧、营养缺乏等不良环境中的生存。细胞通过调控线粒体关键衔接子BNIP3、Nix(BNIP3L)等来调控线粒体自噬。BNIP3和Nix在蛋白序列上有56%的同源性[15],都是细胞死亡相关蛋白。BNIP3主要在心脏、肌肉和肝脏中高表达,而Nix在造血组织中高表达,研究发现,Nix在红细胞成熟期间线粒体的清除过程中发挥作用[10]。
BNIP3和Nix介导的线粒体自噬,不同于Parkin/PINK1通路,因为BNIP3和Nix蛋白可直接与线粒体作用并靶向与自噬体相连。BNIP3和Nix(BNIP3L)引起的线粒体自噬,通过形成稳定的二聚体整合到线粒体外膜上,该二聚体的C末端存在跨膜结构区域对于其在线粒体上的定位是必需的[16]。其氨基末端区域存在一段保守的LC3相互作用区(LIR),通过磷酸化其丝氨酸/苏氨酸上的关键残基可与新生的隔离膜(isolation membrane)上的LC3-II相互作用(图2B)。
2.3 FUNDC1介导的线粒体自噬
除此之外,线粒体自噬的受体蛋白FUNDC1参与了低氧介导的线粒体自噬[15]。FUNDC1是一个三次跨膜蛋白,定位在线粒体外膜上,在FUNDC1高表达的情况下能够引起明显的线粒体自噬,并且FUNDC1引起的线粒体自噬是Atg5依赖的[17]。与BNIP3和Nix类似,在低氧环境下FUNDC1通过其N端氨基序列中的一段保守LIR结构域直接与LC3结合[17],介导线粒体自噬。FUNC1的18位酪氨酸和13位丝氨酸是2个可磷酸化位点,正常情况下可相应地被Src激酶和CK2磷酸化[12,17],磷酸化状态下的FUNC1与LC3相互作用较弱。但在低氧条件下,Src激酶和CK2的活性降低,导致FUNDC1磷酸化水平降低,从而促进其与LC3相互作用和线粒体自噬。Src激酶和CK2负向调控FUNDC1,而蛋白磷酸酶PGAM5可使FUND1的13位丝氨酸去磷酸化[18],增强与LC3的相互作用。ULK1激酶是自噬启动复合物中的关键组成成分,在低氧条件下,ULK1移动至线粒体FUNDC1上并将其17位丝氨酸磷酸化,以增强FUNDC1与LC3的相互作用,从而促进线粒体自噬(图2C)[19]。
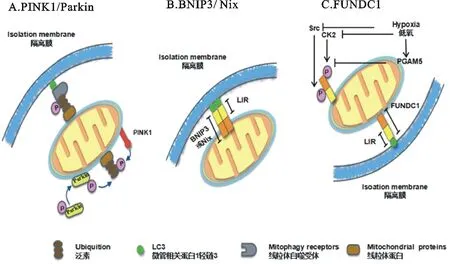
A.PINK1/Parkin:PINK1激酶介导途径激活,Parkin被募集泛素化大量线粒体蛋白如MIF、MARF和 VDAC家族。PINK1磷酸化连接在线粒体蛋白上的泛素招募线粒体自噬受体(包括OPTN和NDP52),受体可与LC3相连,LC3被招募后使得隔离膜延伸促进受损线粒体周围的自噬体形成;B.BNIP3和Nix:在低氧时BNIP3和Nix表达上调,它们可通过LIR区域直接与LC3连接介导线粒体自噬;C.FUNDC1:FUNDC1受到Src和CK2磷酸化失活,但PGAM5使得FUNDC1去磷酸化,FUNDC1和LC3连接介导线粒体的吞噬
A.PINK1 and Parkin: following PINK1-mediated recruitment and activation,Parkin ubiquitinates some mitochondrial proteins including the mitofusins,MARF and VDAC family members.PINK1 phosphorylates the ubiquitin attached to mitochondrial proteins to recruit mitophagy receptor proteins (including Optineurin and NDP52).This drives LC3 recruitment to extend the isolation membrane and promote autophagosome formation around the damaged mitochondrion;B.BNIP3 and Nix:BNIP3 and NIX are upregulated in response to hypoxia.These mitophagy receptors directly bind LC3 via LIR domains and induce isolation membrane recruitment and formation for mitophagy;C.FUNDC1:FUNDC1 is inactivated by phosphorylation by Src and CK2. When dephosphorylated by PGAM5,FUNDC1 can bind LC3 to induce mitochondrial engulfment
图2线粒体自噬介导机制示意图
Fig.2 Nix or BINIP3,FUNDC1and PINK1-parkin pathways of mitophagy
3 线粒体自噬机制与癌症
癌症是机体在各种致瘤因素作用下,局部组织的细胞在基因水平上失去对其生长的正常调控导致异常增生与分化而形成的新生物,是目前人类健康的主要“杀手”之一。从线粒体自噬机制与肿瘤的研究报道中可发现PARK2(Parkin)基因在乳腺癌、卵巢癌和肺癌等多种癌症中功能受到抑制,并频繁缺失,提示PINK1/Parkin介导的线粒体自噬可能是一种肿瘤抑制机制。Nix和BNIP3类似于Parkin也起抑制肿瘤的作用[3],而FUNDC1作为新的线粒体自噬受体蛋白,其机制与癌症的关系尚不清除,可能成为未来研究的焦点。
3.1 PINK1/Parkin与癌症
线粒体自噬异常与常染色体隐性青少年帕金森综合征(Recessive Autosomal Juvenile Parkmsonism,AR-JR)的发生有关联,PARK6 (PINK1)或PARK2(Parkin)纯合子缺失是主要的形成因素。近年越来越多的证据表明,线粒体自噬机制缺陷与癌症的形成可能存在某种联系,不同癌症中PARK2(Parkin)和PARK6(PINK1)的变化情况见表1[18],常见PARK2的拷贝数发生改变。例如,在肉瘤和子宫癌中常见PARK2扩增,但在其他肿瘤中,如卵巢癌、乳腺癌和肺癌[3]等PARK2往往出现缺失或功能丧失这样的损害突变。PARK2基因位于染色体上的常见脆性位点(FRA6E,6q26),其缺失并不一定意味着与这些肿瘤存在因果关系。因为该位点PARK2的丧失也可能是某种肿瘤复制过程中的应激结果[20]。然而,在多种肿瘤中却检测到了PARK2特定位点的突变或缺失,这支持了Parkin基因在该脆性位点驱动突变[21]的可能。这里收集了新的证据,表明线粒体自噬缺陷促进了特定肿瘤的发展。
3.1.1 PINK1/Parkin与结肠直肠癌的关系 有证据表明多达33%的结肠直肠癌患者出现PARK2杂合性缺失[22]。另一项研究再次证明了这一断言,该结果显示25%的结肠直肠癌肿瘤具有局灶性的PARK2缺失,因此PARK2可作为良好的结肠直肠癌鉴定基因[18]。由于结肠直肠癌的特征在于基因组的不稳定性,这些肿瘤中PARK2的丢失也可能是偶然性的。然而,在Apcmin小鼠模型中PARK2的单个等位基因的缺失加速了自发性结肠直肠肿瘤的生长,意味着PARK2突变驱动了肿瘤进展而不仅仅是基因组不稳定性的结果,Parkin的E3连接酶活性是真正的肿瘤抑制机制[23]。 还有研究发现被诊断为结肠直肠癌的患者在其转移性肝肿瘤中出现PARK2中的局灶性缺失,但祖代原发性肿瘤不发生。提示PARK2缺失或功能突变丧失为某些癌细胞的转移提供条件。
3.1.2 PINK1/Parkin与肺癌的关系 Parkin缺失在肺癌中是常见的突变,由于自噬抑制,细胞周期蛋白E的上调和ROS积累都被称为肺癌中的肿瘤驱动因子[24]。当Atg5(autophagy related gene 5)缺陷后,由KRAS诱导的肺癌出现受损线粒体数量的上升,并伴随着线粒体的氧化磷酸化带来的损伤[25]。Atg5是自噬体膜扩展延伸的重要下游效应蛋白。当Atg5缺失,Park2拟表型中的ROS大量在受损线粒体中积累。然而,有趣的是该疾病的加速发展却没有影响这些Atg5缺失小鼠中肿瘤的侵袭[25]。另外,在A549细胞中也出现线粒体自噬清除功能的减弱,这可能是由于裂变蛋白Drp1下调造成的结果[26]。如前所述,线粒体网络中受损细胞器的适当分裂和融合是线粒体自噬必需的。另外,发现在相同细胞系中使用化学诱导剂其不仅可以诱导自噬的发生,同时还可抑制肿瘤增殖,但是这是否与线粒体特异性应答有关,目前仍不清楚。还有研究发现Ⅰ型复合物的mtDNA突变竟出现在没有吸烟史的肺癌患者中。然而,对于KRAS突变的肺癌患者其患病原因与mtDNA突变的增加没有显著的相关性[27],线粒体代谢缺陷可能是其患肺癌的主要因素。
3.1.3 PINK1/ Parkin与乳腺癌的关系 线粒体自噬功能缺陷也影响着乳腺癌。在某些乳腺癌中常见含PARK2的FRA6E脆性区域缺失,这也支持了Parkin对肿瘤的抑制作用,并在侵袭性三阴性乳腺癌中也见到了PARK2的拷贝数高频率的发生改变[28]。有研究发现,在乳腺癌中周期蛋白D和E(Parkin底物)两者上调[29]。细胞克隆形成试验结果显示,Parkin在许多乳腺癌细胞系(包括MCF7细胞)中的再表达降低了细胞克隆能力。这表明PARK2特异性地缺失引起了其生长优势,至少在体外试验中是这样的。并且PARK2功能性基因丧失被认为不仅仅是一种“过客”突变,而是乳腺癌的重要驱动因素。
3.2 Nix、BNIP3与癌症
然而有趣的是BNIP3和Nix(BNIP3L)作为重出要的线粒体自噬受体在乳腺导管内原位癌(DCIS)中呈现上调趋势,但是在侵袭癌中不管在蛋白水平还是RNA水平均不见BNIP3表达,这与肿瘤细胞的增殖指数和淋巴结转移有一定的联系。三阴性乳腺癌(TNBC)是一种侵袭性的人类亚型乳腺癌,BNIP3在该疾病中频繁缺失,并且BNIP3缺失预示着患者的不良预后和癌症转移[3]。BNIP3在其他类型的肿瘤中也发生表观遗传学沉默,包括肺癌、结肠直肠癌、胰腺癌和肝癌,尤其对于已发展成侵袭性和转移性的癌症。BNIP3在胰腺癌中失活,这提示BNIP3的激活可以防止细胞的恶性转化,通过控制ROS的水平和保持HIF-1α稳定。致癌物的暴露导致BNIP3缺失,造成损伤的线粒体积累,ROS增加,胰腺癌的恶化。线粒体自噬缺陷造成的线粒体功能障碍可以促进肿瘤生长[29]。
在乳腺癌、肺癌、前列腺癌、宫颈癌等多肿瘤细胞中均有发现Nix的高表达。在肺癌还发现了高表达的Nix与预后较差相关。Yan J等发现在肺癌细胞中,高表达的Nix的细胞亚群表现为更强的转移能力。但是与此同时,也有文献报道在乳腺癌中Nix表达缺陷所致的线粒体自噬受损反而可促进肿瘤的转移说明在不同种类不同时期的肿瘤细胞中Nix可能发挥不同的作用。杨莹[30]的研究发现肺癌干细胞中存在活跃的线粒体自噬现象,推测肺癌干细胞中代谢及线粒体数目的相关改变与线粒体自噬现象有关,且Nix蛋白在其中起着一定的作用。
4 线粒体自噬与癌症治疗
在癌症治疗中,通过提高靶向线粒体自噬作用,这可大大提高其治疗癌症的可能性,因为肿瘤细胞与正常细胞相比,胞内ROS大量积累致使它们的代谢发生改变,更依赖于线粒体代谢。这就使得癌细胞比正常细胞对呼吸链抑制剂和其他线粒体毒素更为敏感,如抑制线粒体蛋白质翻译的抗生素,可重新用于癌症治疗。USP30线粒体自噬的负调节蛋白,USP30[18]的抑制可增强线粒体自噬能力并因此可能抑制肿瘤的生长。如上所述,抑制线粒体自噬的负调节的是增强其作用的有效途径。线粒体自噬的上调也可通过抑制PINK1蛋白水解作用,增强PINK1在线粒体膜上的稳定性,从而使得Parkin在MOM上积累以诱导线粒体自噬[27]。
另外,也有研究证明其他方式也可诱导线粒体自噬发生,如低强度超声波可在姜黄素存在条件下诱导线粒体自噬,从而促进鼻咽癌CNE2细胞死亡[31]。利用诱导多能干细胞治疗肿瘤也是近年来新的研究方向,而Vazquez-Martin发现线粒体自噬参与诱导多能干细胞的转化过程通过调节线粒体自噬机制,从而为调控线粒体自噬治疗肿瘤提供了又一思路[32],线粒体对多种肿瘤细胞生长的影响使得线粒体增强剂的发展成为在癌症治疗中探索的新希望。
5 展望
线粒体自噬缺陷和线粒体功能障碍与多种疾病的发生密切相关。目前所知的人类多数癌症、肌肉性疾病、神经变性疾病,其发病机理与线粒体的稳定性有关,而线粒体自噬又是维持线粒体稳定性的关键调控机制。线粒体损伤后致使胞内ROS积累、ATP产生异常,进一步可导致线粒体DNA损伤,功能发生紊乱。线粒体自噬可清除功能紊乱的线粒体,以减弱胞内ROS的积累,降低细胞癌变率,避免细胞凋亡、坏死。那么,利用线粒体自噬靶向治疗的方法来医治多种癌症是很有希望的。但目前该方面研究还存在较多不足与盲点,这需要后续对线粒体自噬、癌症机理做大量的基础理论研究,为癌症等疾病的药物研发提供新的方向。总之,通过调控线粒体自噬而防止或减轻疾病病变,这是一个新兴的研究领域,具有广阔的研究潜能和治疗前景。
[1] 熊珊珊,石英英,石汉平.活性氧与肿瘤研究进展[J].中华肿瘤防治杂志,2014,21(13):1045-1048.
[2] 叶 璐,于晓红.Kras基因在肿瘤中的研究与展望[J].实用癌症杂志,2010,25(3):323-325.
[3] Chourasia A H,Boland M L,Macleod K F.Mitophagy and cancer[J].Cancer Metab,2015,3(1):4.
[4] 刘 垒,冯 杜,朱玉山,等.线粒体自噬的研究进展[J].中国细胞生物学学报,2012(10):959-966.
[5] 邹 利,王云甫.线粒体自噬及其机制在神经系统疾病中的研究进展[J].卒中与神经疾病,2016(4):302-308.
[6] Youle R J,Narendra D P.Mechanisms of mitophagy[J].Nat Rev Mol Cell Biol,2011,12(1):9.
[7] 刘洹洹,王志舒,谭晓荣.线粒体自噬与人类疾病[J].中国生物化学与分子生物学报,2015(5):466-472.
[8] Zhang C,Lee S,Peng Y,et al.PINK1 triggers autocatalytic activation of Parkin to specify cell fate decisions.[J].Cur Biol,2014,24(16):1854-1865.
[9] Heo J M,Ordureau A,Paulo J A,et al.The Pink1-Parkin mitochondrial ubiquitylation pathway drives a program of OPTN/NDP52 recruitment and TBK1 activation to promote mitophagy[J].Mol Cell,2015,60(1):7-20.
[10] Springer M Z,Macleod K F.Mitophagy:Mechanisms and role in human disease[J].J Pathol,2016,240(3):253-255.
[11] Pickrell A M,Youle R J.The roles of PINK1,parkin and mitochondrial fidelity in Parkinson's disease[J].Neuron,2015,85(2): 257-273.
[12] 王志舒,谭晓荣,刘洹洹.线粒体自噬调控机制研究进展[J].生物技术通报,2015,31(6):42-47.
[13] Geisler S,Holmstr m K M,Skujat D,et al.PINK1/Parkinmediated mitophagy is dependent on VDAC1 and p62/SQSTM1[J].Nat Cell Biol,2010,12(2):119-131.
[14] 刘洹洹,王志舒,谭晓荣.线粒体自噬与人类疾病[J].中国生物化学与分子生物学报,2015(5):466-472.
[15] 何云凌,吴丽颖,朱玲玲,等.线粒体自噬在低氧适应中的作用[J].生物化学与生物物理进展,2012,39(3):217-223.
[16] Ney P A.Mitochondrial autophagy:Origins,significance,and role of BNIP3 and NIX.[J].Biochim Biophysi Acta (BBA) Mol Cell Res,2015,1853(10):2775-2783.
[17] Chen M,Chen Z,Wang Y,et al.Mitophagy receptor FUNDC1 regulates mitochondrial dynamics and mitophagy[J].Autophagy,2016,12(4):689-702.
[18] Bernardini J P,Lazarou M,Dewson G.Parkin and mitophagy in cancer[J].Oncogene,2017,36(10):1315.
[19] Wu W,Tian W,Hu Z,et al.ULK1 translocates to mitochondria and phosphorylates FUNDC1 to regulate mitophagy[J].Embo Reports,2014,15(5):566-575.
[20] Burrell R A,McClelland S E,Endesfelder D,et al.Replication stress links structural and numerical cancer chromosomal instability[J].Nature,2013,494(7438):492-496.
[21] Veeriah S,Taylor B S,Meng S,et al.Somatic mutations of the Parkinson's disease-associated gene PARK2 in glioblastoma and other human malignancies[J].Nat Gene,2010,42(1):77.
[22] Poulogiannis G,Mcintyre R E,Dimitriadi M,et al.PARK2 deletions occur frequently in sporadic colorectal cancer and accelerate adenoma development in Apc mutant mice.[J].Proc Natl Acad Sci USA,2010,107(34):15145-15150.
[23] Matsuda S,Nakanishi A,Minami A,et al.Functions and characteristics of PINK1 and Parkin in cancer[J].Front Biosci,2015,20(3):491.
[24] Kaminskyy V O,Piskunova T,Zborovskaya I B,et al.Suppression of basal autophagy reduces lung cancer cell proliferation and enhances caspase-dependent and -independent apoptosis by stimulating ROS formation[J].Autophagy,2012,8:1032-1044.
[25] Rao S,Tortola L,Perlot T,et al.A dual role for autophagy in a murine model of lung cancer[J].Nat Commun,2014,5(3):3056.
[26] Thomas K J,Jacobson M R.Defects in mitochondrial fission protein dynamin-related protein 1 are linked to apoptotic resistance and autophagy in a lung cancer model[J].PloS One,2012,7(9):e45319.
[27] Dasgupta S,Dasgupta S,Soudry E,et al.Mitochondrial DNA mutations in respiratory complex-I in never-smoker lung cancer patients contribute to lung cancer progression and associated with EGFR gene mutation[J].J Cell Physiol,2012,227(6):2451-2460.
[28] Shah S P,Roth A,Goya R,et al.The clonal and mutational evolution spectrum of primary triple negative breast cancers[J].Nature,2012,486(7403):395-399.
[29] Kulikov A V,Luchkina E A,Gogvadze V,et al.Mitophagy:Link to cancer development and therapy[J].Biochem Biophys Res Commun,2017,482(3):432-439.
[30] 杨 莹.肺癌干细胞的氧化磷酸化异常与线粒体自噬关系的研究[D].浙江杭州:浙江大学,2016.
[31] Vazquezmartin A,Cufí S,Corominasfaja B,et al.Mitochondrial fusion by pharmacological manipulation impedes somatic cell reprogramming to pluripotency:New insight into the role of mitophagy in cell stemness[J].Aging,2012,4(6):393-401.
[32] Li F,Chung T,Vierstra R D.Autophagy-related11 plays a critical role in general autophagy- and senescence-induced mitophagy in Arabidopsis[J].Plant Cell,2014, 26(2):788-807.
ProgressonRelationshipbetweenMitophagyandCancer
LI Xu-hui,WU Xi-xi,ZHANG Kai,LUO Hai-xia,LI Min
(KeyLaboratoryofMinistryofEducationforConservationandUtilizationofSpecialBiologicalResources(NingxiaUniversity)/LifeScienceSchool,NingxiaUniversity,Yinchuan,Ningxia,750021,China)
Mitophagy, the selective engulfment and clearance of mitochondria, is essential for the homeostasis of a healthy network of functioning mitochondria.Cells use mitophagy to eliminate dysfunctional mitochondria or reduce the number of mitochondria to adapt to stress and maintain intracellular environmental stability.At present, mitophagy can be mediated by a variety of molecular mechanisms, such as PINK1/Parkin,BNIP3,Nix and FUNDC1 pathways.In recent studies,it is reported that there exists mitophagy in a variety of cancer,including lung cancer, breast cancer and so on.In this review,we briefly summarized recent progress in understanding the function and process of mitophagy.In particular,we focused on studies that reveal the relationship between mitophagy and cancer.
mitophagy;PINK1;cancer
2017-03-13
国家自然科学基金项目(31460039)
李旭卉(1991-),女(回族),浙江临安人,硕士研究生,主要从事自噬在巨噬细胞抗绵羊肺炎支原体感染中作用的研究。*
S852.33
:A
:1007-5038(2017)09-0109-06

