ARMS法检测非小细胞肺癌液基细胞学标本中EGFR基因突变
万 涛,余雪梅,胡前芳,徐 莉,刘金华,李岱容
ARMS法检测非小细胞肺癌液基细胞学标本中EGFR基因突变
万 涛1,余雪梅2,胡前芳1,徐 莉1,刘金华1,李岱容1
目的 探讨非小细胞肺癌液基细胞学标本在突变扩增阻滞系统(amplification refractory mutation system, ARMS)检测EGFR基因突变中的应用及特点。方法 收集诊断阳性的液基细胞学标本,提取样本DNA,采用ARMS法检测EGFR基因突变情况,并分析EGFR基因突变与临床特征、标本类型、病理类型、肿瘤细胞含量等关系。结果 279例液基细胞学样本中检测EGFR基因突变117例,突变率为41.9%,其中腺癌突变率为44.7%,非腺癌突变率为15.4%;细胞学标本中肿瘤细胞含量丰富时、中等时、小的集群、少量时EGFR基因突变率分别为53%、44%、45%、24%;EGFR基因突变标本中,19外显子缺失突变(19Del)发生比例为51.9%,21外显子错义突变L858R发生比例为39.4%。结论 各种类型的液基细胞学标本能够很好的用于非小细胞肺癌EGFR基因突变检测;肿瘤细胞含量丰富的样本EGFR基因突变率高于肿瘤细胞含量较少的样本。EGFR基因19Del最为常见。
肺肿瘤;非小细胞肺癌;液基细胞学;表皮生长因子受体基因突变;突变扩增阻滞系统
目前,超过70%的肺癌患者确诊时已处Ⅳ期,无法手术,难以获取肿瘤组织。因此他们的诊断大多数是通过针吸细胞学标本获得。CT、超声引导下的细针穿刺活检、支气管抽吸物、胸水及痰等细胞学检查是晚期肺癌患者的主要诊断途径,而液基细胞学正逐渐被广泛用于此类标本的检测[1-2]。随着分子生物学技术的发展,肺癌靶向治疗成为热点,其中EGFR基因是肺癌分子检测中最常用的分子靶点[3-4]。基于实时荧光定量PCR的突变扩增阻滞系统(amplification refractory mutation system, ARMS)是目前检测EGFR基因突变最为敏感的方法。为探讨液基细胞学标本在EGFR基因突变检测中的应用及特点,本文采用ARMS法检测胸腔积液、心包积液、纤维支气管镜抽吸物[5]、痰、细针穿刺针吸等通过微创方式获取的细胞学标本中EGFR基因突变,并分析EGFR突变与肺癌患者临床病理特征之间的关系。
1 材料与方法
1.1 标本来源 收集2014年2月~2015年7月行肺癌EGFR基因突变检测的各类标本共计403例。液基细胞学标本为重庆医科大学附属第一医院呼吸内科细胞病理学室细胞学诊断为非小细胞肺癌后的剩余标本,细胞学标本要求液基细胞保存液中的剩余标本>10 mL以及液基薄层细胞涂片中癌细胞量不低于5%,共计279例,分别是胸腔积液97例、心包积液4例、纤维支气管镜抽吸物125例、痰液39例和淋巴结穿刺细胞学标本4例、超声内镜引导下的经支气管针吸活检(endobronchial ultrasound-guided transbronchial needle aspiration, EBUS-TBNA)细胞学标本10例。组织学标本来自于重庆医科大学病理诊断中心,均为福尔马林-石蜡包埋(formalin-fixed paraffin-embedded, FFPE)标本,共124例,其中包括手术切除标本21例、气管镜活检标本88例、肺穿刺活检标本15例。
1.2 液基细胞学处理及制片 胸腔积液或心包积液:标本经离心处理后,倒去上清液,滴加液基保存液稀释细胞制成细胞悬液,如离心后下层含有较多的红细胞,去掉上清液后,轻轻刮去表层细胞于另一离心管中,然后滴加液基稀释细胞制成细胞悬液,沉降式制备薄片,剩余标本用于基因检测。
痰液和纤维支气管镜抽吸标本检查:将痰液和抽吸标本置于液基保存液中,加入黏液消化剂,震荡15 min,2 000 r/min离心5 min,去掉上清液,然后滴加液基稀释细胞制成细胞悬液,沉降式制备薄片,剩余标本用于基因检测。
穿刺标本:将穿刺标本置于液基保存液中,2 000 r/min离心5 min,去掉上清液,然后滴加液基稀释细胞制成细胞悬液,沉降式制备薄片,剩余标本用于基因检测。
1.3 镜下细胞学标本肿瘤细胞含量评估 虽然ARMS法检测EGFR的灵敏度高,能够检测到标本中1%的肿瘤细胞,但细胞学标本中常含有较多的非肿瘤细胞,为了观察肿瘤细胞在标本中的占比对EGFR状态的影响,所有病例的涂片初步在光镜下观察液基薄层涂片中癌细胞数量占整个细胞量的比例,将其分为4级:(1)minimal:多数是红细胞和有核细胞,肿瘤细胞群较少见;(2)small cluster:肿瘤细胞群不均匀的分布在整个片子上;(3)moderate:众多的肿瘤细胞群广泛分散在片子上;(4)abundant:大量细胞群分布在整个片子上。
1.4 标本中DNA的提取
1.4.1 液基细胞学标本DNA提取 收集液基细胞保存液中的细胞沉淀,按照QIAamp DNA Mini Kit (QIAGEN GmbH, Germany)试剂盒说明书提取标本中的DNA。用Nanodrop 2000分光光度计检测DNA样品的浓度。
1.4.2 石蜡标本处理及DNA提取 石蜡标本经病理学家评估肿瘤细胞含量≥10%,石蜡包埋组织5 μm厚连续切片8~10张,用于EGFR基因检测。FFPE标本需经脱蜡及蛋白酶K消化处理,按照QIAamp DNA FFPE Tissue Kit试剂盒说明书提取FFPE标本DNA。用Nanodrop 2000分光光度计检测DNA样品浓度。
1.5 EGFR基因突变检测 本实验室对各类标本提取基因组DNA并纯化,采用ARMS PCR法对EGFR基因编码区的4个外显子29种突变位点进行检测。根据人类EGFR基因21种突变检测试剂盒(厦门艾德生物公司)说明书进行操作,并使用COBAS z480实时荧光定量PCR仪进行检测。
1.6 统计学分析 采用SPSS 19.0软件进行统计学分析,不同标本类型、不同病理分型、不同分期、肿瘤细胞含量等组间EGFR基因突变率差异采用χ2检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 镜下液基细胞学的形态特征 液基细胞制片背景清晰,黏液杂质少。由于细胞固定及时,保存较好,立体感强。腺癌细胞呈单个、腺样聚集,大圆形、多角形及柱状,双核或多核细胞常见,细胞质淡染透明,核/质比增大,核居中心或偏位,染色质呈细颗粒状,有明显核仁;也有呈乳头状或管状腺样排列或三五成群,群内细胞互相重叠形成立体三维结构,清晰、多层面,癌细胞凸现。液基涂片中鳞癌细胞体积大,有明显异形性,核/质比例增大,核居中央,染色质呈粗颗粒状,可见较大的核仁浓染、固缩;有的染色质呈团块状、胞质丰富粉染,高分化鳞癌细胞形态似蝌蚪形、纤维形或蛇形(图1)。
2.2 样本中DNA浓度的评价 所有样本DNA提取后均经紫外分光光度计测量浓度及通过计算OD值进行质量评估,液基细胞学样本DNA平均浓度为28.6 ng/μL(0.21~859.6 ng/μL);石蜡包埋组织样本DNA平均浓度为65.8 ng/μL(15.5~988.3 ng/μL)。2.3 临床病理特征与EGFR基因突变的关系 本实验共收集403例肺癌患者的临床样本,其中液基细胞学标本279例,组织学标本124例,通过ARMS法共检测162例EGFR基因发生突变(阳性率为40.2%),其中男性254例,女性149例;男性患者EGFR基因突变率为32.7%(83/254),低于女性患者(53.0%,79/149)(P<0.000 1)。所有标本中诊断为腺癌者350例,鳞癌者47例,另有6例腺鳞癌。腺癌患者EGFR基因突变率为44.3%(155/350),高于其他非小细胞肺癌者的EGFR基因突变率(13.2%,7/53)(P<0.01)。肺癌切除病例的EGFR突变率为33.3%(7/21),肺部肿瘤小活检病例的EGFR突变率为36.8%(38/103),液基细胞学标本的EGFR突变率为41.9%(117/279),临床分期:Ⅰ~Ⅲa期者58例,Ⅲb~Ⅳ期者232例;分期不明者113例,Ⅰ~Ⅲa期与Ⅲb~Ⅳ期者EGFR基因突变率之间差异有统计学意义(20.7%vs42.7%,P<0.05,表1、2)。2.4 液基细胞学样本与组织学样本EGFR基因突变状态的比较 为比较液基细胞学标本与组织学标本中EGFR基因突变率是否存在差异,本实验对液基细胞学标本与组织学标本进行了分类统计(表2)。液基细胞学标本279例,腺癌的EGFR突变率为44.7%(113/253),组织学标本124例,检出腺癌者97例,EGFR突变率为43.3%(42/97),液基细胞学与组织学标本两组EGFR基因突变率之间差异无统计学意义(P>0.05)。

ABCDE图1 腺癌细胞液基薄片镜下所见,标本分别为痰液(A)、淋巴结穿刺(B)、胸水(C)和气管镜抽吸物(D)、胸水鳞癌(E)
2.5 不同组织类型EGFR基因突变状态分析 403例非小细胞肺癌患者EGFR突变率为40.2%(162/403),包括19外显子(19Del)缺失突变84例(占总突变51.9%,84/162),21外显子置换突变(包括L858R和L816Q)66例(40.7%,66/162),20外显子插入突变(非敏感突变)2例(1.2%,2/162)、置换突变(G719X和T790M)10例(6.17%,10/162)。腺癌或鳞癌,EGFR基因突变类型主要为19Del和L858R突变(表3)。ARMS法检测EGFR基因突变结果(图2、3)。
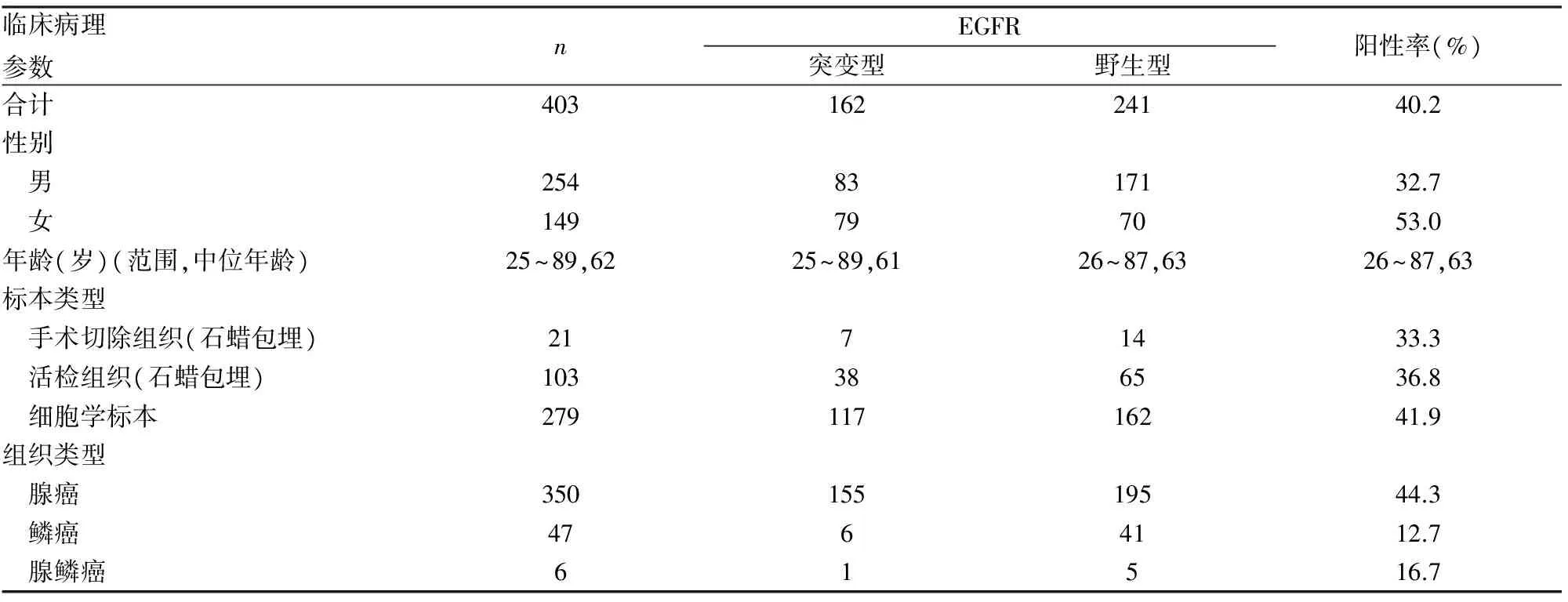
表1 临床病理特征与EGFR基因突变的关系

表2 液基细胞学样本与组织学样本中EGFR基因突变状态的比较

表3 不同肺癌组织类型EGFR基因突变情况

图2 ARMS法检测19Del基因突变

图3 ARMS法检测L858R基因突变
2.6 不同类型细胞学标本的EGFR基因突变分析 本组实验中诊断为腺癌的液基细胞学样本共253例,其中针吸细胞学标本4例,EGFR基因突变率为50.0%(2/4);积液标本101例,EGFR基因突变率为48.5%(49/101);EBUS-TBNA样本10例,EGFR基因突变率为30.0%(3/10);纤维支气管镜抽吸物样本99例,EGFR基因突变率为42.4%(42/99),痰液标本39例,EGFR基因突变率为43.6%(17/39)。各组间EGFR基因突变率差异无统计学意义(P<0.05)。
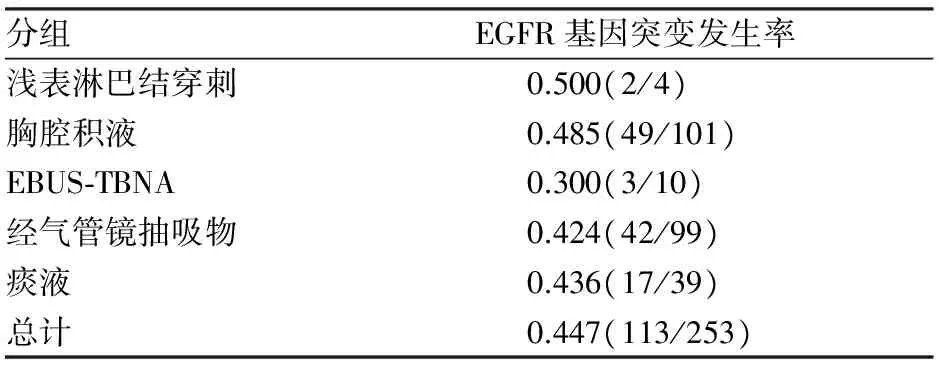
表4 不同类型液基细胞学标本中腺癌EGFR基因突变发生率
2.7 标本中癌细胞量与EGFR基因突变之间的关系 为探讨标本中癌细胞的量是否影响基因突变的检出率,在光镜下对243例腺癌标本的液基涂片中癌细胞数量占整个涂片细胞量的比例进行了评估、计数,根据细胞学标本中不同癌细胞量并分为4级(minimal、small cluster、moderate、abundant),各级标本数量分别为minimal 29例,占比11.8%;small cluster 67例,占比27.5%;moderate 96例,占比39.6%;abundant 51例,占比21.1%(图4A)。图4B中可见癌细胞量较少时,EGFR基因突变率相对较低,样本癌细胞量评价为minimal时EGFR阳性率仅为24%,当标本中癌细胞量评价为abundant时,其EGFR基因突变率为53%,两者相比差异有统计学意义(P<0.05,)。当癌细胞量为moderate和small cluster时,AMRS法检测EGFR基因突变率分别为44%和45%,与另外两个级别相比,差异无统计学意义(P>0.05)。
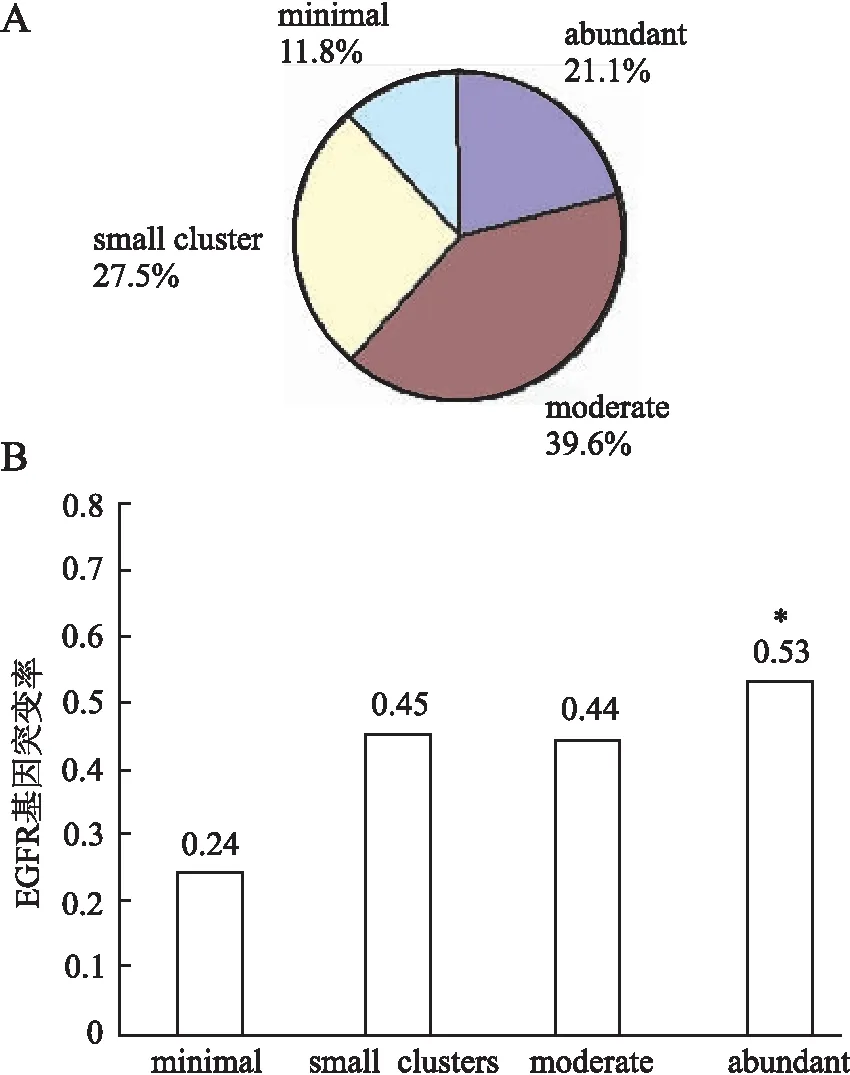
图4 样本中肿瘤细胞含量对EGFR突变检出率的影响
A.不同癌细胞量的样本数占总样本数的百分比;B.癌细胞含量与EGFR基因突变率的关系;abundantvsminimal,*P<0.05
3 讨论
因大多数晚期肺癌患者被诊断时已失去手术机会,故过去常采用以铂类为基础的联合化疗对患者进行治疗。现在这些患者越来越多的选择靶向治疗,对肺腺癌患者的肿瘤样本中进行基因突变分析,已成为一种常规的临床实践[6]。检测EGFR活化突变在确定酪氨酸激酶抑制剂靶向疗法的应用上起着至关重要的作用。预先了解肺腺癌患者的EGFR和K-RAS基因突变情况有利于临床上合理选择不同药物对患者进行治疗。
大部分肺癌患者通过细针穿刺细胞标本、胸腔积液、支气管冲洗/刷和支气管肺泡灌洗细胞学样本等进行诊断[7],细胞学标本有时候可能是分子检测唯一可用的材料。但是在大多数细胞学标本中肿瘤细胞的数量是有限的,寻找一种更加敏感的检测EGFR基因突变的方法显得至关重要。有研究表明,直接测序检测标本中肿瘤细胞<50%的突变DNA标本,重复性较差,很少能在<25%肿瘤细胞中检测到突变。在众多EGFR基因突变检测方法中,直接测序法是DNA序列分析的“金标准”,但因只有突变DNA含量≥20%才能被检测到,其敏感性并不高。由于非小细胞肺癌患者脱落细胞标本中常含有较多的正常细胞,为避免非肿瘤细胞对EGFR检查结果的影响。故本组实验采用ARMS法检测EGFR基因突变,因敏感性高,可检测含量低至1%的突变DNA,为真正的闭管无污染操作。
利用细胞学标本进行肺癌EGFR基因检测已有报道,Billah等[8]收集263例肺癌患者的细胞学样本,使用ARMS进行EGFR基因突变检测,其细胞学样本包括超声引导下经气管细针抽吸(endobronchial ultrasound-guided fine-needle aspiration, EBUS-FNA)、CT引导下FNA、胸水、心包积液以及肺泡、气管灌洗液。结果显示,总体标本不足率仅为6.2%。近年来EBUS-TBNA在临床上对肺癌的诊断和分期的应用越来越广泛,国内外不少学者也开始尝试利用该细胞学标本提取DNA进行基因突变检测。Garcia-Olive等[9]收集51例非小细胞肺癌患者的EBUS-TBNA细胞学标本,分析EGFR基因突变情况,标本经FFPE处理后,其中35例(68.6%)DNA提取的质量可以进行基因突变检测。经FFPE的细胞块在提取DNA时和经石蜡包埋的组织处理方法一样,均需经过切片、二甲苯脱蜡、无水乙醇脱水、烘干等常规处理,在经过上述多种步骤、多种理化因素刺激及DNA酶的作用后,肿瘤细胞的DNA易于断裂和降解,提取的DNA质量受到影响。本组实验采用液基细胞学诊断后保存在液基细胞保存液小瓶内的标本,减少了DNA的降解,获得较好的DNA提取满意度。同时作者采用灵敏度更高的ARMS法进行EGFR基因突变检测,可避免通过测序法进行检测所导致的假阴性。
Hubers等[10]尝试用灵敏度较高的技术检测痰标本的EGFR基因突变情况,作者收集10例经组织学证实存在EGFR基因突变的肺癌患者痰液标本,分别釆用Cycleave PCR、COLD-PCR、PangaeaBiotech SL Technology和高分辨率溶解曲线分析技术(high resolution melting, HRM)等方法进行EGFR基因突变检测,取决于检测方法的不同,结果10例经组织学证实存在EGFR基因突变的痰标本成功检测出了3~5例基因突变(30%~50%)。本组中共有35例痰标本,DNA浓度和纯度均较满意,虽然痰标本和纤维支气管镜抽吸物标本中均混有较多呼吸道分泌物及正常上皮细胞等干扰物,但是经过液基细胞技术处理后,不影响DNA提取的满意率,说明痰标本是可以用于分子检测的。
文献报道[11],EGFR突变率在东亚人群中为36.4%~66.3%,多见于非吸烟的女性腺癌患者,两种主要的EGFR基因突变类型为19Del和L858R,19Del突变占45%~50%,L858R突变占45%~50%,其他少见突变(5%)主要为20外显子置换和插入突变及18外显子密码子719置换突变。本组实验结果发现腺癌患者EGFR突变率为44.3%(155/350),19Del占总突变的52.3%(81/155),L858R(包括L858R和L816Q)占总突变的39.4%(61/155),20外显子插入突变(非敏感突变)占1.3%(2/155),总突变率与文献报道一致,只是突变类型比例稍有不同,考虑与样本量及人群选择有关。本组中鳞癌的突变率为12.7%(6/47),这与Choi等[12]研究发现亚裔鳞癌的突变率(11.1%,6/54)、非吸烟鳞癌突变率16.7%(2/12)等结果一致。未来将进行大样本、非吸烟鳞癌患者的EGFR突变检测及EGFR-TKIs疗效随访实验,以确定亚裔肺鳞癌患者尤其是非吸烟患者的EGFR突变率及EGFR-TKIs使用疗效。
在有组织学标本的情况下,一般优先采用组织学标本进行EGFR基因和K-RAS基因检测。Smouse等[13]曾按照满意标本的标准即肿瘤细胞的数量大于有核细胞的25%,收集FFPE的细胞块,提取DNA后对EGFR基因第18~24外显子扩增,然后直接测序,得出的EGFR基因突变率高达58%(7/12),因此指出细胞学标本中肿瘤细胞数量较少限制了其广泛应用于测序,为尽量避免非肿瘤细胞的干扰,在进行EGFR基因突变检测前对肿瘤组织/细胞量进行评估非常重要,否则会造成假阴性结果。与本组实验相比,其EGFR基因的突变率较高,这可能是由于本组实验采用了较多液基细胞学标本,其中有较多的病例肿瘤细胞含量较少,使得EGFR基因突变率降低。此外,Smouse等[13]选取的细胞学标本均是腺癌和支气管肺泡癌病例,无鳞癌,而腺癌和支气管肺泡癌的EGFR基因突变率比鳞癌高。因此,利用液基细胞学标本进行EGFR基因检测前,需对样本中肿瘤细胞含量进行评估,合适的样本才能用于EGFR基因突变检测。
总之,本组实验表明液基细胞学标本是进行肺癌分子靶向治疗基因检测有价值的材料来源,对于很多肺癌晚期患者来说,通过获取痰液、胸腹水、心包积液、纤维支气管镜抽吸物、细针穿刺针吸物等样本进行细胞学诊断是常见的诊断方式。而这类标本目前广泛采用液基细胞制片技术进行处理,由于液基细胞保存液能够很好的保留细胞形态及其完整性,且不影响样本核酸的提取,进行诊断后往往有多余标本,故将其用于肺癌EGFR基因检测能够避免患者再次取材或被迫接受有创性操作,提高标本的利用率,节省了时间及费用。本组实验结果显示与组织学标本相比,液基细胞学标本是一个很好的肿瘤细胞突变检测来源。各种类型的液基细胞学样本间EGFR基因突变率差异无显著性,均可用于ARMS法检测肺癌EGFR基因突变。特别是痰液标本也能够用于肺癌EGFR基因突变检测。在ARMS法检测肺癌EGFR基因突变时,肿瘤细胞含量丰富的标本,EGFR基因突变率高于肿瘤细胞量较少的标本。因而在将细胞学标本送检EGFR基因检测之前,需对标本中肿瘤细胞含量进行评估,这样才能保证检测的真实、准确,避免出现假阴性。同时,本实验通过液基细胞学样本进行肺癌EGFR基因检测还发现临床分期Ⅲb~Ⅳ期的肺癌患者中,EGFR基因突变率高于临床分期I~Ⅲa期的患者。当然这一结论尚需进一步深入分析。
[1] Tabatabai Z L, Auger M, Kurtycz D F,etal. Do liquid-based preparations of pulmonary bronchial brushing specimens perform differently from classically prepared cases for the diagnosis of malignancies? Observations from the college of American pathologists interlaboratory comparison program in nongynecologic cytology[J]. Arch Pathol Lab Med, 2015,139(2):178-183.
[2] Rossi E D, Martini M, Straccia P,etal. The potential of liquid-based cytology in lymph node cytological evaluation: the role of morphology and the aid of ancillary techniques[J]. Cytopathology, 2014,27(1):50-58.
[3] 王晓敏, 李 军, 袁 勇, 等. 荧光原位杂交技术检测非小细胞肺癌EGFR基因扩增[J]. 临床与实验病理学杂志, 2011,27(11):1218-1220.
[4] 魏摇冰, 马摇杰, 马智勇, 等. 肺腺癌患者恶性胸腔积液中EGFR突变状况分析[J]. 临床与实验病理学杂志, 2012,28(3):323-325.
[5] Li D R, Wan T, Su Y,etal. Liquid-based cytological test of samples obtained by catheter aspiration is applicable for the bronchoscopic confirmation of pulmonary malignant tumors[J]. Int J Clin Exp Pathol, 2014,7(5):2508-2517.
[6] Jung C Y. Biopsy and mutation detection strategies in non-small cell lung cancer[J]. Tuberc Respir Dis (Seoul), 2013,75(5):181-187.
[7] Bellevicine C, Malapelle U, Vigliar E,etal. Epidermal growth factor receptor test performed on liquid-based cytology lung samples: experience of an academic referral center[J]. Acta Cytol, 2014,58(6):589-594.
[8] Billah S, Stewart J, Staerkel G,etal. EGFR and KRAS mutations in lung carcinoma: molecular testing by using cytology specimens[J]. Cancer Cytopathol, 2011,119(2):111-117.
[9] Garcia-Olive I, Sanz-Santos J, Andreo F,etal. Application of real time endobronchial ultrasound-guided transbronchial needle aspiration for lung cancer staging[J]. Zhongguo Fei Ai Za Zhi, 2010,13(5):406-409.
[10] Hubers A J, Heideman D A, Yatabe Y,etal. EGFR mutation analysis in sputum of lung cancer patients: amultitechnique study[J]. Lung Cancer, 2013,82(1):38-43.
[11] Gao B, Sun Y, Zhang J,etal. Spectrum of LKB1, EGFR, and KRAS mutations in chinese lung adenocarcinomas[J]. J Thorac Oncol, 2010,5(8):1130-1135.
[12] Choi Y L, Sun J M, Cho J,etal. EGFR mutation testing in patients with advanced non-small cell lung cancer: a comprehensive evaluation of real-world practice in an east asian tertiary hospital[J]. PLoS One, 2013,8(2):269-284.
[13] Smouse J H, Cibas E S, Jänne P A,etal. EGFR mutations are detected comparably in cytologic and surgicalpathology specimens of nonsmall cell lung cancer[J]. Cancer, 2009,17(1):67-72.
EGFR mutations detection in non-small cell lung cancerliquid based cytology samples by ARMS method
WAN Tao1, YU Xue-mei2, HU Qian-fang1, XU Li1, LIU Jin-hua1, LI Dai-rong1
(1DepartmentofRespiratoryDiseases,theFirstAffiliatedHospital,ChongqingMedicalUniversity,Chongqing400016,China;2DepartmentofClinicalLaboratory,University-TownHospitalofChongqingMedicalUniversity,Chongqing401331,China)
Purpose To explore the application and char-acteristics of liquid-based cytology samples of non-small cell lungcancer for detection of EGFR mutations by ARMS method. Methods The positive samples of liquid-based cytology were collected and the DNA of samples was extracted to detect the EGFR mutations by ARMS method and the analyze the association with clinical features, types of samples, pathological types and the contents of tumor cells, etc. Results There were 117 genetic mutations detected in 279 liquid-based cytology specimens, with the mutation rate of 41.9%. The mutation rate of adencarcinoma was 44.7% and the other was 11.3%. When the tumor cells in cytology samples were abundant, medium, small clusters and few, EGFR gene mutation rate were 53%, 44%, 45% and 44% respectively. 19Del was 51.9%. Exon 21 L858R missense mutation occurred at 39.4% of EGFR mutations. Conclusion All liquid-based cytology of non-small cell lung cancer samples are adequate for EGFR mutation analysis. In the tumor cell-rich samples EGFR gene mutation rate is higher than that of the less tumor cells samples. 19Del is the most common type of EGFR mutations.
lung neoplasms; non-small cell lung cancer; liquid based cytology; epidermal growth factor receptor gene mutation; amplification refractory mutation system
重庆市科委资助项目(cstc2016shmszx130029)
1重庆医科大学附属第一医院呼吸内科,重庆 4000162重庆医科大学附属大学城医院检验科,重庆 401331
万 涛,男,硕士,主管技师。E-mail: wantao715@sina.com 李岱容,女,博士,副主任技师,通讯作者。Tel: (023)89012745,E-mail: lidairong@126.com
时间:2017-8-20 15:27 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170820.1527.012.html
R 734.2
A
1001-7399(2017)08-0884-07
10.13315/j.cnki.cjcep.2017.08.012
接受日期:2017-04-07

