miR-185靶向Six1对肺癌上皮-间质转化过程的影响及其机制
曹燕飞,任 睿,杨 晔,罗向晖,王水利
miR-185靶向Six1对肺癌上皮-间质转化过程的影响及其机制
曹燕飞1,任 睿2,杨 晔1,罗向晖1,王水利3
目的 探讨miR-185影响人肺癌细胞迁移和侵袭能力的分子机制。方法 在肺癌细胞系H520和A549中转染miR-185 mimic获得miR-185过表达,利用Transwell实验和细胞划痕实验检测细胞的迁移和侵袭能力;荧光素酶报告实验验证miR-185靶向Six1基因;采用qRT-PCR和Western blot法检测miR-185对细胞中Six1基因表达水平的影响;Western blot法检测miR-185过表达对肺癌细胞上皮-间质转化(epithelial-mesenchymal transition, EMT)过程的影响。结果 miR-185过表达降低肺癌细胞的迁移和侵袭能力(P<0.05),上皮细胞标志物E-cadherin表达升高(P<0.01),间质细胞标志物vimentin表达降低(P<0.01),H520细胞过表达miR-185后,Six1基因表达水平降低(P<0.01),miR-185调控肺癌细胞的迁移和侵袭是通过靶向Six1基因实现的。结论 miR-185靶向Six1基因调控人肺癌细胞EMT途径。
肺肿瘤;迁移;侵袭;miR-185;Six1
肺癌是最常见的恶性肿瘤之一,由于肺癌发病隐匿、复发率高、侵袭性强等,给临床治疗带来极大困难[1]。miR-185是一个长度为22个核苷酸的非编码小分子RNA,定位于人染色体22q11.21,在肿瘤的发生、发展过程中扮演着非常重要的角色,研究表明miR-185在人肺癌细胞中呈低表达[2],在非小细胞肺癌中miR-185诱导细胞周期在G1期阻滞,抑制细胞增殖[3-4]。有研究证明,在肿瘤中Six1是miR-185的靶基因之一[5]。Six1在早期肺腺癌中表达上升[6],但目前Six1基因在肺癌中的作用机制还有待研究。上皮-间质转化(epithelial-mesenchymal transition, EMT)在肿瘤的发生与迁移过程中起着十分重要的作用,而E-cadherin和vimentin是EMT过程中的关键因子,在EMT中,常伴有E-cadherin的功能缺失[7]。研究发现,Six1的过表达能够引起EMT[8]。本文旨在探讨miR-185对肺癌细胞的迁移、侵袭的影响及其分子机制是否与Six1基因相关以及对肺癌细胞EMT过程的影响。
1 材料与方法
1.1 细胞和主要试剂 人肺癌细胞系H520、A549购自ATCC公司,RPMI 1640及胎牛血清购自Hyclone公司;RNA抽提和纯化试剂盒购自德国Qiagen公司;qRT-PCR试剂盒及所有引物均购自美国ABI公司,miR-185模拟物(miR-185 mimic)及其对照(miR-185 NC)购自美国AB公司。Lipofetamine 2000转染试剂购自美国Invitrogen公司,荧光素酶报告载体pmirGLO vector购自湖南科爱医疗公司;转染用无血清Opti-MEMI购自Sigma公司;Six1 siRNA由上海英俊生物公司合成,Six1抗体购自Abcam公司,E-cadherin和vimentin购自上海安妍生物公司。Transwell小室(8 μm孔径聚碳酸酯膜)和Matrigel购自美国Corning Costar公司。
1.2 细胞培养和转染 细胞培养于含10%胎牛血清的RPMI 1640培养基中,置于37 ℃ 5%CO2的饱和湿度细胞培养孵箱中传代培养。每2~3天消化传代。转染前1天将细胞按需接种于细胞培养板,次日按Lipofectamine 2000转染试剂说明书进行质粒转染,转染时细胞达70%~90%的板底面积。按照转染试剂盒使用说明转染阴性对照组(si-Con,转染无效序列5′-TTCTCCGAACGTGTCACGT-3′)、实验组(si-Six1,转染有效序列5′-AGTTTGAGCTAATGGCGTG-3′)。实验分组:(1)正常对照为normal组;(2)转染miR-185 mimic为miR-185组;(3)转染miR-185 NC为NC组。
1.3 Transwell实验检测细胞的侵袭性 细胞侵袭实验在Transwell小室中进行,在聚碳酸酯膜上室面铺Matrigel胶,整个操作在冰上和无菌条件下进行,37 ℃固化1 h备用。实验分为3组:normal组、miR-185组和NC组,每组重复3次,48 h后用含1%血清的DMEM培养基洗涤细胞,调整细胞浓度,在上室接种5×104/100 μL,下室加入含10%血清的完全培养基作为趋化剂。37 ℃、5%CO2条件下培养24 h后,擦掉上室细胞,用4%多聚甲醛固定30 min,0.1%结晶紫染色20 min,PBS洗3次,然后在显微镜下计数5个不重复视野的穿膜细胞数。
1.4 划痕实验 将处于对数生长期的细胞以0.25%胰酶消化处理,离心弃上清,以完全培养基重悬细胞沉淀,吹匀后计数细胞并调整至所需细胞的浓度,接种单细胞悬液于6孔板中,待24 h细胞密度达90%时,换正常培养基为无血清的基础培养基,待细胞贴壁率达100%时,用无菌枪头在每个孔中长满的单层细胞上迅速而轻轻地划1~2道痕,1×PBS冲洗去掉脱落的细胞,换无血清的培养基继续培养24 h,并在5 h及24 h后拍照观察,利用显微镜自带的测量工具测量同一位点上5、24 h划痕的宽度,计算迁移距离,细胞迁移距离=1/2(5 h划痕宽度-24 h划痕宽度)。
1.5 qRT-PCR 将细胞接种于6孔板,实验分为3组:normal组、miR-185组和NC组,重复3次,转染48 h时用Trizol法提取总RNA,检测浓度及纯度,并用琼脂糖凝胶电泳鉴定RNA的完整性,然后以总RNA为模板,miRNA第一链cDNA合成试剂盒进行第一链cDNA的合成,以cDNA为模板进行实时荧光定量PCR检测,以U6为阳性对照基因校正PCR模板的拷贝数,基因相对表达量采用2-ΔΔCt值计算。引物序列:miR-185反转录引物5′-GTCGTATC CAGTGCAGGGTCCGAGGTATTCGCACTGGATACGAC TCAGGA-3′;miR-185 PCR下游引物5′-TGGAGAGA AAGGCAGTTCCTGA-3′;内参U6上游引物5′-CTC GCTTCGGCAGCACA-3′,下游引物5′-AACGCTTC ACGAATITGCGT-3′;Sixl上游引物5′-CAGTTCT CGCCTCACAAC-3′,下游引物5′-TTCTCCTTGAAGC AGTAGC-3′;GAPDH上游引物5′-TATGACAACA GCCTCAAGAT-3′,下游引物5′-AGTCCTYCCACGA TACCA-3′。
1.6 Western blot法检测蛋白表达 用预冷的RIPA细胞裂解液裂解细胞,经超声机粉碎后离心取上清。提取的细胞蛋白经SDS-PAGE电泳后转移到硝酸纤维素膜上,5%脱脂奶粉封闭,加入Six1、E-cadherin及vimentin抗体,内参为抗GAPDH抗体,4 ℃孵育过夜,洗膜后加入HRP标记的二抗进行杂交,孵育1 h,ECL试剂显色,采用成像仪拍照,以目的条带与内参GAPDH的A值比值表示蛋白的相对表达水平。1.7 荧光素酶检测 将含有miR-185结合位点的Six1 3′-UTR的cDNA片段插入到pmirGLO载体,通过点突变方法,构建结合位点突变的Six1 3′-UTR的cDNA片段,插入pmirGLO载体,并经测序验证插入序列正确。采用脂质体转染方法,将pmirGLO-Six1或pmirGLO-mut Six1重组载体与miR-185 mimic或miR-185 NC共转染入H520细胞,转染48 h后,收集并裂解细胞,按双荧光素酶报告基因检测系统说明书操作,以萤火虫荧光素酶活性与海肾荧光素酶活性的比值表示各组细胞的荧光强度。
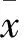
2 结果
2.1 过表达miR-185对H520、A549细胞迁移和侵袭的影响 qRT-PCR结果显示,转染miR-185 mimic后H520细胞miR-185表达水平较normal组和NC组明显增加,差异有统计学意义(P<0.05)。表明H520细胞转染miR-185 mimic后miR-185过表达效果显著(图1A);A549细胞转染miR-185 mimic后,与normal组和NC组相比,miR-185表达水平明显增加,差异有统计学意义(P<0.05,图1B)。Transwell结果显示,48 h后过表达miR-185的H520细胞中迁移到下室的细胞数目为121±2,normal组为432±4,NC组为416±5,miR-185组细胞的侵袭能力明显低于normal组(P<0.05,图1C);A549细胞转染48 h后,miR-185组迁移到下室的细胞数目为241±5,normal组为384±3,NC组为361±5,miR-185过表达后,细胞的侵袭能力明显降低(P<0.05,图1D)。划痕实验显示,5 h时H520和A549细胞均无细胞越过“划痕”,而24 h后miR-185组H520细胞迁移距离为(142.32±2.45) μm,A549细胞迁移距离为(167.24±5.37) μm;normal组H520细胞迁移距离为(237.03±4.24) μm,A549细胞迁移距离为(285.97±8.13) μm;NC组H520细胞迁移距离为(224.06±3.62) μm,A549细胞迁移距离为(276.54±6.23) μm,提示在两种肺癌细胞系中,中,miR-185组细胞迁移能力与normal组相比差异有统计学意义(P<0.05)。
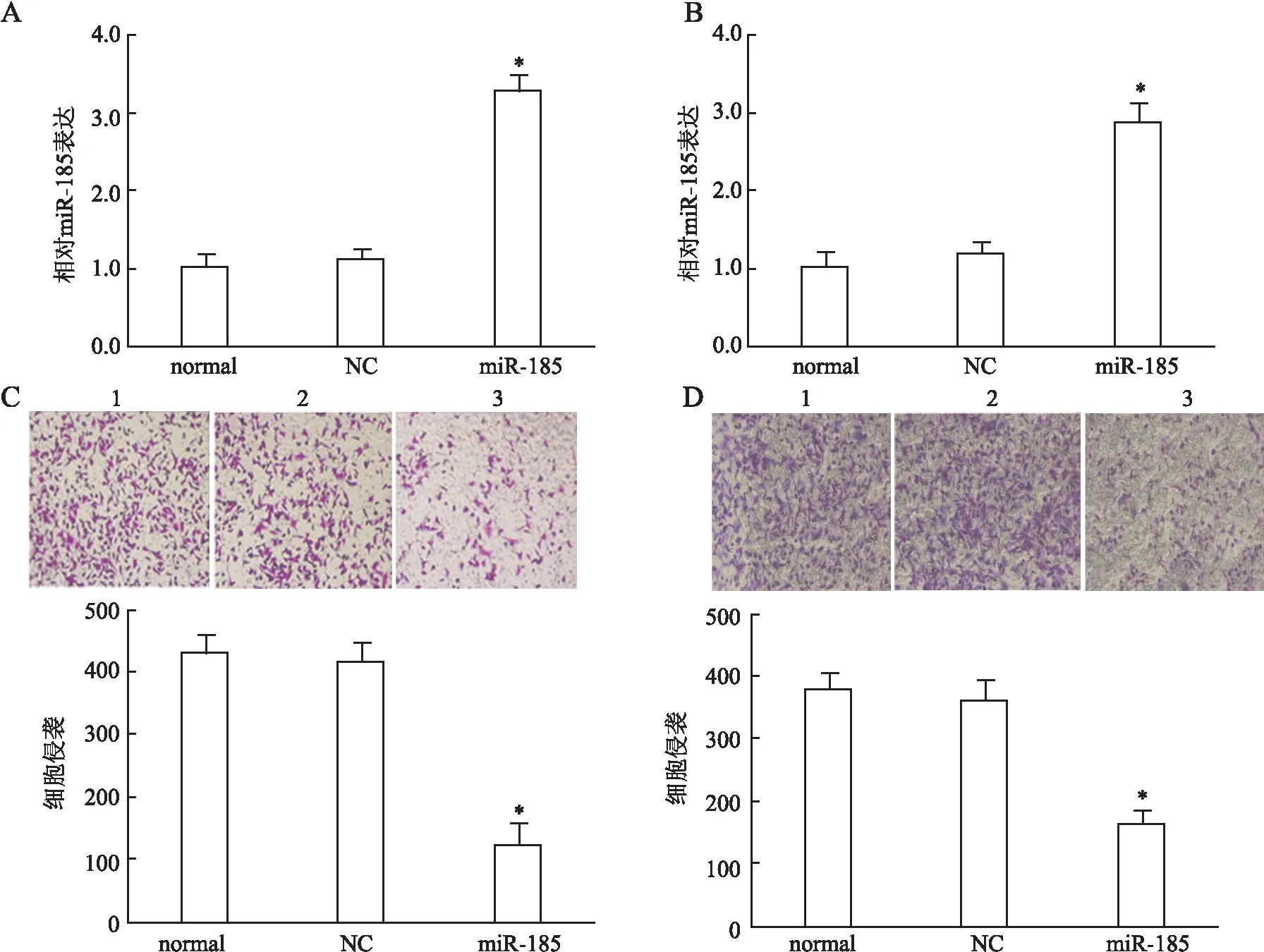
图1 A.H520细胞中miR-185过表达;B.A549细胞中miR-185过表达;C.miR-185过表达对H520细胞侵袭的影响;D.miR-185过表达对A549细胞侵袭的影响;与normal组相比,*P<0.05;1. normal组;2. NC组;3. miR-185组
2.2 miR-185调控肺癌细胞EMT过程 Western blot结果显示miR-185表达上调后,肺癌H520细胞中E-cadherin表达量明显增高(P<0.01),而vimentin表达量减低(P<0.01,图2)。提示细胞miR-185过表达后,H520细胞发生了EMT转换。该结果表明miR-185可通过诱导EMT改变促进肺癌细胞的侵袭、转移。
2.3 过表达miR-185对Six1表达水平的影响 荧光素酶报告基因结果显示,在H520细胞中,转染miR-185 mimic抑制荧光素酶的活性,与NC组相比,差异有统计学意义(P<0.05)。将Six1 3′UTR点突变后,则miR-185过表达对荧光素酶的活性无明显影响(图3A)。qRT-PCR结果显示,miR-185组细胞Six1 mRNA较normal组和NC组均明显降低,差异有统计学意义(P<0.01,图3B)。Western blot检测结果显示,在H520细胞中,miR-185组细胞Six1蛋白表达水平较normal组和NC组也均明显降低,差异有统计学意义(P<0.01,图3C)。
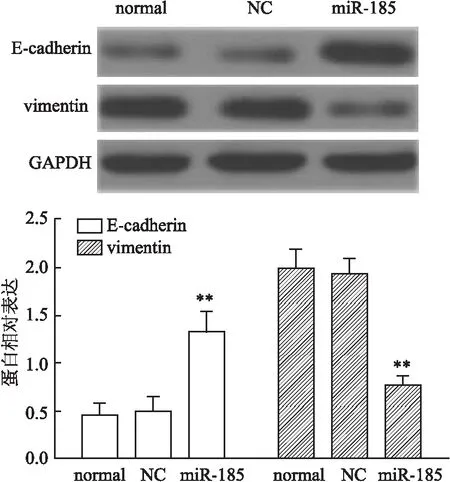
图2 miR-185调控肺癌细胞EMT过程 与normal组相比,**P<0.01
2.4 miR-185靶向Six1调节肺癌细胞的迁移、侵袭和EMT途径 为进一步分析miR-185影响肺癌细胞的侵袭、迁移能力的分子机制,本实验采用转染Six1 siRNA来检验normal组和miR-185组细胞的侵袭和迁移变化及EMT过程相关蛋白的变化。结果显示:抑制Six1基因,肺癌细胞的迁移和侵袭率明显降低(图4A、B)。说明miR-185影响肺癌细胞迁移和侵袭是通过靶向Six1基因实现的。同时,Western blot检测了低表达Six1对EMT过程标记蛋白表达的影响,发现抑制Six1,miR-185过表达造成的E-cadherin表达增加情况减弱,miR-185过表达造成的vimentin表达降低的情况同样减弱(图4C)。
图3 A.miR-185靶向Six1;B.过表达miR-185对Six1 mRNA表达 水平的影响;C.过表达miR-185对Six1蛋白表达水平的影响
与NC组相比,*P<0.05;与normal组相比,**P<0.01
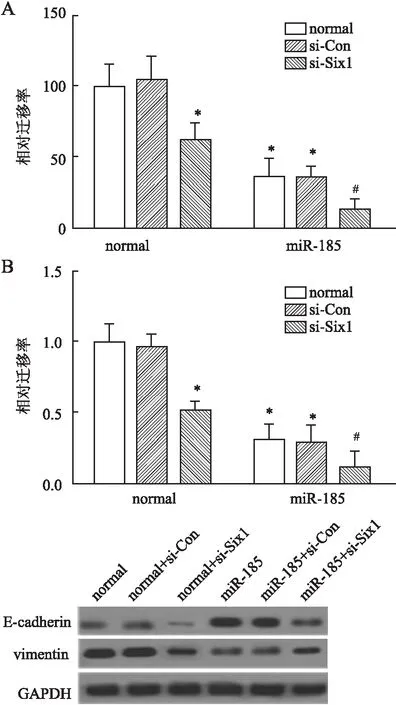
图4 A.抑制Six1对细胞迁移的影响;B.抑制Six1对细胞侵袭的 影响;C.抑制Six1对EMT过程中标记蛋白表达的影响
与normal组相比,*P<0.05;与miR-185组相比,#P<0.05
3 讨论
肺癌患者就诊时多伴有远端转移,80%~90%的肺癌患者死亡是由转移引起的。而转移很大程度上影响了肺癌患者的治疗、生存质量及预后。因此,肺癌的转移是医学的重大难题。阐明肺癌转移发生的分子机制进而采取靶向干预措施控制转移,有望进一步改善肺癌患者预后。研究发现miR-185在肺癌中的表达降低,本组实验进一步阐明了miR-185能通过影响肺癌细胞EMT过程变化,从而影响肺癌的侵袭、转移。
目前对miR-185的功能及其机制研究发现,miR-185在肿瘤的发生、发展中扮演着非常重要的角色,其对于肿瘤细胞的生长、侵袭迁移和耐药性等多种生物学行为具有非常重要的作用[9]。Liu等[4]对人结肠癌细胞SW1116、LoVo研究发现miR-185能下调RhoA/Cdc42表达,抑制细胞周期G1/S期的转变、诱导细胞凋亡和抑制细胞侵袭。本组实验在查阅大量相关文献的基础上,通过过表达miR-185,发现其在肺癌的侵袭和转移中通过靶向调节Six1基因发挥调控作用,因此上调miR-185可能是潜在的肺癌分子治疗策略。
EMT为上皮细胞发生向间质细胞的形态及基因表达改变,其常伴有上皮细胞标志物E-cadherin等表达下调,而间质细胞标志物vimentin等表达升高。目前,肿瘤细胞EMT改变与其侵袭转移、干性维持、耐药及放疗抵抗关系密切[10]。一直以来,EMT被认为是导致肿瘤侵袭、转移的重要原因之一。本组实验发现miR-185上调后,肺癌细胞的体外迁移及侵袭能力降低的同时,发生了EMT改变。从而初步表明miR-185经EMT调控肺癌的侵袭、转移。
本实验证实了在肺癌中miR-185影响细胞迁移和侵袭时通过靶向Six1实现的。总之,本实验通过体外实验证实miR-185能对肺癌细胞的迁移和侵袭能力发挥调控作用。同时初步表明该调控作用的产生与其诱导的肺癌细胞EMT过程密切相关。研究结果有助于实现将Six1作为今后肺癌癌治疗的潜在干预靶点。
[1] Shim H S, Lee D H, Park E J,etal. Histopathologic characteristics of lung adenocarcinomas with epidermal growth factor receptor mutations in the international association for the study of lung cancer/American Thoracic Society/European Respiratory Society lung adenocarcinoma classification[J]. Arch Pathol Lab Med, 2011,135(10):1329-1334.
[2] Corvalan A H, Patnaik S K, Yendamuri S,etal. MicroRNA expression profiles of whole blood in lung adenocarcinoma[J]. PLoS One, 2012,7(9):e46045.
[3] Takahashi Y, Forrest A R, Maeno E,etal. MiR-107 and miR-185 can induce cell cycle arrest in human non small cell lung cancer cell lines[J]. PLoS One, 2009,4(8):e6677.
[4] Liu M, Lang N, Chen X,etal. miR-185 targets RhoA and Cdc42 expression and inhibits the proliferation potential of human colorectal cells[J]. Cancer Lett, 2011,301(2):151-160.
[5] Imam J S, Buddavarapu K, Lee-Chang J S,etal. MicroRNA-185 suppresses tumor growth and progression by targeting the Six1 oncogene in human cancers[J]. Oncogene, 2010,29(35):4971-4979.
[6] Mimae T, Okada M, Hagiyama M,etal. Upregulation of notch2 and six1 is associated with progression of early-stage lung adenocarcinoma and a more aggressive phenotype at advanced stages[J]. Clin Cancer Res, 2012,18(4):945-955.
[7] Yu J M, Sun W, Hua F,etal. BCL6 induces EMT by promoting the ZEB1-mediated transcription repression of E-cadherin in breast cancer cells[J]. Cancer Lett, 2015,365(2):190-200.
[8] Radisky D C. Defining a role for the homeoprotein Six1 in EMT and mammary tumorigenesis[J]. J Clin Invest, 2009,119(9):2528-2531.
[9] Tang H, Wang Z, Liu X,etal. LRRC4 inhibits glioma cell growth and invasion through a miR-185-dependent pathway[J]. Curr Cancer Drug Targets, 2012,12(8):1032-1042.
[10] Gonzalez D M, Medici D. Signaling mechanisms of the epithelial-mesenchymal transition[J]. Sci Signal, 2014,7(344):re8.
Effect of miR-185 targeting Six1 on epithelial-mesenchymaltransition in lung cancer and its mechanism
CAO Yan-fei1, REN Rui2, YANG Ye1, LUO Xiang-hui1, WANG Shui-li3
(1DepartmentofThoracicSurgery,3DepartmentofRespiratory,ShanxiProvincialPeople’sHospital,Xi’an710068,China;2DepartmentofObstetricsandGynecology,Xin’anCentralHospitalofShanxiProvince,Xi’an710048,China)
Purpose To study the molecular mechanism of miR-185 affecting the migration and invasion of human lung cancer cell. Methods MiR-185 overexpression was obtained by transfection of miR-185 mimic in lung squamous cell carcinoma cell line H520 and A549, transwell assay and cell scratch assay were used to detection of cell migration and invasion. The luciferase reporter assay confirmed that miR-185 targets the Six1 gene. qRT-PCR and Western blot were used to detect the impact of miR-185 cells Six1 gene expression. Western blot was used to detect the effect of miR-185 overexpression on the epithelial-mesenchymal transition of lung cancer cells. Results miR-185 overexpression reduced migration and invasion of lung cancer cells (P<0.05), increased epithelial cell marker E-cadherin expression (P<0.01), and decreased the expression of mesenchymal cell markers vimentin of (P<0.01). After overexpression of miR-185 in H520 cells, the expression level of Six1gene was reduced (P<0.01). MiR-185 regulated the migration and invasion of lung cancer cells by targeting the Six1 gene. Conclusion MiR-185 targets the Six1 gene to regulate the EMT pathway of human lung cancer cells.
lung neoplasms; migration; invasion; miR-185; Six1
陕西省自然科学基础研究计划项目(2014JM2-8166)
1陕西省人民医院胸外科、3呼吸内科,西安 7100682陕西省新安中心医院妇产科,西安 710048
曹燕飞,男,硕士,主治医师。E-mail: cyf.521@qq.com 任 睿,女,硕士,主治医师,通讯作者。Tel: (029)82229222,E-mail: 80921@126.com
时间:2017-8-20 15:27 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170820.1527.011.html
R 734.2
A
1001-7399(2017)08-0879-05
10.13315/j.cnki.cjcep.2017.08.011
接受日期:2017-04-25

