小细胞肺癌干细胞和肿瘤组织中HIF-1α和HIF-2α的表达及意义
栾雅静,郑 旭,仇晓菲
小细胞肺癌干细胞和肿瘤组织中HIF-1α和HIF-2α的表达及意义
栾雅静,郑 旭,仇晓菲
目的 观察小细胞肺癌干细胞和肿瘤组织中HIF-1α和HIF-2α的表达,并探讨其临床意义。方法 采用干细胞无血清培养技术富集小细胞肺癌细胞系H446第3代肿瘤球细胞作为肿瘤干细胞;实时荧光定量PCR法检测H446干细胞中HIF-1α和HIF-2α mRNA的表达;免疫荧光法检测H446干细胞中HIF-1α和HIF-2α蛋白表达;免疫组化SP法检测小细胞肺癌组织中HIF-1α和HIF-2α蛋白表达。结果 小细胞肺癌干细胞HIF-2α mRNA表达上调(P<0.05),而HIF-1α mRNA表达下调(P<0.05);小细胞肺癌干细胞中HIF-2α蛋白呈阳性,而HIF-1α蛋白呈阴性;小细胞肺癌组织中HIF-1α的阳性率为46.7%(28/60),HIF-2α阳性率为25%(15/60)。相关分析结果显示HIF-2α与小细胞肺癌干细胞标志物uPAR呈正相关且两者共同表达于小细胞肺癌坏死组织周围区域;HIF-2α与小细胞肺癌肿瘤直径和远处转移有关(P<0.05),而HIF-1α与患者年龄、性别、肿瘤直径、淋巴结转移、胸膜侵袭和远处转移无关(P>0.05)。结论 HIF-2α在小细胞肺癌干细胞中表达上调且与小细胞肺癌干细胞标志物uPAR呈正相关,与小细胞肺癌肿瘤直径和远处转移相关,提示HIF-2α表达可能与小细胞肺癌干细胞样特征有关。关键词:肺肿瘤;小细胞肺癌;肿瘤干细;HIF-1α;HIF-2α
小细胞肺癌又称小细胞未分化癌,是肺癌中恶性程度最高的类型,占全部肺癌的10%~20%。具有恶性度高、进展快、全身播散和预后差等特点。
恶性肿瘤在生长过程中,由于肿瘤细胞过度增殖需要高度消耗能量,从而引起局部组织供氧与耗氧失衡,形成肿瘤组织缺氧微环境。缺氧与肿瘤患者放、化疗抵抗,增加转移潜能和不良预后有关[1-3]。缺氧诱导因子HIF-1α和HIF-2α在这些转录反应中起着关键作用[4]。虽然HIF-1α和HIF-2α高度同源,由于它们独特的靶基因及不同的需氧条件,经常起着非冗余的生物学角色[5]。研究显示,在缺氧状态下,HIF-2α及其特异性调控的靶基因(OCT-4、SerpinB9)在神经胶质瘤干细胞的表达显著高于非肿瘤干细胞。有趣的是,数据表明HIF-2α优先在肿瘤干细胞中表达,参与干细胞的调节[6-8]。然而,缺氧诱导因子HIF-1α和HIF-2α在小细胞肺癌干细胞的表达及其与小细胞肺癌的临床意义鲜有研究。
1 材料与方法
1.1 材料 人小细胞肺癌细胞系H446购自美国典型培养物保藏中心(ATCC,美国);RPMI 1640培养基、L-谷氨酰胺、Trizol和SYBR Green(Real Master Mix)试剂盒购自天津润泰科技公司;胎牛血清购自HyClone公司;表皮生长因子和碱性成纤维生长因子购自PeproTech公司;SuperScript Ⅱ反转录酶购自Invitrogen公司;牛血清白蛋白购自天津津脉基因测绘公司;反转录引物和上、下游引物由天津赛尔生物公司合成。
1.2 方法
1.2.1 肿瘤细胞球培养 体外无血清培养肿瘤细胞球参考Dontu等[9]的标准。H446细胞贴壁生长达90%融合后,用0.25%胰酶消化成单细胞,再将H446单细胞悬液以105/mL的密度置于含有无血清培养基的超低吸附培养板中进行培养,获得悬浮肿瘤细胞球。无血清培养基由DMEM/F12、B27(1 ∶50),20 ng/mL EGF、bFGF、2 mmol/L L-谷氨酰胺、0.4%BSA、5 μg/mL胰岛素、1%KO-血清替代物和0.8%甲基纤维素。待肿瘤球生长到一定体积后,通过自由沉淀或者低速离心法收集培养板内肿瘤球,然后经0.125%胰酶消化,吸管反复吹打至成单细胞悬液后进行传代。以下实验均使用第3代肿瘤细胞球。
1.2.2 实时荧光定量PCR Trizol法提取细胞总RNA,经逆转录合成cDNA。按SYBR Green (Real Master Mix)试剂盒说明书分别检测HIF-1α、HIF-2α、OCT-4、SOX2、NANOG和c-MYC的mRNA表达量。HIF-1α引物序列:5′-GAAACCACCTATGACCTGC-3′、5′-CTGTTTGTTGAAGGGAGAA-3′,目的片段长度434 bp;HIF-2α引物序列:5′-TGAAAACGAGT CCGAAGCC-3′、5′-GTGGCTGACTTGAGGTTGA-3′,目的片段长度342 bp;OCT-4引物序列:5′-GCTC GAGAAGGATGTGGTCC-3′、5′-CGTTGTGCATAGTCG CTGCT-3,目的片段长度81 bp;SOX2引物序列:5′-CACTGCCCCTCTCACACATG-3′、5′-TCCCATTTCCCT CGTTTTTCT-3′,目的片段长度82 bp;NANOG引物序列:5′-ACCTGGAGCAACCAGACCCAGA-3′、5′-GC TTCCAAGGCAGCCTCCAAGT-3′,目的片段长度194 bp;c-myc引物序列:5′-AAAGACAGCGGCAGCC CGAA-3′,5′-TCTTGCGAGGCGCAGGACTT-3′,目的片段长度167 bp;相对定量用2-ΔΔCt表示,ΔΔCt=(Ct1-Ct2)-(Ct3-Ct4)。Ct1:干细胞基因临界循环数、Ct2:干细胞管家基因临界循环数、Ct3:亲本细胞基因临界循环数、Ct4:亲本细胞管家基因临界循环数。
1.2.3 免疫荧光 免疫荧光染色方法参考文献[10]。通透化处理:将滴片取出,室温恢复10 min,PBS洗涤细胞3次,0.1%Triton-X100室温孵育15 min;封闭:将滴片浸入含有5%FBS的PBS溶液中,37 ℃ 30 min;滴加一抗,4 ℃过夜;滴加FITC标记二抗,37 ℃ 1 h,PBS洗5 min×3次,此步之后需注意避光操作;染核:DAPI染核,37 ℃ 5 min,95%乙醇洗1遍,PBS洗3遍;将淬灭剂滴1滴至载玻片,盖玻片盖其上,激光共聚焦显微镜下观察。实验重复2次,每次至少数100个细胞,记录阳性细胞,计算阳性率=阳性细胞数/100,结果用3次独立实验的平均值表示。
1.2.4 免疫组化 免疫组化染色采用EnVision两步法。石蜡切片常规脱蜡至水;自来水冲洗5 min,蒸馏水冲洗3次;枸橼酸缓冲液(0.01 mol/L pH 6.0),微波95~98 ℃,维持15 min后室温自然冷却,自来水冲洗5 min,蒸馏水冲洗3次,PBS洗3×5 min;正常山羊血清封闭,室温30 min;滴加一抗,室温放置30 min,湿盒内4 ℃冰箱过夜;次日晨取湿盒,放置室温50 min,PBS洗5 min×3,滴加EnVision二抗,室温孵育30 min,PBS洗5 min×3次,平放于湿盒中;DAB显色;苏木精复染胞核;常规脱水、透明;中性树胶封固。
1.2.5 免疫组化结果判定 采用半定量积分法,即根据每张切片的阳性细胞比例及着色程度评分。(1)按阳性细胞比例评分:阳性细胞数<10%为1分,10%~30%为2分,30%以上为3分;(2)按着色程度评分:未着色为0分,浅棕色为1分,棕色为2分,深棕色为3分。将两项得分结果相乘:0分为(-);1~2分为(+);3~4分为();4分以上为()。1.3 统计学分析 应用SPSS 19.0软件进行统计学分析,采用Spearman秩相关方法分析HIF-1α/HIF-2α表达与uPAR的相关性,两组定量数据的比较采用t检验,两组定性数据采用χ2检验或确切概率法进行数据处理,以P<0.05为差异有统计学意义。
2 结果
2.1 小细胞肺癌干细胞中HIF-1α和HIF-2α mRNA的表达 本课题组前期工作证明小细胞肺癌细胞系H446第3代肿瘤球细胞富集肿瘤干细胞,本组以第3代肿瘤球细胞作为肿瘤干细胞,以贴壁H446细胞作为对照组代表非干细胞。实时荧光定量PCR结果显示:与亲代细胞相比,小细胞肺癌干细胞HIF-2α mRNA的表达水平上调,差异有统计学意义(P<0.05)。但HIF-1α mRNA表达水平反而下调(图1A),HIF-1α和HIF-2α mRNA表达水平呈互补特征。
2.2 小细胞肺癌干细胞中干细胞相关基因mRNA的表达 进一步检测HIF-2α下游靶基因OCT-4及其可能调控的干细胞基因在小细胞肺癌干细胞中的表达,包括c-myc、SOX2和NONOG。实时荧光定量PCR结果显示:与非干细胞相比,小细胞肺癌干细胞中HIF-2α的靶基因OCT-4 mRNA表达水平显著上调,差异有统计学意义(P<0.05,图1B),但其它干细胞基因SOX2、c-myc和NONOG mRNA表达差异无统计学意义(P>0.05)。
2.3 小细胞肺癌干细胞中HIF-1α和HIF-2α蛋白的表达 免疫荧光染色结果显示:HIF-2α在小细胞肺癌干细胞中呈阳性,但在非干细胞中呈阴性(图2);与之相反,HIF-1α在小细胞肺癌干细胞中呈阴性,在非干细胞中呈阳性(图2),HIF-1α和HIF-2α蛋白表达也呈互补特征,即在小细胞肺癌干细胞中HIF-2α表达上调,而HIF-1α表达下调,与实时荧光定量PCR结果一致;OCT-4在小细胞肺癌干细胞中呈阳性(图2)。
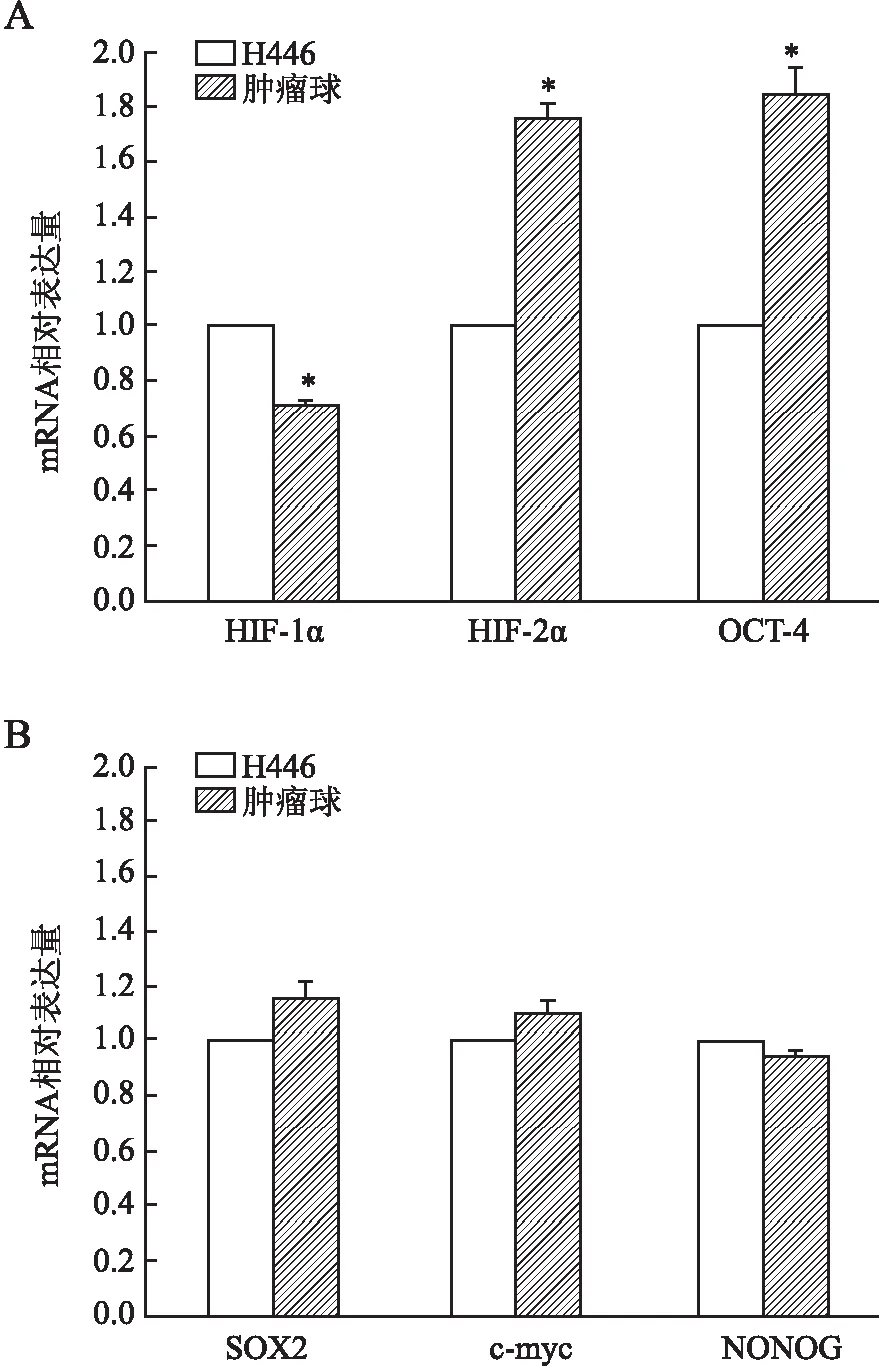
图1 A.小细胞肺癌干细胞HIF-1α、HIF-2α和OCT-4 mRNA的表达;B.干细胞相关基因SOX2、c-myc和NONOG mRNA的表达;*P<0.05
2.4 小细胞肺癌组织中HIF-1α和HIF-2α的表达 小细胞肺癌组织中HIF-1α的阳性率为46.7%(28/60),其中(+)10例,()12例,()6例。癌旁正常组织未见HIF-1α的表达。HIF-1α阳性呈棕黄色,主要定位于肿瘤细胞核内(图3),HIF-1α阳性肿瘤细胞在癌巢呈弥散性分布;HIF-2α的阳性率为25%(15/60),其中(+)7例,()6例,()2例。癌旁正常组织中未见HIF-2α的表达。HIF-2α阳性呈棕黄色,主要定位于肿瘤细胞核。HIF-2α阳性肿瘤细胞主要分布于小细胞肺癌坏死组织周围区域(图4A)。
2.5 HIF-2α表达与小细胞肺癌干细胞标志物uPAR的相关性 本组前期工作证明uPAR为小细胞肺癌干细胞标志物,且在肿瘤干细胞中高表达。而本组实验结果显示HIF-2α在小细胞肺癌干细胞亦高表达。进一步探讨HIF-1α/HIF-2α表达与小细胞肺癌干细胞标志物uPAR的相关性,Spearman相关性分析显示:HIF-1α与uPAR表达无相关性(P=0.096,r=0.217,表1),而HIF-2α与uPAR表达呈正相关(P=0.001,r=0.409,表2)。为进一步证实HIF-2α和uPAR在小细胞肺癌组织表达定位是否也具相关性,实验进行HIF-2α和uPAR免疫组化连续切片染色。结果显示HIF-2α与uPAR共同表达于小细胞肺癌坏死组织周围区域(图4)。
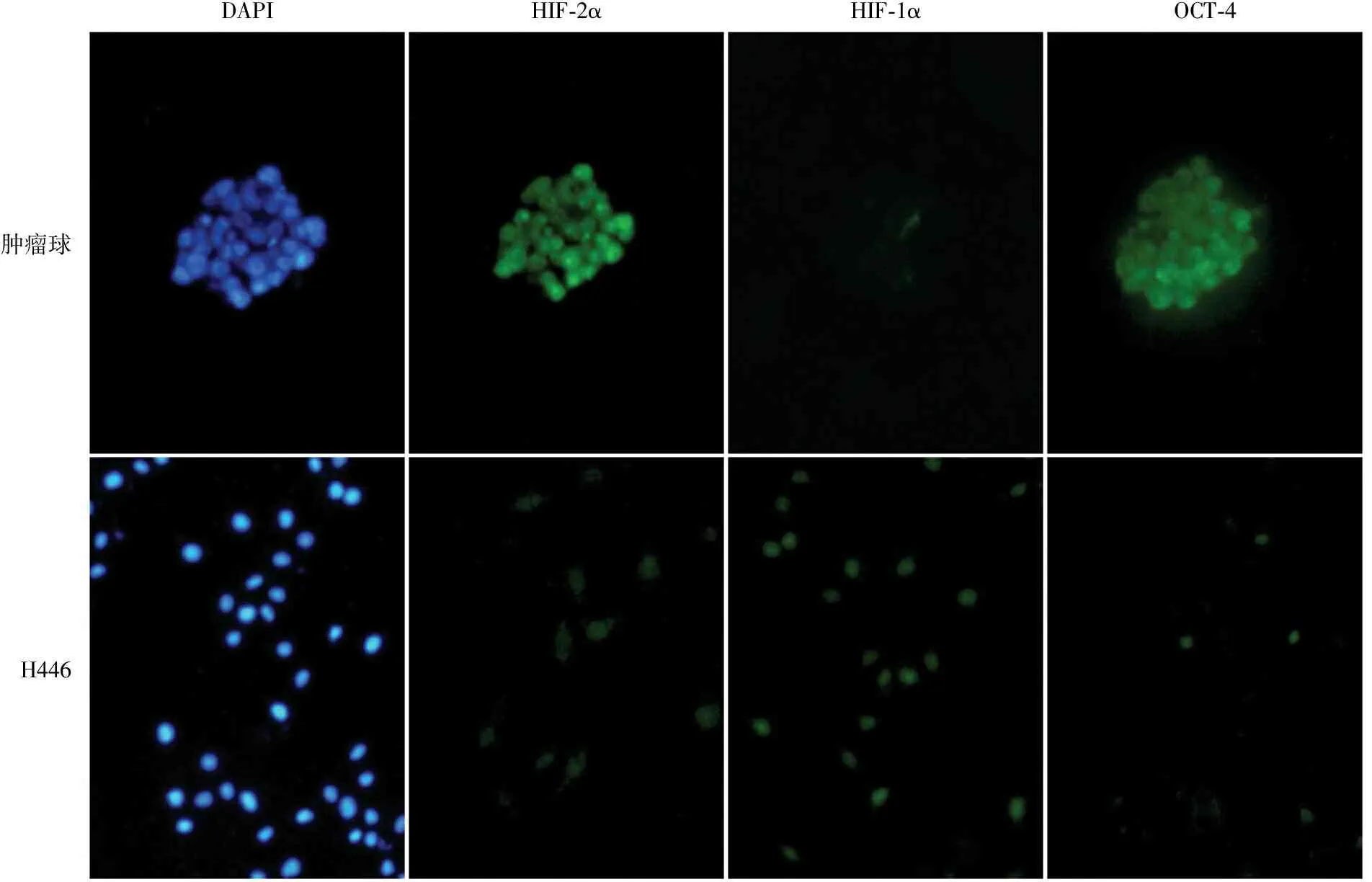
DAPIHIF⁃2αHIF⁃1αOCT⁃4肿瘤球H446
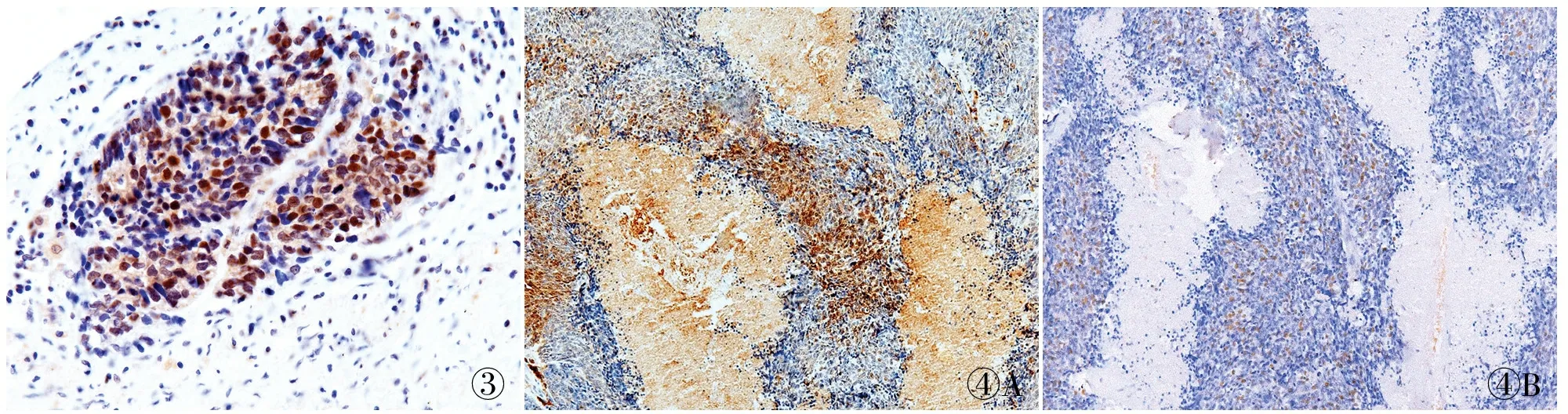
图2 HIF-2α、HIF-1α和OCT-4在肿瘤球细胞和H446亲代细胞中的表达,免疫荧光染色
图3 HIF-1α在小细胞肺癌肿瘤组织中的表达,EnVision两步法 图4 HIF-2α与uPAR共同表达于小细胞肺癌坏死组织周围区域:A.HIF-2α;B.uPAR,EnVision两步法
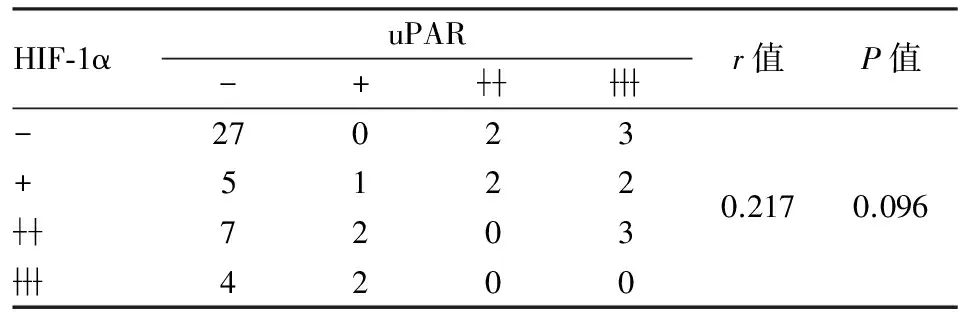
表1 HIF-1α和uPAR表达的相关性
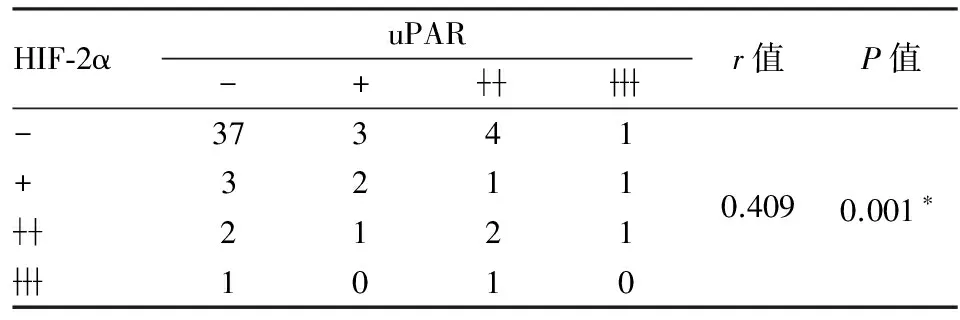
表2 HIF-2α和uPAR表达的相关性
*P<0.05
2.6 HIF-1α和HIF-2α表达与小细胞肺癌临床病理特征的关系 将患者年龄、性别、肿瘤直径、淋巴结转移、胸膜侵袭和远处转移与HIF-1α和HIF-2α表达进行相关分析,结果显示,HIF-2α与肿瘤直径和远处转移密切相关(表3)。随着肿瘤体积的增大,HIF-2α表达随之增高(P<0.05);HIF-2α阳性组患者远处转移率高于HIF-2α阴性组(P<0.05)。HIF-1α表达与以上临床病理参数均无关(P>0.05,表3)。
3 讨论
本课题组前期工作证明小细胞肺癌细胞系H446第3代肿瘤球细胞富集肿瘤干细胞,进一步证明uPAR可能为小细胞肺癌的干细胞标志物[11]。有趣的是,文献报道[3,12]缺氧微环境能够诱导uPAR的表达。越来越多的证据表明,缺氧微环境可能是干细胞壁龛的关键组成部分[13]。缺氧能够维持间充质干细胞的未分化状态和多潜能性[14-15]。Heddleston等[16]发现,缺氧条件下非干神经细胞成球率是常氧时的2倍,缺氧微环境在促进和维持干细胞自我更新能力中起着重要角色。因此,作者提出这样的问题:缺氧微环境中起关键作用的HIF-1α和HIF-2α在小细胞肺癌干细胞中的表达如何?其表达与小细胞肺癌干细胞存在什么关系?
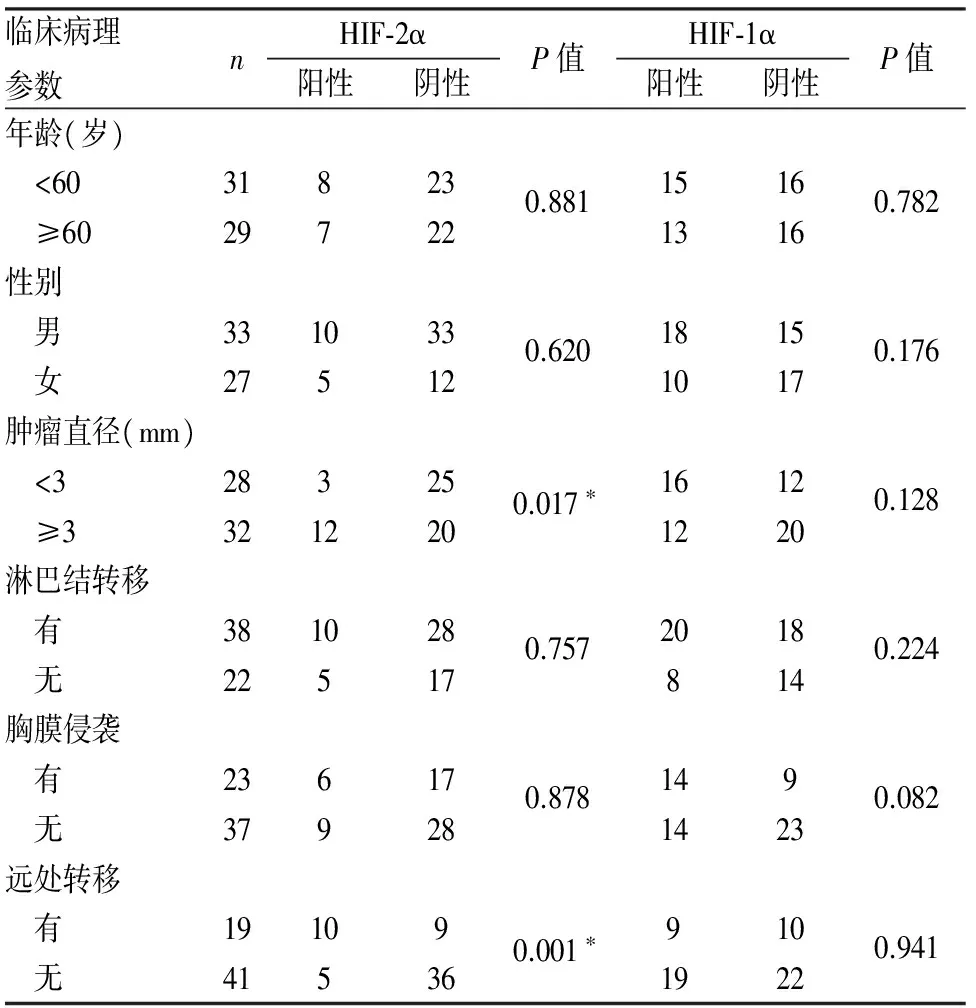
表3 HIF-2α和HIF-1α表达与小细胞肺癌临床病理特征的关系
*P<0.05
本组实验结果显示,HIF-2α在小细胞肺癌干细胞中表达上调,HIF-1α表达反而下调。新近研究表明HIF-2α在缺氧诱导的肿瘤干细胞维持中起到重要的作用。Li等[6]指出HIF-2α及其特异调节的靶基因OCT-4在神经胶质瘤干细胞中均显著高于非干细胞,提示HIF-2α可能是神经胶质瘤干细胞中起关键作用的调节因子。Seidel等[13]指出HIF-1α过表达对侧群细胞(干细胞)标记基因的表达无影响,而HIF-2α过表达能够显著上调侧群细胞标记基因和干细胞因子OCT-4的表达水平,并证实了缺氧壁龛通过HIF-2α来调节神经母细胞瘤的干细胞特征。而且,确定关键的干细胞因子OCT-4和c-myc为HIF-2α的靶基因直接将HIF-2α与干细胞的生物学特征联系起来[7,17]。本组实验结果显示,HIF-2α在小细胞肺癌干细胞中优先表达,与上述研究结果一致。进一步验证HIF-2α可能调控的干细胞因子OCT-4和c-myc,NONOG和SOX2在干细胞的表达情况,结果显示:仅HIF-2α的下游靶基因OCT-4在小细胞肺癌干细胞中表达上调。OCT-4在维持胚胎干细胞的多潜能性和干细胞的自我更新中起重要作用[18]。Covello等[7]指出HIF-2α能够连接到OCT-4的启动子上,诱导OCT-4的表达和转录活力,并证实OCT-4为HIF-2α直接调控的下游靶基因。本组中HIF-2α和OCT-4在小细胞肺癌干细胞中的表达均上调,提示HIF-2α可能通过激活干细胞因子OCT-4的表达来维持肿瘤球的干细胞功能,以提供肿瘤球细胞更好的生长和生存优势。小细胞肺癌干细胞中HIF-1α和HIF-2α的表达呈现相互抑制的互补关系。Raval等[19]指出,在肾透明细胞癌RCC4细胞系和SKRC28细胞系中HIF-2α显著下调HIF-1α的表达;然而,抑制HIF-2α后能够上调HIF-1α的蛋白,支持本组实验结果。这种相互的调控以及由此产生的生存优势也许可以解释仅敲除HIF-α的一个亚单位在目前肿瘤治疗中存在困难的原因。因此,靶向攻击HIF-1α和HIF-2α的治疗应该慎重考虑。
本组前期工作证明uPAR为小细胞肺癌干细胞标志物,且在干细胞高表达。本研究HIF-2α在小细胞肺癌干细胞中亦呈高表达。设想HIF-2α和uPAR在小细胞肺癌组织的表达定位是否相关,免疫组化连续切片结果显示HIF-2α与uPAR共同表达于小细胞肺癌坏死组织周围区域。在胶质瘤切片中HIF-2α与胶质瘤干细胞标志物共表达[6]。HIF-2α与小细胞肺癌干细胞标志物uPAR密切相关不是偶然事件,最近文献[6-8]报道HIF-2α能够优先表达于干细胞,并在干细胞维持中起到重要作用。鉴于小细胞肺癌干细胞中HIF-2α和uPAR表达均上调、小细胞肺癌组织中HIF-2α与uPAR共同表达于坏死组织周围区域且缺氧能够调节uPAR表达,作者推测HIF-2α可能作为uPAR的上游调节因子,在调节小细胞肺癌干细胞通路中起着重要的作用。
缺氧微环境在肿瘤的生长过程中起着重要的作用。随着肿瘤体积的增加、氧浓度和营养物质不足以维持肿瘤的生长。因此,体积较大的肿瘤经常会经历长期的慢性缺氧。在应对肿瘤的缺氧反应时,HIF-1α和HIF-2α经常起着不同的角色。在缺氧早期,HIF-1α急速增加,通过激活血管生成和糖代谢来调节对急性缺氧的适应性反应。随后形成一个中度缺氧微环境,该微环境能够诱导HIF-1α迅速降解同时上调HIF-2α表达。当HIF-2α积累到较高的水平时,通过激活其下游靶基因来促进肿瘤生长和生存优势。介导长期的慢性缺氧反应[5]。这可解释随着肿瘤体积增大,HIF-2α表达水平逐渐增加,如本组结果所示。大量数据表明,HIF-2α能够特异的激活肾透明细胞癌中TGF-α和Cyclin D1的表达[19]。TGF-α和Cyclin D1均是细胞生长调节因子。更重要的是,HIF-2α和HIF-1α相比,能够通过增强c-myc的转录活力来促进细胞增殖,从而促进肿瘤生长。然而,HIF-1α却抑制c-myc的转录活力[17]。根据以上的数据,作者推测HIF-2α在促进小细胞肺癌生长中起重要的作用。
缺氧能促进肿瘤细胞侵袭和转移潜能[20-21]。本组结果显示,HIF-1α与小细胞肺癌远处转移无关。然而,HIF-2α与小细胞肺癌远处转移显著相关。uPA/uPAR蛋白酶系统在缺氧诱导的转移过程中起着重要作用[3]。本组结果表明HIF-2α与uPAR共同位于坏死组织周围区域,推测HIF-2α-uPAR轴可能在缺氧诱导的转移过程中起着重要作用。此外,上皮-间质转化(epithelial to mesenchymal transition, EMT)在肿瘤转移扩散中起着重要的作用。研究表明HIF-2α能够促进EMT的发生[22]。而且,在多种肿瘤细胞中Twist1已经被确定为HIF-2α的下游靶基因[23],其在调节EMT发生中也起着重要作用。有趣的是,uPAR也参与缺氧诱导的EMT的发生[24]。Jo等[25]指出肿瘤细胞高表达uPAR,可促进EMT转变。因此,作者推测HIF-2α、uPAR和EMT可能在缺氧诱导的转移过程中起着网络效应。
综上所述,HIF-2α在小细胞肺癌干细胞中表达上调且与小细胞肺癌干细胞标志物uPAR表达呈正相关,提示HIF-2α表达可能与小细胞肺癌干细胞样特征有关;HIF-2α与小细胞肺癌患者增强的恶性肿瘤行为有关,这可能由其干细胞样特征所决定。
[1] Semenza G L. Intratumoral hypoxia, radiation resistance, and HIF-1[J]. Cancer Cell, 2004,5(5):405-406.
[2] Chi J T, Wang Z, Nuyten D S,etal. Gene expression programs in response to hypoxia: cell type specificity and prognostic significance in human cancers[J]. PLoS Med, 2006,3(3):e47.
[3] Rofstad E K, Rasmussen H, Galappathi K,etal. Hypoxia promotes lymph node metastasis in human melanoma xenografts by up-regulating the urokinase-type plasminogen activator receptors[J]. Cancer Res, 2002,62(6):1847-1853.
[4] Harris A L. Hypoxia-a key regulatory factor in tumour growth[J]. Nat Rev Cancer, 2002,2(1):38-47.
[5] Holmquist-Mengelbier L, Fredlund E, Lofstedt T,etal. Recruitment of HIF-1 alpha and HIF-2 alpha to common target genes is differentially regulated in neuroblastoma: HIF-2 alpha promotes an aggressive phenotype[J]. Cancer Cell, 2006,10(5):413-423.
[6] Li Z, Bao S, Wu Q,etal. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells[J]. Cancer Cell, 2009,15(6):501-513.
[7] Covello K L, Kehler J, Yu H,etal. HIF-2alpha regulates Oct-4: effects of hypoxia on stem cell function, embryonic development, and tumor growth[J]. Genes Dev, 2006,20(5):557-570.
[8] Pietras A, Gisselsson D, Ora I,etal. High levels of HIF-2 alpha highlight an immature neural crest-like neuroblastoma cell cohort located in a perivascular niche[J]. J Pathol, 2008,214(4):482-488.
[9] Dontu G, Abdallah W M, Foley J M,etal. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells[J]. Genes Dev, 2003,17(10):1253-1270.
[10] Cicalese A, Bonizzi G, Pasi C E,etal. The tumor suppressor p53 regulates polarity of self-renewing divisions in mammary stem cells[J]. Cell, 2009,138(6):1083-1095.
[11] Qiu X F, Wang Z Y, Li Y L,etal. Characterization of sphere-forming cells with stem-like properties from the small cell lung cancer cell line H446[J]. Cancer Lett, 2012,323(2):161-170.
[12] Buchler P, Reber H A, Tomlinson J S,etal. Transcriptional regulation of urokinase-type plasminogen activator receptor by hypoxia-inducible factor 1 is crucial for invasion of pancreatic and liver cancer[J]. Neoplasia, 2009,11(2):196-206.
[13] Seidel S, Garvalov B K, Wirta V,etal. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha[J]. Brain, 2010,133(Pt 4):983-995.
[14] Basciano L, Nemos C, Foliguet B,etal. Long term culture of mesenchymal stem cells in hypoxia promotes a genetic program maintaining their undifferentiated and multipotent status[J]. BMC Cell Biol, 2011,12:12.
[15] Kim Y, Lin Q, Glazer P M,etal. Hypoxic tumor microenvironment and cancer cell differentiation[J]. Curr Mol Med, 2009,9(4):425-434.
[16] Heddleston J M, Li Z, McLendon R E,etal. The hypoxic microenvironment maintains glioblastoma stem cells and promotes reprogramming towards a cancer stem cell phenotype[J]. Cell Cycle, 2009,8(20):3274-3284.
[17] Gordan J D, Bertout J A, Hu C J,etal. HIF-2 alpha promotes hypoxic cell proliferation by enhancing c-Myc transcriptional activity[J]. Cancer Cell, 2007,11(4):335-347.
[18] Chambers I, Tomlinson S R. The transcriptional foundation of pluripotency[J]. Development, 2009,136(14):2311-2322.
[19] Raval R R, Lau K W, Tran M G,etal. Contrasting properties of hypoxia-inducible factor 1 (HIF-1) and HIF-2 in von Hippel-Lindau-associated renal cell carcinoma[J]. Mol Cell Biol, 2005,25(13):5675-5686.
[20] 倪小晴, 张佐阳, 吴继锋. HIF-1α蛋白在胃癌中的表达及其与Wnt信号通路、上皮-间质转化的关系[J]. 临床与实验病理学杂志, 2014,30(2):140-144.
[21] 姜丽丽, 师永红, 肖 瑞, 等. 乳腺癌细胞中HIF-1α对MMP1、8、15、16、17的调节作用[J]. 临床与实验病理学杂志, 2012,28(11):1188-1190.
[22] Kim W Y, Perera S, Zhou B,etal. HIF2 alpha cooperates with RAS to promote lung tumorigenesis in mice[J]. J Clin Invest, 2009,119(8):2160-2170.
[23] Gort E H, van Haaften G, Verlaan I,etal. The TWIST1 oncogene is a direct target of hypoxia-inducible factor-2 alpha[J]. Oncogene, 2008,27(11):1501-1510.
[24] Lester R D, Jo M, Montel V,etal. uPAR induces epithelial-mesenchymal transition in hypoxic breast cancer cells[J]. J Cell Biol, 2007,178(3):425-436.
[25] Jo M, Lester R D, Montel V,etal. Reversibility of epithelial-mesenchymal transition (EMT) induced in breast cancer cells by activation of urokinase receptor-dependent cell signaling[J]. J Biol Chem, 2009,284(34):22825-22833.
Expression of HIF-1α and HIF-2α in small cell lung cancerstem cells and tissues and their significance
LUAN Ya-jing, ZHENG Xu, QIU Xiao-fei
(TeachingCenterofBasicMedicalCollege,TianjinMedicalUniversity,Tianjin300070,China)
Purpose To observe the expression of HIF-1α and HIF-2α in tumor stem cells and tumor tissues of small cell lung cancer (SCLC) and to explore their clinical significance. Methods The defined serum-free culture was used to enrich the third passage tumor spheres cells from H446 as the tumor stem cells. Real-time PCR was performed to determine the mRNA expression level of HIF-1α and HIF-2α in H446 tumor stem cells. Immunofluorescence staining was performed to determine the protein expression level of HIF-1α and HIF-2α in H446 tumor stem cells. Immunohistochemistry SP method was used todetect the expression of HIF-1α and HIF-2α in SCLC tissues. Results The mRNA expression level of HIF-2α was up-regulated in tumor stem cells. However, the mRNA expression level of HIF-1α was down-regulated in tumor stem cells(P<0.05). The expression of HIF-2α protein was positive in tumor stem cells. In contrast, HIF-1α protein was negative in tumor stem cells. In SCLC tissues, the positive rate of HIF-1α was 46.7%(28/60), and the positive rate of HIF-2α was 25%(15/60). Correlation analysis showed that HIF-2α was positively correlated with SCLC stem cell marker uPAR, and they co-localized around necrotic regions. The expression of HIF-2α was closely related to tumor diameter and distant metastasis. In contrast, the expression of HIF-1α had no relationship with age, sexy, tumor size, lymph metastasis, pleural invasion and distant metastasis(P>0.05). Conclusion HIF-2α is up-regulated in SCLC stem cells and positively correlated with SCLC stem cell marker uPAR, which are associated with the tumor diameter and distant metastasis of SCLC patients, suggesting that the expression of HIF-2α may be related to SCLC stem-like characteristics.
lung neoplasms; small cell lung cancer; tumor stem cells; HIF-1α; HIF-2α
天津医科大学基础医学院教学中心,天津 300070
栾雅静,女,硕士,助理实验师。E-mail: yajingluan123@126.com 仇晓菲,女,博士,教授,硕士生导师,通讯作者。E-mail: qiuxf@tijtum.edu.com
时间:2017-8-20 15:27 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170820.1527.009.html
R 734.2
A
1001-7399(2017)08-0868-07
10.13315/j.cnki.cjcep.2017.08.009
接受日期:2017-04-17

