Uba-2在肝癌组织中的表达及其对肝癌细胞增殖和侵袭转移能力的影响
袁 征,李 珍,孙彦珍
Uba-2在肝癌组织中的表达及其对肝癌细胞增殖和侵袭转移能力的影响
袁 征,李 珍,孙彦珍
目的 探讨Uba-2在肝癌组织中的差异表达以及过表达和低表达时其对肝癌细胞增殖和侵袭能力的影响。方法 qRT-PCR法检测肝癌组织中Uba-2 mRNA的表达;将Uba-2的过表达载体和siRNA表达载体转染至肝癌细胞HepG2后,MTS实验检测Uba-2对肝癌细胞增殖能力的影响;细胞迁移/侵袭实验检测其对肝癌细胞侵袭转移能力的影响;Western blot法检测肝癌细胞HepG2中TGF-β1~3及VEGF、Snail蛋白的表达。结果 Uba-2在肝癌组织中呈高表达,与癌旁肝组织中的表达差异有显著性(P<0.01),qRT-PCR法检测Uba-2在HepG2细胞中过表达或低表达;细胞增殖实验数据显示Uba-2表达水平与肝癌细胞HepG2的增殖能力相关,siRNA干扰沉默HepG2细胞中Uba-2的表达会抑制其增殖生长,细胞迁移/侵袭实验数据显示Uba-2过表达能促进肝癌细胞HepG2的侵袭、转移能力,且与阴性对照组细胞相比差异有统计学意义;Western blot结果显示Uba-2的异常表达影响TGF-β2及VEGF、Snail蛋白表达水平。结论 Uba-2基因在肝癌组织中的高表达可能具有促进肝癌细胞增殖及侵袭转移的作用。
肝肿瘤;细胞增殖;侵袭转移;Uba-2
肝癌是全球常见的恶性肿瘤之一,由于肝炎病毒感染渐为普遍,原发性肝癌的发病率也逐年增加,且原发性肝癌无特异性临床表现,确诊时多为中晚期[1]。类泛素化修饰(small ubiquitin-like modifier, SUMO)是一种重要的蛋白翻译后修饰形式,可调节靶蛋白的活性与功能。SUMO在转录、DNA修复、核质物质转运及染色体分离等方面发挥重要作用[1-2],其中SUMO-1是SUMO家族成员之一,SUMO-1可抑制p53基因的活性[3-4],促使癌症的发生、发展和转移,而SUMO的激活需SUMO活化酶E1催化,E1是由Aos-1和Uba-2组成的异二聚体[5]。研究[6]发现Uba-2在甲状腺嗜酸细胞肿瘤和人类前列腺癌等癌症组织中出现异常表达,Uba-2基因的沉默会在一定程度上影响肿瘤细胞的增殖以及侵袭转移等过程。本课题组初步研究发现,Uba-2在肝癌组织中的表达显著高于非肝癌组织,而Aos-1的表达无明显差异。为进一步探讨Uba-2与肝癌细胞增殖和侵袭的关系,本实验通过检测Uba-2的过表达或低表达对肝癌细胞株中细胞增殖以及侵袭能力的影响,探讨其在肝癌发生、发展中的作用。
1 材料与方法
1.1 临床资料 40例标本来源于原发性肝癌患者,患者均签署知情同意书且均未接受其他治疗,包括30例男性和10例女性的肝癌组织及癌旁肝组织。肝癌细胞株HepG2购于中国典型培养物保藏中心(China Center for Type Culture Collection, CCTCC)。
1.2 仪器及试剂 脂质体Lipofectamine 2000、TRIzol(Invitrogen公司,USA);PrimeScripts RT Reagent Kit(Takara公司,China);Transwell Flters (8 μm;Millipore, USA);RPMI 1640、Opti-MEMI培养液和胎牛血清(Gibco公司,USA)。定量PCR采用SYBR Green PCR Master Mix(日本TOYOBO公司);ABIPRISM 7500定量PCR仪;抗体为英国Abcam公司产品。Uba-2过表达载体和siRNA干扰表达载体以及Uba-2引物由广州锐博公司设计与合成。
1.3 细胞转染 Lipofectamine 2000转染试剂盒转染。实验分为阴性对照组(只有脂质体)、Uba-2过表达组(Uba-2过表达载体和脂质体)和Uba-2干扰表达组(加入Uba-2 siRNA干扰表达载体100 nmol/L和脂质体)。转染成功后于37 ℃、5%CO2、饱和湿度条件下培养于含100 mL/L胎牛血清的RPMI 1640培养基中48 h,收集细胞进行各项检测。
1.4 Uba-2在肝癌组织及细胞株中的表达 采用Trizol试剂提取肝癌组织中和各组细胞中的总RNA;采用PrimeScripts RT Reagent Kit试剂盒反转录合成cDNA;采用qRT-PCR技术检测Uba-2在组织和细胞株中的表达水平。每一样品重复3次,以U6作为内参,记录Ct值。定量PCR反应程序:50 ℃ 2 min,95 ℃ 10 min预变性(1个循环);95 ℃ 15 s,65 ℃ 1 min,40个循环。各组间Uba-2相对定量的倍数用2-△△Ct值表示。
1.5 Uba-2过表达或低表达对肝癌细胞增殖能力的影响 收集各个时间点的细胞进行检测:在0.2 mL台盼蓝(含0.1%Trypan Blue的PBS)中加0.2 mL细胞悬液,没有活性的细胞被染成蓝色;立即用微量巴氏吸管混匀后,吸足量细胞悬液从血细胞计数室的两边加样;使用Freshney计数板计算细胞数。
1.6 细胞划痕法检测肝癌细胞株迁徙能力 将转染后的HepG2细胞株分别培养于6孔板中直到板孔被细胞覆盖,用200 μL移液器枪头刮一个直径约200 μm的垂直划痕,PBS缓冲液冲洗3次,37 ℃孵育。24 h后在倒置显微镜下观察细胞平均迁徙距离,迁徙距离=总面积/高度,每组实验平行3次。
1.7 Transwell法检测肝癌细胞株侵袭能力 按照Milipore公司Transwell小室说明书操作,于100 μL基质胶中以1 ∶8稀释的无血清培养基中过夜孵育。常规培养12~16 h,3.7%甲醛固定细胞2 h,1%结晶紫染色,随机选5个视野计数,倒置显微镜观察并拍照。
1.8 Western blot法检测TGF-β1~3及VEGF、Snail蛋白的表达 转染48 h后收集各组细胞,制备细胞总蛋白,BCA法进行蛋白定量检测后按一定浓度进行SDS-PAGE恒压电泳。以GAPDH为内参,辣根过氧化物酶标记的山羊抗鼠IgG抗体为二抗,检测TGF-β1~3及VEGF、Snail蛋白的表达。
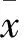
2 结果
2.1 Uba-2在肝癌组织以及肝癌细胞株中的表达 Uba-2在肝癌组织中高表达,与癌旁肝组织中的表达相比差异有显著性(P<0.01,图1);肝癌细胞株转染Uba-2过表达和干扰表达载体48 h后,qRT-PCR检测出Uba-2过表达组在HepG2细胞株中呈高表达,Uba-2干扰表达组在细胞株中呈低表达,与阴性对照组相比差异均有显著性(P<0.01,图2)。

图1 Uba-2在肝癌和癌旁肝组织中的表达

图2 Uba-2在肝癌细胞株HepG2中的表达
2.2 过表达或低表达Uba-2对肝癌细胞增殖能力的影响 由HepG2细胞生长曲线可见,转染72 h后,Uba-2过表达组细胞的生长受到明显促进,而Uba-2干扰表达组受到明显的抑制,在96 h两组的作用效果最为明显(图3)。说明Uba-2的表达水平与肝癌细胞HepG2的增殖能力相关,siRNA干扰沉默HepG2细胞中Uba-2的表达会抑制其增殖生长。
2.3 过表达或低表达Uba-2对肝癌细胞侵袭、转移能力的影响 迁移实验结果显示,Uba-2过表达组较阴性对照组细胞二维水平迁移速度明显提高(P<0.05),而Uba-2干扰表达组较阴性对照组细胞二维水平迁移速度明显降低(P<0.05)。侵袭实验中阴性对照组视野平均侵袭细胞数为61.9±14.5,Uba-2过表达组的平均侵袭细胞数为99.2±10.2;较阴性对照组侵袭力上调,差异有显著性(P<0.01),Uba-2干扰表达组视野平均侵袭细胞数为36.5±6.7,较阴性对照组侵袭力下调,差异有显著性(P<0.05,表1,图4)。
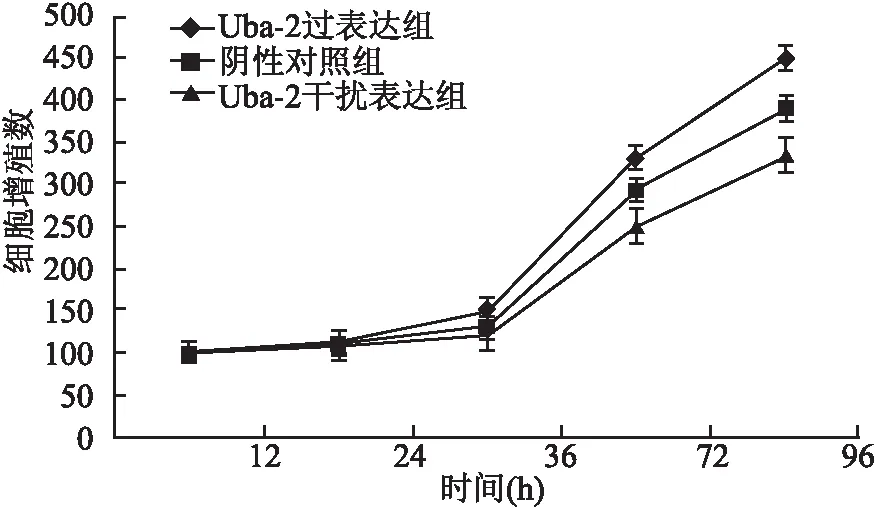
图3 Uba-2对HepG2细胞增殖能力的影响

表1 Transwell法检测肝癌细胞株侵袭能力
与阴性对照组相比,*P<0.05,**P<0.01
2.4 Western blot法检测肝癌细胞株TGF-β1~3及VEGF、Snail蛋白的表达 Western blot法检测HepG2细胞株中TGF-β1~3及VEGF、Snail蛋白的表达,结果显示,相对于阴性对照组,Uba-2过表达组中TGF-β2的表达上调且VEGF、Snail蛋白的表达量也有所增加,TGF-β1和TGF-β3的表达量无明显变化;而Uba-2干扰表达组中TGF-β2、VEGF和Snail的表达均下调。表明Uba-2的异常表达会影响TGF-β2及VEGF、Snail蛋白的表达(图5)。
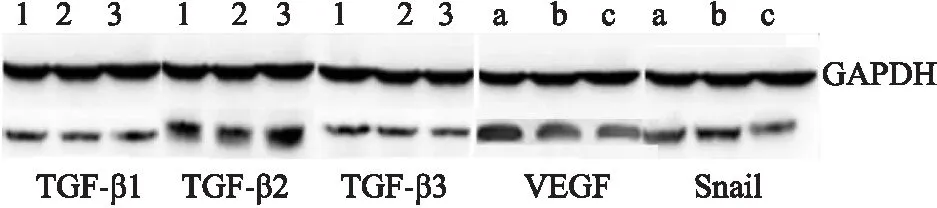
图5 Western blot法检测TGF-β1~3及VEGF、Snail蛋白的表达
1.阴性对照组;2.Uba-2干扰表达组;3.Uba-2过表达组;a.Uba-2过表达组;b.阴性对照组;c.Uba-2干扰表达组
3 讨论
肿瘤的发生、进展是多因素参与的复杂过程,环境、遗传、基因等均与之发生有着密切的关系[7]。如促癌基因的激活、抑癌基因功能被抑制或缺失等均有可能导致肿瘤的发生[8]。肝癌在全球各种致死肿瘤中位居第3位,原发性肝癌是最常见的恶性肝肿瘤之一,具有无特异性临床表现、病情发展迅速和易发生血道转移、手术后易复发等特点,患者确诊时多为中晚期[9]。SUMO通过参与功能蛋白翻译后的修饰,在转录、DNA修复、核质物质转运及染色体分离等方面发挥重要作用[10-12];SUMO靶蛋白不是引导靶蛋白降解,而是通过和靶蛋白共价结合后调节靶蛋白的功能,修饰的底物蛋白非常广泛,参与多种蛋白翻译后功能的调节。在蛋白酶的水解作用下Uba-2过表达组细胞迁移速度高于阴性对照组、Uba-2干扰表达组;Uba-2过表达组的平均侵袭细胞数高于阴性对照组和Uba-2干扰表达组前体蛋白形成成熟的SUMO分子,现已发现能与SUMO结合并被其修饰的蛋白百余种,其大部分是核蛋白,包括p53、MDM2等与转录及调控细胞周期密切相关的蛋白合[13];部分为胞质表达,如低氧耐受因子(HIF-1α),很多癌基因和抑癌基因功能均受SUMO的调节,包括p53、双微基因2(MDm2)、PML等[14],这些基因的活性、表达水平及定位的变化对肿瘤发展至关重要。同时,SUMO分子在活化酶E1作用下激活,SUMO活化酶E1则是由Aos-1和Uba-2两个亚基组成的异源二聚体,且SUMO的激活需Uba-2提供SUMO活性位点的半胱氨酸残基并形成巯酯键,然后再被转移与靶蛋白结合[8],SUMO才可被激活。由此可见,Uba-2表达在SUMO中具有重要意义,虽已知泛素活化酶E1在泛素化信号通路中的作用机制及其重要性,了解SUMO和肿瘤关系密切,可促进癌症的发生、发展和转移[15],但现有针对泛素活化酶E1主要构成物质Uba-2参与肿瘤发生、发展的研究相对较少,Uba-2在肝癌中的表达机制及对肝癌细胞株中细胞增殖以及侵袭能力方面的影响尚未完成阐明,鉴于此,本组实验检测了肝癌中Uba-2表达,旨在进一步探讨Uba-2在肝癌发生、发展中的作用。
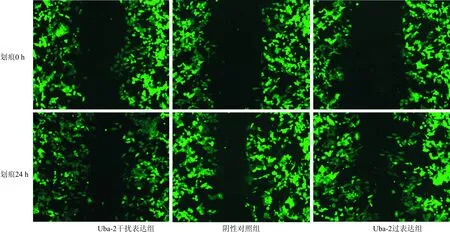
图4 划痕实验结果
本实验检测肝癌及癌旁组织中Uba-2 mRNA的表达,利用Uba-2的过表达载体和siRNA表达载体转染至肝癌细胞HepG2,通过MTS实验和细胞迁移/侵袭实验观察Uba-2在肝癌组织中的差异表达以及过表达和低表达时其对肝癌细胞增殖和侵袭能力的影响。Uba-2在肝癌组织中呈高表达,较癌旁肝组织中的表达差异有显著性;细胞增殖实验数据显示Uba-2的表达水平与肝癌细胞HepG2的增殖能力相关,siRNA干扰沉默HepG2细胞中Uba-2的表达会抑制其增殖生长;细胞迁移/侵袭实验数据显示Uba-2的过表达能促进肝癌细胞HepG2的侵袭转移能力,且与阴性对照组细胞相比差异有统计学意义;Western blot检测结果显示Uba-2影响与增殖侵袭有关的信号分子TGF-β2、VEGF和Snail的表达水平。推测肝癌细胞中Uba-2主要针对某些与肝癌细胞增殖侵袭相关靶蛋白的SUMO,影响肿瘤细胞增殖与侵袭过程有关的信号通路如TGF-β2、VEGF等[16],进而影响肝癌细胞的增殖和侵袭能力,因此Uba-2在肝癌组织中的高表达可能具有促进肝癌增殖侵袭的作用。在后续实验中将探讨Uba-2激活SUMO在肝癌细胞中对哪些靶蛋白起作用,为肝癌尤其原发性肝癌发生机制的研究以及为肝癌的临床诊断和生物治疗提供有效靶点。
[1] Mattoscio D, Segré C V, Chiocca S. Viral manipulation of cellular protein conjugation pathways: the SUMO lesson[J]. World J Virol, 2013,2(2):79-90.
[2] Li R, Wei J, Jiang C,etal. Akt SUMOylation regulates cell proliferation and tumorigenesis[J]. Cancer Res, 2013,73(18):5742-5753.
[3] Xu Y, Zuo Y, Zhang H,etal. Induction of SENP1 in endothelial cells contributes to hypoxia-driven VEGF expression and angiogenesis[J]. J Biol Chem, 2010,285(47):36682-36688.
[4] Wang R T, Zhi X Y, Zhang Y,etal. Inhibition of SENP1 induces radiosensitization in lung cancer cells[J]. Exp Ther Med, 2013,6( 4):1054-1058.
[5] Bawa K T, Yeh E T H. Conjugation and deconjugation of ubiquitin family modifiers[M]. Texas: Springer, 2010:584-595.
[6] Chen C H, Chang C C, Lee T H,etal. SENP1 deSUMOylates and regulates Pin1 protein activity and cellular function[J]. Cancer Res, 2013,73(13):3951-3962.
[7] Cube as-Potts C, Goeres J D. SENP1 and SENP2 affect spatial and temporal control of sumoylation in mitosis[J]. Mol Biol Cell, 2013,24(22):3483-3495.
[8] Cheng J, Bawa T, Lee P,etal. Role of desumoylation in the development of prostate cancer[J]. Neoplasia, 2006,8(8):667-676.
[9] Cheng J, Kang X, Zhang S,etal. SUMO-specific protease 1 is essential for stabilization of HIF1alpha during hypoxia[J]. Cell, 2007,131(3):584-595.
[10] Meinecke I, Cinski A, Baier A,etal. Modification of nuclear PML protein by SUMO-1 regulates Fas-induced apoptosis in rheu- matoidarthritis synovial fibroblasts[J]. Proc Natl Acad Sci USA, 2007,104(12):5073-5078.
[11] Watson I R, Irwin M S. Ubiquitin and ubiquitin-like modificaions of the p53 family[J]. Neoplasia, 2006,8(8):655-666.
[12] Yeh E T. SUMOylation and De-SUMOylation: Wrestling with life’s pro-cesses[J]. J Biol Chem, 2009,284(13):8223-8227.
[13] Carter S, Bischof O, Dejean A,etal. C-terminal modifications regulate MDM2 dissociation and nuclear export of p53[J]. Nat Cell Biol, 2007,9(4):428.
[14] Ihara M, Koyama H, Uchimura Y,etal. Noncovalent binding of small ubiquitin-related modifier (SUMO) pro-tease to SUMO is necessary for enzymatic activities and cell growth[J]. J Biol Chem, 2007,282(22):16465.
[15] Karamouzis M V, Konstantinopoulos P A, Badra F A,etal. SUMO and estrogen receptors in breast cancer[J]. Breast Cancer Res Treat, 2008,107(2):195.
[16] 高建芝, 杜经丽, 李 佳, 等. VEGF相关信号通路在肝癌组织中的表达及临床意义[J]. 临床与实验病理学杂志, 2014,30(1):75-78.
Expression of Uba-2 in hepatic carcinoma andits effect on the proliferation, invasion and metastasis of hepatoma cells
YUAN Zheng, LI Zhen, SUN Yan-zhen
(DepartmentofPathology,CentralHospitalofNanyang,Nanyang473000,China)
Purpose To investigate the effect of differential expression, over expression and low expression of Uba-2 in hepatic carcinoma on the proliferation and invasion of hepatoma cells. Methods The expression of Uba-2 mRNA in clinical specimens was detected by qRT-PCR. After transfection of Uba-2 over expression vector and siRNA expression vector into hepatoma cell HepG2, the effect of Uba-2 on proliferation of hepatoma cells was detected by MTS assay while the effect on the invasion and metastasis of hepatoma cells was detected by cell migration/invasion assay. The expression levels of TGF-β1-3, VEGF and Snail proteins in hepatoma cell HepG2 were detected by Western blot. Results The expression of Uba-2 was high in hepatic carcinoma. Compared with that in adjacent liver tissues, there were significant differences (P<0.01). qRT-PCR detected over expression or low expression of Uba-2 in HepG2 cells. Cell proliferation data showed that the expression level of Uba-2 was related to the proliferation ability of hepatoma cell HepG2, and siRNA interferring the expression of Uba-2 in silent HepG2 cells could inhibit its growth. The data of cell migration/invasion showed that over expression of Uba-2 could promote the invasion and metastasis of hepatoma cell HepG2. Compared with cells in the control group, there were statistically significant differences. The results of Western blot indicated that the abnormal expression of Uba-2 affected the expression levels of TGF-β2, VEGF and Snail proteins. Conclusion The high expression of Uba-2 gene in hepatic carcinoma may promote the proliferation, invasion and metastasis of hepatoma cells.
hepatic neoplasms; cell proliferation; invasion and metastasis; Uba-2
河南省南阳市中心医院病理科,南阳 473000
袁 征,女,硕士,主治医师。E-mail: yzyz2128@163.com 李 珍,女,副主任医师,通讯作者。E-mail: zhengIi6366@163.com
时间:2017-8-20 15:27 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170820.1527.003.html
R 735.7
A
1001-7399(2017)08-0837-05
10.13315/j.cnki.cjcep.2017.08.003
接受日期:2017-06-19

