输尿管肾源性腺瘤合并肾脏结核1例并文献复习
秦东瑞,周 莉,朱 琳,马广贞
输尿管肾源性腺瘤合并肾脏结核1例并文献复习
秦东瑞,周 莉,朱 琳,马广贞
目的 探讨输尿管肾源性腺瘤(nephrogenic adenoma, NA)的临床病理学和免疫表型特征。方法 回顾性分析1例输尿管NA合并肾脏结核的临床资料及病理学特征,对其行HE及免疫组化EnVision法染色,并复习相关文献。结果 患者男性,18岁。大体上输尿管腔内见狭窄区;镜下见黏膜下增生腺体形成小管状、乳头状结构,管腔大小形状不一,被覆单层立方上皮,黏膜下见慢性炎细胞浸润;肾脏结核改变。免疫表型:AMACR(P504s)(+);CK7(弱+);CK34βE12(局灶+);CD10、CK20、Villin、vimentin(-)。结论 输尿管NA是非常少见的泌尿系统病变,需与息肉、移行细胞癌及腺癌鉴别,掌握其组织形态特征及免疫表型是正确诊断的关键。
输尿管肿瘤;肾源性腺瘤;肾脏结核;免疫组织化学
肾源性腺瘤(nephrogenic adenoma, NA)是一种少见的泌尿系统病变,目前国内外已报道数百例,多数发生于膀胱,而发生于尿道、输尿管及肾盂者极少见,输尿管NA合并肾脏结核者尚未见报道。本文现对1例输尿管NA合并肾脏结核进行HE及免疫组化染色,并结合文献复习其病因及发病机制、临床病理学、诊断、鉴别诊断、治疗及预后,旨在提高认识水平。
1 材料与方法
1.1 临床资料 患者男性,18岁,3年前因泌尿系结石在当地行体外碎石治疗,1年前因尿频、尿急、盗汗,偶有腰部痛及尿痛来院就诊,诊断泌尿系结核,抗结核药物规律治疗。20天前来院治疗,泌尿系CT示符合右侧肾积水,右侧输尿管扩张,双侧肾盂多发高密度灶,考虑结石,膀胱壁局部稍厚;胸部CT符合双上肺结核表现;肾动态:GFR(mL/min):左46.27,右0.12,总46.39,右肾GFR重度受损,无法判断右侧上尿路引流情况;左肾GFR未见异常,上尿路引流不畅。行右肾输尿管切除,切除组织送病理检查。
1.2 方法 标本经10%中性福尔马林固定,石蜡包埋,HE染色,光镜检查,免疫组化染色采用EnVision两步法。单克隆鼠抗人AMACR(P504s)、CK7、CK34βE12、CD10、CK20、Villin、vimentin均购自福州迈新公司,具体操作步骤严格按试剂盒说明书进行。
2 结果
2.1 眼观 带部分输尿管肾脏切除标本1个,输尿管长25 cm,周径3 cm,距输尿管断端6 cm处见一狭窄区,面积2.5 cm×2 cm,周径1.5 cm,管壁增厚,黏膜粗糙,呈多乳头状,输尿管部分管腔扩张,管壁变薄,肾脏体积大小12 cm×7 cm×4 cm,肾实质萎缩,肾盂肾盏扩张,局灶肾盂黏膜略粗糙,肾盂腔内见大量石灰渣样物。
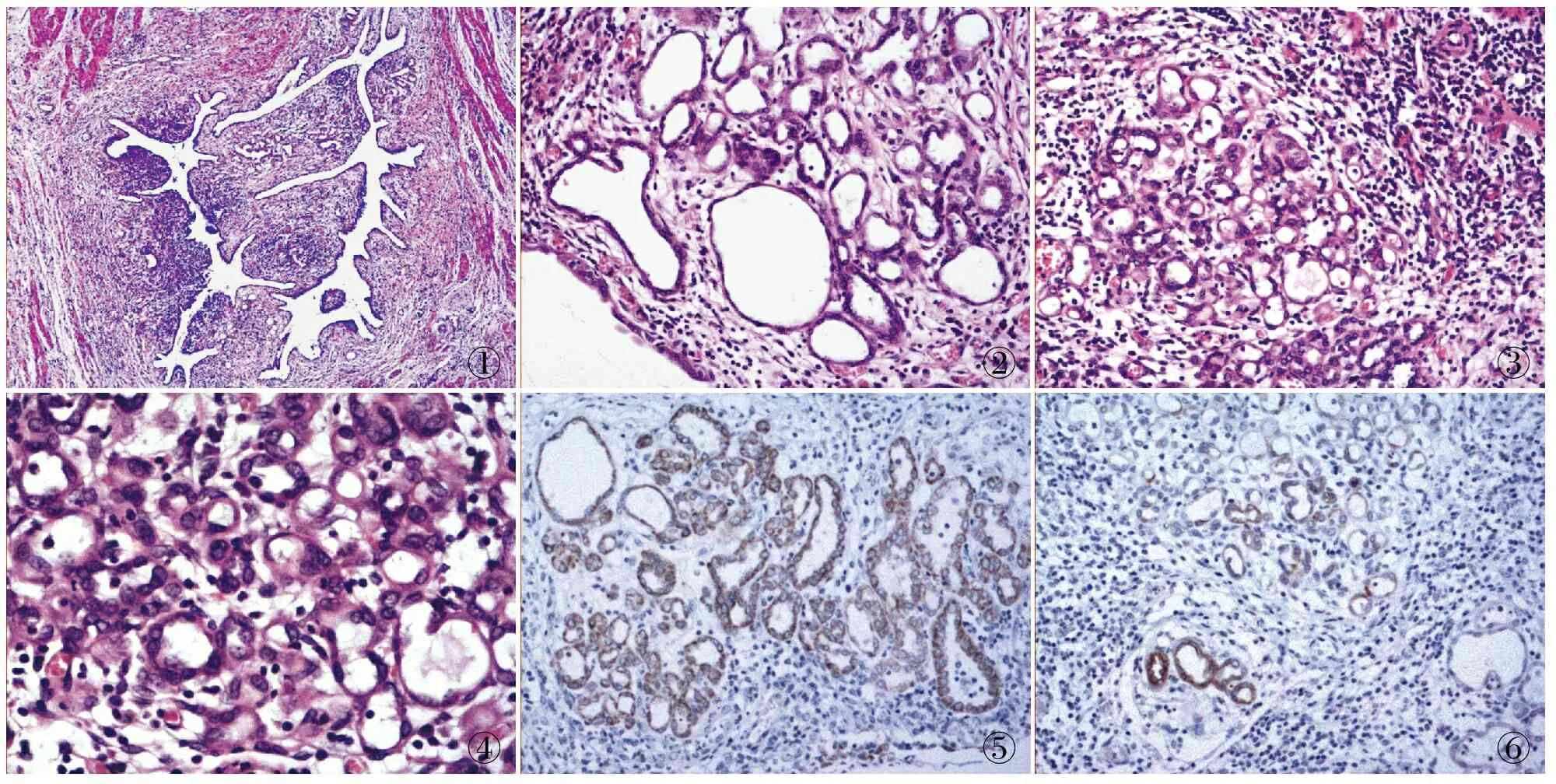
2.2 镜检 输尿管管腔狭窄,黏膜下见增生腺体形成小管状、乳头状结构,管腔大小形状不一,被覆单层立方上皮,细胞核圆形或椭圆形,未见明显核异型及核分裂,胞质嗜酸(图1~4),大量增生、扩张血管出现于黏膜下方,可见慢性炎细胞浸润;肾肉芽肿性炎,见多灶性干酪样坏死,散在多核巨细胞及钙化,符合肾结核改变。
2.3 免疫表型 AMACR(P504s)(+)(图5);CK7(弱+);CK34βE12(局灶+)(图6);CD10、CK20、Villin、vimentin(-)。
2.4 病理诊断 肾脏结核;输尿管NA。
3 讨论
3.1 病因及发病机制 NA于1949年由Davis首次报道,命名为膀胱错构瘤。1950年,Friedman和Kuhlenbeck根据其形态类似于肾小管的特点,将其命名为“肾源性肿瘤”[1]。一些学者认为该病是各种损伤造成的一种尿路上皮反应性化生,应命名为肾源性化生(nephrogenic metaplasia)[2]。
①②③④⑤⑥
图1 黏膜下见增生腺体形成小管状、乳头状结构 图2 管腔大小形状不一,被覆单层立方上皮 图3 背景中见大量慢性炎细胞浸润
图4 细胞核圆形或椭圆形,未见明显核异型及核分裂,胞质嗜酸 图5 输尿管肾源性腺瘤细胞AMACR(P504s)(+),EnVision法 图6 输尿管肾源性腺瘤细胞CK34βE12(局灶+),EnVision法
NA发病率罕见,国内外已报道的病例中,绝大多数发生在膀胱(约80%),尿道次之(15%),输尿管和肾盂更次之(5%)[3],多发病于成年男性,其临床表现为血尿和尿路刺激征,也可隐匿发病。NA发病机制不明确,以往认为该病起源于残留的胚胎中肾管,现在一般集中在以下两种学说:(1)慢性损伤刺激尿路上皮而产生的一种化生性病变,其损伤原因一般包括手术、创伤、留置导尿管、结石、慢性感染及化学性刺激;(2)NA是由于肾小管上皮剥脱,种植于泌尿系统而产生的,类似于子宫内膜异位[4-5]。本例患者既往有过泌尿系碎石病史及肾脏结核病史,其致病原因或为两者之一,或为两者共同作用结果,具体需进一步研究检查。
3.2 临床特点 NA临床无特异性改变,单发较多见,临床表现多与其发生位置有关,发生于膀胱的NA多出现血尿、尿频;发生于输尿管、肾盂的NA多出现镜下血尿和尿路梗阻表现,继发引起肾脏功能的损害。患者多因以上症状就诊时于腔镜和影像学检查时发现息肉或乳头状结构病变,不易与癌或炎性息肉鉴别,因此术前活检及术中病理对NA的治疗有决定性作用。本例出现尿路梗阻症状,正是由于其输尿管NA造成输尿管狭窄而出现的症状。
3.3 病理特征 NA的确诊往往需要病理特征和免疫表型相结合。输尿管NA病变多数位于固有层内,但极少数病例可渗透肌层甚至可达到周围脂肪组织,其原因可能是机械性损伤造成输尿管黏膜缺失和肾小管上皮脱落造成种植的结果[6]。镜下NA以小管状结构最为常见,典型的为圆形小管,管腔内衬覆立方上皮,可出现鞋钉样细胞,细胞核圆形或椭圆形,少见核异型,无核分裂象,管腔扩张可为囊状结构,腔内出现嗜酸物质。此外还可见乳头状、实体状或伴有梭形细胞的纤维黏液样结构[7],间质内出现水肿,大量慢性炎细胞浸润。NA免疫组化多数表达CK7、EMA、HCK,部分表达AMACR,不表达CD31、PSA、CD10、PSA,Ki-67增殖指数一般<5%[8]。近来有学者发现,PAX2和PAX8在NA中特异性表达,为其诊断及鉴别诊断提供依据[9-12]。
3.4 鉴别诊断 输尿管NA最重要的是与输尿管息肉、移行细胞癌以及腺癌等相鉴别。(1)输尿管息肉表现为柔软的息肉状,可沿管腔伸入膀胱,镜下可见移行上皮被覆,其下为疏松结缔组织和毛细血管,可与输尿管NA相鉴别。(2)移行细胞癌可与部分NA并存发生[13],因此输尿管NA与移行细胞癌的鉴别尤为重要,两者在影像上无能够区分开的特异表现,输尿管移行细胞癌主要是肿瘤细胞沿尿路上皮分布,细胞异型明显,而NA为柱状细胞、立方细胞或扁平细胞沿乳头表面分布,以此鉴别两者并不难。当NA为管状、囊状或实体结构,尤其是渗透肌层的时候,需与有巢状变异的移行细胞癌鉴别。同一病灶中可见管状、囊状或实体结构,间质疏松和炎细胞背景倾向于NA,而间质内出现纤维化,则移行细胞癌可能性大。免疫表型上,NA特异性表达PAX8但不表达p63的特点与移行细胞癌相反。(3)透明细胞腺癌虽然在输尿管发病率低,但透明细胞腺癌在光镜下可出现与NA相似的乳头状、腺管样及囊状结构,使两者的鉴别相对困难,前者肿瘤呈乳头状,细胞质透亮,核高度异型,坏死、核分裂象和广泛浸润生长非常常见。免疫表型上,PAX8、AMACR(P504s)、p63、CK34βE12等对两者鉴别帮助不大,而CEA在NA阴性,透明细胞腺癌表达CA125和CEA,因此建议用CA125和CEA区分透明细胞腺癌和NA。
3.5 治疗及预后 输尿管NA治疗主要以手术治疗为主,大量资料显示,NA无恶变倾向,手术效果良好,无需进一步治疗。考虑到其有一定复发倾向,故需长期随访,本例随访14个月,未见其复发及转移。
[1] Amin W, Parwani A V. Nephrogenic adenoma[J]. Pathol Res Pract, 2010,2016(10):659-62.
[2] Herlitz L C, Tong G X, Hamele-Bena D, Greenebaum E. Nephrogenic adenoma identified on urine cytology using PAX-2 immunos taining[J]. Diagn Cytopathol, 2008,36(1):47-49.
[3] Peeker R, Aldenborg F, Fall M. Nephrogenic adenoma-a study with special reference to clinical presentatinon[J]. Br J Urol, 1997,80(4):539-542.
[4] 秦桂萍, 华玉兰, 侯海娜. 膀胱肾源性腺瘤1例[J]. 临床与实验病理学杂志, 2012,28(3):355-351.
[5] Gordetsky J, Gennaro K H, Selph J P, Rais-Bahrami S. Nephrogenic adenoma: clinical features, management, and diagnostic pitfalls[J]. Urology, 2016,95:29-33.
[6] Diolombi M, Ross H M, Mercalli F,etal. Nephrogenic adenoma: a report of 3 unusual cases infiltrating into perinephric adipose tissue[J]. Am J Surg Pathol, 2013,37(4):532.
[7] Khedaoui R, Encabo B, Tardio J C. Fibromyxoid nephrogenic adenoma protruding in a renal cortical cyst.A rare morphological variant in an outstanding location[J]. Pathol Res Pract, 2016,212(2):135-138.
[8] 陈 铌, 陈雪芹, 徐 苗, 等. 肾源性腺瘤临床病理和免疫组化分析[J]. 临床与实验病理学杂志, 2012,28(8):883-886.
[9] Herlitz L C, Tong G X, Hamclc-Bena D,etal. Nephrogenic adenoma identified on urnie PAX-2 immunostaining[J]. Diagn Cytopathol, 2008,36(1):47-49.
[10] Quinones W, Ziober A, Yao Y,etal. Immunohistochemical marers for the differential diagnosis of nephrogenic adenomas[J]. Diagn Cytopathol, 2013,17(1):41-44.
[11] Alexiev B A, LeVea C M. Nephrogenic adenoma of the urinary tract: a revicw[J]. Int J Surg Pathol, 2012,20(2):123-131.
[12] Kuzaka B, Pudeko P, Powaa A,etal. Nephrogenic adenoma of the urinary bladder: a report of three cases and a review of the literature[J]. Ann Transplant, 2014,19:153-156.
[13] Lopez J I, Schiavo-Lena M, Corominas-Cishek A,etal. Nephrogenic adenoma of the urinary tract: clinical, histological, and immunohistochemical characteristics[J]. Vicrchow Arch, 2013,463(6):819-825.
山东省聊城市第二人民医院病理科,临清 252600
秦东瑞,男,硕士,主治医师。Tel: (0635)2342343, E-mail: qindongrui82@sina.cn 马广贞,男,副主任医师,通讯作者。E-mail: maguangzhen@163.com
时间:2017-8-20 15:27 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170820.1527.022.html
R 737.13
A
1001-7399(2017)08-0920-03
10.13315/j.cnki.cjcep.2017.08.022
接受日期:2017-02-27

