香葱灰霉病病原鉴定及其生物学特性研究
李聪丽,阳亚婕,傅本重,张志林,付应林,李国元*
(1.湖北工程学院 生命科学技术学院/特色果蔬质量安全控制湖北省重点实验室,湖北 孝感 432000;2.湖北大学 生命科学学院,湖北 武汉 430062; 3.孝感市野生动物和森林植物保护站,湖北 孝感 432000)
香葱灰霉病病原鉴定及其生物学特性研究
李聪丽1,2,阳亚婕1,傅本重1,张志林1,付应林3,李国元1*
(1.湖北工程学院 生命科学技术学院/特色果蔬质量安全控制湖北省重点实验室,湖北 孝感 432000;2.湖北大学 生命科学学院,湖北 武汉 430062; 3.孝感市野生动物和森林植物保护站,湖北 孝感 432000)
为明确香葱灰霉病病原及其生物学特性,采用单孢分离法分离香葱灰霉病病原菌,依据病原菌形态特征及rDNA-ITS序列分析结果,鉴定香葱灰霉病病原为灰葡萄孢菌(BotrytiscinereaPers.),同时对其生物学特性进行研究。结果表明:病原菌在供试的10种培养基上均能生长,最适宜培养基为PDA培养基;供试的9种碳源和11种氮源中,最利于病原菌菌丝生长的碳源为可溶性淀粉,氮源为酵母粉;在pH值为4.0~12.0条件下,病原菌都能生长,最适pH值为5.0~6.0;病原菌在4~30 ℃均能生长,适合病原菌菌丝生长的温度为15~25 ℃, 25 ℃时病原菌菌丝不仅生长快且非常浓密,温度高于30 ℃菌丝停止生长;菌丝致死温度是52 ℃(10 min)。
香葱; 灰霉病; 病原菌; 生物学特性; 灰葡萄孢菌
香葱(Alliumascalonicum),属百合科(Liliaceae)葱属(Allium)多年生宿根草本植物[1]。它是世界性香料蔬菜和调味品,全株均可食用,具有较高的营养、药用和经济价值[2-3],在我国广泛种植,具有久远栽培历史。灰霉病是葱属蔬菜常见的病害之一,在全国各地都有不同程度的发生,春冬低温多雨的季节危害更为严重,影响香葱的外观、产量和品质,危害严重时造成葱叶枯死、腐烂,导致减产或绝收。随着蔬菜保护地栽培的兴起,低温、高湿、密集、不透风的环境有利于灰霉病的侵染和危害,使其由香葱生产上的次要病害上升为主要病害。
葱属蔬菜灰霉病自1876年后陆续被澳大利亚、德国、日本等国报道[4],国内有关葱属蔬菜灰霉病的报道较少[5-7],且鲜见香葱灰霉病的报道。2016年3—5月,经过田间调查发现,孝感肖港香葱产区和湖北工程学院试验基地香葱灰霉病田间发生极严重。因此,采集病样,根据柯赫氏法则对病原菌进行分离纯化及致病性检验,采用形态鉴定和分子鉴定相结合的方法鉴定代表菌株AG-1,明确病原种类后对其生物学特性进行研究,以期增加对香葱灰霉病的了解,为科学有效地防控香葱灰霉病提供理论依据。
1 材料和方法
1.1病原菌鉴定
1.1.1 病原菌的分离 病样为孝感肖港香葱产区及湖北工程学院试验基地的香葱病叶,病原菌的分离参考Zhang等[7]的方法,并于25 ℃恒温培养72 h后,镜检,挑取所有疑似的单菌落分别接入新鲜马铃薯葡萄糖培养基(PDA)平板中培养。经4次纯化后,将所获菌株置于30%的甘油中-20 ℃保藏。
1.1.2 致病性测定 采用离体接种法测定。将新鲜健康的香葱植株采回后,用自来水冲洗干净并擦干水珠,置于铺有湿润滤纸的托盘中,取培养2 d的菌饼(直径d=6 mm)接种于经刺伤的离体叶片上,以接种琼脂块为对照。重复处理20株香葱,盖上保鲜膜,25 ℃恒温保湿培养4 d后,观察记录发病情况及病斑直径。对发病叶片再次进行病原菌分离培养,镜检观察菌落及分生孢子形态。试验重复3次。用新鲜健康的青椒、生菜、红椒、草莓、黄瓜、甘蓝、油菜、番茄、葡萄和小白菜对香葱灰霉病病原菌的寄主范围进行测定。
1.1.3 病原菌形态观测 将纯化后的菌种接种到PDA平板上,于25 ℃条件下暗培养3 d。观察记录菌落形态、颜色、产孢结构、分生孢子形态及大小等特征,参照魏景超的《真菌鉴定手册》[8]和陆家云[9]的方法进行病原菌鉴定。
1.1.4 病原菌rDNA-ITS的扩增与序列分析 根据何月秋[10]的方法提取病原菌的DNA,置于-20 ℃保存。采用通用引物ITS4和ITS5[11]扩增rDNA的ITS区。ITS4为5′-TCCTCCGCTTATTGATATGC-3′,ITS5为5′-GGAAGTAAAAGTCGTAACAAGG-3′,由上海生工生物工程股份有限公司合成。PCR扩增体系50 μL:DNA模板1 μL、ddH2O 23.6 μL、引物各0.2 μL、2×PCR Master 25 μL。PCR扩增程序:94 ℃预变性4 min;94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min,共设34个循环;最后72 ℃延伸10 min,4 ℃保存。扩增产物用1.2%的琼脂糖凝胶在100 V、90 mA的条件下进行电泳检测,并委托上海生工生物工程股份有限公司进行双向测序。
1.1.5 系统发育树的构建 将测序结果拼接后在NCBI网站上进行BLAST分析,通过与GenBank上的序列进行同源性比对,找出相似性高的序列,再利用MEGA 7软件中的Maximum Likelihood(最大似然法)构建系统发育树。
1.2病原菌生物学特性分析
1.2.1 不同培养基对香葱灰霉病病原菌生长的影响试验 设置10个处理,分别为PDA培养基、马铃薯蔗糖培养基(PSA)、清水琼脂培养基(WA)、沙氏培养基(SDA)、燕麦培养基(OA)、玉米粉培养基(CMM)、查氏培养基(CA)、高氏1号培养基、LB培养基、酵母蛋白胨葡萄糖琼脂培养基(YPGA)[12]。将培养2 d的菌饼(d=6 mm)分别接种至不同的培养基平板中央,每个处理重复4次,于恒温25 ℃暗培养3 d后,采用十字交叉法测量菌落直径,并进行统计分析[13]。
1.2.2 不同碳源对香葱灰霉病病原菌生长的影响试验 设置10个处理,分别以甘露醇、麦芽糖、葡萄糖、木糖、乳糖、D-山梨醇、可溶性淀粉、肌醇、D-半乳糖9种碳源代替CA培养基中的蔗糖,以无碳的处理作为对照(CK)[14]。将培养2 d的菌饼(d=6 mm)分别接种至不同的培养基平板中央,每个碳源处理重复4次,于恒温25 ℃暗培养4 d后,采用十字交叉法测量菌落直径,并进行统计分析。
1.2.3 不同氮源对香葱灰霉病病原菌生长的影响试验 设置12个处理,分别以硝酸铵、蛋白胨、硝酸钾、尿素、L-丙氨酸、草氨酸、L-赖氨酸、氯化铵、甘氨酸、酵母粉、硫酸铵11种氮源代替CA培养基中的硝酸钠,以无氮的处理作为对照(CK)[14]。将培养2 d的菌饼(d=6 mm)分别接种至不同的培养基平板中央,每个氮源处理重复4次,于恒温25 ℃暗培养4 d后,采用十字交叉法测量菌落直径,并进行统计分析。
1.2.4 不同温度对香葱灰霉病病原菌生长的影响试验 设置10个温度处理,分别为4、5、10、15、20、25、28、30、35、37 ℃。将培养2 d的菌饼(d=6 mm)接种到PDA平板的中央,每个处理重复4次,于不同的恒温培养箱中暗培养3 d后,采用十字交叉法测量菌落直径,并进行统计分析。
1.2.5 不同pH值对香葱灰霉病病原菌生长的影响试验 设置9个pH值处理,分别调整培养基的pH值达到4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0。将培养2 d的菌饼(d=6 mm)接种至不同pH值的PDA平板中央,每个处理重复4次,于恒温25 ℃条件下暗培养3 d后,采用十字交叉法测量菌落直径,并进行统计分析。
1.2.6 香葱灰霉病病原菌的致死温度测定 将菌饼(d=6 mm)置于装有5 mL无菌水的离心管中,将离心管分别置于40~65 ℃(温度梯度为1 ℃)的恒温水浴锅中处理10 min,迅速冷却后,接种至新鲜的PDA培养基上,以未经处理的菌丝块为对照。每个处理重复4次,试验重复3次,于恒温25 ℃条件下暗培养,每天进行观察。有菌丝生长的记作“+”,没有菌丝生长的记作“-”。
1.3数据处理与统计分析
采用Excel 2007对试验数据进行简单的统计处理,采用SPSS 19.0软件对试验数据做进一步分析。
2 结果与分析
2.1香葱灰霉病病原菌的致病性及寄主范围
2.1.1 致病性 采用刺伤接种法将分离所得菌株(编号AG-1)接至新鲜健康的香葱叶上,4 d后可观察到灰色霉层,接种发病症状(图1A)与自然条件下(图1B)一致,对照处理未发病(图1C)。从接种发病的香葱叶片上再分离得到的菌株与接种菌形态相同,依据柯赫氏法则确定接种菌为香葱灰霉病的病原菌。

A:接种香葱发病; B:香葱灰霉病症状; C:接种对照; D:病原菌在PDA平板上的菌落形态; E:分生孢子; F:分生孢子梗
图1香葱灰霉病症状及病原菌形态
2.1.2 寄主范围 香葱灰霉病病原菌对供试的蔬菜和水果均有不同程度的侵染(表1)。依据病斑直径可知,最易被侵染的寄主植物为青椒,其后依次为生菜、红椒、草莓、黄瓜、甘蓝、油菜、番茄、葡萄、小白菜;在接种总叶(果)数中,除甘蓝发病率为86%外,其余几种蔬菜和水果发病率均为100%。以上结果表明,香葱灰霉病病原菌具有非寄主专化性。
2.2香葱灰霉病病原菌的鉴定
将从香葱病叶上分离得到的病原菌菌株AG-1接种到PDA培养基上,菌丝生长迅速;菌落初为白色,后为灰白色,菌丝浓密,边缘整齐(图1D);分生孢子椭圆形或卵圆形,单孢,无色至淡褐色,表面光滑,大小为(9.2~12.3)μm×(6.8~10.0)μm(图1E);分生孢子着生在小梗上聚集成葡萄穗状,分生孢子梗单生或丛生,褐色至浅褐色,大小为(212~298)μm×(10~14)μm(图1F);菌核黑色且形状不规则。
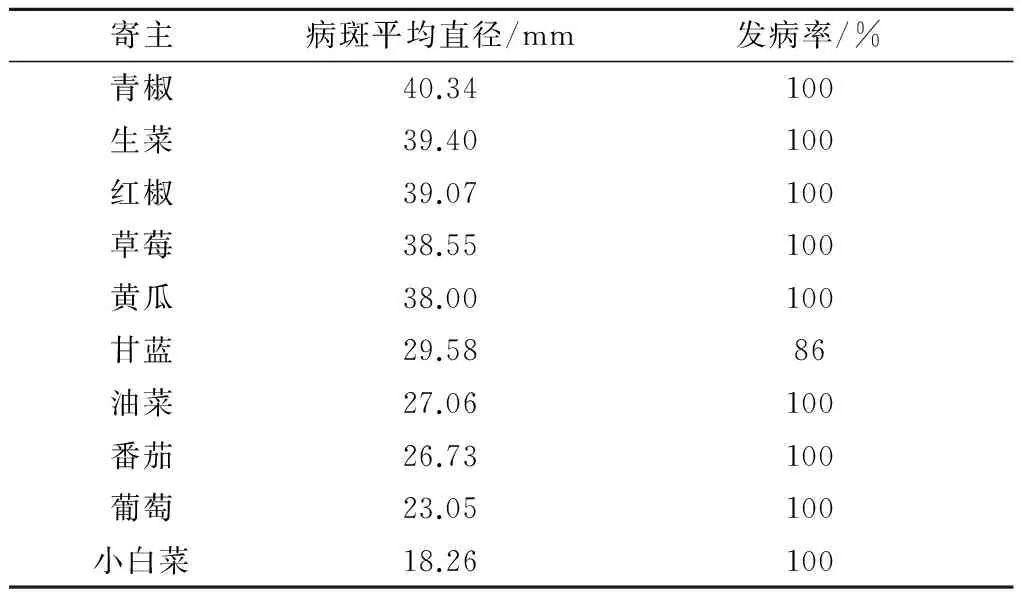
表1 香葱灰霉病病原菌致病性测定结果
注:发病率=病叶(果)数/接种总叶(果)数×100%。
将测序所得病原菌ITS区序列(567 bp)与GenBank中已知序列进行比对,选取湖北省已报道的葱属蔬菜葡萄孢属真菌进行多序列比对分析,以褐腐病菌(Moniliniafructigena)为外群,构建系统发育树(图2)。所测序列与GenBank中灰葡萄孢菌(B.cinerea)的序列(登录号KR055050.1)相似性为100%。结合病原菌的形态特征和ITS序列比对结果,确定香葱灰霉病的病原为灰葡萄孢菌(B.cinereaPers.)。
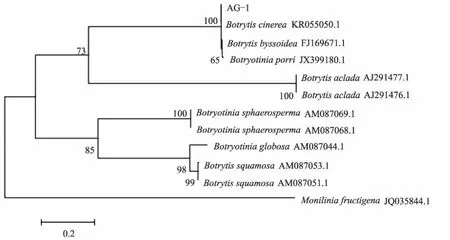
图2 香葱灰霉病菌株AG-1基于rDNA-ITS序列的系统发育树
2.3香葱灰霉病病原菌的生物学特性
2.3.1 不同培养基对香葱灰霉病病原菌菌丝生长的影响 供试的10种不同培养基对病原菌菌丝生长的影响差异显著(表2),PDA培养基和SDA培养基上病菌生长最快,菌落直径均为84.00 mm,生长速率为28.00 mm/d,但PDA培养基上菌丝密集程度高于SDA培养基;其次是PSA培养基,菌落直径可达78.79 mm,生长速率为26.26 mm/d;WA培养基最不利于菌丝的生长,菌落直径只有26.04 mm,且菌丝稀疏。
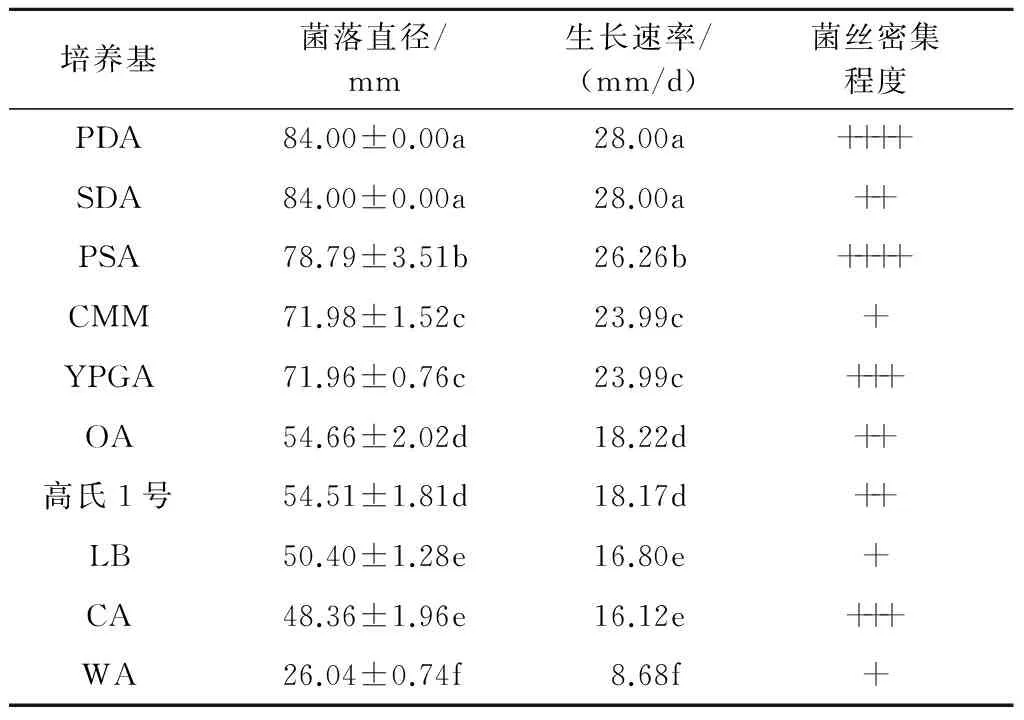
表2 不同培养基对香葱灰霉病病原菌菌丝生长的影响
注:(1)表中同列数据后面不同小写字母表示差异显著(P<0.05);(2)++++表示菌丝非常浓密,+++表示菌丝浓密,++表示菌丝比较浓密,+表示菌丝稀疏。下同。
2.3.2 不同碳源对香葱灰霉病病原菌菌丝生长的影响 香葱灰霉病病原菌对不同碳源的利用能力存在差异(表3)。病菌在含有不同碳源的9种培养基中生长状况均好于对照,说明病菌对碳源的要求不高。其在可溶性淀粉作为碳源的培养基上生长最快,菌落直径为70.53 mm,生长速率为17.63 mm/d;其次是肌醇和葡萄糖,菌落直径分别为64.28 mm和63.61 mm,生长速率依次为16.07 mm/d和15.90 mm/d;相对不利于病菌生长的碳源是D-山梨醇,菌落直径为55.44 mm,生长速率为13.86 mm/d。
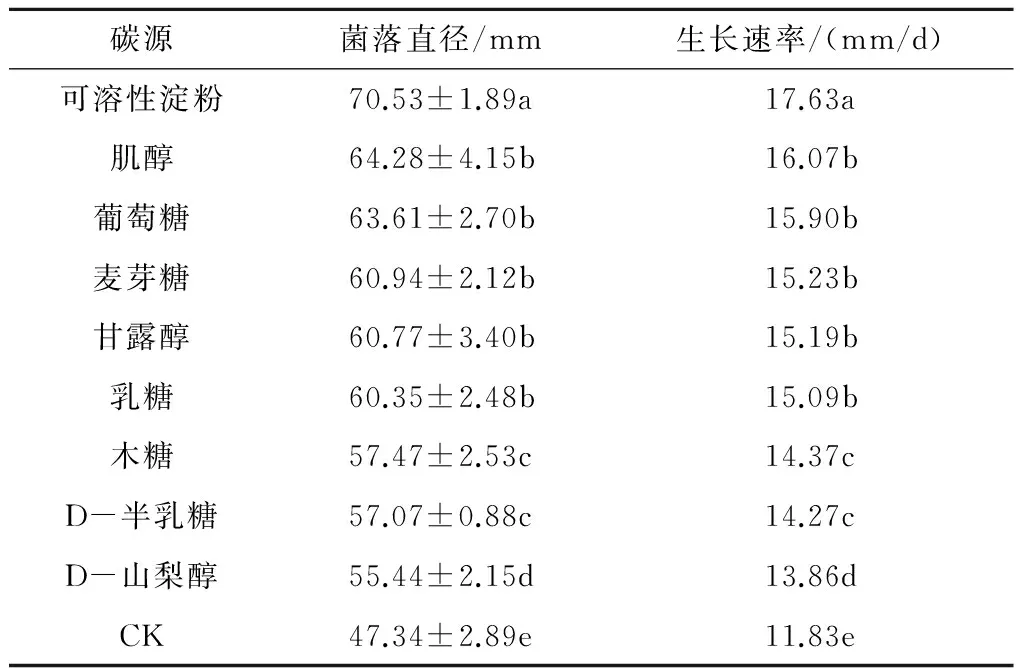
表3 不同碳源对香葱灰霉病病原菌菌丝生长的影响
2.3.3 不同氮源对香葱灰霉病病原菌菌丝生长的影响 不同氮源对香葱灰霉病病原菌菌丝生长的影响差异显著(表4)。以酵母粉作为氮源的培养基最利于病菌的生长,菌落直径为84.00 mm,生长速率为21.00 mm/d;其次是蛋白胨,菌落直径为70.91 mm,生长速率为17.73 mm/d;尿素和草氨酸不利于病菌生长,菌落直径分别为31.97 mm和30.17 mm,生长速率依次为7.99 mm/d和7.54 mm/d,与CK相比表现出明显的抑制作用。
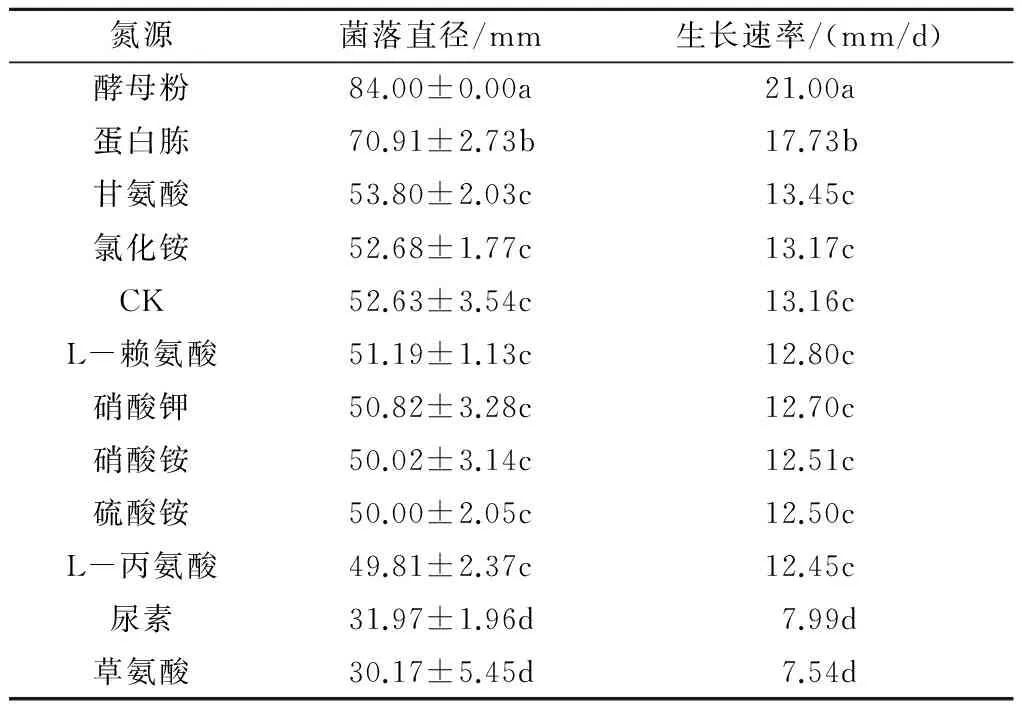
表4 不同氮源对香葱灰霉病病原菌菌丝生长的影响
2.3.4 不同温度对香葱灰霉病病原菌菌丝生长的影响 香葱灰霉病病原菌在4~30 ℃均能生长(表5)。温度在15~25 ℃时,病原菌菌丝生长最快,生长速率可达28.00 mm/d,尤其25 ℃时病原菌菌丝生长非常浓密;温度大于30 ℃时,病原菌菌丝停止生长。
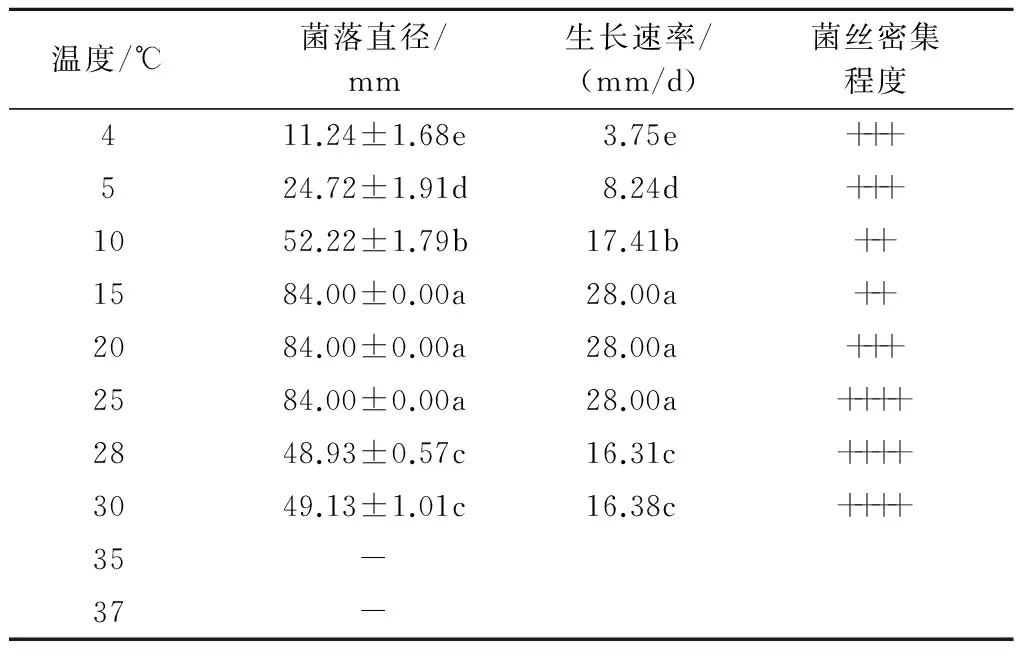
表5 不同温度对香葱灰霉病病原菌菌丝生长的影响
注:-表示菌丝不能生长。
2.3.5 不同pH值对香葱灰霉病病原菌菌丝生长的影响 在pH值为4.0~12.0条件下,病原菌都能生长(表6)。pH值为5.0~6.0时最适宜病原菌生长,菌落直径可达84.00 mm,生长速率为28.00 mm/d,且菌丝非常浓密。当pH值大于6.0时,病原菌菌落直径随pH值的增大而减小,说明偏酸的环境更有利于香葱灰霉病病原菌的生长。
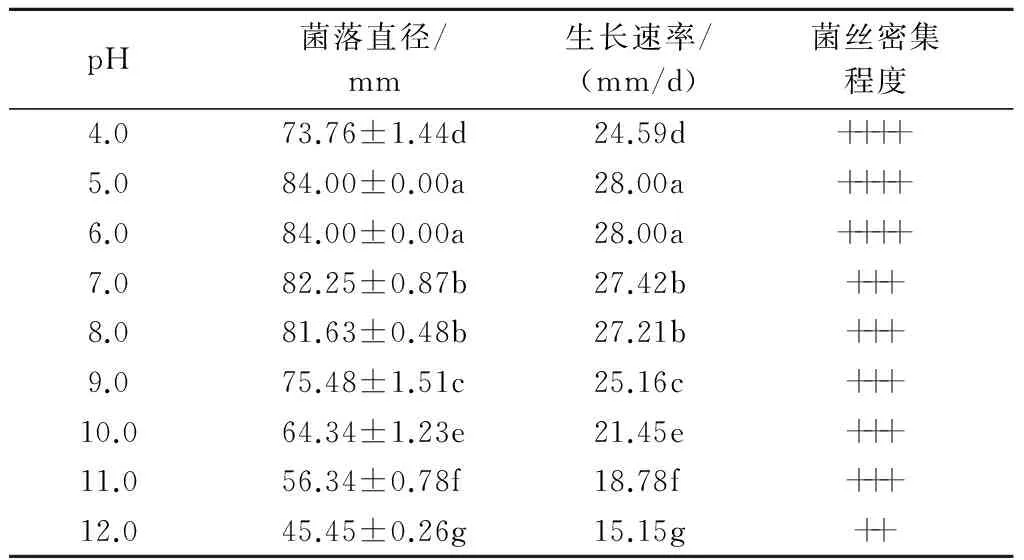
表6 不同pH值对香葱灰霉病病原菌菌丝生长的影响
2.3.6 香葱灰霉病病原菌的致死温度 病原菌经过40、41、42、43、44、45、46、47、48、49、50、51 ℃处理10 min后,接种到新鲜的PDA培养基上有菌丝生长,而52 ℃及以上温度处理后,接种至新鲜的PDA培养基上未见菌丝生长,表明52 ℃(10 min)是香葱灰霉病病原菌的致死温度。
3 结论与讨论
本研究所得的病样经分离纯化病原菌后,根据柯赫氏法则、形态特征及分子鉴定的结果,参照《真菌鉴定手册》等[8-9],确定引起孝感香葱灰霉病的病原为葡萄孢属的灰葡萄孢菌(B.cinereaPers.)。
生物学特性研究表明:病原菌在供试的10种培养基上均能生长,最适宜培养基为PDA培养基,最不适合的培养基为WA培养基;供试的碳源中最利于病原菌菌丝生长的碳源为可溶性淀粉,最不适宜的碳源为D-山梨醇;最适合病原菌菌丝生长的氮源为酵母粉,最不适合的氮源为草氨酸和尿素;在pH值为4.0~12.0条件下病原菌都能生长,最适pH值为5.0~6.0;病原菌在4~30 ℃均能生长,适合病原菌菌丝生长的温度为15~25 ℃,25 ℃时病原菌菌丝不仅生长快且非常浓密,温度大于30 ℃时,病原菌菌丝停止生长;菌丝致死温度是52 ℃(10 min)。最利于香葱灰霉病病原菌菌丝生长的pH值和温度范围与张鹏[13]报道的葡萄灰霉病菌及朱建兰[15]报道的番茄灰霉病菌基本一致,但在病原菌对培养基和碳源的利用方面,与张鹏[13]研究的葡萄灰霉病菌有差异。
致病性测定结果表明,香葱灰霉病病原菌对供试的蔬菜和水果均有不同程度的侵染,体现了病原菌的非寄主专化性。李建厂等[5]研究了陕西大葱灰霉病菌(灰葡萄孢菌)对油菜的致病性,结果表明,在室内离体接种和田间接种情况下该菌均不侵染油菜,而本研究中得出,在离体接种的条件下,香葱灰葡萄孢菌可以侵染油菜,这可能与不同环境下不同寄主上病原菌的致病力分化和遗传差异有关,具体原因有待深入研究。
目前,关于香葱的研究报道主要是栽培模式、配方施肥及一些有益化合物提取方面[16-21],有关病虫害的防治研究较少,但病害对香葱的产量和品质都有很大的影响,亟需加强研究。掌握香葱灰霉病病原、生物学特性及发病规律成为现今防治香葱灰霉病的关键,可为科学有效地防治香葱灰霉病提供理论依据。本试验鉴定了孝感香葱灰霉病的病原菌,并对其部分生物学特性进行了研究,而有关香葱灰霉病病原菌孢子的生物学特性、病害的发生规律及防治技术,以及我国其他香葱产区的病原情况是否相同,主要病原菌有哪些,还需要做进一步研究。另外,尿素、草氨酸等对香葱灰霉病病原菌有抑制作用的氮源能否在病害防治方面加以利用以及能否通过合理施肥控制该病害的发生,也有待进一步研究。
[1] 中国科学院中国植物志委员会.中国植物志(第十四卷):被子植物门单子叶植物纲百合科(1)[M].北京:科学出版社,1980:258.
[2] 国家中药学管理局《中华本草》编委会.中华本草:精选本[M].上海:上海科学技术出版社,1998.
[3] 永学林.元谋县出口香葱创汇9 480.1万元[J].云南科技管理,2010(3):96.
[4] Rφed H.Botrytis(gray mold) onAlliumcepaandAlliumascalonicumin Norway[J].Acta Agriculturae Scandinavica,1950,1(1):20-39.
[5] 李建厂,李永红,郭徐鹏,等.葱灰霉病病原菌的培养特性及其对油菜的致病性研究[J].陕西农业科学,2013,59(3):3-5.
[6] 王燕燕,薛婷,梁宁,等.蒜薹灰霉病菌的生物学特性研究[J].河南农业科学,2006(8):113-116.
[7] Zhang J,Zhang L,Li G Q,etal.Botrytissinoallii:A new species of the gray mould pathogen onAlliumcrops in China[J].Mycoscience,2010,51(6):421-431.
[8] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:257-258.
[9] 陆家云.真菌病害诊断[M].2版.北京:中国农业出版社,1997.
[10] 何月秋.真菌菌丝体培养和提取DNA方法的改进[J].菌物系统,2000,19(3):434.
[11] Ma J J,Lu B H,Wang X,etal.First report of gray mold ofSaposhnikoviadivaricatacaused byBotrytiscinereain Jilin province,China[J].Plant Disease,2015,99(11):1644-1645.
[12] 方中达.植病研究方法[M].3版.北京:中国农业出版社,1998:122-125.
[13] 张鹏.葡萄灰霉病发生规律及防治技术研究[D].北京:中国农业科学院,2011.
[14] 傅本重,杨敏,李国元,等.滇楸叶斑病病原菌的生物学特性及其抑菌药剂筛选[J].华中农业大学学报,2013,32(6):65-69.
[15] 朱建兰.番茄灰霉病菌的生物学特性研究[J].甘肃农业大学学报,1995,30(1):73-78.
[16] Francke A,Klasa A.The effect of cultivation method on the macronutrients content of shallot bulbs (AlliumascalonicumL.)[J].Vegetable Crops Research Bulletin,2009,70:163-171.
[17] 辛焱,单玉斌,薛淑文.香葱栽培技术[J].吉林蔬菜,2005(4):10.
[18] Mellawati J,Furukawa J,Tanoi K,etal.An effect of phosphate fertilizer on accumulation of Na,Mg,K and Ca in shallot plants (AlliumascalonicumL.)[J].Radioisotopes,2002,51(12):533-539.
[19] 徐晔.香葱挥发性成分的研究和香葱香精的研制[D].上海:华东理工大学,2011.
[20] Amin M,Kapadnis B P.Heat stable antimicrobial activity ofAlliumascalonicumagainst bacteria and fungi[J].Indian Journal of Experimental Biology,2005,43(8):751-754.
[21] Adeniyi B A,Anyiam F M.In vitro anti-Helicobacterpyloripotential of methanol extract ofAlliumascalonicumLinn.(Liliaceae) leaf:Susceptibility and effect on urease activity[J].Phytotherapy Research,2004,18(5):358-361.
Identification and Biological Characterization of the Pathogen ofAlliumascalonicumGray Mould
LI Congli1,2,YANG Yajie1,FU Benzhong1,ZHANG Zhilin1,FU Yinglin3,LI Guoyuan1*
(1.College of Life Science and Technology,Hubei Engineering University/Hubei Key Laboratory of Quality Control of Characteristic Fruits and Vegetables,Xiaogan 432000,China; 2.College of Life Sciences,Hubei University,Wuhan 430062,China; 3.Xiaogan Wildlife and Forest Plant Protection Station,Xiaogan 432000,China)
In order to identify the pathogen and its biological characteristics ofAlliumascalonicumgray mould,the pathogen was isolated from diseased leaves ofA.ascalonicumby single spore isolation method.Based on the morphological characteristics and rDNA-ITS sequence analysis,the pathogen ofA.ascalonicumgray mould was identified asBotrytiscinereaPers..The biological characteristics ofB.cinereawere studied,and the results showed that the pathogen was able to grow on the ten media tested,during which the optimum medium for the growth of the pathogen was PDA medium.In the nine carbon sources and eleven nitrogen sources tested,the optimum carbon and nitrogen sources were soluble starch and yeast powder respectively.The pathogen could grow in pH from 4.0 to 12.0,while the optimal pH was 5.0—6.0.The pathogen could grow at 4—30 ℃,and 15—25 ℃ was suitable for the mycelia growth.The mycelia grew quickly and very densely at 25 ℃,when the temperature was above 30 ℃,the mycelia growth stopped.The mycelia lethal temperature was 52 ℃ for 10 min.
Alliumascalonicum; gray mould; pathogen; biological characteristics;Botrytiscinerea
2017-03-16
湖北省教育厅重点项目(D20102704,D20102703);湖北省重点实验室开放基金重点项目(2016K03)
李聪丽(1991-),女,湖北麻城人,在读硕士研究生,研究方向:植物病理。 E-mail:licongli1124@163.com
*通讯作者:李国元(1964-),男,湖北孝感人,教授,主要从事植物保护方面的研究。 E-mail:lgy64662@sohu.com
S436.33
: A
: 1004-3268(2017)09-0073-06

