河南地区猪呼吸道隐性感染大肠杆菌耐药基因检测及分析
李进福,丁海峰,李小申,刘保光,苏 嘉,苑 丽
(河南农业大学,河南 郑州 450002)
河南地区猪呼吸道隐性感染大肠杆菌耐药基因检测及分析
李进福,丁海峰,李小申,刘保光,苏 嘉,苑 丽*
(河南农业大学,河南 郑州 450002)
为了解河南地区猪呼吸道隐性感染大肠杆菌对β-内酰胺类、四环素类及氟苯尼考的耐药情况及耐药基因的分布,采用微量肉汤稀释法对从河南地区猪肺脏分离的31株大肠杆菌进行青霉素、头孢吡肟、庆大霉素、多西环素、氟苯尼考等16种药物敏感性检测及耐药表型分析,采用PCR对31株受试大肠杆菌进行β-内酰胺类、四环素类、氟苯尼考耐药基因检测。药敏试验结果表明,受试菌对青霉素、氨苄西林、阿莫西林3种药物的耐药率均达到100%,对头孢噻呋、头孢噻肟、头孢吡肟的耐药率分别为29.03%、32.26%、3.23%,对四环素、多西环素的耐药率分别为83.87%、70.97%,对氟苯尼考的耐药率为48.39%,但对喹诺酮类药物(环丙沙星、恩诺沙星)、氨基糖苷类药物(庆大霉素、阿米卡星)较为敏感。耐药基因检测发现,β-内酰胺类耐药基因TEM、SHV、CTX-M-U、CTX-M-1、CTX-M-9的检出率分别为54.84%、61.29%、25.81%、9.68%、9.68%;四环素类耐药基因tet(A)、tet(M)、tet(L)的检出率分别为87.10%、54.84%、19.35%,tet(C)、tet(O)阳性菌各1株,未检出tet(B)、tet(K)、tet(W);氟苯尼考耐药基因floR检出率为54.84%。2株菌含有7种耐药基因,19株菌含有4种及以上耐药基因。可见,多种耐药基因共同介导大肠杆菌的多重耐药性已呈流行趋势。
猪; 呼吸道; 隐性感染; 大肠杆菌; 耐药基因
近年来,混合感染已成为畜牧业发展的最大障碍,特别是呼吸道疾病的混合感染,更加复杂多样化。大肠杆菌为主要的传染因子,因其血清型多样、致病力、毒力不一等特点给大肠杆菌的预防和治疗带来很大困难,且大肠杆菌可以同时感染人和动物,也可通过食物链导致人发病,给人类健康、畜牧业、食品安全造成了极大威胁[1-3]。另外,随着抗菌药物的滥用,使得大肠杆菌多重耐药情况严重,对β-内酰胺类药物、四环素类药物、氟苯尼考的耐药情况尤为明显[4-6]。大肠杆菌是一个天然的多重耐药基因库,不仅可以借助基因突变使菌株产生耐药性,而且可以通过质粒、转座子、整合子等多种移动原件将耐药基因垂直或水平传播给其他菌株,使耐药情况更加严重[7-8]。可见,了解大肠杆菌的耐药情况对有效防控大肠杆菌病具有重要意义。为此,对来自河南8个地市的猪源肺脏大肠杆菌进行分离鉴定,利用微量肉汤稀释法测定受试菌株耐药表型,采用PCR检测β-内酰胺类、四环素类、氟苯尼考等相关耐药基因,分析其耐药性,检测各耐药基因在受试大肠杆菌中的分布,分析其耐药分子机制,旨在为临床抗菌药物的合理使用提供理论依据。
1 材料和方法
1.1试验菌株
31株供试大肠杆菌于2015年5—9月从来自郑州(49份)、开封(23份)、新乡(16份)、安阳(4份)、平顶山(10份)、许昌(3份)、南阳(8份)、焦作(1份)地区猪源肺脏共计114份病料(所有病料来源猪只表观正常,但肺脏有病变)中分离。31株大肠杆菌经BD PhoenixTM-100全自动细菌鉴定仪鉴定。药敏试验质控菌株大肠杆菌ATCC25922,购自中国普通微生物菌种保存中心。
1.2试验用培养基
血平板(批号:20160311B)购自郑州博赛生物科技股份有限公司,LB肉汤(批号:150414)、LB琼脂(批号:160614)、麦康凯琼脂(批号:160610)、MHB肉汤(批号:150429)、TSB液体培养基(批号:160310)均购自北京陆桥技术有限责任公司,使用时均在保质期内。
1.3试验药品
所选药物青霉素、氨苄西林、阿莫西林、头孢噻肟、头孢噻呋、头孢吡肟、环丙沙星、恩诺沙星、四环素、多西环素、庆大霉素、阿米卡星、泰妙菌素、氟苯尼考、磷霉素、磺胺六甲氧嘧啶,均由河南牧翔药业有限公司提供,使用时均在保质期内。
1.4主要试剂
主要试剂有DL2000 DNA Marker、琼脂糖、2×TaqMasterMix酶(北京康为世纪生物技术有限公司),荧光染料溴化乙锭(上海生工生物技术服务有限公司),50×TAE(北京索莱宝生物科技有限公司)等。
1.5主要仪器
BD PhoenixTM-100全自动细菌鉴定仪(美国BD公司)、细菌比浊仪(法国Biomerieux公司)、离心机(德国Eppendorf公司)、PCR仪(美国ABI公司)、DYY-BC型电泳仪(北京市六一仪器厂)、凝胶成像系统(英国Syngene公司)等。
1.6细菌分离培养与鉴定
无菌取少量肺脏涂布于血平板培养基上,在37 ℃无菌恒温箱中孵育24 h,挑取单个菌落接种于LB肉汤中进行增菌培养,水浴摇床37 ℃培养8~12 h,然后接种于麦康凯琼脂平板上,以上操作反复3次纯化菌落。然后观察其形态特征,取单个菌落经BD PhoenixTM-100全自动细菌鉴定仪鉴定,取其中的大肠杆菌纯培养后备用。
1.7药物敏感性试验
1.7.1 药物的制备 用分析天平精密称取各种适量药物后,无菌操作用适当的溶剂配制成质量浓度为5 120 μg/mL的药液,置4 ℃冰箱中保存备用,保存期限为1个月。
1.7.2 菌液的制备 无菌环境下挑取少量保存的细菌,接种到LB肉汤中,37 ℃、210 r/min摇床中振摇过夜培养,经麦氏比浊管测定菌液浊度为109cfu/mL备用。以大肠埃希氏菌ATCC25922为药敏试验的质控菌,试验时受试菌菌悬液浓度为5×105cfu/mL。
1.7.3 最小抑菌浓度(MIC)的测定 采用CLSI(2015)推荐的微量肉汤稀释法。采用相同方法分别将每株细菌每种药物重复3次,观察并记录结果,按CLSI(2015)标准进行判定。
1.8耐药基因PCR扩增
1.8.1 模板的制备 采用煮沸裂解法制备31株大肠杆菌受试菌株的DNA模板,放入-20 ℃保存备用。
1.8.2 引物设计 根据GenBank公布的基因序列,利用Primer Premier 6.0软件设计相关引物,引物序列见表1。引物由上海生工生物技术服务有限公司合成。

表1 相关耐药基因引物序列
注:引物序列中Y=C或者T。
1.8.3 PCR扩增 PCR反应体系20 μL:模板1 μL,上、下游引物(20 μmol/L)各 1 μL, 2×TaqMasterMix 10 μL,无菌去离子水7 μL。PCR反应退火温度详见表1。
PCR产物经1.0%琼脂糖凝胶电泳,溴化乙锭染色,紫外投射仪下观察结果并用凝胶成像系统摄像。阳性PCR产物送往上海生工生物技术服务有限公司进行测序,测序结果应用DNAStar软件进行分析,并应用在线软件http://blast.ncbi.nlm.nih.gov/Blast进行比对,确定基因亚型。
2 结果与分析
2.1药物敏感性试验测定结果
由表2可知,大肠杆菌对青霉素、氨苄西林、阿莫西林的耐药率均为100%,对头孢噻呋、头孢噻肟、头孢吡肟的耐药率分别为29.03%、32.26%、3.23%,对四环素、多西环素耐药率分别为83.87%、70.97%,对氟苯尼考耐药率为48.39%,但对喹诺酮类药物环丙沙星、恩诺沙星,氨基糖苷类药物阿米卡星、庆大霉素较为敏感。
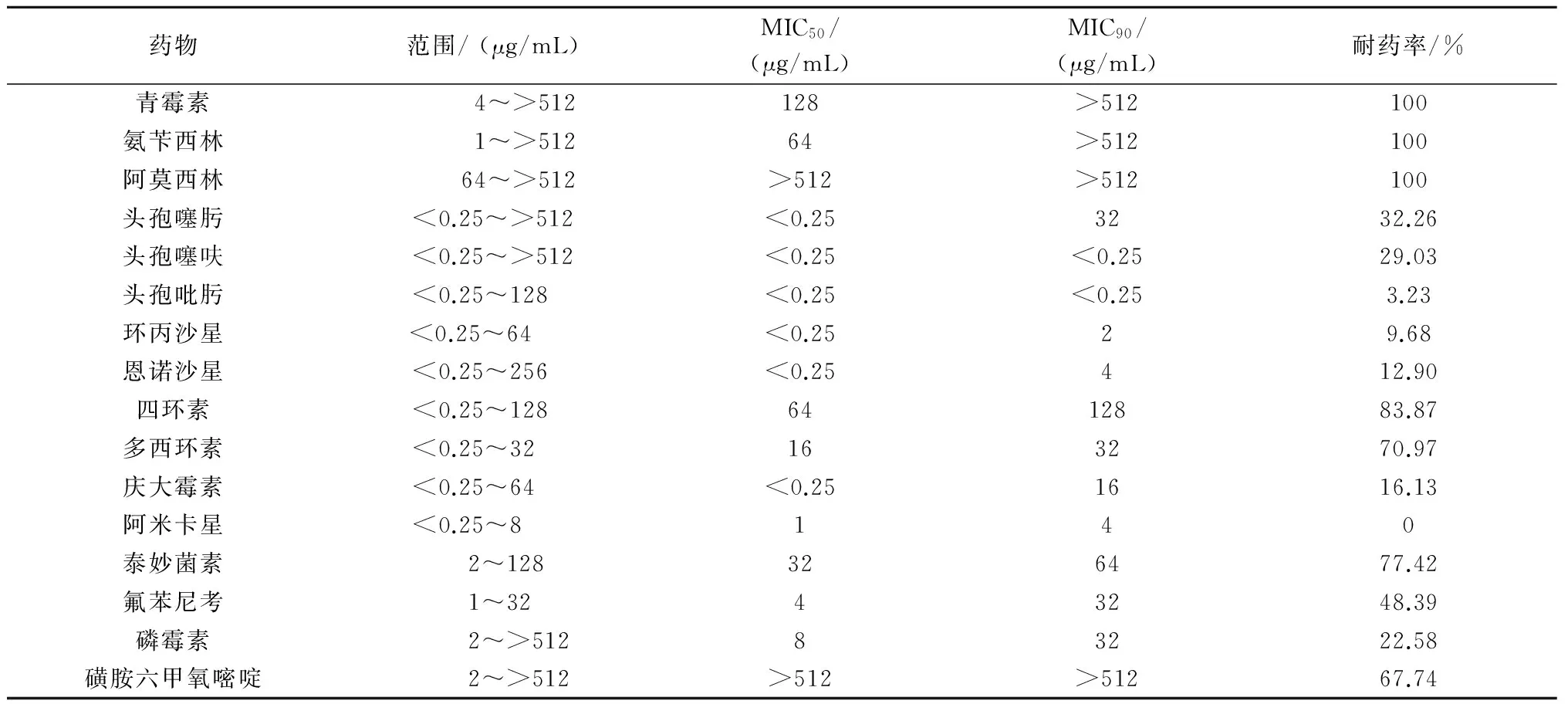
表2 大肠杆菌对不同抗菌药物的药敏试验结果
2.2耐药基因的检测结果
2.2.1 β-内酰胺类药物耐药基因 图1为TEM基因的扩增结果。检测结果显示,TEM、SHV、CTX-M-U检出率分别为54.84%、61.29%、25.81%,其中,属于CTX-M-1亚群、CTX-M-9亚群的大肠杆菌各3株,占9.68%。
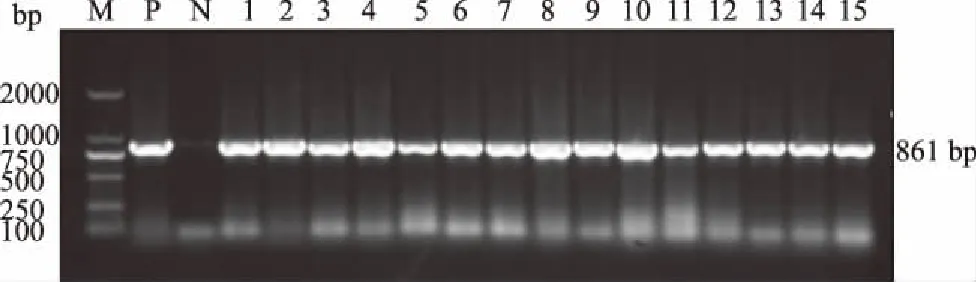
M:DL2000 DNA Marker; P:阳性对照; N:阴性对照; 1—15:部分供试大肠杆菌图1 大肠杆菌TEM基因的扩增结果
2.2.2 四环素类耐药基因 图2为tet(M)基因的扩增结果。检测结果显示,27株供试大肠杆菌四环素耐药基因tet(A)阳性,检出率为87.10%;tet(C)与tet(O)阳性菌均检测出1株;17株tet(M)阳性,阳性率为54.84%,且17株tet(M)阳性菌株中有16株同时也携带有tet(A);6株tet(L)耐药基因呈阳性,检出率为19.35%;另外,tet(B)、tet(K)、tet(W)检测阴性。
2.2.3 氟苯尼考耐药基因 图3为floR基因的扩增结果。检测结果显示,17株供试大肠杆菌floR基因阳性,检出率为54.84%。

M:DL2000 DNA Marker; P.阳性对照; N.阴性对照; 1—15:部分供试大肠杆菌图2 大肠杆菌tet(M)基因的扩增结果
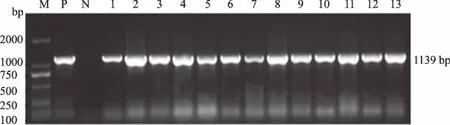
M:DL2000 DNA Marker; P.阳性对照; N.阴性对照; 1—13:部分供试大肠杆菌图3 大肠杆菌floR基因的扩增结果
耐药基因检测结果表明,含有2种耐药基因的菌株有30株,占受试菌株的96.77%,2株受试大肠杆菌含有7种耐药基因,19株受试大肠杆菌含有4种及以上耐药基因。
3 结论与讨论
本试验中分离菌株对青霉素、氨苄西林及阿莫西林耐药率达到100%,对头孢噻肟、头孢噻呋的耐药率分别为32.26%、29.03%,对第4代头孢菌素头孢吡肟耐药率仅为3.23%;对耐药基因进行检测发现,31株猪源肺脏大肠杆菌TEM检出率为54.84%,SHV检出率为61.29%,CTX-M-U检率为25.81%,其中属于CTX-M-1亚群与CTX-M-9亚群的菌株均占9.68%。田国宝等[9]报道,602株大肠杆菌分离株对氨苄西林耐药率为88.37%,头孢噻呋耐药率为11.63 %;耐药基因检测发现,35株CTX-M阳性,占比5.81%,且检测出的CTX-M均为CTX-M-1亚群,20株SHV阳性,占比3.32%,53株菌TEM阳性,占比8.80%。整体上,其耐药基因检出率低于本试验中的检出率。另外,本试验受试菌株对β-内酰胺类药物的耐药情况也明显高于张济培等[10]于广东地区分离的大肠杆菌对β-内酰胺类药物的耐药结果。本试验受试菌株对头孢噻肟的耐药率与史秋梅等[11]的检测结果相似。以上结果表明,本试验中,31株受试大肠杆菌对β-内酰胺类药物的耐药情况检测结果与其他来源大肠杆菌流行情况一致,且呈一定上升趋势,但区域间流行情况略有不同。
药敏试验结果显示,分离大肠杆菌对四环素和多西环素的耐药率分别为83.87%、70.97%,可能与四环素类药物的大量使用有关。此外,根据相关文献[12]报道,推测本试验中分离菌株耐药基因可能位于可移动原件转座子及质粒上,这也为其高度耐药起到了决定性作用。tet(A)检出率达到87.10%,与Schwaiger等[13]的检测结果(90.13%)接近;本试验中,tet(M)检出率为54.84%,且17株tet(M)阳性菌株中有16株同时也携带有tet(A),其原因可能为tet(M)位于可结合的转座子上,而可结合的转座子又可以转座多个四环素耐药基因[14]。
前人研究表明,大肠杆菌floR耐药基因存在于可结合质粒上,便于其水平传播,且floR耐药基因位于大肠杆菌染色体上,可以通过基因盒传递其耐药表型[15-18]。本试验中分离大肠杆菌氟苯尼考耐药基因floR检出率为54.84%。可能是由于氟苯尼考药物长期添加于饲料中造成的。
[1] 李红丽,詹丽娥,王彩先,等.山西省猪致病性大肠杆菌血清型调查及耐药性监测[J].山西农业科学,2012,40(11):1226-1330.
[2] 毛福超,郁川,韩璐,等.豫西地区禽源大肠杆菌的分离鉴定与耐药性分析[J].河南农业科学,2016,45(1):127-130.
[3] 梁乔,赵凤菊,顾贵波,等.辽宁地区猪源大肠埃希菌氨基糖苷类抗生素耐药基因的检测与分析[J].河南农业科学,2017,46(6):134-137.
[4] 司红彬,吴永继,黄丽云,等.黄柏与抗菌药联合抗耐药大肠杆菌的作用研究[J].河南农业科学,2015,44(2):123-126.
[5] 孙硕,吕世明,谭艾娟,等.适应度代价对大肠杆菌药物敏感性恢复的作用[J].天津农业科学,2016,22(4):33-35.
[6] 赵凤菊,曹东,李井春,等.猪源大肠埃希菌超广谱β-内酰胺酶的检测及其耐药性分析[J].河南农业科学,2017,46(2):111-115.
[7] 曾芸,贾永起.猪繁殖障碍与呼吸道综合征病毒和大肠杆菌的混合感染[J].中国畜牧兽医,2007,34(5):102-103.
[8] 朱志刚.一起猪传染性胸膜肺炎与大肠杆菌混合感染的诊治[J].山东畜牧兽医,2015,36(7):44.
[9] 田国宝,王红宁,张安云,等.规模化猪场大肠杆菌β-内酰胺类药物耐药性检测及其超广谱β-内酰胺酶调查[J].中国预防兽医学报,2011,33(10):776-780.
[10]张济培,谭华龙,韦庆兰,等.广东地区水禽源大肠杆菌对β-内酰胺类药物的耐药性及耐药基因检测[J].中国畜牧兽医,2015,42(9):2487-2492.
[11]史秋梅,项方,郭蕊,等.猪源大肠杆菌tem耐药基因的检测[J].黑龙江畜牧兽医,2016(16):106-108.
[12]Kim T E,Jeong Y W,Cho S H,etal.Chronological study of antibiotic resistances and rheir relevant genes in Korean Avian pathogenicEscherichiacoliisolates[J].Journal of Clinical Microbiology,2007,45(10):3309-3315.
[13]Schwaiger K,Hölzel C,Bauer J.Resistance gene patterns of tetracycline resistantEscherichiacoliof human and porcine origin[J].Veterinary Microbiology,2010,142(3/4):329-336.
[14]Jones C H,Tuckman M,Murphy E,etal.Identification and sequence of atet(M) tetracycline resistance determinant homologue in clinical isolates ofEscherichiacoli[J].Journal of Bacteriology,2006,188(20):7151-7164.
[15]代敏,王雄清,殷桂兰.四环素耐药基因的生化和遗传机制研究进展[J].绵阳师范学院学报,2006,25(5):72-78.
[16]Doublet B,Schwarz S,Nuβbeck E,etal.Molecular analysis of chromosomally florfenicol-resistantEscherichiacoliisolates from France and Germany[J].Journal of Antimicrobial Chemotherapy,2002,49(1):49-54.
[17]Bolton L F,Kelley L C,Lee M D,etal.Detection of multidrug-resistantSalmonellaentericaserotype typhimurium DT104 based on a gene which confers cross-resistance to florfenicol and chloramphenicol[J].Journal of Clinical Microbiology,1999,37(5):1348-1351.
[18]陈阳阳.猪源大肠杆菌对氟苯尼考的耐药性分析及其floR基因研究[D].长春:吉林农业大学,2014.
Detection and Analysis ofEscherichiacoliResistance Gene in Recessive Infection of Pigs in Henan Province
LI Jinfu,DING Haifeng,LI Xiaoshen,LIU Baoguang,SU Jia,YUAN Li*
(Henan Agricultural University,Zhengzhou 450002,China)
In order to understand the distribution of the resistance gene and drug resistance to β-lactam antibiotics,Tetracycline antibiotics and Florfenicol of the pig silent infection pathogenic bacteria in the respiratory tract in Henan province,the mircrobroth dilution method was adopted to analyze the drug resistance phenotypes and the drug susceptibility to 16 kinds of drugs such as Penicillin,Cefepime,Gentamycin,Doxycycline and Florfenicol of 31 stains ofEscherichiacoliisolated from the pig lungs in Henan province,and the PCR was adopted to analyze the drug resistance genes to β-lactam antibiotics,Tetracycline antibiotics and Florfenicol of 31 strains ofEscherichiacoli.The results showed that the drug resistance rates of the tested bacteria to Penicillin,Ampicillin and Amoxicillin were 100%,the drug resistance rates of the tested bacteria to Ceftiofur Cefotaxime and Cefepime respectively were 29.03%,32.26% and 3.23%,the drug resistance rates of the tested bacteria to Tetracycline and Doxycycline respectively were 83.87% and 70.97%,and the drug resistance rates of the tested bacteria to Florfenicol was 48.39%. The tested bacteria were more sensitive to Quinolones,such as Ciprofloxacin and Enrofloxacin,and Aminoglycosides,such as Gentamycin and Amikacin. The detection rate of β-lactam antibiotics resistance gene such as TEM,SHV,CTX-M-U,CTX-M-1 and CTX-M-9 respectively were 54.84%,61.29%,25.81%,9.68% and 9.68%,the detection rate of Tetracycline antibiotics resistance gene such astet(A),tet(M) andtet(L) were respectively 87.10%,54.84% and 19.35%,the positive bacteria oftet(C) andtet(O) are all detected one strain,tet(B),tet(K) andtet(W) were not detected,and the detection rate of Florfenicol resistance gene(floR) was 54.84%.Two strains of bacteria had seven resistance genes and 19 strains had four or more resistant genes.It can be seen that multiple drug resistance genes co-mediated the multidrug resistance ofEscherichiacolihad become a popular trend.
porcine; respiratory tract; recessive infection;Escherichiacoli; resistance gene
2017-04-10
国家自然科学基金项目(31201965)
李进福(1989-),男,河南鹤壁人,在读硕士研究生,研究方向:药理学与临床医学。 E-mail:lijinfu4550@163.com
*通讯作者:苑 丽(1973-),女,河南新乡人,副教授,博士,主要从事药理学与毒理学及细菌耐药分子机制的研究。 E-mail:liyuanhn03@henau.edu.cn
S855.1
: A
: 1004-3268(2017)09-0144-05

