白介素-17对人宫颈腺癌细胞株HeLa体外增殖的影响
邓康丽,葛利本,陈玉丙,闫文星,吴达军
(1.三六三医院体部伽马刀治疗中心,四川 成都 610041;2.吉林省人民医院放疗科,吉林 长春 130021;3.吉林大学第二医院放疗科,吉林 长春 130041)
白介素-17对人宫颈腺癌细胞株HeLa体外增殖的影响
邓康丽1,葛利本2,陈玉丙3,闫文星3,吴达军1
(1.三六三医院体部伽马刀治疗中心,四川 成都 610041;2.吉林省人民医院放疗科,吉林 长春 130021;3.吉林大学第二医院放疗科,吉林 长春 130041)
目的观察IL-17对人宫颈腺癌细胞株HeLa细胞体外增殖的影响,并探讨可能的机制。方法分别采用0、1、10 、50 、100 ng/ml的rIL-17刺激人宫颈腺癌HeLa细胞24小时,MTT法检测细胞增殖情况,根据筛选出的浓度进行后续实验。用rIL-17(0、50、100 ng/ml)刺激经饥饿诱导凋亡的细胞24小时,FCM法检测细胞凋亡情况;用rIL-17刺激细胞48小时,检测促血管生成因子VEGF mRNA和蛋白的表达量。结果rIL-17刺激细胞一定时间后,1、10及100 ng/ml浓度组细胞增殖无明显变化,50 ng/ml组细胞增殖明显增加(P< 0.01);50 ng/ml组细胞的晚期凋亡率和总凋亡率较正常对照组均明显下降(P< 0.01;P< 0.05),100 ng/ml组细胞下降更为显著(P< 0.01);50 ng/ml和100 ng/ml两组细胞内VEGF mRNA和蛋白的表达量均升高,以50 ng/ml组最为明显(P< 0.05)。结论IL-17可能通过抑制细胞凋亡及上调VEGF mRNA和蛋白水平的表达促进宫颈腺癌HeLa细胞体外增殖。
白细胞介素-17;宫颈肿瘤;细胞增殖;血管内皮生长因子
宫颈癌是全球女性第二大常见且死亡率极高的恶性肿瘤,每年有超过27万人死于宫颈癌[1]。其中,宫颈腺癌约占宫颈癌总数的15%,预后较差,发病率稳中有升,尤其在年轻女性[2]。其具有与鳞癌不同的生长模式、分子基础和放化疗敏感性[3],影响疾病的进展及预后。因此,发现新的疾病监测指标和找到新的治疗策略迫在眉睫。
白细胞介素17(IL-17)是1993年发现的一种功能强大的炎症因子,参与机体特异和非特异性免疫。研究表明其在多种恶性肿瘤中过表达。但在癌症中的作用及内在机制尚未完全阐明[4],其发挥促瘤还是抑瘤作用,尚有争议[4,5]。HPV病毒感染是宫颈癌最重要的致病因素,尤其是HPV-16/18基因型[6,7],但只有少数HPV感染导致持续病变或进展为恶性肿瘤,这意味着必定存在其他因素参与其发病机制[8]。目前研究认为炎症在肿瘤进展中起重要作用[5]。国内外关于IL-17与宫颈癌关系的报道甚少,尚未证实其是否可以促进宫颈癌细胞的增殖。本文通过体外实验,观察IL-17对宫颈腺癌HeLa细胞增殖的影响,探讨其可能的内在机制,为IL-17在宫颈腺癌的研究提供实验基础。
1 材料与方法
1.1主要材料及仪器人宫颈腺癌细胞株HeLa由吉林大学中日联谊医院唐敖庆特聘教授实验室惠赠;重组人白细胞介素17(rIL-17)购自美国Peprotech公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)一抗、山羊抗兔二抗、山羊抗鼠二抗、β-Actin一抗购自美国ABGENT公司;流式细胞仪购自美国Sigma公司;RT-PCR 扩增仪购自美国ABI公司。
1.2方法
1.2.1细胞培养 用10%FBS的高糖DMEM培养基培养细胞,于5% CO2,37 ℃的培养箱中静置培养。 实验前一天换液,每个实验重复三次。
1.2.2MTT实验检测HeLa细胞增殖情况 选对数生长期细胞,制成单细胞悬液,按每孔4×103个细胞200 μl培养液的浓度接种于96孔板,按rIL-17的浓度设5个组:0 (空白对照组)、1、10、50、100 ng/ml,每组设5个复孔。次日用不同浓度的rIL-17低血清培养液(含2% FBS的DMEM)200 μl继续培养24 h,取出96孔板,每孔加入20 μl无菌MTT(5 mg/ml)孵育4 h,吸弃孔板内的培养液,每孔中加入150 μl DMSO,在室温下震荡10 min,用酶标仪测定490 nm波长处每孔的吸光度值(OD),根据吸光度值,计算细胞相对增殖率(RGR),RGR=(实验组OD值均值/空白对照组OD均值)×100%。
1.2.3FCM法检测HeLa细胞凋亡情况 将细胞按每孔2.5 ml培养液中含2×105个细胞接种于6孔板,根据MTT实验结果筛选的IL-17刺激浓度,设3个实验组(空白对照组、50 ng/ml rIL-17组、100 ng/ml rIL-17组)及3个调试组。调试组用于上机检测前调试仪器,由3组正常细胞组成。次日,用含相应浓度rIL-17的无血清培养液2.5 ml饥饿培养24 h。分别收集各组细胞,1 h内完成上机检测。
1.2.4RT-PCR法检测HeLa 细胞VEGF mRNA表达 将细胞按每孔2.5 ml培养液中含1×105个细胞接种于6孔板中,同前设3个组,次日用不同浓度的rIL-17低血清培养液2.5 ml培养细胞48 h,分组收集细胞,提取细胞总RNA,将总RNA电泳和测定浓度后,用RT-PCR法扩增目的基因片段。逆转录条件:37 ℃反应1 h,将逆转录的cDNA作为模板,PCR扩增获得目的基因片段,人VEGF-A基因上游引物序列:ATGACGAGGGCCTGGAGTGTG,下游引物序列:CCTATGTGCTGGCCTTGGTGAG,产物91 bp;人 GAPDH(内参)基因上游引物序列:TGTTGCCATCAATGACCCCTT,下游引物序列:CTCCACGACGTACTCAGCG,产物202 bp。PCR扩增条件:94 ℃预变性2 min;94 ℃变性30 s、58 ℃退火30 s,72 ℃延伸30 s,共30个循环;最后72 ℃延伸7 min。PCR结束后,取产物电泳检测,电泳结束,用BIO-RAD凝胶成像分析仪照相及Quantity One软件进行灰度分析,VEGF mRNA的表达量=VEGF条带灰度值/GADPH(内参)条带灰度值。
1.2.5Western blot法检测HeLa细胞VEGF蛋白的表达 将细胞按每孔2.5 ml培养液中含2×105个细胞的密度接种至6孔板,同前设3个组。次日用相应浓度的rIL-17低血清培养液2.5 ml继续培养细胞48 h,分别收集各组细胞,采用反复冻融的方法提取细胞总蛋白,蛋白定量后,行SDS-PAGE分离蛋白,并将蛋白转移至聚偏氟乙烯(PVDF)膜上,4 ℃封闭过夜后,根据蛋白Marker的指示,剪下目的条带及β-actin内参条带所在的膜并标记膜的正反面,目的条带加入一抗兔抗人VEGF多克隆抗体(1:250稀释),摇床上37 ℃孵育2.5 h后,加入二抗辣根过氧化物酶(HPR)标记山羊抗兔多克隆抗体(1:2000 稀释),摇床上37 ℃孵育2 h,以β-actin作为对照,β-actin内参条带加入内参蛋白一抗(1:2000 稀释),摇床上37 ℃孵育2.5 h后,加入二抗HRP标记山羊抗鼠多克隆抗体(1:2000 稀释),37 ℃孵育2 h,最后采用ECL显色,通过Quantitiy One灰度分析软件进行分析,VEGF蛋白量= VEGF 条带灰度值/β-actin(内参)条带灰度。
1.3统计学方法数据采用SPSS 12.0软件进行统计学分析。计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两两均数间比较采用LSD-t检验;计数资料采用卡方检验。P< 0.05为差异有统计学意义。
2 结果
2.1MTT实验检测HeLa细胞增殖情况实验组OD值均大于正常对照组,RGR均大于100%,其中50 ng/ml组OD值及RGR显著高于正常对照组,差异有统计学意义(P< 0.01),其它浓度对细胞的增殖影响不显著(P> 0.05),见表1。根据实验结果,并结合IL-17在其他瘤种的研究情况,选择50、100 ng/ml两个浓度组完成后续实验。

表1 MTT法测定不同浓度rIL-17刺激24 h后HeLa细胞的增殖情况
与空白对照组相比,*P< 0.01
2.2FCM法检测HeLa细胞凋亡情况50、100 ng/ml组细胞晚期凋亡率及总凋亡率均明显低于对照组,差异有统计学意义,50、100 ng/ml组的早期凋亡率,相比于对照组,差异均无统计学意义(表2,图1)。
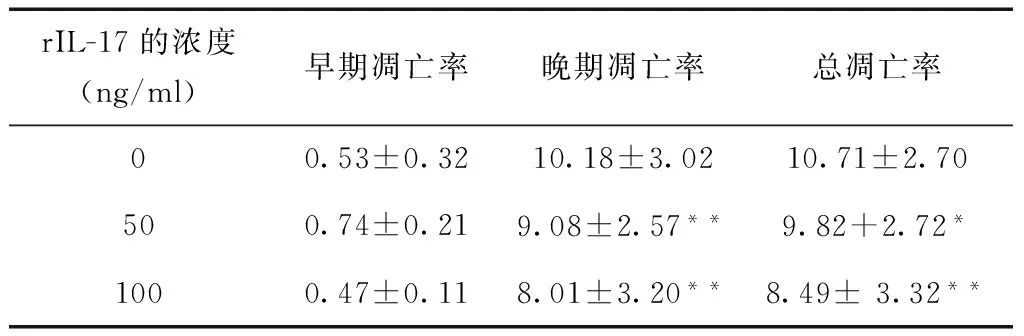
表2 FCM 法检测rIL-17 刺激24 h后HeLa细胞的凋亡情况 (%)
与空白对照组相比,*P< 0.05,**P< 0.01
2.3VEGFmRNA和蛋白的表达情况实验组中细胞VEGF mRNA(表3,图2a)及蛋白的表达量(表4,图2b)均高于对照组,以50 ng/ml 组最为明显,差异有统计学意义(P< 0.05)。

表3 rIL-17处理48 hVEGF的表达情况
与空白对照组比较,*P< 0.05

图1 流式细胞仪测定rIL-17刺激 24 h后HeLa细胞凋亡情况

图2 VEGFmRNA和蛋白的表达水平 a:RT-PCR检测mRNA表达;b:Western blot法检测蛋白表达 (1:空白对照组;2:50 ng/ml rIL-17组;3:100 ng/ml rIL-17组)
3 讨论
大量研究证明炎症在肿瘤进展中起重要作用[5],而IL-17作为功能强大的炎症因子,在肿瘤的进展中扮演着重要角色[9]。但关于IL-17与宫颈癌的关系,国内外文献报道较少。1999年,Tartour 等[8]用IL-17cDNA转染宫颈癌HeLa细胞再移植到裸鼠体内,发现肿瘤显著地生长。Vidal 等[10]检测宫颈癌标本发现,相比于感染其它基因型,IL-17在感染HPV-16/18的宫颈癌组织中高表达。近年研究认为[11],IL-17和其它细胞因子如转化生长因子β(TGF-β),IL-6,IL-23一起促进Th17/Treg比值失衡,并通过影响Th17/Treg失衡促进宫颈癌的发生发展。Zhang 等[12]研究同样发现Th17/Treg失衡可能参与宫颈癌的发展进程。但该研究并未阐明IL-17在此过程中的作用。Punt[13]在宫颈鳞癌的研究中发现IL-17的增高与疾病的不良预后显著相关,而Th17细胞与宫颈鳞癌患者生存改善密切相关。国内文献表明宫颈癌患者血清中IL-17的水平较健康对照组明显升高,IL-17水平与肿瘤分化程度呈负相关,与疾病分期成正相关[14]。HPV阳性宫颈癌患者血清中IL-17的含量比阴性患者明显增高[15]。近年的研究更多集中在Th17细胞(IL-17的主要来源)。对于IL-17是否参与宫颈癌尤其是感染高危型HPV腺癌的发病机制还不清楚。
实验中,MTT实验结果发现各浓度组IL-17均可以促进宫颈腺癌细胞的生长。然而,细胞表现为净生长的结果与凋亡关系密切,考虑OD值反应的是活细胞的数量,所以根据MTT实验结果,我们筛选出50、100 ng/ml 两种浓度检测IL-17对细胞凋亡的影响,结果发现,两种浓度均可明显抑制细胞凋亡,并呈剂量依赖,提示IL-17可以促进细胞增殖和抑制细胞凋亡,与国外的多数研究结果一致。
对于IL-17如何促进肿瘤进展,研究认为,IL-17可以通过上调IL-6的表达促进宫颈癌细胞生长[8]。IL-17也可通过IL-17-MMP7信号轴促进前列腺癌的发展,并且该信号轴是前列腺上皮内瘤变进展到前列腺癌所必需的[16]。Wang等[17]的研究证实,IL-17可直接刺激肿瘤细胞分泌IL-6,上调促血管生成因子VEGF的表达而促进肿瘤生长。在结肠癌组织中,VEGF及其受体水平升高和微血管密度的变化,与IL-17和IL-17RA(IL-17A的受体)水平升高密切相关,外源性IL-17可以刺激多种结直肠癌细胞株上调VEGF mRNA和蛋白的表达,并呈浓度依赖,表明IL-17可能是通过上调VEGF表达促进肿瘤血管生成进而促进结直肠癌的演进[18,19]。VEGF是现阶段发现的效果最强的促血管生成因子,在启动及调节各种肿瘤新生血管形成过程中起关键性作用,该种促血管生成因子的表达水平反映了肿瘤血管内皮细胞增殖、迁移和肿瘤内血管构建的水平,可直接反映肿瘤的生长速度和转移倾向,故我们选择观察VEGF的表达情况,以便更直观的了解IL-17与宫颈癌细胞增殖的关系。实验发现,经IL-17刺激48小时后,50 、100 ng/ml两个浓度组细胞VEGF mRNA和蛋白水平的表达量均增高,以50 ng/ml组作用最为明显(P< 0.05)。这与文献报道的IL-17在结肠癌、鼠黑色素瘤等中的研究结果一致。
综上,IL-17可能通过抑制细胞凋亡、上调VEGF mRNA和蛋白水平的表达的方式,间接促进宫颈腺癌HeLa细胞的体外增殖。我们推测感染高危型HPV的宫颈腺癌,IL-17在其疾病进展中起重要作用,IL-17可能通过抑制肿瘤细胞凋亡及促进肿瘤血管生成的方式促进肿瘤进展。但是IL-17能否作为预测宫颈腺癌进展的良好指标,以及是否可以通过抗IL-17靶向治疗宫颈腺癌,还需要大量的基础及临床研究。
[1] Yang B,Lu Y,Zhang A,et al.Doxycycline Induces Apoptosis and Inhibits Proliferation and Invasion of Human Cervical Carcinoma Stem Cells[J].PLoS One,2015,10(6):e0129138.
[2] Punt S,van Vliet ME,Spaans VM,et al.FoxP3(+) and IL-17(+) cells are correlated with improved prognosis in cervical adenocarcinoma[J].Cancer Immunol Immunother,2015,64(6):745-753.
[3] Gien LT,Beauchemin MC,Thomas G.A denocarcinoma:a unique cervical cancer[J].Gynecol Oncol,2010,116(1):140-146.
[4] Hayata K,Iwahashi M,Ojima T,et al.Inhibition of IL-17A in tumor microenvironment augments cytotoxicity of tumor-infiltrating lymphocytes in tumor-bearing mice[J].PLoS One,2013,8(1):e53131.
[5] Parajuli P,Mittal S.Role of IL-17 in glioma progression[J].J Spine Neurosurg,2013,Suppl 1:S1-004.
[6] Meloni A,Pilia R,Campagna M,et al.Prevalence and molecular epidemiology of human papillomavirus infection in italian women with cervical cytological abnormalities[J].J Public Health Res,2014,3(1):157.
[7] Bateman AC,Katundu K,Polepole P,et al.Identification of human papillomaviruses from formalin-fixed,paraffin-embedded pre-cancer and invasive cervical cancer specimens in Zambia:a cross-sectional study[J].Virol J,2015,12:2.
[8] Tartour E,Fossiez F,Joyeux I,et al.Interleukin 17,a T-cell-derived cytokine,promotes tumorigenicity of human cervical tumors in nude mice[J].Cancer Res,1999,59(15):3698-3704.
[9] Kuang DM,Zhao Q,Wu Y,et al.Peritumoral neutrophils link inflammatory response to disease progression by fostering angiogenesis in hepatocellular carcinoma[J].J Hepatol,2011,54(5):948-955.
[10]Vidal AC,Skaar D,Maguire R,et al.IL-10,IL-15,IL-17,and GMCSF levels in cervical cancer tissue of Tanzanian women infected with HPV16/18 vs.non-HPV16/18 genotypes[J].Infect Agent Cancer,2015,10:10.
[11]Chen Z,Ding J,Pang N,et al.The Th17/Treg balance and the expression of related cytokines in Uygur cervical cancer patients[J].DiaqnPathol,2013,8:61.
[12]Zhang Y,Ma D,Zhang Y,et al.The imbalance of Th17/Treg in patients with uterine cervical cancer[J].ClinChim Acta,2011,412(11-12):894-900.
[13]Punt S,Fleuren GJ,Kritikou E,et al.Angels and demons:Th17 cells represent a beneficial response,while neutrophil IL-17 is associated with poor prognosis in squamous cervical cancer[J].Oncoimmunology,2015,4(1):e984539.
[14]宋利.宫颈癌患者血清中IL-17水平的检测及临床意义[J].现代预防医学,2012,39(19):4966-4967.
[15]张哲雄,徐承来,曹永涛.高危型人乳头状病毒和IL-17在宫颈病变患者宫颈脱落细胞中表达的相关性和临床意义[J].中国实验诊断学,2012,16(2):252-254.
[16]Zhang Q,Liu S,Ge D,et al.Interleulin-17 promotes formation and growth of prostate adenocarcinoma in mouse models[J].Cancer Res,2012,72(10):2589-2599.
[17]Wang L,Yi T,Kortylewski M,et al.IL-17 can promote tumor growth through an IL-6-Stat3 signaling pathway[J].J Exp Med,2009,206(7):1457-1464.
[18]Xie Z,Qu Y,Leng Y,et al.Human colon carcinogenesis is associated with increased interleukin-17-driven inflammatory responses[J].Drug Des Devel Ther,2015,9:1679-1689.
[19]Liu J,Duan Y,Cheng X,et al.IL-17 is associated with poor prognosis and promotesangiogenesis via stimulating VEGF production of cancer cells incolorectal carcinoma[J].Biochem Biophys Res Commun,2011,407(2):348-354.
EffectofIL-17onproliferationofhumancervicaladenocarcinomacelllineHeLainvitro
DENGKang-li1,GELi-ben2,CHENYu-bing3,YANWen-xing3,WUDa-Jun1
(1.DepartmentofBodyGammaKnifeTreatmentCenter,363Hospital,Chengdu610042,China;2.DepartmentofRadiotherapy,JilinProvincialPeople’sHospital,Changchun130021,China;3.DepartmentofRadiotherapy,TheSecondHospitalofJilinUniversity,Changchun130041,China)
ObjectiveTo explore the effect of IL-17 on proliferation of human cervical adenocarcinoma cell line HeLa in vitro and the underlying mechanisms of the effect.MethodsFirst,human cervical adenocarcinoma cell line HeLa was stimulated with varying concentrations of rIL-17 (0,1,10,50 to 100 ng/ml) for 24 hours.The proliferation rate was detected by a MTT assay.Then,following experiments were carried out according to the selected concentrations of rIL-17.The induced apoptosis cells by starvation were stimulated with rIL-17 (0,50 and 100 ng/ml) for 24 h,the apoptosis was detected by flow cytometry.RT-PCR and Western blot were used to detect the expression of VEGF at mRNA and protein levels after 48 h of cell stimulation by rIL-17.ResultsAfter stimulation by rIL-17 for a certain period of time,cells proliferation in the 1,10 and 100 ng/ml concentration groups of rIL-17 had no significant changes,but proliferation rate in the 50 ng/ml group was increased significantly (P< 0.01).The late apoptosis rate and total apoptosis rate in 50 ng/ml group were significantly decreased when compared with the normal control group (P< 0.01 and < 0.05,respectively),and the late apoptosis and total apoptosis rate of cells in the 100 ng/ml group were decreased more significantly (allP< 0.01).The production of VEGF mRNA and protein in both the 50 ng/ml and 100 ng/ml,especially in 50 ng/ml group,were increased when compared with the control group (P< 0.05).ConclusionIL-17 could promote the proliferation of cervical adenocarcinoma cell line HeLa in vitro by inhibiting apoptosis and up-regulating the production of VEGF mRNA and protein.
Interleukin-17(IL-17);Cervical neoplasia;Cell proliferation;Vascular endothelial growth factor
R737.33
A
1672-6170(2017)05-0070-04
2016-12-11;
2017-06-23)

