双荧光标记小鼠模型研究破骨细胞融合
唐 勇,吴家顺,牛好曼,代璐岭,杨 肖
(1.成都铜雀台整形美容医院美容牙科,四川 成都 610041;2.四川大学华西口腔医学院,四川 成都 610041)
双荧光标记小鼠模型研究破骨细胞融合
唐 勇1,吴家顺2,牛好曼2,代璐岭2,杨 肖2
(1.成都铜雀台整形美容医院美容牙科,四川 成都 610041;2.四川大学华西口腔医学院,四川 成都 610041)
目的利用双荧光标记小鼠模型观察破骨细胞的融合过程并探讨不同浓度的细胞核因子κB受体活化因子配体(RANKL)和甲状旁腺激素(PTH)对破骨细胞融合效率的影响。方法使用5周龄CTSK-Cre和的ROSAmt/mg两种转基因小鼠,前者无荧光表达而在其破骨细胞中表达CRE重组酶,后者表达红色荧光(tomato)。处死两种小鼠并冲出骨髓间充质干细胞(BMSCs)且以1∶1的比例混合培养。将不同浓度的RANKL和PTH加入共培养体系,计算绿色荧光的量。结果CTSK-Cre和ROSAmt/mg2种转基因小鼠BMSCs共培养第5天观察到绿色荧光阳性的细胞出现;RANKL组:随着RANKL浓度的升高,共培养体系内绿色荧光阳性的细胞数不断增加;PTH组:共培养体系内绿色荧光阳性的细胞数与PTH浓度之间未发现明显的相关性。结论基于cre-loxp系统建立的cre重组酶诱导的双荧光标记小鼠模型可有效用于破骨细胞融合过程的研究;RANKL的浓度越高其诱导破骨细胞融合的效率越高;PTH与破骨细胞的融合效率之间无明显的剂量相关规律。
破骨细胞;细胞融合;CTSK-Cre;ROSAmt/mg
骨吸收异常是当代医学试图克服的重大难题之一。异常的骨吸收会导致一系列的临床疾病,包括骨质疏松症、恶性高钙血症,以及包括牙槽骨在内的骨的炎症性吸收和牙齿萌出异常等。而破骨细胞在骨吸收过程中发挥着最主要的作用。破骨细胞是由骨髓中的髓系祖细胞分化而成的单核巨噬细胞相互融合,所形成的多核巨细胞[1]。而细胞融合是破骨细胞形成过程中必不可少的环节,也是破骨细胞重要的特点之一。研究破骨细胞融合的传统方式往往对其形成过程探究有限。因此我们试图寻找一种简单直接而又有效的方法来研究破骨细胞的融合过程。本实验采用基于cre-loxp系统建立的cre重组酶诱导的双荧光标记小鼠模型来研究破骨细胞的融合过程及其影响因素。旨在为破骨细胞融合及骨吸收的临床用药提供新的指导。
1 材料与方法
1.1实验动物2014年12月至2017年2月,转基因小鼠CTSK-Cre与ROSAmt/mg各12只(The Jackson Laboratory,美国),5周龄,SPF级。该转基因小鼠购自美国杰克逊实验室。饲养于四川大学生物治疗国家重点实验室基因工程小鼠中心。所用饲料营养全面均衡,经过严格无菌处理。小鼠饮用水、木屑垫料及培养笼经严格高温高压处理,空气经层流过滤,动物房饲养环境达到无特定病原体SPF级别。
1.2试剂a-MEM、特级胎牛血清(hyclone公司,澳大利亚)、青霉素/链霉素(Hyclone公司,美国),鼠重组细胞核因子κB受体活化因子配体(receptor activator of nuclear factor kappa B ligand,RANKL)、甲状旁腺激素(parathyroid hormone,PTH)、巨噬细胞集落刺激因子(macrophage colony stimulating factor,MCSF)(Peprotech公司,美国)、荧光显微镜(Olympus CKX41,Japan)。
1.3两种转基因小鼠骨髓间充质干细胞混合培养颈椎脱臼法处死5周龄CTSK-Cre与ROSAmt/mg小鼠,两种小鼠使用同样的方法处理并取骨髓间充质干细胞混合75%乙醇浸泡消毒2分钟。无菌条件下分离股骨及胫骨于无菌PBS中,去除附着肌肉及韧带,剪断两侧骨骺端,用注射针头将a-MEM轻轻冲洗骨髓腔于50 ml无菌离心管中。分别全都冲出后,注射器反复吹打成细胞悬浮液,细胞计数,用a-MEM完全培养液将细胞密度调整至5×106个/ml。将两种小鼠来源的细胞以1:1的比例混合后接种于6孔板中,每孔培养基2 ml。37 ℃,5%CO2条件下完全培养基(含 α-MEM培养基、10%胎牛血清、1% 青霉素/链霉素)培养。分别在细胞培养后的每天使用荧光显微镜观察是否有绿色荧光(GFP)表达,当GFP出现时采图。
1.4不同浓度的RANK和PTH对破骨细胞融合效率的影响将两种转基因小鼠骨髓来源的单核细胞以1∶1的比例混合后种于6孔板中,每孔培养基2 ml,每孔加入巨噬细胞集落刺激因子(M-CSF,终浓度为50 ng/ml)。同时将不同浓度的RANKL和PTH(分别为10、50、100、200、300 ng/ml)加入以上的共培养体系。37 ℃,5%CO2条件下完全培养基(含 α-MEM培养基、10%胎牛血清、1% 青霉素/链霉素)培养。分别在细胞培养第3、6、9天,使用荧光显微镜观察细胞行为并采图。从细胞培养第二天开始直至培养结束,每天通过对孔板内表达GFP的细胞数量计数,绘制绿色荧光细胞数随着细胞培养时间变化的趋势图。
2 结果
2.1两种转基因小鼠骨髓间充质干细胞混合培养后的荧光表达情况当培养至第2天时荧光显微镜下并未观察到明显的GFP阳性的细胞出现(图1 a所示),而培养进行至第5天时镜下出现明显空泡状的破骨细胞(灰色箭头),同时荧光显微镜下就可以观察到GFP阳性的细胞(绿色箭头)出现(图1b)。
2.2不同浓度的RANKL与PTH对共培养体系内破骨细胞融合效率的影响标号1-5Rankl的浓度依次为10、50、100、200、300 ng/ml。荧光显微镜采集的图片显示,随着Rankl浓度的增高,视野内GFP的量也随之增加,而红色荧光(tomato)的表达量会随之减少(图2a)。并根据不同浓度的Rankl组表达GFP阳性细胞数随时间的变化,绘制其变化趋势图(图2b)。
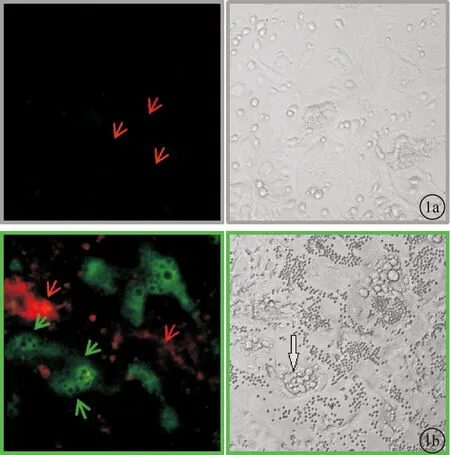
图1 混合培养体系荧光及倒置显微镜采图 a.混合培养2天;b.混合培养5天(10X)
而不同浓度的PTH组,标号1-5PTH的浓度依次为10、50、100、200、300 ng/ml。随着PTH浓度的增加,视野内GFP阳性的量并未表现出明显的剂量相关性(图3a)。并根据不同浓度的PTH组表达GFP阳性细胞数随时间的变化,绘制其变化趋势图(图3b)。

图2 RANKL组GFP阳性细胞荧光及变化趋势图 a.Rankl组荧光图(10X);b.Rankl组GFP变化趋势图

图3 PTH组GFP阳性细胞荧光及变化趋势图 a.PTH组荧光图(10X);b.PTH组GFP变化趋势图
3 讨论
破骨细胞是来源于造血干细胞或单核前体细胞的多核巨细胞[1],细胞融合在破骨细胞的形成以及行使功能的过程中发挥着重要的作用。骨稳态由成骨细胞和骨细胞共同维持[2],而破骨细胞功能异常会引起一系列的临床症状和功能异常,因此研究破骨细胞的融合过程以及其影响因素,可以为临床治疗及用药提供指导意义。为了更直观有效地观察破骨细胞的融合过程,我们构建了双荧光标记的转基因小鼠模型。在该模型中我们可以根据绿色荧光是否出现以及其出现的量的多少来判断破骨细胞前体是否发生融合以及融合效率的差异。
为了验证该模型的有效性,我们首先将两种转基因小鼠,即CTSK-Cre与ROSAmt/mg骨髓来源的单核细胞以1∶1的比例混合培养。二者共培养5天后便观察到了绿色荧光的出现,该结果表明CTSK-Cre与ROSAmt/mg转基因小鼠的破骨细胞前体细胞发生了融合,Cre重组酶发挥作用并剪切后者编码红色荧光(tomato)的基因片段,使得融合后的破骨细胞表达GFP。
因此本实验利用该模型来研究不同浓度的PTH和RANKL对破骨细胞融合效率的影响。RANKL属于肿瘤坏死因子配体超家族成员,对于破骨细胞的形成、发挥功能及存活是必须的。同时有研究表明,在淋巴细胞分化、乳腺发育、肠内皱褶细胞的产生、雌性动物的体温调节等过程中RANKL也发挥着重要的作用[3]。RANKL有两种受体:一种是RANK,主要表达于破骨细胞前体及破骨细胞表面;当RANKL与破骨细胞膜表面的RANK受体结合时,便会启动一系列基因转录,并且诱导破骨细胞前体相互之间的融合,进而促进破骨细胞的形成及分化,并抑制其凋亡;另一种受体为OPG,其对RANKL和RANK的结合起负调节作用,进而抑制破骨细胞的形成和分化[4]。RANKL/RANK/OPG系统在调节骨代谢和维持骨稳态的过程中发挥重要作用[5]。本实验中为了研究不同浓度的RANKL对破骨细胞融合效率的影响,将稀释后的不同浓度的RANKL加入到两种转基因小鼠骨髓来源单核细胞的共培养体系,我们发现RANKL对破骨细胞融合效率的影响与以往的研究一致,即Rankl浓度越高,破骨细胞的融合效率越高,破骨细胞的形成对Rankl呈现出浓度依赖性。
PTH是由甲状旁腺分泌的用以调节机体内钙、磷代谢平衡的重要激素之一,其主要靶器官是骨、小肠和肾脏。在骨组织内,PTH是调节骨重建的主要激素,通过对骨形成和骨吸收的调控作用行使其功能。当间歇性给予PTH时,它会通过增加成骨细胞的量及其活性来促进骨形成;而持续给药时,PTH会通过刺激骨吸收来减少骨形成。PTH的受体主要在成骨细胞以及前成骨细胞表达。因此,我们认为,当持续给予PTH时,其对骨吸收的促进作用是由于PTH首先作用于成骨细胞,成骨细胞分泌的因子激活破骨细胞,进而导致骨吸收。有文献指出当骨吸收作用被抑制时,间歇性应用PTH对于骨形成的促进作用也会受到影响,因此PTH对于骨形成的促进作用可能需要骨吸收的诱导[6]。而此过程最终的结果是骨形成多于骨吸收,而骨吸收的发生只是成骨细胞发挥作用前一过性的反应。然而此过程中破骨细胞的激活机制仍不清楚。所以PTH是通过成骨细胞间接的发挥对破骨细胞的调节作用,并通过二者之间复杂的相互作用来调节骨重建。而在PTH对于破骨细胞融合效率的研究中,我们直接将不同浓度的PTH直接加入到骨髓来源的单核细胞,PTH对于破骨细胞的调节作用十分复杂,对于体内环境的模拟有限。因此实验结果并未反应出二者明显的相关性。找到并建立一种合适的模型对于研究PTH对破骨细胞的双重作用至关重要,并为PTH治疗骨代谢紊乱疾病提供临床指导。
[1] Chambers TJ.The cellular basis of bone resorption[J].Clin Orthop Relat Res,1980,151(151):283-293.
[2] 吴爽,蒋科,蔚芃,等.骨代谢指标与骨关节炎患者骨密度变化的相关性研究[J].实用医院临床杂志,2015,12(3):57-59.
[3] Hanada R,Leibbrandt A,Hanada T,et al.Central control of fever and female body temperature by RANKL/RANK[J].Nature,2009,462:505-509.
[4] Karmakar S,Kay J,Gravallese EM.Bone damage in rheumatoid arthritis:mechanistic insights and approaches to prevention[J].RheumDis Clin North Am,2010,36(2) :385-404.
[5] 田娟,龙丽,周彬.类风湿关节炎骨侵蚀研究进展[J].实用医院临床杂志,2017,14(2):133-136.
[6] 万启龙,王强,李祖兵.PTH对骨代谢双重作用的研究进展[J].中国口腔颌面外科杂志,2011,9(4):343-346.
杨 肖
R318
A
1672-6170(2017)05-0020-03
2017-03-11;
2017-07-23)

