宫颈癌患者血清miR-130a的表达及意义*
沙敏,何翠琴,钱华,樊晓艳,王变,汪佳
(泰州市人民医院, a. 中心实验室,b. 妇产科,c. 新生儿重症监护室,d. 感染科,e. 生殖医学科,江苏泰州 225300)
·液体活检与临床实验研究·
宫颈癌患者血清miR-130a的表达及意义*
沙敏a,何翠琴b,钱华b,樊晓艳c,王变d,汪佳e
(泰州市人民医院, a. 中心实验室,b. 妇产科,c. 新生儿重症监护室,d. 感染科,e. 生殖医学科,江苏泰州 225300)
目的 分析宫颈癌患者血清miR-130a的表达水平及临床意义。方法 用荧光定量PCR检测60例宫颈癌患者和60例体检健康者血清miR-130a的表达水平,分析血清miR-130a水平与宫颈癌患者临床病理参数的相关性。结果 与体检健康者(0.029±0.024)相比,宫颈癌患者血清miR-130a表达水平(0.087±0.038)明显升高(P<0.01)。miR-130a的高水平与肿瘤分化(P<0.01)以及肿瘤分期(P=0.01)密切相关。ROC曲线分析结果显示,血清miR-130a诊断宫颈癌的曲线下面积(AUCROC)为0.878(95%CI:0.809~0.947),敏感性为86.7%,特异性为90.8%。与早期宫颈癌患者(0.074±0.034)相比,晚期宫颈癌患者血清miR-130a表达水平(0.105±0.038)明显升高(P<0.05);与术前(0.082±0.014)相比,宫颈癌术后血清miR-130a表达水平(0.033±0.022)明显降低(P<0.01)。结论 血清miR-130a有助于宫颈癌诊断和预后监测,并可作为宫颈癌进展的辅助判断指标。
宫颈癌;血清;miR-130a;预测指标
越来越多的研究证实,miRNA可作为宫颈癌早期诊断、术后监测及预后判断的生物学标志物[1-3]。研究发现,miR-130a在宫颈癌细胞中的表达异常升高,并可通过激活NF-κB等信号通路促进宫颈癌细胞增殖和侵袭转移[4]。此外,还有学者发现,宫颈癌组织中Dicer(miR-130a靶分子)的表达水平与宫颈癌远处转移和复发密切相关,其进一步的生存分析显示miR-130a高水平患者的无疾病生存(DFS)明显低于低水平患者[5]。本研究通过检测宫颈癌患者与体检健康者血清miR-130a表达水平的差异,旨在分析血清miR-130a作为宫颈癌诊断和预后监测指标的可能性。
1 材料与方法
1.1 研究对象 收集2014年9月至2016年8月本院初诊的宫颈癌患者60例,年龄32~68岁,中位年龄50岁。均参照文献[6],经病理组织学明确诊断,患者术前均未进行放化疗治疗。纳入标准:(1)初次治疗的患者;(2)无现在或既往的其他原发恶性肿瘤病史,临床记录完整;(3)有明确病理组织学诊断,均为宫颈癌。排除标准:(1)无卵巢癌、严重肝肾疾病、盆腔炎及其他严重脑部器质性病变;(2)排除生殖道结核、盆腔子宫内膜异位症、子宫内膜炎、有其他严重精神疾病者、消化道肿瘤及有酒精药物滥用史者;(3)不伴有心、肝、脑、肾、肺等器官及血液系统疾病。病理类型:鳞癌43例,腺癌17例;组织学分型:高分化和中分化28例,低分化32例;FIGO分期I~Ⅱ期35例, Ⅲ~Ⅳ期25例。随机选取15例术后1个月宫颈癌患者进行随访。收集同期体检健康女性60例作为健康人对照组,年龄30~65岁,中位年龄49岁。另收集同期就诊的38例慢性宫颈炎患者作为相关疾病对照,年龄30~67岁,中位年龄49.5岁。本研究经医院医学伦理学委员会批准,患者知情同意。
1.2 主要仪器及试剂 miRNeasy Mini Kit(德国Qiagen公司);MicroRNA逆转录试剂盒(美国TaqMan公司);HPV检测试剂盒(美国Digene公司);微量高速离心机(德国Eppendorf公司);实时荧光 PCR仪(7500型,美国ABI公司)。
1.3 HPV检测 采用第二代杂交捕获技术,按照HPV检测试剂盒说明书操作检测样本中HPV-DNA含量及结果判读。
1.4 血清miRNA的提取 Ⅰ~Ⅱ期宫颈癌患者于术前3~5 d抽取患者空腹静脉血3 mL,术后 5~7 d再次采集; Ⅲ~Ⅳ期宫颈癌患者于确诊时采集空腹静脉血3 mL; 健康人对照组于体检时采集空腹静脉血3 mL,1 500 r/min离心15 min,吸取血清,置-80 ℃保存。所有标本避免溶血和反复冻融。取180 μL血清,按miRNeasy Mini Kit试剂盒说明书操作提取miRNA,样本用30 μL DEPC处理的ddH2O
溶解,置-80 ℃保存。取2 μL总RNA,用NanoDrop 1000微量核酸测定仪测定RNA的吸光度(A260/280 nm)值,取A260/280 nm值在1.8~2.0的样本用于后续实验。
1.5 引物设计及逆转录反应 miR-130a特异性逆转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGACATGCCCT′-3′;U6特异性逆转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACGATT-3′。均由上海吉凯基因化学公司设计并合成。按照TaqMan MicroRNA逆转录试剂盒说明书操作将总RNA逆转录成cDNA。样本置-20 ℃保存。
1.6 荧光定量PCR检测血清miRNA-130a的表达 miR-130a上游引物序列: 5′-GGGGCAGTGCAATGTTAAAA -3′;下游引物序列:5′-GTGCAGGGTCCGAGGT-3′;U6上游引物序列: 5′-GTGCGTGTCGTGGAGTCG-3′; 下游引物序列: 5′-AACGCTTCACGAATTTGCGT-3′。 均由上海吉凯基因化学公司设计并合成。按照TaqMan MicroRNA Assay试剂盒说明书操作检测miR-130a的表达水平。PCR反应体系为20 μL,包括10×PCR buffer 2 μL,25 mmol/L MgCl21.2 μL,10 mmol/L dNTP 0.4 μL,10 mmol/L上、下游引物各0.5 μL,Taq酶 0.4 μL,模板cDNA 1 μL,无RNA酶ddH2O 14 μL。PCR循环参数:94 ℃变性5 min; 94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,共40个循环。在60 ℃下采集荧光信号,并用7500 software V2.0.6软件进行熔解曲线分析。每份样品设3个复管,Ct值取2次PCR反应的平均值。血清miR-130a的表达水平用2-ΔCt法计算。
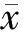
2 结果
2.1 各组宫颈癌患者血清miR-130a的表达水平 荧光定量PCR检测结果表明,宫颈癌患者血清中miR-130a的表达水平(0.087±0.038)明显高于体检健康者(0.029±0.024),差异有统计学意义(t=-9.74,P<0.01)。进一步对15例随访宫颈癌患者术后1个月血清miR-130a水平进行检测,结果显示,术前血清miR-130a表达水平为(0.082±0.014),术后为(0.033±0.022),两组间差异有统计学意义(t=8.408,P<0.01)。此外, 25例Ⅲ~Ⅳ期宫颈癌患者血清miR-130a表达水平(0.105±0.038)明显高于35例Ⅰ~Ⅱ期宫颈癌患者(0.074±0.034),差异具有统计学意义(t=-3.24,P=0.002)。低分化宫颈癌患者血清miR-130a表达水平(0.107±0.034)高于高中分化宫颈癌患者(0.066±0.032),差异具有统计学意义(t=-4.785,P<0.01)。血清miR-130a的表达水平在宫颈癌鳞癌患者(0.087±0.037)与腺癌患者(0.087±0.042)之间的差异无统计学意义(t=-0.065,P=0.948)。
2.2 血清miR-130a表达水平与宫颈癌临床病理参数的关系 根据参考文献[7-8],以宫颈癌患者血清miR-130a表达水平高于体检健康者3.02倍作为界值,分为低表达(<3.02倍)和高表达(≥3.02倍)。宫颈癌患者血清miR-130a表达水平与患者年龄、肿瘤直径及HPV感染无关(P>0.05),但与肿瘤分化程度(P<0.01)和FIGO分期(P=0.01)密切相关。见表1。

表1 miR-130a与宫颈癌患者临床病理参数的关系
2.3 血清miR-130a表达水平在宫颈癌诊断中的价值 以60例宫颈癌患者作为疾病组,60例体检健康者和38例慢性宫颈炎患者作为对照组,分析血清miR-130a诊断宫颈癌的效能,结果表明,ROC曲线下面积(AUCROC)为0.878,95%可信区间(CI)为(0.809~0.947)。当cut-off值为0.05时,其敏感性为86.7%,特异性为90.8%。见图1。
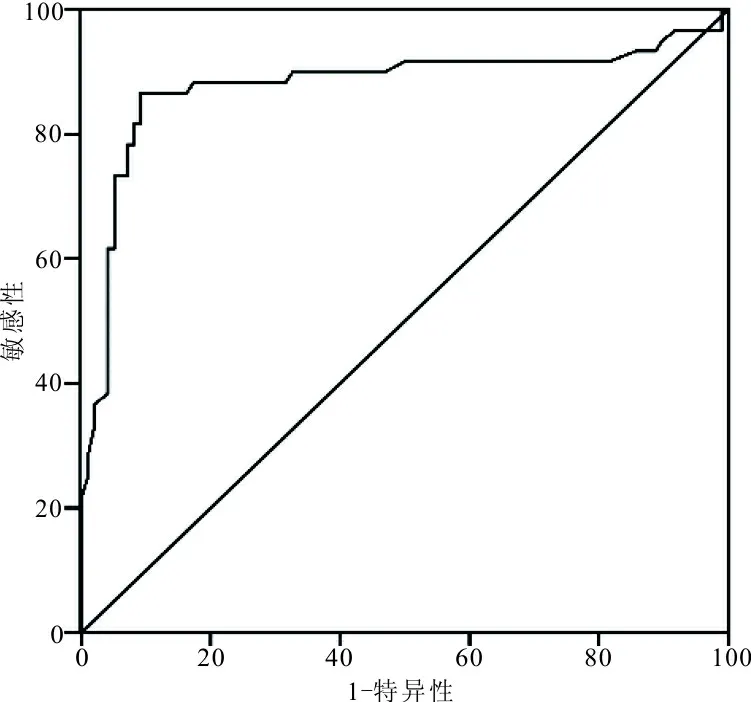
图1 血清miR-130a诊断宫颈癌的ROC曲线
3 讨论
研究表明,在肺癌、肝癌和卵巢癌等肿瘤组织中均发现miR-130a的表达水平升高,并进一步证实了其可促进肿瘤细胞的增殖、浸润和转移,可作为肿瘤早期诊治的新指标[9]。另有学者发现,miR-130a在宫颈癌细胞中的表达水平异常升高,并可通过激活NF-κB等信号通路促进癌细胞增殖和侵袭转移[4]。血清miR-130a在宫颈癌诊断方面的报道较少,且因其发挥致癌基因的作用,故本研究选择血清miR-130a用于宫颈癌诊断研究。
本研究采用荧光定量PCR检测宫颈癌患者和体检健康者血清miR-130a表达水平,结果表明miR-130a在宫颈癌患者血清中呈高表达,与其他文献报道的miR-130a在宫颈癌组织中表达水平升高较为一致[4-5]。分析宫颈癌患者血清miR-130a表达升高的原因,可能是癌细胞的死亡和溶解,或由癌细胞释放出miR-130a至血液循环中所致。在临床实践中,外周血采集方便且具有创伤小、可重复等优点,且miRNA稳定性强,因此,血清miR-130a有望成为宫颈癌诊断的分子标志物。
此外,本研究通过分析宫颈癌患者血清miR-130a表达水平与临床病理参数之间的关系,结果表明血清miR-130a表达在患者年龄和病理类型方面
差异无统计学意义,但在肿瘤分化程度和FIGO分期方面存在差异,表明miR-130a可能发挥促进宫颈癌发展的作用。随着肿瘤的进展,miR-130a表达呈现进一步升高的趋势,Ⅲ~Ⅳ期患者血清miR-130a的相对表达水平较Ⅰ~Ⅱ期患者明显升高。此外,宫颈癌患者术后血清miR-130a表达水平较术前明显降低,说明miR-130a可能用于宫颈癌术后判断。血清miR-130a诊断宫颈癌的AUCROC为0.878,敏感性为86.7%,特异性为90.8%,提示血清miR-130a有望成为宫颈癌诊断的一种新型肿瘤标志物。虽然本研究检测的样本例数没有达到大样本的要求,但可为今后的大样本研究提供实验依据。
[1]Zhang Y, Zhang D, Wang F,etal. Serum miRNAs panel (miR-16-2*, miR-195, miR-2861, miR-497) as novel non-invasive biomarkers for detection of cervical cancer[J]. Sci Rep, 2015, 5: 17942.
[2]Nagamitsu Y, Nishi H, Sasaki T,etal. Profiling analysis of circulating microRNA expression in cervical cancer[J]. Mol Clin Oncol, 2016, 5(1): 189-194.
[3]车玉传,温旺荣.宫颈癌发病相关microRNA作用及其临床应用研究进展[J].临床检验杂志,2013,31(1):36-39.
[4]Feng Y, Zhou S, Li G,etal. Nuclear factor-κB-dependent microRNA-130a upregulation promotes cervical cancer cell growth by targeting phosphatase and tensin homolog[J]. Arch Biochem Biophys, 2016, 598: 57-65.
[5]He L, Wang HY, Zhang L,etal. Prognostic significance of low DICER expression regulated by miR-130a in cervical cancer[J]. Cell Death Dis, 2014, 5: e1205.
[6]连利娟.林巧稚妇科肿瘤学[M].第4版.北京:人民卫生出版社,2006,304-312.
[7]Ma Q, Wan G, Wang S,etal. Serum microRNA-205 as a novel biomarker for cervical cancer patients[J]. Cancer Cell Int, 2014, 14: 81.
[8]陈光辉,闫慧,孙长义,等.非小细胞肺癌患者癌组织和血浆中microRNA-21的表达及意义[J].临床检验杂志,2014, 32(9):652-655.
[9]Zhang HD, Jiang LH, Sun DW,etal. The role of miR-130a in cancer[J]. Breast Cancer, 2017, 24(4):521-527.
(本文编辑:许晓蒙)
10.13602/j.cnki.jcls.2017.08.08
2016年泰州市人民医院院级课题指令性项目(ZL201617)。
沙敏,1986年生,女,主管技师,硕士研究生,主要从事临床肿瘤及相关检验项目研究。
汪佳,副主任医师,E-mail:32735644@qq.com。
R711.74
A
2017-05-15)

