CMIA与HPLC监测新生儿万古霉素血药浓度的比较研究
唐喆,王菲,童鑫,贾岩岩
(南京医科大学附属妇产医院,江苏 南京 210004)
CMIA与HPLC监测新生儿万古霉素血药浓度的比较研究
唐喆,王菲,童鑫,贾岩岩
(南京医科大学附属妇产医院,江苏 南京 210004)
目的:比较化学发光微粒子免疫法(CMIA)和高效液相色谱法(HPLC)测定新生儿血浆中万古霉素浓度所得结果的区别与相关程度。方法:建立测定新生儿万古霉素血药浓度的HPLC,并进行方法学验证。收集新生儿患者万古霉素峰谷浓度血浆样本,分别用CMIA与HPLC进行测定,比较两种测定方法的异同。结果:CMIA和HPLC检测的新生儿万古霉素血药浓度差异有统计学意义(P<0.05),HPLC测定结果均值高于CMIA,Passing-Bablok回归结果显示两种测定方法相关性较好,一致性欠佳。结论:CMIA和HPLC测定新生儿万古霉素血浆药物浓度所得结果有明显差异,临床进行血药浓度监测时应予以注意,避免跨系统监测。
化学发光微粒子免疫法;高效液相色谱法;万古霉素;新生儿;血药浓度监测
万古霉素是一种糖肽类抗生素,临床用于治疗革兰氏阳性菌特别是耐甲氧西林金黄色葡萄球菌(MRSA)所致的严重感染。万古霉素具有一定的肾毒性与耳毒性,临床应用时个体差异较大,用于新生儿时尤其应谨慎使用,避免血药浓度过高,防止不良反应发生。但万古霉素血药浓度过低,易诱导产生耐药菌,导致治疗失败。因此,万古霉素应用于新生儿时必须进行血药浓度监测,并根据监测结果及时调整万古霉素剂量[1-2]。
监测万古霉素血药浓度的主要技术方法有高效液相色谱法(HPLC)、化学发光微粒子免疫法(CMIA)、酶放大免疫法(EMIT)等。国外近期研究显示,不同的检测技术方法对新生儿万古霉素血药浓度的监测有重大影响,直接影响临床个体化给药[3]。《万古霉素临床应用中国专家共识(2011年版)》也并未提示不同血药浓度检测方法之间的差异[4]。因此不同方法所得测定结果的相关性、一致性亟待验证。
目前,国内比较HPLC与CMIA测定万古霉素血药浓度的研究较少,且有统计学方法选择不当的情况[5]。本次研究收集使用万古霉素治疗的新生儿血样119份,分别用HPLC与CMIA进行测定,评价两种方法的相关性与一致性,为临床提供参考。
1 材料
1.1 仪器
Waters高效液相色谱仪(1525泵,2487紫外检测器,2707自动进样器,Empower 3色谱工作站);Architect I1000化学发光免疫分析仪;Mettler XS105DU分析天平;Eppendorf 5424R 高速冷冻离心机。
1.2 试药
万古霉素标准品(中国食品药品检定研究院,批号:130360-201302,纯度99.2%);色谱纯甲醇、乙腈;分析纯磷酸二氢钾、高氯酸、磷酸;注射用水(安徽双鹤药业,批号:1502106A);万古霉素试剂盒、标准曲线盒与质量控制试剂盒(Abbott公司);空白成人血浆由南京医科大学附属妇产医院检验科提供。
1.3 样本
样本来源于2015年1月- 2016年12月南京医科大学附属妇产医院使用万古霉素治疗的新生儿患者,于第4剂或第5剂给药前采血测定谷浓度(C谷),于万古霉素静滴结束后0.5 h采血测定峰浓度(C峰)。每份采集到的血样离心后分成两份血浆样品,4℃冰箱内保存,分别用于HPLC和CMIA测定万古霉素血药浓度,取样后24 h内完成检测。
2 方法
2.1 HPLC
2.1.1 溶液的配制 精密称取万古霉素标准品50 mg于100 mL容量瓶中,加入注射用水稀释至刻度,摇匀,得万古霉素储备液,4℃避光保存。将万古霉素储备液稀释成浓度为12.5,25.0,50.0,125.0,250.0,500.0 μg/mL的标准溶液备用。精密称取磷酸二氢钾6.8 g,加注射用水溶解至1000 mL,用磷酸调节pH至3.2,0.45 μm微孔滤膜滤过,超声脱气后备用。
2.1.2 色谱条件 色谱柱:Waters SunFire C18柱(4.6 mm× 250 mm,5 μm);流动相:甲醇-0.05 mol/L磷酸二氢钾缓冲溶液(V/V,20∶80,pH=3.2);流速:1.0 mL/min;检测波长:236 nm;柱温:30℃;进样量:20 μL。
2.1.3 样品前处理 取血清样品300 μL于1.5 mL EP管中,加入225 μL沉淀剂(甲醇-乙腈-6%高氯酸:1∶1∶6,V/V/V)沉淀蛋白,涡旋混匀1 min,13 500 r/min离心10 min,取上清经0.45 μm针头过滤器滤过后,转入样品瓶中待测。
2.1.4 方法学考察 ①线性关系考察。取“2.1.1”项下万古霉素标准溶液75 μL,加入空白血清300 μL,配制成含万古霉素2.5~100.0 μg/mL的系列标准浓度血浆样本,按“2.1.3”项下方法进行预处理,按“2.1.2”项下色谱条件进行测定。记录万古霉素的保留时间(tR),以样品峰面积(Y)对浓度(C)进行线性回归。②专属性考察。使用万古霉素进行治疗的新生儿患者往往合并使用多种抗菌药治疗感染,可能会对万古霉素血药浓度测定造成潜在影响。配制含万古霉素、头孢他啶、阿莫西林、头孢哌酮、哌拉西林、头孢曲松、美罗培南、氟康唑的血浆样本,预处理后进行测定,计算各抗菌药色谱峰与万古霉素色谱峰之间的分离度。③回收率、精密度、稳定性考察。配制万古霉素浓度为2.5,25.0,100.0 μg/mL的标准浓度血样各5份,每个质量浓度连续测量3次,连续测定5 d,计算3个质量浓度日内精密度和日间精密度。所测得药物峰面积代入回归方程计算,以计算测得量与加入量之比即方法回收率;所测得药物峰面积除以同一浓度的标准溶液所得峰面积,以计算提取回收率。3种质量浓度的标准浓度血样于4℃冰箱内保存,于0,4,8,12,24 h取样测定,计算峰面积RSD值即稳定性。
2.1.5 患者血浆测定 取待测血浆,按“2.1.3”项下所述方法处理分析,用相应的标准曲线计算样品中万古霉素的含量。
2.2 CMIA
取质量浓度为0.0,5.0,10.0,25.0,50.0,100.0 μg/mL的万古霉素标准品,以万古霉素试剂盒检测,得到相应的标准曲线,运行后仪器进行自动测试与标准曲线的拟合。精密度、回收率、线性、专属性等性能指标均按照ARCHITECT系统操作手册执行。每次检测患者样品时均按照仪器标准操作规范测定,仪器自行取样、分析测定,每批血浆样本测定时需进行质控样品的平行测定。
2.3 数据分析
对得到的C谷和C峰进行分别比较。采用Shapiro-Wilk检验样本正态性。如符合正态分布,则用配对t检验比较两组测定结果有无差异,反之则用Wilcoxon配对检验。回归分析采用Passing-Bablok。采用R软件(R i386 3.2.5)进行数据分析。
3 结果
3.1 HPLC方法学考察结果
在上述色谱条件下,万古霉素tR为7.219 min,与其他内源性物质分离完全(见图1),在浓度2.5~100.0 μg/mL的范围内线性良好,标准曲线方程为:
Y=9606.8C-6962.4,r=0.9996(n=5)。
HPLC的定量限为2.5 μg/mL,检测限为1.0 μg/mL。
据图2可知,万古霉素与阿莫西林、头孢哌酮、头孢他啶的分离度均大于1.5,而哌拉西林、头孢曲松、美罗培南、氟康唑在该前处理和色谱条件下不出峰,可见上述药物在临床与万古霉素合并使用时,不会对万古霉素血药浓度监测产生影响。
由表1可见,万古霉素的回收率和精密度符合生物样本的测定要求。稳定性试验结果显示,万古霉素血浆样本24 h内在4℃环境下保持稳定。
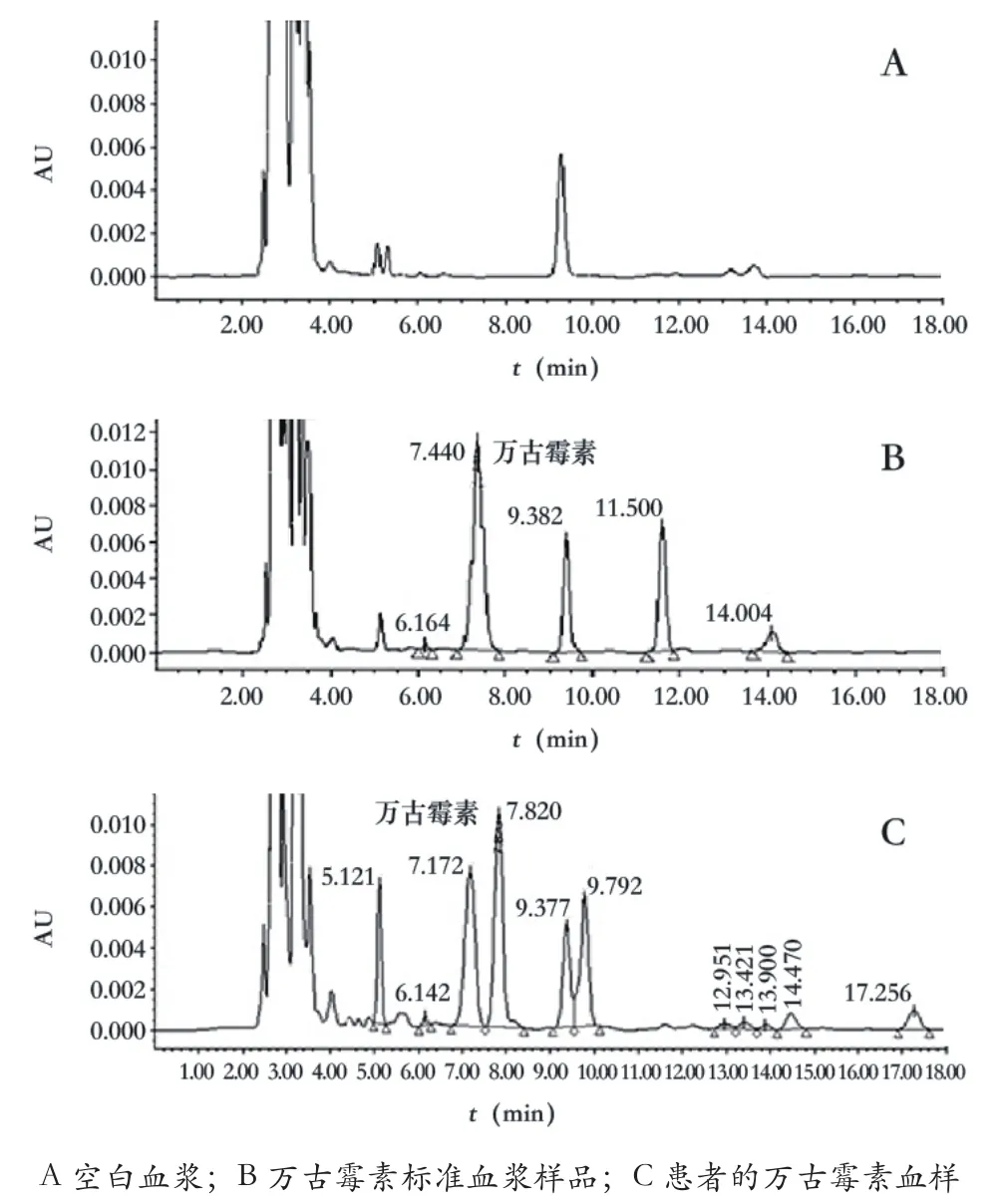
图1 HPLC检测万古霉素血浆样品色谱图
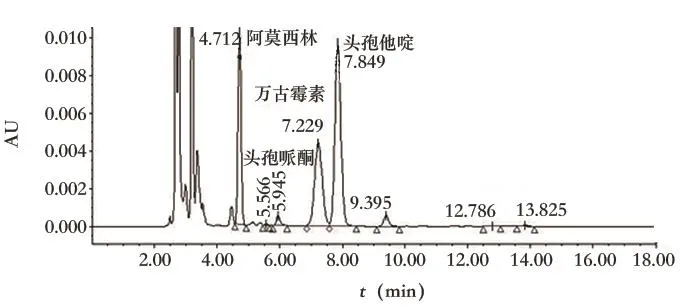
图2 含多种抗生素的万古霉素血浆样品色谱图
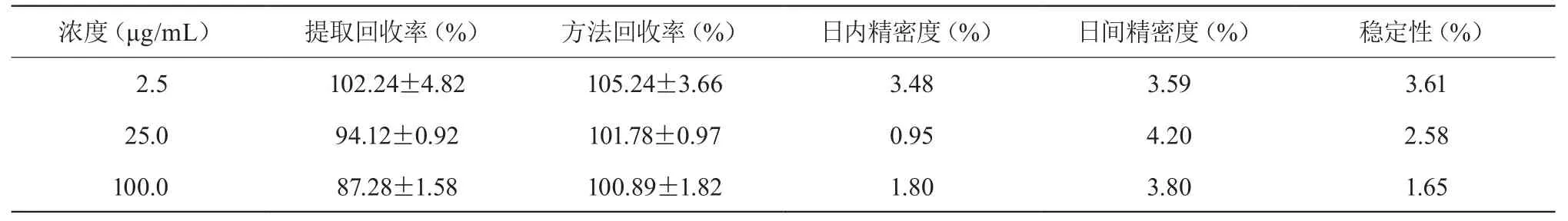
表1 HPLC回收率、精密度、稳定性结果
3.2 HPLC与CMIA的比较
本次研究从临床采集万古霉素谷浓度血浆样品84例,峰浓度样品35例。将每份样品分别用HPLC与CMIA进行检测。正态分布性结果显示,两种方法所得C谷、C峰,两种方法测定差值均呈正态分布。应用配对t检验比较两种方法所得C谷和C峰,差异均有统计学意义(P<0.05)。
计算两种方法所得测定值的相对偏差(RE):
RE(%)=(两种方法测定差值/两种方法测定均值)×100%
并以RE为纵坐标,两种方法测定均值为横坐标,分别绘制C谷和C峰的Bland-Altman偏差图(图3)。对于C谷,有5.95%的点在95%的一致性界限以外;对于C峰,有5.71%的点在95%的一致性界限以外。此外,HPLC所得测定值明显高于CMIA,RE绝对值最大为35.65。可见两种方法测定值相差幅度较大,故认为两种方法测定值的一致性欠佳。
Passing-Bablok回归结果见表2和图4。回归方程的截距和斜率的95%置信区间提示两种检测方法之间的固定误差和比例误差大小。C谷和C峰所得回归方程的斜率非常接近于1,表明两种方法测定的结果之间比例误差很小,且存在着良好的直线相关关系(Spearman系数>0.95)。C谷和C峰所得回归方程的截距明显远离原点,表明两种检测方法之间存在一定的固定误差,这也与Bland-Altman偏差图显示的结果一致。
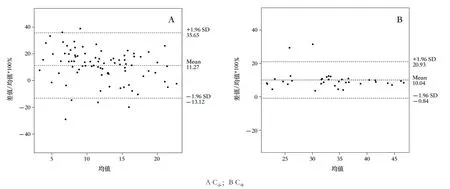
图3 Bland-Altman偏差图
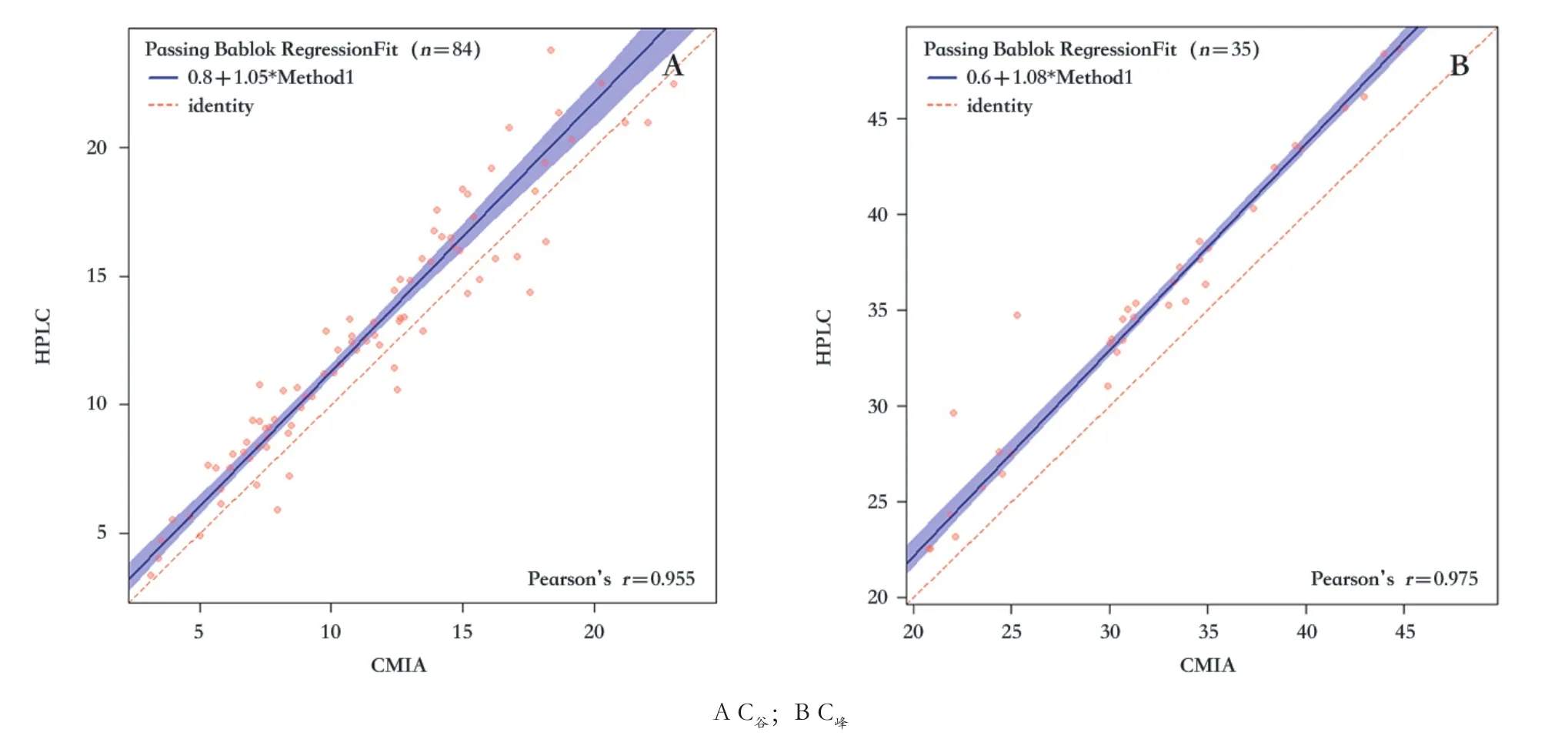
图4 Passing-Bablok回归图
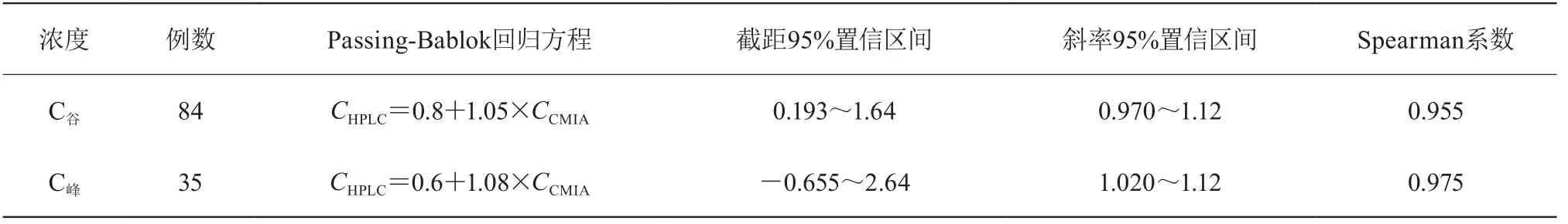
表2 HPLC与CMIA的回归和相关性分析
4 讨论
本次研究纳入万古霉素血浆样本数量较多,所得结果与以往研究有所差别。本次研究结果显示,CMIA与HPLC测定值之间相关性良好,一致性欠佳,HPLC测定结果明显高于CMIA。两种检测方法均会受到万古霉素代谢产物、血浆中内源性物质及临床样本条件的影响。CMIA的原理为:以样本、万古霉素抗体包被顺磁微粒子后,与吖啶酯标记的丙戊酸结合物混合,制成反应混合物,万古霉素抗体包被的微粒子与样本中的吖啶酯标记的万古霉素结合物结合,冲洗,加入预激发液和激发液到反应混合物中,测量其发生的化学发光反应。血浆样本中的蛋白、盐等内源性物质含量各有不同,对样本中的万古霉素和抗体结合的影响也各有不同,特别是对于万古霉素浓度较低的样本[6]。本次研究结果也显示,C谷的相对偏差大于C峰。HPLC在方法研究时,难以取得新生儿空白血浆配制标准浓度血浆样本,新生儿空白血浆的色谱图与成人有明显不同,造成方法开发时存在一定局限性。HPLC的前处理较为简单,但使得检测结果易受到血浆基质效应的影响,检测背景偏高。这可能是造成HPLC的测定值高于CMIA的原因。
比较两种分析方法时,除了关注两种方法的测定值是否相关以外,更重要的是考察两者的差异程度。研究方法主要有回归法和图解法。回归法分析中,最小二乘法易受到数据的分布形态、线性关系、异常值等因素的影响,此外,最小二乘法假定测量方法不存在误差。考虑到这些局限性,在比较仪器分析方法结果时,宜采用Passing-Bablok回归等[7-9]。在差值呈正态分布的前提下,可使用Bland-Altman偏差图法直观地反映两种检测方法之间的差异性[10-11]。
综上所述,临床均可应用HPLC与CMIA监测新生儿万古霉素血药浓度,两种方法所得结果相关性较好,但差异明显,使用二者的检测结果以及在阅读万古霉素血药浓度测定相关专业文献时,需要考虑检测方法的差异,临床上也应避免跨系统监测。
[1] 陈新谦,金有豫,汤光.新编药物学[M].17版.北京:人民卫生出版社,2011:86.
[2] 印晓星.治疗药物监测[M].人民军医出版社,2011:125-126.
[3] Jacqz-Aigrain E, Zhao W, Sharland M, et al. Use of antibacterial agents in the neonate:50 years of experience with vancomycin administration[J].Semin Fetal Neonatal Med,2013,18(1):28-34.
[4] 翁心华,黄仲义,陈佰义,等.万古霉素临床应用中国专家共识(2011版)[J].中国新药与临床杂志,2011,30(8):561-573.
[5] 孙秀漫,姜顺军,曾彩芳.HPLC法与CMIA法测定万古霉素血药浓度的比较[J].今日药学,2016,26(11):779-782.
[6] Oyaert M, Peersman N, Kiedder D, et al.Novel LC-MS/ MS method for plasma vancomycin: comparison with immunoassays and clinical impact[J].Clin Chim Acta, 2015, 441:63-70.
[7] Bilic-Zulle L.Comparison of methods: Passing and Bablok regression[J].Biochem Med(Zagreb) 2011, 21(1):49-52.
[8] Bablok W, Passing H. Application of statistical procedures in analytical instrument testing[J].J Automat Chem, 1985,7(2):74-79.
[9] 焦正,张明,仲珑瑾,等.两种单克隆抗体荧光免疫偏振法测定人全血中环孢素浓度的比较[J].中国医院药学杂志,2006,26(7):789-791.
[10] Bland JM, Altman DG. Measuring agreement in method comparison studies[J]. Stat Methods Med Res,1999,8(2):135-160.
[11] 陈卉. Bland-Altman分析在临床测量方法一致性评价中的应用[J].中国卫生统计,2007,24(3):308-309,315.
本文编辑:鲁守琴
The Comparative Study of Comparing Chemiluminescent Micro-particle Immunoassay (CMIA) and High Performance Liquid Chromatography (HPLC) for Determination of Serum Vancomycin Concentrations from Neonates
Tang Zhe, Wang Fei, Tong Xin, Jia Yan-yan
(Obstetrics and Gynecology Hospital Affliated to Nanjing Medical University, Jiangsu Nanjing 210004,China)
Objective:To compare the difference and correlation of Chemiluminescent Micro-particle Immunoassay (CMIA) and High Performance Liquid Chromatography (HPLC) for determination of serum vancomycin concentrations from neonates. Methods:A HPLC method to determine vancomycin serum concentrations from neonates was established and verified. The plasma sample of vancomycin in peak valley concentration were collected and detected by CMIA and HPLC, respectively. At last, the similarities and differences of two methods were compared. Results:The significant difference was existed between this two methods (P<0.05), and the average concentrations of HPLC was higher than CMIA. The Pass-Bablok regression indicated that the correlation of two methods was satisfactory while the consistency was limited. Conclusion:The signifcant difference is existed between two methods when vancomycin serum samples from neonates are analyzed by CMIA and HPLC. More attention should be paid to monitoring serum concentration in clinical, and cross-system monitoring should be avoided.
Chemiluminescent Micro-particle Immunoassay (CMIA); High Performance Liquid Chromatography (HPLC); Vancomycin; Neonates; Blood Concentration Monitoring
R969;R927.2
A
10.3969/j.issn.2096-3327.2017.07.018
2017 - 05 - 08
南京药学会-常州四药医院药学科研基金(2015YX013)
唐喆,女,硕士,主管药师。研究方向:药物分析。E-mail:tjj870520@hotmail.com
王菲,女,副主任药师。研究方向:医院药学。E-mail:361998364@qq.com

