陆地棉脱水素蛋白GhDHN1的结构特征和无序性分析
王俊娟,阴祖军,王德龙,王帅,王晓歌,樊伟丽,郭丽雪,陈超,叶武威
(中国农业科学院棉花研究所/棉花生物学国家重点实验室/农业部棉花生物学与遗传育种重点实验室,河南安阳455000)
陆地棉脱水素蛋白GhDHN1的结构特征和无序性分析
王俊娟,阴祖军,王德龙,王帅,王晓歌,樊伟丽,郭丽雪,陈超,叶武威*
(中国农业科学院棉花研究所/棉花生物学国家重点实验室/农业部棉花生物学与遗传育种重点实验室,河南安阳455000)
利用生物信息学对陆地棉脱水素蛋白GhDHN1的氨基酸组成理化性质、保守结构域K片段以及无序性进行分析。结果表明,GhDHN1蛋白无明显跨膜结构,不是分泌蛋白,其2个序列相近的K片段均具有高度亲水性,属于部分无序性蛋白。推测GhDHN1的这些结构特性与其调控棉花响应低温胁迫有关。
棉花;脱水素蛋白GhDHN1;结构特征;K片段;无序性
脱水素属胚胎发育晚期丰富蛋白 (Lateembryogenesisabundant protein,LEA)第二家族成员[1],是植物中广泛存在的亲水性蛋白,与植物抗逆密切相关[2]。脱水素蛋白具有很强的热稳定性,在非生物逆境下可以稳定植物细胞膜结构[3]。脱水素的结构是其行使功能的前提条件,脱水素的K片段所形成的双亲性螺旋与部分变性蛋白的疏水位点相结合,起到类似于分子伴侶的作用[4]。笔者团队在陆地棉(Gossypium hirsutumL.)3叶期的真叶中克隆了棉花脱水素基因GhDHN1,试验结果显示,GhDHN1响应低温胁迫,在抗冷材料和冷敏感材料中表达水平差异显著,其表达量与棉花的抗冷性呈正相关[5]。研究还表明,GhDHN1编码的蛋白含有211个氨基酸,预测相对分子质量为23.79 kD,等电点为5.04;GhDHN1的二级结构α螺旋包含116个氨基酸残基,组成该蛋白的主体结构。但GhDHN1蛋白在棉花抗冷中所行使的具体功能尚需进一步研究,其蛋白质性质与其功能的关系尚不清楚。本研究对GhDHN1蛋白的结构特性和无序性进行分析,为探索脱水素蛋白GhDHN1的分子功能奠定基础。
1 材料与方法
1.1 供试数据库和脱水素蛋白GhDHN1序列的获取
从已公布的陆地棉基因组数据库[6](http://cgp.ge
nomics.org.cn/page/species/index.jsp)以及王俊娟等[5]研究结果获得所需要的棉花脱水素蛋白GhDHN1序列(序列号:CotAD_58358)。
1.2 方法
1.2.1 脱水素蛋白GhDHN1跨膜结构和信号肽分析。利用在线工具TMHMM Server(http://www.cbs. dtu.dk/services/TMHMM-2.0)分析GhDHN1的跨膜结构;利用在线工具SignalP Server(http://www. cbs.dtu.dk/services/SignalP-2.0/)分析GhDHN1蛋白质N端的信号肽。
1.2.2 脱水素蛋白GhDHN1核心结构域分析。用在线 Needle软件(http://www.ebi.ac.uk/Tools/psa/emboss_needle/nucleotide.html)将 Close[7]报道的脱水素结构域序列与GhDHN1蛋白质序列进行全局比对,分析GhDHN1保守结构域。
1.2.3GhDHN1蛋白功能结构示意图绘制。利用在线功能结构域制图软件DOG1.0[8](http://ibs.biocuckoo.org/online.php)绘制。
1.2.4 脱水素蛋白GhDHN1固有无序性研究。利用在线工具PONDR○RVL-XT[9](Predictors of Natural Disordered Regions,http://www.pondr.com/)分析GhDHN1蛋白的固有无序性。
2 结果与分析
2.1 脱水素蛋白GhDHN1跨膜结构和信号肽分析
由图1可以看出,GhDHN1无明显跨膜结构域(图1A),不属于跨膜蛋白,这与其具有高度亲水性的特性相符合;其N端没有信号肽段(图1B),说明GhDHN1不属于分泌蛋白。
2.2 脱水素蛋白GhDHN1核心结构域特性分析
K片段是1段由15个氨基酸残基组成的富含赖氨酸的结构域(EKKGIMDKIKEKLPG),是脱水素DHN的特征结构,每个脱水素蛋白中至少含1个K片段[10]。通过对GhDHN1与NCBI上报道的脱水素蛋白序列进行多重比较发现,依据Close[7]报道的脱水素结构域序列与GhDHN1蛋白质序列进行全局序列比对,发现GhDHN1的N端第81~88个氨基酸残基之间含有1个保守的S片段 (由8个连续的丝氨酸组成:SSSSSSSS),C端含有2个K片段,分别为位于144~158位的EKKGFLEKIKEKLPG和位于185~199的EKKGILEKIKEKLPG,分别记为K1和K2,不含Y片段(图1),符合SKn类型脱水素结构特点[7]。进一步分析表明,GhDHN1的K1的氨基酸残基组成,与大多数物种脱水素的共有结构K片段(EKKGIMDKIKEKLPG)的相似性为93.3.0%,一致性为80.0%,有3个氨基酸残基的差异,而K2的氨基酸残基组成与后者的相似性为100%,一致性为86.7%,有2个氨基酸残基不同。GhDHN1的2个K片段之间只有1个氨基酸残基不同。进一步对其理化性质进行分析发现,GhDHN1的2个K片段均富含带电和极性氨基酸,其中赖氨酸含量为33.3%,谷氨酸含量为20.0%,甘氨酸含量为13.3%,说明GhDHN1蛋白的K片段具有高度亲水性,与高粱(Sorghum bicolor)的脱水素蛋白SbDHN1的K片段特性很相似[11]。
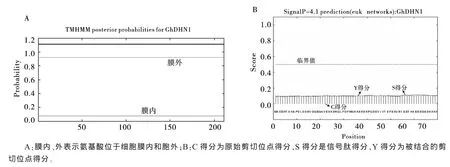
图1 GhDHN1蛋白的跨膜结构和信号肽分析示意图
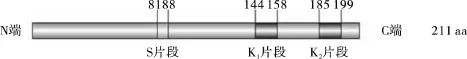
图2 GhDHN1蛋白结构域示意图
2.3 脱水素蛋白GhDHN1的无序性分析
通过无序性分析软件PONDR[9]对GhDHN1蛋白结构进行无序性分析,输出结果(图3)显示GhDHN1是1个固有无序性蛋白(Intrinsically disordered protein,IDP)。图3中纵坐标预测值大于0.5的认为趋于无序分布,小于0.5趋于有序分布[9]。图3显示,GhDHN1的211个氨基酸残基中,有109个是无序的,占总氨基酸残基数的51.66%,含有5个无序区域,分别位于氨基酸残基1~27,72~113,128~138,164~180和200~211之间,最长的无序区域位于氨基酸残基72~113之间(图3中画黑粗线的区域),包含有42个氨基酸残基。这些结果说明GhDHN1是1个部分无序蛋白。

图3 脱水素蛋白GhDHN1的PONDR预测结果
3 讨论
脱水素蛋白是高度亲水性蛋白,在植物中响应干旱、低温、盐等造成的渗透胁迫[12],其序列富含带电和极性氨基酸残基,缺少不带电荷和非极性氨基酸残基如色氨酸和半胱氨酸[13],特别是其保守结构域K片段富含赖氨酸,可形成α-双螺旋两亲的二级结构,这种结构具有亲水性和疏水性的双重特征[7],可与膜和蛋白相互作用,在植物遭遇渗透胁迫时起稳定细胞膜结构的作用[14],而Y片段一般不与膜结合,与植物的抗冷性关系不密切[15]。冷胁迫对植物造成的最大伤害主要是对细胞膜的损伤[16-17],K片段富含带正电荷的赖氨酸,与带负电荷的细胞膜脂质头部基团相互作用,起稳定细胞膜作用[18],可使细胞膜在低温下保持流动性,使其在低温条件下也能正常发挥作用[19]。本研究表明GhDHN1含有2个K片段,不含Y片段,这与笔者团队前期的研究结果相一致,即GhDHN1表达的蛋白可能在细胞膜附近行使功能,调控棉花响应低温胁迫[5],据推测,这些功能与其含有2个K片段的结构具有一定相关性。
脱水素缺少有序的三级结构,属于IDP,可以在水分胁迫过程中或在低温条件下阻止蛋白质或酶的变性[20-21],具有IDP性质的脱水素会在清除自由基和结合金属离子方面发挥双重作用[12,22]。本研究中 PONDR的输出结果显示棉花脱水素GhDHN1属于部分无序性蛋白,推测是由于GhDHN1蛋白质结构的无序性,使其在低温胁迫下具有更高的结构弹性和适应性,容易与细胞膜中的酸性磷酸脂特异结合,对细胞膜起保护作用[23],从而使GhDHN1的积累与棉花的抗冷性呈正相关[5],减轻低温胁迫对棉花的伤害。
[1]Dure L,Crouch M,Harada J,et al.Common amino acid sequence domains among the lea proteins of higher plants [J].Plant Molecular Biology,1989,12(5):475-486.
[2]Graether S P,Boddington K F.Disorder and function:a review of the dehydrin protein family[J].Frontiers in Plant Science,2014,5(5):576.
[3]Hanin M,Brini F,Ebel C,et al.Plant dehydrins and stress tolerance:Versatile proteins for complex mechanisms[J]. Plant Signaling&Behavior,2011,6(10):1503-1509.
[4]Kovacs D,Kalmar E,Torok Z,et al.Chaperone activity of ERD10 and ERD14,two disordered stress-related plant proteins[J].Plant Physiology,2008,147(1):381-390.
[5]王俊娟,穆敏,王帅,等.棉花脱水素GhDHN1的克隆及其表达[J].中国农业科学,2016,49(15):2867-2878.
[6]Li Fuguang,Fan Guangyi,Lu Cairui,et al.Genome sequence of cultivated upland cotton (Gossypium hirsutum TM-1)provides insights into genome evolution[J].Nature Biotechnology,2015,33(5):524-530.
[7]Close T J.Dehydrins:Emergence of a biochemical role of a family of plant dehydration proteins[J].Physiologia Plantarum,1996,97(4):795-803.
[8]Ren Jian,Wen Longping,Gao Xinjiao,et al.DOG 1.0:illustrator of protein domain structures[J].Cell Research, 2009,19(2):271-273.
[9]Romero P,Obradovic Z,Li Xiaohong,et al.Sequence complexity of disordered protein[J].Protein,2001,42(1):38-48. [10]Close T J.Dehydrins:A commonalty in the response of plants to dehydration and low temperature[J].Physiologia Plantarum,1997,100(2):291-296.
[11]Lakshmi T V,Varalaxmi Y,Yadav S K,et al.Metabolic engineering of SK2-type of dehydrin1(DHN1)gene isolated from Sorghum bicolorenhances tolerance to water-deficit and NaCl stresses in transgenic tobacco[J].Plant Omics Journal,2015,8(6):556-564.
[12]Hara M.Metal binding by citrus dehydrin with histidine-rich domains[J].Journal of Experimental Botany, 2005,56(420):2695-2703.
[13]Rahman L N,Chen Lin,Nazim S,et al.Interactions of intrinsically disorderedThellungiella salsugineadehydrins TsDHN-1 and TsDHN-2 with membranes-synergistic effects of lipid composition and temperature on secondary structure[J].Biochemistry&Cell Biology,2010,88(5): 791-807.
[14]Epand R M,Shai Y,Segrest J P,et al.Mechanisms for the modulation of membrane bilayer properties by amphipathic helical peptides[J].Biopolymers,1995,37(5):319-338. [15]Lin C H,Peng P H,Ko C Y,et al.Characterization of a novel Y2K-type dehydrin VrDhn1 fromVigna radiata[J]. Plant&Cell Physiology,2012,53(5):930-942.
[16]Steponkus P L.Role of the plasma membrane in freezing injury and cold acclimation[J].Annual Review of Plant Biology,2003,35(1):543-584.
[17]王俊娟,王帅,陆许可,等.棉花幼苗对低温胁迫的响应及抗冷机制初步研究[J].棉花学报,2017,29(2):147-156.
[18]Koag M C,Wilkens S,Fenton R D,et al.
28
The Structure and Disordered Characteristics of GhDHN1 from Upland Cotton
Wang Junjuan,Yin Zujun,Wang Delong,Wang Shuai,Wang Xiaoge,Fan Weili,Guo Lixue,Chen Chao,Ye Wuwei*
Q754:S562.01
A
1000-632X(2017)08-0017-04
10.11963/1000-632X.wjjyww.20170821
2017-04-27 *通信作者:yew158@163.com
国家重点研发计划 “七大农作物育种”(2016YFD0100203)

