一株异养硝化细菌TT1的分离鉴定及其硝化特性
褚文珂,谢蔚鹏,黄 媛,陈 敏
(杭州师范大学生命与环境科学学院,浙江 杭州310036)
一株异养硝化细菌TT1的分离鉴定及其硝化特性
褚文珂,谢蔚鹏,黄 媛,陈 敏
(杭州师范大学生命与环境科学学院,浙江 杭州310036)
利用富集培养和平板分离的方法,从西溪湿地土壤中分离得到一株高效异养硝化细菌TT1.通过形态观察、生理生化反应以及16S rRNA基因序列分析,鉴定该菌株为假单胞菌属(Pseudomonas).硝化特性研究结果表明,碳源、C/N、温度等因素均对氨氮去除有较大的影响.在乙酸钠为碳源、C/N为11、转速140 r/min、pH 7~9及温度35 ℃时脱氮效果最佳,24 h的氨氮去除率为100%.
异养硝化细菌;鉴定;16S rRNA;硝化作用
随着工农业生产的发展,我国污水的排放总量不断增加,其中的氮素是造成水体污染的主要原因之一.目前,含氮污水的处理技术可分物化法和生物脱氮法,前者因需要增加设备投资,且操作复杂,对有机物无法同时去除,还会带来二次污染等问题,在实际运用中受到一定的局限.生物脱氮法以其操作简单、成本低、不易造成环境污染、除氮效果较好等多方面的优点,被公认为是最有发展前途的方法[1].
生物脱氮传统理论认为脱氮包括好氧硝化和缺氧反硝化两个过程,且自养型硝化细菌在硝化作用过程中占据主要地位.但近年来的许多研究发现,一些异养细菌也能进行硝化作用,包括粪产碱菌(Alcaligenesfaecalis)[2], 乙酸钙不动杆菌(Acinetobactercalcoaceticus)[3],木糖氧化无色杆菌(Achromobacterxylosoxidans)[4]等.与自养硝化细菌相比,异养硝化菌具有生长速率快、对环境适应能力强等优点[5].本研究以杭州西溪国家湿地公园中的土壤细菌为研究对象,分离筛选出能高效脱氮的异养硝化细菌,旨在为高效异养硝化菌处理污染废水提供理论参考.
1 材料与方法
1.1 土壤样品
土壤样品采自杭州西溪国家湿地公园.取表层土壤(0~10 cm),4 ℃冰箱保存,用于富集分离.
1.2 培养基
富集培养基:柠檬酸三钠9.0 g/L、(NH4)2SO42.0 g/L、NaNO22.0 g/L、NaCl 1.0 g/L、FeSO4·7H2O 0.4 g/L、K2HPO41.0 g/L、KH2PO40.4 g/L、MgSO4·7H2O 0.5 g/L,pH 7.3.
分离培养基:氮源仅加(NH4)2SO4,琼脂粉20.0 g,其余成分同富集培养基.
异养硝化菌培养基:(NH4)2SO40.5 g/L、NaNO20.5 g/L、乙酸钠7.5 g/L、维式盐50.0 mL,pH 7.0.维式盐溶液:K2HPO45.0 g/L,MgSO4· 7H2O 2.5 g/L,NaCl 2.5 g/L,FeSO4· 7H2O 0.05 g/L,MnSO4·4H2O 0.05 g/L.
1.3 细菌分离
取10 g土壤样品加入100 mL富集培养基中,30 ℃、160 r/min摇床上振荡培养.取富集培养液适当稀释后接种于分离培养基平板上,30 ℃下培养1 d,待形成菌落后挑取单菌落,在平板上划线分离纯化,4 ℃斜面保存.
1.4 异养硝化细菌筛选
将上述分离得到的菌株接种到富集培养基中,30 ℃摇床培养24 h,5000 r/min离心10 min,弃上清,再用0.85%生理盐水洗涤沉淀,再次离心,如此重复3次,以去除菌体培养过程中产生的无机氮素,最后用0.85%生理盐水制备菌悬液,按1%接种到异养硝化细菌培养基中,置于30 ℃,150 r/min摇床培养48 h.取1 mL培养液,加入少量奈斯勒试剂,混匀后观察颜色变化.若培养液中铵离子浓度高,会呈现黄色或棕色;反之,无色.取上述呈现无色的培养液20 mL,于3000 r/min离心10 min,测定上清液中的氨氮含量,未接种的培养基为对照,计算脱氮率,选取脱氮效果最好的菌株.
1.5 细菌鉴定
1.5.1 形态和生理生化实验
菌株的形态观察和生理生化实验根据《常见细菌系统鉴定手册》[6]进行.
1.5.2 16S rRNA序列分析
提取基因组DNA,以基因组DNA为模板扩增.采用细菌通用引物进行菌株16S rDNA基因的V3、V4可变区扩增.细菌通用引物,正向引物为:22F:5’-AGAGTTTGATCCTGGCTCAG -3’;反向引物为1492R:5’-TACGGCTACCTTGTTACGACTT-3’.PCR反应体系(25 μL)为:ddH2O 15.25 μL,10×PCR Buffer 2.5 μL,25 mm MgCl21.5 μL,2.5 mm dNTPs 2.0 μL,引物27F和1492R各0.5 μL,Taq 聚合酶 0.25 μL,模板DNA 2.5 μL.将PCR产物送上海英骏生物公司测序.
测序所得序列用Blast搜索相似性较高的模式菌株及其16S rRNA基因序列,并应用MEGA 6.06软件采用邻接法(Neighbor-Joining)绘制系统发育树.
1.6 异养硝化活性测定
菌株接种到100 mL异养硝化培养基中,置于30 ℃,160 r/min恒温摇床培养.每隔4 h取样测定培养液的OD600以及上清液中的NH4+-N 、NO3--N和NO2--N的含量.
1.7 脱氮特性研究
1.7.1 碳源对菌株脱氮的影响
在异养硝化培养基中分别添加乙酸钠、丁二酸钠、葡萄糖和柠檬酸三钠作为碳源,并使培养基的C/N都达到 11,其余成分均相同.取菌悬液1 mL,分别接种到100 mL不同碳源的异养硝化培养基中,培养24 h后检测培养液的NH4+-N浓度以及OD600.
1.7.2 C/N对脱氮效果的影响
根据上述结果选取最佳碳源,设置C/N分别为9、11、13、15、17,其余步骤同1.7.1.
1.7.3 pH对脱氮效果的影响
在上述最佳碳源、C/N条件下,用HCl和NaOH溶液将异养硝化培养基pH分别调为5.0、6.0、7.0、8.0、9.0,其余步骤同1.7.1.
1.7.4 温度对脱氮效果的影响
在上述最佳碳源、C/N和pH条件下,设置温度梯度为25 ℃、30 ℃、35 ℃、40 ℃,其余步骤同1.7.1.
1.7.5 溶氧量对脱氮效果的影响:
在上述最佳碳源、C/N、pH和温度条件下,通过改变摇床转速来改变培养基的溶氧量.转速分别设为120、140、160、180和200 r/min.其余步骤同1.7.1.
1.8 分析方法
NH4+-N的测定采用纳氏试剂分光光度法;NO2--N的测定采用N-(1-萘基)-乙二胺分光光度法;NO3--N的测定采用紫外分光光度法;菌体生长的测定采用浊度法(OD600);pH值的测定采用pH计[7].
降解率计算公式:η=(C1-C2)/C1,式中η为NH4+-N、NO2--N和NO3--N的降解率;C1、C2分别为未接种的对照组和接种的实验组NH4+-N、NO2--N和NO3--N的浓度,单位mg/L.
2 结果与分析
2.1 菌株的形态鉴定
通过富集分离,筛选得到1株高效异养硝化细菌,编号为TT1.菌体呈短杆状,革兰氏染色阴性.菌落呈黄色,表面光滑,湿润,不透明,边缘形状不规则.菌株的生理生化特性见表1.
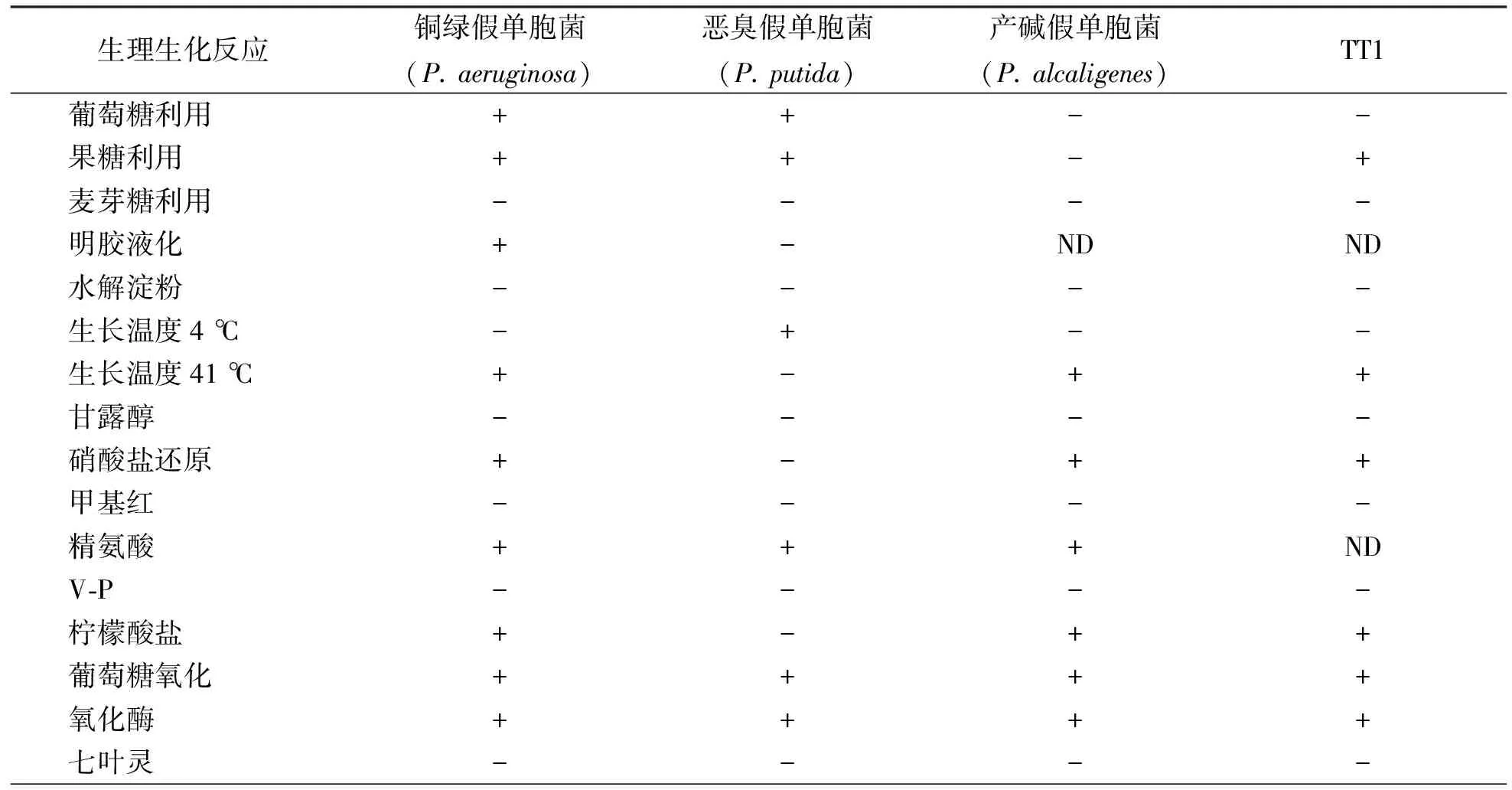
表1 菌株TT1的生理生化特性
注:“+”阳性;“-”阴性;“ND”不确定.
2.2 16S rRNA基因序列分析
菌株TT1的16S rRNA序列在GenBank的登录号为KY178286,经BLAST与数据库中的基因序列进行比较,发现TT1与假单胞菌属(Pseudomonas)的多个菌株同源性达99.9%.从GenBank中取得相关序列作为参考序列,构建系统发育树如图1所示.结合菌株的形态学、生理生化特性和16S rRNA基因测序,初步鉴定菌株TT1属于假单胞菌属(Pseudomonas).
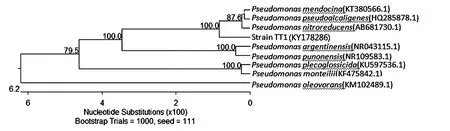
图1 基于16S rRNA基因的系统发育树Fig.1 Phylogenetic tree based on 16S rRNA sequence homology
2.3 菌株TT1的生长曲线和脱氮特性
在异养硝化细菌培养基中培养TT1菌株,观察其生长过程及培养基pH的变化.如图2所示,在培养最初8 h内细菌增殖速率缓慢;在8 h后,迅速进入对数生长期,并在28 h左右到达稳定期,OD600值达到最高.同时随着细菌的生长,培养液的pH值也随之增高,由起始时的7.0上升到最高时的8.8.

图2 菌株TT1的生长曲线和pH值变化Fig.2 Growth curve of strain TT1 and the changes of pH during cultivation
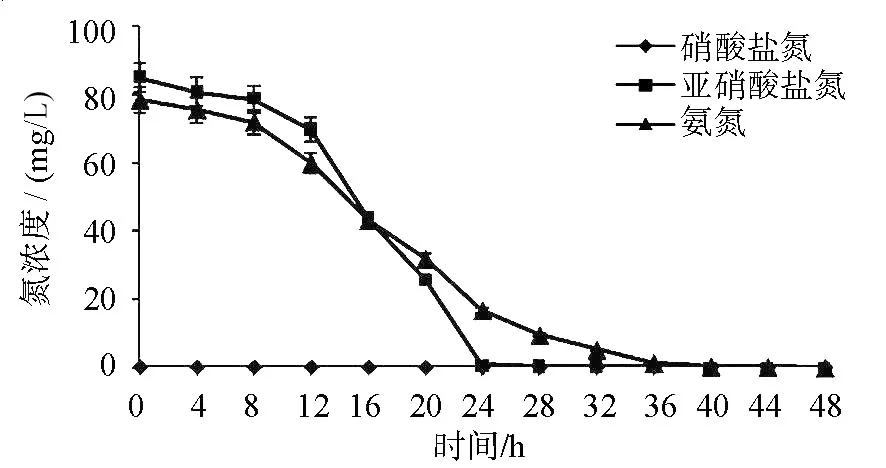
图3 菌株TT1的异养硝化过程Fig.3 Heterotrophic nitrification process of strain TT1
脱氮特性研究结果(图3)显示,NH4+-N和NO2--N在对数生长期和稳定期初期去除速率最快,28 h氨氮的去除率达到86.8%,亚硝酸盐氮去除率达到99.3%,且在降解过程中没有检测到硝酸盐氮的积累,可能是因为TT1菌株同时具有好氧反硝化的功能,能将硝态氮分解为N2O、N2等气体而去除.相关特性有待进一步研究.
2.4 环境条件对TT1菌株脱氮的影响
2.4.1 碳源对脱氮效果的影响
将菌株TT1接入不同碳源的异氧硝化培养基中,经过24 h的培养后,检测培养液的NH4+-N浓度.结果显示:以乙酸钠为碳源时,NH4+-N去除率最高,为93.4%;其次是柠檬酸三钠为碳源,NH4+-N去除率为79.6%;葡萄糖为碳源时,NH4+-N去除率最低,只有31%.从细菌生长来看,柠檬酸三钠为碳源时生长量最高,其次是乙酸钠,说明细菌的生长量和氨氮去除率之间并非始终是平行关系,从脱氮效果来看,最佳碳源应该是乙酸钠.

图4 碳源种类对菌株TT1生长及NH4+-N去除率的影响Fig.4 Effect of carbon source on growth and NH4+-N degradation rate of strain TT1
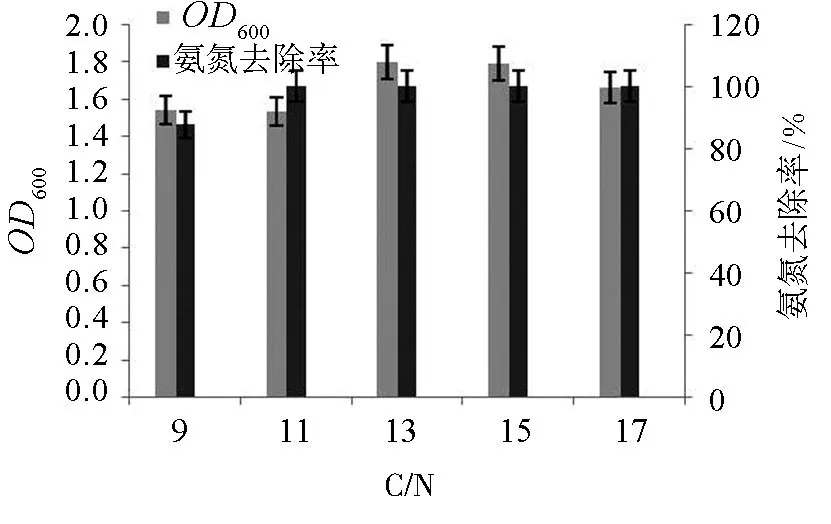
图5 C/N比对菌株TT1生长及NH4+-N去除率的影响Fig.5 Effect of C/N ratio on growth and NH4+-N degradation rate of strain TT1
2.4.2 C/N对脱氮效果的影响
如图5所示,在C/N为9时,其NH4+-N去除率为88.4%;C/N为11、13、15、17时,NH4+-N去除率均达到100%.从细菌生长量来看,不同的C/N的培养基中的OD600都较高,都在1.5以上,其中C/N为13的OD600值最高为1.80.综合考虑成本等因素,建议培养基的C/N 为11较好.
2.4.3 温度对脱氮效果的影响
设置不同培养温度,24 h后氨氮去除率试验结果(图6)表明,当温度在35 ℃以下,菌株生物量和NH4+-N去除率随温度的升高而增大,在35 ℃时达到最大值.这与Mahendrappa等[10]对美国南部的土壤硝化作用的研究相似,其硝化作用的最适温度为35 ℃.但是当温度达到40 ℃时,菌株生物量和NH4+-N去除率明显下降,表明该菌株不耐高温.同时异氧硝化菌的适宜温度范围可能因不同温度带湿地土壤的环境而有所不同.

图6 温度对菌株TT1生长及NH4+-N去除率的影响Fig.6 Effect of temperature on growth and NH4+-N degradation rate of strain TT1

图7 pH对菌株TT1生长及NH4+-N去除率的影响Fig.7 Effect of pH on growth and NH4+-N degradation rate of strain TT1

图8 转速对菌株TT1生长及NH4+-N去除率的影响Fig.8 Effect of shaking speed on growth and NH4+-N degradation rate of strain TT1
2.4.4 pH对脱氮效果的影响
pH对脱氮效果的影响如图7所示,在pH 7~9范围内,菌株TT1的氨氮去除率都接近100%,但是pH为9时,生长呈下降趋势.而pH为5和6时,菌株TT1基本不生长,其氨氮去除为零.因此,菌株脱氮的最适pH为7~9.
2.4.5 溶氧量对脱氮效果的影响
通过改变摇床转速来改变培养基中的溶氧量,如图8所示,结果表明,在140~200 r/min的范围内,菌株的生长量和氨氮去除率均可达到最高.因此转速为140 r/min比较适宜.
3 讨 论
自20世纪80年代以来,国内外的研究发现,某些假单胞菌例如Peseudomonasflurescens和Pseudomonasaeruginos等具有异养硝化的功能[8-9].不仅如此,研究者还发现很多具有异养硝化功能的细菌同时具有好氧反硝化的功能,能将氨态氮最终转化为可以逸出的气态氮而将其去除[10-11].很多研究表明,同步异养硝化-好氧反硝化细菌在有机物的去除及脱氮效率方面比传统脱氮菌更胜一筹[12].
从TT1菌株脱氮特性的初步研究结果来看,该菌株具有生长快、高效脱氮的特点.在硝化培养基中培养8 h左右进入对数期,OD600最大可达1.8.在乙酸钠为碳源、C/N为11、转速140 r/min、pH 7~9及温度35 ℃时脱氮效果最佳,24 h的氨氮去除率为100%.同时,通过对硝化反应过程中硝态氮和亚硝态氮的含量测定发现,培养基中硝态氮和亚硝态氮几乎没有积累.据此推测,该菌株还可能同时具有较高的好养反硝化能力,相关特性有待进一步研究.
[2] ZHAO B, AN Q, HE Y L, et al. N2O and N2production during heterotrophic nitrification byAlcaligenesfaecalisstrain NR[J]. Bioresource Technology, 2012, 116: 379-385.
[3] SARIOGLU O F, SULUYAYLA R, TEKINAY T. Heterotrophic ammonium removal by a novel hatchery isolateAcinetobactercalcoaceticusSTB1[J]. International Biodeterioration & Biodegradation, 2012, 71: 67-71.
[4] KUNDU P, PRAMANIK A, MITRA S, et al. Heterotrophic nitrification byAchromobacterxylosoxidansS18 isolated from a small-scale slaughterhouse wastewater[J]. Bioprocess and Biosystems Engineering, 2012, 35(5): 721-728.
[5] MATSUZAKA E, NOMURA N, TOSHIAKI N K. A simple screening procedure for heterotrophic nitrifying bacteria with oxygen-tolerant denitrification activity[J]. Journal of Bioscience and Bioengineering, 2003, 95(5): 409-411.
[6] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[7] 国家环境保护局.水和废水监测分析方法[M].3版.北京:中国环境科学出版,1989.
[8] CHEN F, XIA Q, JU L K. Aerobic denitrification ofPseudomonasaeruginosamonitored by online NAD(P)H fluorescence[J]. Applied and Environmental Microbiology, 2003, 69(11): 6715-6722.
[9] JOO H S, HIRAI M, SHODA M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification byAlcaligenesfaecalisNo. 4[J]. Journal of Bioscience and Bioengineering, 2005, 100(2): 184-191.
[10] ROBERTSON L A, KUENEN J G.Thiosphaerapantotrophagen.nov.sp.,a facultatively anaerobic, facultatively autotrophic sulphur bacterium[J]. Journal of General Microbiology, 1983, 129: 2847-2855.
[11] SU J J, LIU B Y, LIU C Y. Comparison of aerobic denitrification under high oxygen atmosphere byThiosphaerapantotrophaATCC35512 andPseudomonasstutzeriSU2 newly isolated from the activated sludge of a piggery wastewater treatment system[J].Journal of Applied Microbiology, 2001, 90(3): 457-462.
[12] CHEN M, WANG W, FENG Y, et al. Impact resistance of different factors on ammonia removal by heterotrophic nitrification-aerobic denitrification bacteriumAeromonassp HN-02[J]. Bioresource Technology, 2014, 167(3):456-461.
Isolation,Identification and Nitrifying Characterization of a Heterotrophic Nitrifying Bacterium TT1
CHU Wenke, XIE Weipeng, HUANG Yuan, CHEN Min
(College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China)
A high efficiency heterotrophic nitrifying bacterium TT1 was isolated from the soil of Xixi Wetland by enrichment culture and plate separation. The strain was identified asPseudomonassp. through morphological feature, biochemical characteristics and 16S rRNA sequence analysis. The factors including carbon source, C/N and cultivation temperature were important for the removal of ammonia nitrogen. The optimum condition for heterotrophic nitrification was as follows, sodium acetate as the carbon source, C/N ratio of 11, shaking speed of 140 r/min, pH of 7-9 and culture temperature of 35 ℃. The removal rate of ammonia nitrogen reached 100% after 24 h cultivation under the optimum condition.
heterotrophic nitrifying bacteria; identification; 16S rRNA; nitrification
2016-12-12
浙江省自然科学基金项目(LY14C010004).
陈 敏(1963—),女,教授,主要从事环境微生物研究.E-mail:mchen63@163.com
10.3969/j.issn.1674-232X.2017.04.011
Q938
A
1674-232X(2017)04-0404-06

