熊果酸和粉防己碱对肿瘤相关信号通路的互补抑制及其协同抗肿瘤增殖作用研究
石荣珍 李世发 高建莉
浙江中医药大学 杭州 310053
熊果酸和粉防己碱对肿瘤相关信号通路的互补抑制及其协同抗肿瘤增殖作用研究
石荣珍 李世发 高建莉
浙江中医药大学 杭州 310053
[目的]通过分析中药活性成分对肿瘤相关的多条信号通路抑制作用的差异,研究对信号通路抑制作用存在互补现象的两个化合物熊果酸(ursolic acid,UA)和粉防己碱(tetrandrine,Tet)协同抗肿瘤增殖的作用及其最优配比。[方法]运用多信号通路报告基因技术,研究5个具有抗肿瘤活性的化合物千金藤碱(cepharanthine,Cep)、Tet、18α-甘草酸(18α-glycyrrhetinic acid,18α-Gly)、UA、木犀草素(luteolin,Lut)对肿瘤相关的MAPK/ ERK、MAPK/JNK、NF-κB、Wnt、Notch、Cell Cycle、Myc/Max以及Hypoxia信号通路活化程度的影响;采用MTT法和结晶紫法研究由Cep、Tet、18α-Gly、UA、Lut组成的15个不同化合物组合对人肿瘤细胞MDA-MB-231、SW480、MG63、PC3、DU145、HCT116、143B、MDA-MB-468的抗增殖作用;运用两药相互作用指数(coefficient of drug interaction,CDI)法筛选存在协同增效作用的化合物组合;采用等效线法和合用指数(combination index,CI)法筛选该组合协同抗肿瘤细胞增殖的最优配比。[结果]信号通路报告基因实验发现化合物组合UA+Tet对与肿瘤相关的8条信号通路活化的抑制作用存在互补,提示UA和Tet之间可能具有协同抗肿瘤细胞增殖作用。CDI法验证后发现UA和Tet具有协同抗肿瘤细胞增殖作用。等效线法、CI法分析得出UA与Tet最佳浓度比为9:1。[结论]UA、Tet对8条肿瘤相关信号通路具有抑制互补作用,用MTT、结晶紫等不同方法证实二者协同抗增殖作用,并筛选出UA和Tet的最优配比,这为研发抗癌复方提供了新的思路。
协同作用;信号通路互补;UA;Tet;抗肿瘤;药物组合;报告基因;最佳配比
多种药物联合作用是肿瘤治疗的常见方法,可以增加药物疗效,降低药物剂量,减少药物毒性,并且可以尽可能防止耐药性的产生[1-3]。研究表明,肿瘤的发生发展与相关信号通路的激活密切相关,MAPK/ ERK、MAPK/JNK、NF-κB、Wnt、Notch、Cell Cycle、Myc/ Max以及Hypoxia等信号通路均与肿瘤的发生发展密切相关[4-10]。有研究表明千金藤碱(cepharanthine,Cep)、粉防己碱(tetrandrine,Tet)、18α-甘草酸(18αglycyrrhetinic acid,18α-Gly)、熊果酸(ursolic acid,UA)、木犀草素(luteolin,Lut)均具有较强的抗肿瘤作用[10-17]。本研究拟采用报告基因检测上述化合物对与肿瘤相关的8条信号通路活化的影响,并采用MTT法、结晶紫法结合等效线法、合用指数(combination index,CI)法、两药相互作用指数(coefficient of drug interaction,CDI)法分析和验证对信号通路作用互补的化合物是否在抗肿瘤增殖中存在协同增效作用。
1 材料与方法
1.1 主要药物、试剂及仪器 UA、Tet、Cep、18α-Gly、Lut均购自Sigma公司。DMEM培养基、胰蛋白酶(批号:2016030801,杭州吉诺生物医药技术有限公司);胎牛血清(FBS,批号:A66E00F,Gemini,美国);0.4%台盼蓝溶液(批号:20120906,Solarhio);噻唑蓝(MTT,批号:MKBJ2415V,Sigma,美国);二甲基亚砜(DMSO,批号:SHBC2572V,Sigma,美国);结晶紫(批号:20090117,中国上海标本模型厂);乙酸(批号:20120920,杭州化学试剂有限公司);BioLuxRGaussia Luciferase Assay Kit(批号:0441111,New England Biolabs,美国)。培养板、培养皿(BD Falcon);超净工作台(型号:BJ-2CD,上海博迅实业有限公司,中国);荧光倒置显微镜(Olympus,型号:IX71型,日本);二氧化碳培养箱(Thermo Scientific,型号:Series 8000,美国);酶标仪(BioTek公司,型号:PowerWave HT340,美国);单管型多功能检测仪(Promegal公司,型号:E6080,美国)。实验采用的质粒pAmpho等由美国芝加哥大学何通川教授惠赠。
1.2 细胞株与细胞培养 人骨肉瘤细胞143B和MG63,人前列腺癌细胞DU145和PC3,人乳腺癌细胞MDA-MB-231和MDA-MB-468,人结肠癌细胞HCT116和SW480,人肾上皮细胞HEK293,小鼠乳腺癌细胞4T1细胞株均由ATCC(Manassas,VA)提供。上述细胞用DMEM完全培养基(含10%胎牛血清、青霉素1× 105U·L-1、链霉素100mg·L-1),在37°C、饱和湿度及5%CO2的细胞培养箱内培养,待细胞融合至85%时,用0.25%胰蛋白酶(含EDTA)消化,按1:4传代,取对数生长期细胞用于实验。整个实验过程中用台盼蓝染色检测细胞活性。
1.3 MTT法检测不同化合物的细胞毒性作用 取对数生长期的MDA-MB-231、SW480、MG63、PC3、DU145、HCT116、143B、MDA-MB-468细胞,按细胞数1×104/ 100μL接种于96孔板内,培养24h之后,加入浓度分别为100μmol·L-1、50μmol·L-1、25μmol·L-1、12.5μmol· L-1、6.25μmol·L-1、3.125μmol·L-1、1.5625μmol·L-1的化合物进行处理,终体积为200μL/孔,同时设置对照组和空白组,每组3个复孔。培养48h后,每孔加入(5g· L-1)20μL MTT工作液,继续培养4h,弃去孔内培养液,加入DMSO150μL,摇床震荡10min,待沉淀物完全溶解后,用酶联免疫检测仪在波长570nm处读取吸光度值,按公式计算细胞存活率。细胞存活率(%)=(给药组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。采用 SPSS19.0 probite法计算药物半数致死率(IC50)。
1.4 多信号通路报告基因稳定细胞株的构建 为研究与肿瘤发生发展密切相关的8条不同的信号通路,分别构建了针对不同信号通路响应的报告基因质粒。具体步骤详见课题组前期研究[13]。将携带不同信号通路的报告基因质粒的载体,与pAmpho质粒一起转染至HEK293细胞内,36h后收集细胞培养液中相应的逆转录病毒,用其感染靶细胞HCT116。经过抗药性筛选和克隆化培养,可以检测出癌细胞荧光素酶的表达情况。若干代培养后,即成功构建了稳定的细胞株模型。
1.5 不同化合物对信号通路活化程度的研究 采用已构建的插入报告基因质粒的稳定细胞株,按细胞数2×104/孔接种于96孔板。根据前期研究及文献资料[13]设浓度分别为1μmol·L-1、5μmol·L-1、10μmol·L-1的UA、Cep、18α-Gly组,浓度分别为 5μmol·L-1、25 μmol·L-1、50μmol·L-1的Tet、Lut组,以及溶剂对照,每孔终体积为200μL,每组设3复孔。培养2h后,每孔取50μL上清液用于荧光素酶活性的检测。信号通路相对活化程度=给药组荧光信号强度/对照组荧光信号强度×100%。荧光素浓度采用BioLuxRGaussia Luciferase Assay Kit检测,具体步骤可见课题组前期研究[13]。
1.6 结晶紫法评价不同化合物配伍对细胞的抗增殖作用 根据1.3项实验所得不同化合物的IC50,设计不同化合物配比试验。课题组设计15个不同的药物组合,分别为:(1)Cep单独用药组,(2)Cep:Tet=1:1组,(3)Cep:18α-Gly=1:1组,(4)Cep:UA=1:3组,(5)Cep: Lut=1:5组,(6)Tet单独用药组,(7)Tet:18α-Gly=1:1组,(8)Tet:UA=1:3组,(9)Tet:Lut=1:5组,(10)18α-Gly单独用药组,(11)18α-Gly:UA=1:2组,(12)18α-Gly:Lut=1:5组,(13)UA单独用药组,(14)UA:Lut=1: 2.5组,(15)Lut单独用药组。取对数生长期的143B细胞,5×104/孔接种于24孔培养板,培养24h。设溶剂对照组、空白组、不同浓度组,每组设3个复孔。给药后培养48h,弃去培养液,每孔加入300μL 0.2%结晶紫染液,室温染色30min后洗去染料,用20%的醋酸溶液溶解结晶,摇床振摇10min后,酶联免疫检测仪540nm波长下测各孔吸光度。按1.3所述公式计算细胞抑制率。
1.7 CI法、等效线法、CDI法筛选最佳组合和最优配比 设置空白对照组 (仅含等体积0.1%DMSO的培养液)、溶剂对照组(细胞+含等体积0.1%DMSO的培养液)、UA+Tet不同配比给药组。根据本课题组预试验结果,UA、Tet对小鼠4T1细胞的IC50值分别为42.93 μmol·L-1、22.93μmol·L-1。据此设计5个UA与Tet的不同配比组别,两者比例分别为UA:Tet=9:1、3:1、1:1、1:3和1:9。每个组合中,UA和Tet在细胞培养液中对应的浓度分别为:UA90μmol·L-1、75μmol·L-1、50μmol·L-1、25μmol·L-1、10μmol·L-1;Tet 10μmol·L-1、25 μmol·L-1、50μmol·L-1、75μmol·L-1、90μmol·L-1。
1.7.1 CI法 根据公式计算CI,CI=D1/DX1+D2/DX2+ α(D1D2/DX1DX2)[18]。D1、D2为联合用药达到X效应时药物1、药物2的浓度,DX1、DX2为单独用药达到X效应时药物1和药物2的浓度,药物作用机制不同时α=0。CI<1表示协同,CI=1表示相加,CI>1表示拮抗。信号通路研究表明UA、Tet为作用机制不同的药物,故此处α=0。
1.7.2 等效线法 等效线法是用来确定药物之间相互作用的另一种数学方法[19]。细胞协同作用的结果显示为相加等效线。采用药物单用和联用时的IC50分别构建三条曲线:ModeⅠ,ModeⅡa,ModeⅡb,并在图中标明不同组合作用时的数据点。ModeⅡa及ModeⅡb曲线之间为加和囊,数据点在加和囊中,表明药物作用为相加,数据点在加和囊上侧,表明药物作用为拮抗,数据点在加和囊下侧,表明药物作用为增效[3]。
1.7.3 CDI法 根据公式计算CDI:CDI=AB/(A×B)[20]。AB为两药联用时的细胞增殖率,A或B是各个药物单用时的细胞增殖率。CDI<1时增效,CDI>1为拮抗,CDI<0.7时,药物之间的作用为显著增效。
1.8 统计学方法 采用统计分析软件SPSS19.0进行统计学处理。连续型变量用均数±标准差 (means± SD)表示,分别采用单因素方差分析(one-way ANOVA)、两两比较的Student's t-test分析实验结果,P<0.05为差异有统计学意义。
2 结果
2.1 候选化合物对8种人源肿瘤细胞增殖的影响MTT结果分析显示,5个候选化合物能体外抑制多种人源肿瘤的生长,IC50结果见表1。
2.2 候选化合物对8条肿瘤相关信号通路活化的影响 对于Cep、UA、Tet、Lut、18α-Gly等5个化合物进行报告基因实验,根据IC50确定给药浓度。Cep、UA、18α-Gly最高浓度为10μmol·L-1,Lut、Tet最高浓度为50μmol·L-1。各个化合物最高浓度时信号通路激活程度的结果(表2),发现Cep对Notch、NF-κB、MAPK/ JNK、MAPK/ERK通路抑制率达50%以上;18α-Gly对Notch、Cell cycle通路有促进作用;UA对Cell cycle、Wnt、NF-κB、Hypoxia、MAPK/ERK通路抑制率达50%以上;Lut对Wnt、Hypoxia、MAPK/JNK、MAPK/ERK通路抑制率达50%以上;Tet对Notch、MAPK/JNK、Myc/ Max通路抑制率达50%以上。其中UA对Cell cycle、Wnt、NF-κB、Hypoxia、MAPK/ERK通路,Tet对Notch、 MAPK/JNK、Myc/Max通路抑制作用显著,体现出对所有8条肿瘤相关的信号通路抑制作用的互补。
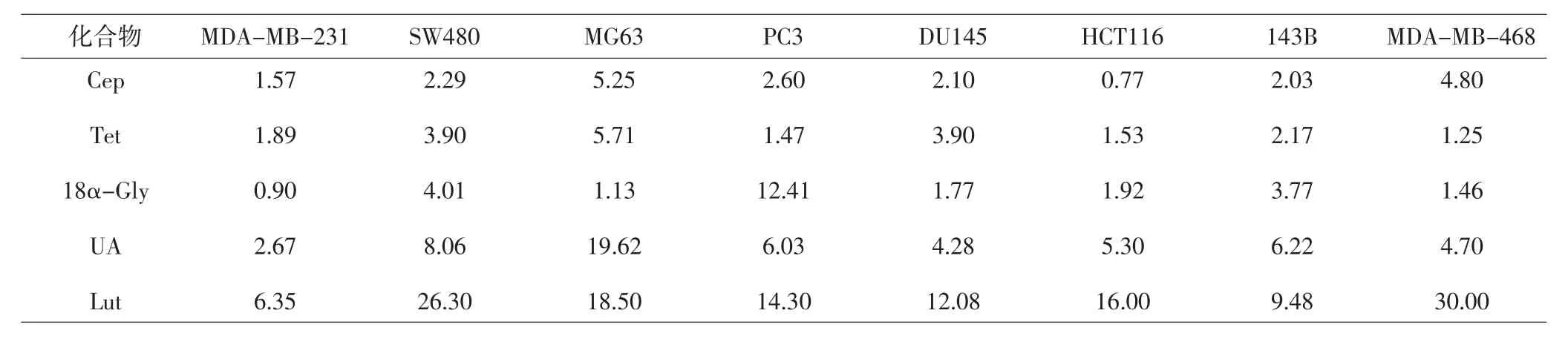
表1 5种候选化合物对8种人源肿瘤细胞的细胞毒性作用(IC50,μmol·L-1)Tab.1 Cytotoxic effects of 5 compounds in 8 human tumor cell lines(IC50,μmol·L-1)
2.3 CDI法验证UA和Tet的协同作用 采用CDI法检测1.6项下的15个化合物组合(UA、Tet、Cep、Lut、18α-Gly单独或联用)对143B的增殖抑制作用。发现15个组合CDI值在0.9±0.12到3.7±1.50之间。其中,Tet:UA为1:3时,CDI值<1,说明UA+Tet有协同抗肿瘤作用。其余各组CDI值均>1,说明存在拮抗作用。
2.4 UA和Tet最佳协同比例的筛选
表2 5种化合物对信号通路的激活程度(±S,%)Tab.2 The activation of signaling pathways for 5 compounds(±S,%)
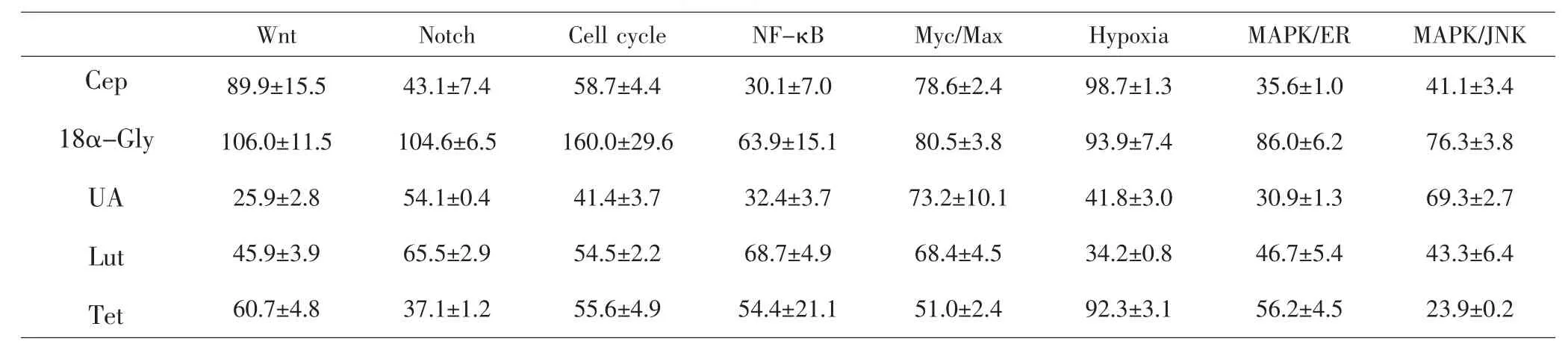
表2 5种化合物对信号通路的激活程度(±S,%)Tab.2 The activation of signaling pathways for 5 compounds(±S,%)
Wnt Notch Cell cycle NF-κB Myc/Max Hypoxia MAPK/ER MAPK/JNK Cep 18α-Gly UA Lut Tet 89.9±15.5 106.0±11.5 25.9±2.8 45.9±3.9 60.7±4.8 43.1±7.4 104.6±6.5 54.1±0.4 65.5±2.9 37.1±1.2 58.7±4.4 160.0±29.6 41.4±3.7 54.5±2.2 55.6±4.9 30.1±7.0 63.9±15.1 32.4±3.7 68.7±4.9 54.4±21.1 78.6±2.4 80.5±3.8 73.2±10.1 68.4±4.5 51.0±2.4 98.7±1.3 93.9±7.4 41.8±3.0 34.2±0.8 92.3±3.1 35.6±1.0 86.0±6.2 30.9±1.3 46.7±5.4 56.2±4.5 41.1±3.4 76.3±3.8 69.3±2.7 43.3±6.4 23.9±0.2
2.4.1 CI法 检测UA:Tet=9:1、3:1、1:1、1:3、1:9时的CI值,结果表明,当UA:Tet=9:1时CI=0.36,增效作用最强。UA和Tet各比例联合应用时的CI值见表3。
2.4.2 等效线法 采用经典isbologram法评价UA和Tet间的相互作用,结果显示UA及Tet不同比例联用数据点位于ModeⅠ下区域内,提示都具有较强的协同增效性。如图1所示,UA:Tet=9:1时的数据点距离加和囊最远,结合CI值分析表明UA:Tet=9:1联用时具有最强的协同效应。
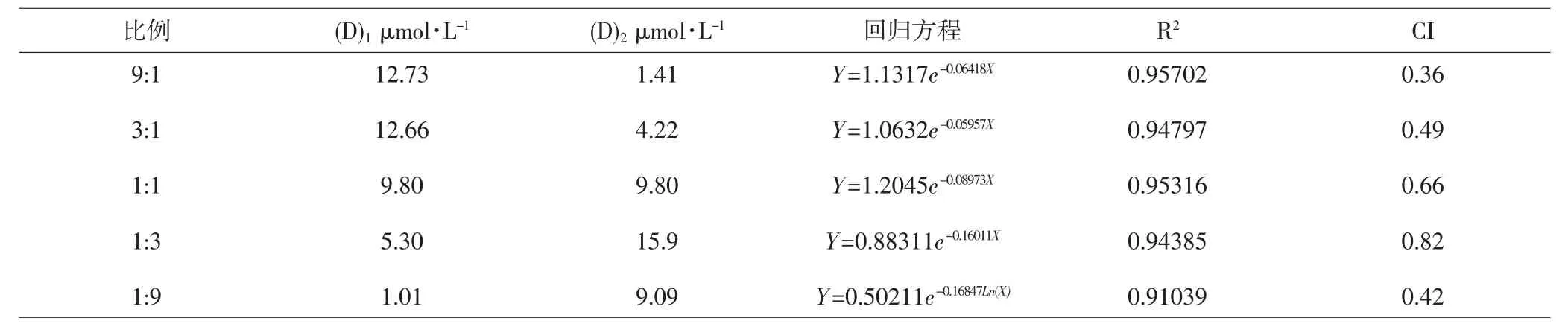
表3 UA和Tet不同比例联用时的CI值Tab.3 CI values of different proportions for UA and Tet
3 讨论
在肿瘤的发生发展中,Wnt、MAPK/JNK、MAPK/ ERK等不同的信号通路发挥了关键的作用。其中MAPK/ ERK、MAPK/JNK、Wnt、Notch、Cell Cycle、Myc/Max、NF-κB以及Hypoxia等8条信号通路与肿瘤关系密切,在不同肿瘤(如乳腺癌、结肠癌、卵巢癌和前列腺癌等)中发挥重要作用[4-10]。新药的研究多针对单靶点和单通路,然而机体往往能调控信号通路之间的“此消彼长”,导致单靶点和单通路的作用在体内常常达不到预期,较易发生耐药反应。基于上述认识,根据信号通路之间的互补作用设计抗肿瘤药物的联合应用方案,可能更有助于快速准确的筛选化疗方案。

图1 等效线法评价UA和Tet间的相互作用Fig.1 Evaluating the drug interaction between UA and Tet by isobologram method
本研究发现UA和Tet对8条肿瘤相关的信号通路的抑制有互补作用。课题组用多种方法进一步分析了这两个药物单独和联合应用时的抗肿瘤细胞增殖作用,研究发现与其它药物组合相比,UA和Tet两者协同作用时细胞的增殖率最低。UA属三萜类化合物,近年来研究表明UA不仅对多种致癌、促癌物有抵抗作用,如鼻咽癌,胃癌,食管癌,肝癌,宫颈癌,肺癌,乳腺癌等[10,21-23]。课题组前期研究表明,UA能通过抑制乳腺癌缺氧及缺氧诱导的髓外造血延缓乳腺癌的肺转移[10]。亦有研究表明UA可通过Wnt通路调控前列腺癌细胞的凋亡[24],与NF-κB信号通路密切相关[25];UA可抑制神经胶质瘤血管内皮细胞的产生,与MAPK/ERK、Myc/Max等信号通路表达相关[26]。Tet是从防己科植物的干燥块根中提取的一种双苄基异喹啉类生物碱。有研究结果表明Tet对乳腺癌,肝癌,胃癌,膀胱癌,结肠癌等具有明显抑制作用[7,12,27-32]。本课题组之前的研究表明Tet可以通过Wnt信号传导并抑制人结肠、直肠癌的肿瘤生长。也有研究表明Tet可以通过Notch信号通路抑制白血病细胞的凋亡[33],可以通过NF-κB、MAPK/JNK、MAPK/ERK等信号通路激活肝脏星状细胞[34]。以上众多相关报道结合本研究的结果表明UA对MAPK/ERK、Wnt、Cell Cycle、NF-κB以及Hypoxia通路有较强抑制作用,而Tet对MAPK/JNK、Notch以及Cell Cycle通路有较强抑制作用,两者对与肿瘤相关的信号通路群具有互补抑制作用。
根据以上结果,课题组推测UA及Tet联合应用时,对于肿瘤相关的信号通路可以发挥更全面的抑制作用,由此推测它们可能存在协同抗肿瘤作用。本研究进一步采用了CI法、等效线法、CDI法来分析化合物之间是否可能存在协同抗肿瘤作用并筛选其最优配比。结果显示:UA和Tet协同作用可以在多个肿瘤细胞上发挥协同抗肿瘤细胞增殖的作用,且在UA: Tet=9:1时,具有最强的协同增效作用。本文通过对比较全面的信号通路活化作用进行分析,可以预测不同化合物之间的协同抗肿瘤作用。这种方法可以为抗肿瘤药物组合的筛选和临床化疗方案的研究带来很好的启示,更好地指导临床抗肿瘤用药。
References:
[1]Xu H,Yu J,Sun Y,et al.Scutellaria barbata,D.Don extract synergizes the antitumor effects of low dose 5-fluorouracil through induction of apoptosis and metabolism [J].Phytomedicine International Journal of Phytotherapy &Phytopharmacology,2013,20(10):897-903.
[2]Baxevanis C N,Perez S A,Papamichail M.Combinatorial treatments including vaccines,chemotherapy and monoclonal antibodies for cancer therapy[J].Cancer Immunology,Immunotherapy,2009,58(3):317-324.
[3]Gao J L,He T C,Li Y B,et al.A traditional Chinese medicine formulation consisting of Rhizoma Corydalis and Rhizoma Curcumae exerts synergistic anti-tumor activity [J].Oncology Reports,2009,22(5):1077-1083.
[4]刘兆国,朱智杰,周梁,等.Notch信号通路与肿瘤研究[J].中国药理学通报,2012,28(8):1045-1048. LIU Zhaoguo,ZHU Zhijie,ZHOU Liang,et al.On Notch signaling pathway and tumor[J].Chinese Pharmacological Bulletin,2012,28(8):1045-1048.
[5]郭建霞,张小云,赵春林,等.Wnt/β-catenin信号通路相关因子与结肠癌患者预后的相关性研究[J].河北医药,2016, 38(3):371-373. GUO Jianxia,ZHANG Xiaoyun,ZHAO Chunlin,et al. Correlation between Wnt/β-catenin signaling pathway and prognosis in patients with colon cancer[J].Hebei Medical Journal,2016,38(3):371-373.
[6]Bao R F,Shu Y J,Hu Y P,et al.miR-101 targeting ZFX suppressestumorproliferation and metastasisby regulating the MAPK/Erk and Smad pathways in gallbladder carcinoma[J].Oncotarget,2016,7(16):22339-22354. [7]He B C,Gao J L,Zhang B Q,et al.Tetrandrine inhibits Wnt/β-catenin signaling and suppresses tumor growth of human colorectal cancer[J].Molecular Pharmacology,2011,79(2):211-219.
[8]Olive P G.Neferine induces autophagy of human ovarian cancer cells via p38 MAPK/JNK activation[J].Tumor Biology,2016,37(7):8721-8729.
[9]Faria M,Matos P,Pereira T,et al.RAC1b overexpression stimulates proliferation and NF-κBmediated antiapoptotic signaling in thyroid cancer cells[J].Plos One,2017, 12(2):e0172689.
[10]Gao J L,Shui Y M,Jiang W,et al.Hypoxia pathway and hypoxia-mediated extensive extramedullary hematopoiesis are involved in ursolic acid's anti-metastatic effect in 4T1 tumor bearing mice[J].Oncotarget,2016,7(44): 71802-71816.
[11]Zhao Y,Gao J L,Ji J W,et al.Cytotoxicity enhancement in MDA-MB-231 cells by the combination treatment of tetrahydropalmatine and berberine derived from Corydalis yanhusuo W.T.Wang[J].Journal of Intercultural Ethnopharmacology,2014,3(2):68-72.
[12]Gao J L,Ji X,He T C,et al.Tetrandrine Suppresses Cancer Angiogenesis and Metastasis in 4T1 Tumor Bearing Mice[J].Evid Based Complement Alternat Med,2013, 2013:265061.
[13]高建莉,何通川,吕圭源.千金藤素对人结肠癌细胞HCT116裸鼠异体移植肿瘤模型肿瘤增殖的影响及机制初探[J].浙江中医药大学学报,2013,37(9):1055-1059. GAO Jianli,HE Tongchun,LV Guiyuan,et al.BioluminescentMonitoringthe Influence ofCepharanthine on Colon Cancer Growth in Mouse Xenograft Tumor Model [J].Journal of Zhejiang Chinese Medical University,2013, 37(9):1055-1059.
[14]De Angel R E,Smith S M,Glickman R D,et al.Antitumor effects of ursolic acid in a mouse model of postmenopausal breast cancer[J].Nutrition&Cancer,2010,62(8): 1074-1086.
[15]Lee E J,Oh S Y,Sung M K.Luteolin exerts anti-tumor activity through the suppression of epidermal growth factor receptor-mediated pathway in MDA-MB-231 ER-negative breast cancer cells[J].Food&Chemical Toxicology An International Journal Published for the British IndustrialBiologicalResearch Association,2012,50(11): 4136-4143.
[16]Pratheeshkumar P,Son Y O,Budhraja A,et al.Luteolin Inhibits Human Prostate Tumor Growth by Suppressing Vascular Endothelial Growth Factor Receptor 2-Mediated Angiogenesis[J].Plos One,2012,7(12):e52279.
[17]Lallemand B,Gelbcke M,Dubois J,et al.Structure-activity relationship analyses of glycyrrhetinic acid derivatives as anticancer agents[J].Mini Reviews in Medicinal Chemistry,2011,11(10):881-887.
[18]Wilmes A,Bargh K,Kelly C,et al.Peloruside A Synergizes with Other Microtubule Stabilizing Agents in Cultured Cancer Cell Lines[J].Molecular Pharmaceutics,2007, 4(2):269-280.
[19]Tallarida R J.An overview of drug combination analysis with isobolograms[J].Journal of Pharmacology&Experimental Therapeutics,2006,319(1):1-7.
[20]Tong W,Cui H,Nan M A,et al.Nicotinamide-mediated inhibition of SIRT1 deacetylase is associated with the viability of cancer cells exposed to antitumor agents and apoptosis[J].Oncology Letters,2013,6(2):600-604.
[21]徐新伟,郭玲玲,顾振纶,等.熊果酸对乳腺癌SK-BR-3细胞增殖和凋亡的影响[J].苏州大学学报,2009,29(1):68-70. XU Xinwei,GUO Lingling,GU Zhenlun,et al.Effects of Ursolic Acid on Proliferation and Apoptosis of SK-BR-3 Cells[J].Journal of Suzhou University,2009,29(1):68-70. [22]Shyu M H,Kao T C,Yen G C.Oleanolic acid and ursolic acid induce apoptosis in HuH7 human hepatocellular carcinoma cells through a mitochondrial-dependent pathway and downregulation of XIAP[J].Journal of Agricultural&Food Chemistry,2010,58(10):6110-6118.
[23]唐丹,李剑萍,郑锡凤,等.熊果酸通过STAT3通路调控胃癌细胞增殖和凋亡[J].中国药理学通报,2012,28(2):179-184. TANG Dan,LI Jianping,ZHENG Xifeng,et al.Regulatory effect of ursolic acid on proliferation and apoptosis of gastric cancer cells via STAT3 signaling pathway[J]. Chinese Pharmacological Bulletin,2012,28(2):179-184.
[24]Park J H,Kwon H Y,Sohn E J,et al.Inhibition of Wnt/β-catenin signaling mediates ursolic acid-induced apoptosis in PC-3 prostate cancer cells[J].Pharmacological Reports Pr,2013,65(5):1366-1374.
[25]Checker R,Sandur S K,Sharma D,et al.Potent antiinflammatory activity of ursolic acid,a triterpenoid antioxidant,is mediated through suppression of NF-κB,AP-1 and NF-AT[J].Plos One,2012,7(2):e31318.
[26]Ye L Q,Ye X F,Xu H.Mechanism of Ursolic Acid-Mediated Inhibition of Proliferation in Vascular Endothelial Glioaytoma[J].Tropical Journal of Pharmaceutical Research,2013,12(4):511-515.
[27]Xu W,Debeb B G,Lacerda L,et al.Tetrandrine,a Compound Common in Chinese TraditionalMedicine, Preferentially Kills Breast Cancer Tumor Initiating Cells (TICs)In Vitro[J].Cancers,2011,3(2):2274-2285.
[28]Qin R,Shen H,Cao Y,et al.Tetrandrine induces mitochondria-mediated apoptosis in human gastric cancer BGC-823 cells[J].Plos One,2013,8(10):e76486.
[29]Liu W,Zhang J,Ying C,et al.Tetrandrine Combined with Gemcitabine and Cisplatin for Patients with Advanced Non-Small Cell Lung Cancer Improve Efficacy[J]. International Journal of Biomedical Science Ijbs,2012,8 (1):28-35.
[30]胡钊,李永生,赵诚.粉防己碱联合阿霉素对人膀胱癌BIU-87/ADM细胞裸鼠移植瘤抑瘤率影响的研究[J].现代泌尿生殖肿瘤杂志,2013,5(1):41-44. HU Zhao,LI Yongsheng,ZHAO Cheng.The study on human bladder cancer cell BIU-87/ADM nude mice xenografts inhibition rate effect by tetrandrine and adriamycin[J]. Journal of Contemporary Urologic&Reproductive Oncology,2013,5(1):41-44.
[31]李桃花,裴晓华.粉防己碱对人乳腺癌细胞MDA-MB-435S的作用[J].世界中西医结合杂志,2015,10(7):934-936. LI Taohua,PEI Xiaohua.Effects of tetrandrine on human breast cancer cell line MDA-MB-435S[J].World Journal of Integrated Traditional and Western Medicine,2015,10 (7):934-936.
[32]Yu V W,Ho W S.Tetrandrine inhibits hepatocellular carcinoma cell growth through the caspase pathway and G2/M phase[J].Oncology Reports,2013,29(6):2205-2210.
[33]Liu T,Men Q,Wu G,et al.Tetrandrine induces autophagy and differentiation by activating ROS and Notch1 signaling in leukemia cells[J].Oncotarget,2015,6(10):7992-8006.
[34]Li X,Jin Q,Wu Y L,et al.Tetrandrine regulates hepatic stellate cell activation via TAK1 and NF-κB signaling [J].International Immunopharmacology,2016,36:263-270.
The Complement Inhibition of Ursolic Acid and Tetrandrine on Tumor Related Signaling Pathways and Their Synergistic Antitumor Proliferation Effects
SHI Rongzhen,LI Shifa,GAO Jianli Basic Medical College,Zhejiang Chinese Medical University,Hangzhou(310053),China
[Objective]This study was aimed to research the synergistic antitumor proliferation effects and their best proportion of ursolic acid(UA)and tetrandrine(Tet),a pair of compounds isolated from Chinese herbs which showed complement inhibition on the multiple signal pathways.[Methods]The reporter assays on tumor-related signal pathways for MAPK/ERK,MAPK/JNK,NF-κB,Wnt,Notch,Cell Cycle,Myc/Max and Hypoxia were used to study the effect of five different Chinese herbal compounds on tumor proliferation,it was concluded cepharanthine(Cep),Tet,18α-glycyrrhetinic acid(18α-Gly),UA and luteolin(Lut).MTT assay and crystal violet staining were used to study the antiproliferative effect of 15 different compounds for the tumor cells of MDAMB-231,SW480,MG63,PC3,DU145,HCT116,143B and MDA-MB-468,which is consisted with Cep,Tet,18α-Gly,UA and Lut for the 15 different compounds.Coefficient of drug interaction(CDI)method was used to detect the synergistic effect of the two compounds.Combination of index(CI)and isobologram method was used to screen the best ratio of compounds in their antiproliferative effects.[Results]The signal pathway reporter assay showed that UA and Tet could complementarily inhibit tumor-related signaling pathways.And the results also showed that UA and Tet could induce synergetic antitumor cell proliferation in vitro.Furthermore,the optimal ratio of UA and Tet was 9:1 by using isobologram and CI method.[Conclusion]UA and Tet can be inhibited and complemented by 8 tumor-related signaling pathways,and we used MTT assay and crystal violet staining or other methods to confirm the synergistic antitumor proliferation effects,furthermore,the optimal proportion for UA and Tet were screened,and it provided a new insight to develop new anticancer formula in research.
drug synergism;complement of signaling pathways;UA;Tet;ant-tumor;drug combination;reporter genes;optimal proportion
R331
A
1005-5509(2017)08-0652-06
10.16466/j.issn1005-5509.2017.08.003
2017-03-31)
国家自然科学基金面上项目(81473575);浙江省科学技术协会“育才工程”项目(2016YCGC002);浙江省科技计划项目(2016C33085) Fund projects:National Natural Science Foundation of China(81473575);Young Talent Cultivation Project of Zhejiang Association for Science and Technology(2016YCGC002);Science and Technology Project of Zhejiang Province(2016C33085)
高建莉,E-mail:jianli-gao@qq.com

