电针改善慢性脑低灌注大鼠认知障碍反应性星形胶质细胞与Aβ代谢的作用研究
张巧玲 胡文盈 殷洁 艾琪 徐雁 刘喆
浙江中医药大学第三临床医学院 杭州 310053
电针改善慢性脑低灌注大鼠认知障碍反应性星形胶质细胞与Aβ代谢的作用研究
张巧玲 胡文盈 殷洁 艾琪 徐雁 刘喆
浙江中医药大学第三临床医学院 杭州 310053
[目的]观察电针对慢性脑低灌注(Chronic Cerebral Hypoperfusion,CCH)大鼠学习记忆能力的影响,并探讨其对海马反应性星形胶质细胞及淀粉样β蛋白(β-amyloid protein,Aβ)代谢的影响。[方法]采用双侧颈总动脉永久性结扎法制备慢性脑缺血大鼠模型,设置假手术组、模型组、药物组、电针组进行对照观察;电针组百会、大椎穴治疗30天,用激光多普勒血流仪观察各组大鼠不同时间点(手术前、后及治疗后)局部脑血流(regional cerebral blood flow,rCBF)变化评价模型制备及电针对脑血流改善情况;采用Morris水迷宫(MWM)观察各组大鼠空间学习记忆能力变化;用Elisa法检测海马促炎细胞因子TNF-α及BACE1浓度变化;免疫组化法检测海马CA1区Aβ1-42及GFAP阳性细胞数量变化。[结果]rCBF检测显示,与假手术组比较,模型组rCBF仍维持低灌注水平(P<0.01),而药物组、电针组动物rCBF均较模型组明显上升(P<0.01);MWM观测显示,与模型组相比,药物组、电针组大鼠平均逃避潜伏期逐步缩短(P<0.05或P<0.01),目标象限的游泳时间明显增多(P<0.01);Elisa检测显示,与假手术组比较,模型组、药物组及电针组大鼠海马TNF-α及BACE1均显著升高(P<0.05或P<0.01),而与模型组相比,药物组、电针组海马TNF-α及BACE1均显著降低(P<0.05或P<0.01);免疫组化染色显示,与模型组相比,药物组、电针组海马CA1区GFAP阳性细胞数和Aβ1-42阳性细胞数减少(P<0.05或P<0.01)。[结论]持续性脑低灌注致海马反应性星形胶质细胞数量增多、促炎细胞因子含量上升,刺激BACE1的表达,进而促进淀粉样β蛋白产生,可能是CCH导致认知功能障碍的重要发病机制;电针改善局部脑血流、抑制海马炎症反应及BACE1的表达,进而减少淀粉样β蛋白生成,可能是其改善慢性脑低灌注大鼠认知障碍的作用机制之一。
慢性脑低灌注;海马淀粉样β蛋白代谢;反应性星形胶质细胞;电针;认知障碍
慢性脑低灌注(chronic cerebral hypoperfusion,CCH)是指由高血压、动脉硬化、颈动脉狭窄等多种因素所引起的脑组织血流降低、供血不足的一种病理状态,是血管性痴呆(vascular dementia,VD)、阿尔兹海默症(Alzheimer disease,AD)等疾病的共同病理基础[1]102。近年来随着我国社会人口老龄化程度的加剧,老年期痴呆成为一个严重的医学和社会问题,而AD和VD是老年期痴呆的主要类型,其发病率有逐年上升趋势。这不仅影响了患者的生活质量,还增加了家庭和社会的经济负担[2]。因此,揭示其发病机制,探索有效的防治手段是相关领域亟待解决的重要课题。
AD的主要病理特征是脑组织β-淀粉样蛋白(amyloid β-protein,Aβ)沉积所形成的老年斑。Aβ是由β淀粉样前体蛋白(β-amyloid precursor protein,APP)通过蛋白酶β-secretases和 γ-secretases顺序水解而成,其中AD大脑与Aβ生成密切相关的βsecretase是BACE1(beta amyloid converting enzyme 1或β-site APP-cleaving enzyme 1)[3],其水解APP形成长度为42个氨基酸残基的片段即Aβ1-42,是AD脑组织老年斑的主要组成成分,脑内Aβ过量的产生、聚集和沉淀促发过氧化应激损伤、炎性级联反应、神经纤维缠结、轴突损伤和突触丢失,导致神经元凋亡和认知功能减退[4]。大量研究发现CCH可导致Aβ的产生与沉积[5],电针可改善多种模型动物认知障碍[6]899,但其对CCH所致Aβ代谢的影响尚未见系统研究报道。本实验采用CCH大鼠模型,给予电针处理并与米诺环素腹腔注射干预进行对照,从反应性星形胶质细胞、促炎细胞因子(TNF-α)及Aβ生成的限速酶BACE1角度,探讨电针对CCH大鼠Aβ代谢及学习记忆能力的影响,为针灸治疗AD提供实验依据。
1 材料与方法
1.1 实验动物分组及主要试剂仪器 实验用清洁级三月龄雄性Sprague Dawley大鼠,体质量280±30g,共48只,购自浙江省医学科学院,饲养于浙江中医药大学动物实验中心,自由饮食,维持12h/12h明暗周期。将大鼠随机分为假手术组12只与手术组36只,分别进行手术处理后将造模动物随机分为模型组、药物组与电针组各12只进行实验观察。试剂仪器:米诺环素(TCI公司,日本)、兔抗GFAP抗体与兔抗Aβ1-42抗体(Bioss,北京)、BACE1与TNF-α检测Elisa试剂盒(R&D,美国)、弯剪、手术刀、缝合线、注
射器、0.3mm×13mm毫针;韩式电针仪、激光多普勒组织血流仪(Peri Flux 5000,Perimed AB,瑞士)、Morris水迷宫系统(深圳瑞沃德生命科技有限公司)、SpectraMax M4酶标仪(Molecular Devices,美国)石蜡切片机(Thermo MICROM,德国)、普通光学显微镜(Leica DM2500,德国)。
1.2 模型制备 大鼠称重后,用10%水合氯醛(3.5ml/ kg体重)腹腔注射麻醉,麻醉后将大鼠仰卧固定于手术台上,固定时充分暴露颈部,用弯剪将颈部正中毛剪去约1.5×3cm2见方,用PV碘消毒后行颈部正中纵向切开(切口约1cm),分离双侧颈总动脉,4#缝合线分别结扎近心端和远心端,缝合切口并用PV碘消毒,施以适量的青霉素钠抗感染,再将大鼠置于37℃环境中待其完全苏醒后分组并予以各项干预处理[7]。
1.3 治疗方法 假手术组与模型组:不予电针及药物治疗,但造模后第一天始行相应剂量生理盐水腹腔注射,且行相应抓取固定,时间及方法同各干预组,30d后处死取材。药物组:造模后第一天开始于腹腔注射美满霉素(minocycline,MC)45mg/kg,每日1次,其余抓取固定方法、时间同电针组,治疗30d后处死取材。电针组:造模后第一天行电针治疗,参照《实验动物穴位图谱》[8]取穴百会(顶骨正中处)、大椎(第七颈椎背侧凹陷处),0.3mm×13mm毫针针刺,接韩氏穴位神经刺激仪,输出电流1mA,频率15Hz连续波,时间20min,每日1次,治疗30d后处死取材,并行生理盐水腹腔注射,时间同药物组。
1.4 局部脑血流检测 采用激光多普勒血流仪检测大鼠rCBF变化,记录手术前20min、术后20min及处死前20min脑血流值,比较手术前后rCBF的变化情况,评价CCH造模成功与否及不同时相二种干预对其变化的影响。
1.5 神经行为学观察 Morris水迷宫实验[9]:所有各组大鼠在处死前6天开始Morris水迷宫检测,连续进行5天的定位航行试验训练并检测逃避潜伏期,每日4次。第6天进行空间探索实验:观察规定时间内大鼠在池中的搜索策略。水迷宫直径为180cm,高58cm的圆形水池,池壁黑色,池内水深约32.5cm,水温保持25±1℃,按东西、南北方向将水池等分为四个象限,将直径15cm、高30cm的平台放置于其中某一象限直至所有实验完成:⑴定位航行试验(place navigation test)。训练时随机选择东南西北四个点将大鼠面向池壁轻放入水,观察并记录大鼠寻找并爬上平台的游泳路径及所需时间,如大鼠在60s内未找到平台,需将其引至平台并停留15s,将其逃避潜伏期计为60s。⑵空间探索试验(spatial probe test)。在上述实验结束后观测大鼠对平台空间位置的记忆能力,即在第6天撤除水下平台,在平台象限对侧沿池壁将大鼠放入水中,测其60s内在目标象限的游泳时间。
1.6 取材处理 每组大鼠随机选取6只,麻醉下迅速断头取脑,置于冰盒上剥取海马,液氮冷冻置于-80℃冰箱保存;其余动物经心灌注4%多聚甲醛灌注后断头取脑,置于4%多聚甲醛灌注4℃后固定24h后切取中段,脑组织常规脱水后石蜡包埋,用于免疫组织化学染色。
1.7 ELISA检测方法 将快速冷冻的海马组织在含有蛋白磷酸酶酶抑制剂混合物的裂解缓冲液(Applgen,北京,中国)中混匀,然后将样品在4℃下12000g离心15min。检测方法参考试剂说明书进行,测量上清液中 TNF-α和 BACE1的含量。使用SpectraMax M4酶标仪在450nm的波长下测量颜色的强度。对每个样品进行一式两份检查,并进行平均数据分析。每组随机选择5只大鼠进行ELISA检测。
1.8 免疫组化染色方法 石蜡切片(5μm)脱蜡复水,采用常规免疫组化法检测海马CA1区Aβ及GFAP阳性细胞。染色步骤简述如下,切片采用pH6.0柠檬酸钠缓冲液微波抗原修复,3%H2O2孵育消除内源性过氧化物酶,滴加山羊血清封闭,滴加兔抗Aβ1-42抗体兔抗GFAP抗体(bs-0107R,1:200;bs-0199R,1:400,Boster公司)4℃冰箱湿盒孵育24h后湿盒复温2h,滴加生物素化二抗37℃恒温水浴箱孵育2h,滴加S-A/HRP 37℃孵育1h加DAB显色;各步骤之间PBS清洗5min×3次。每只大鼠选取3~5张切片染色、每张染色片随机选取3~5个视野(×40)进行阳性细胞计数(Leica DM-2500显微成像系统),求均值作为样本计数结果。
1.9 统计学方法 采用SPSS12.0统计软件处理。统计数据描述用均数±标准差(±S)表示;进行重复度量方差分析(大鼠动物航行实验数据)及其他数据采用单因素方差分析(One-Way ANOVA),检验显著性水平定于P<0.05。
2 结果
手术组大鼠在术后均有脑缺血表现,多数大鼠出现掉毛、毛色黄暗、动作感觉迟缓、活动饮食减少、精神萎靡,少数大鼠可见单侧眼睑下垂,但无明显活动障碍。假手术组上述症状不明显。
2.1 大鼠局部脑血流的检测结果
2.1.1 手术前后rCBF变化情况 经激光多普勒血流仪检测,造模前假手术与手术组、假手术组术后与术前比较rCBF值均无显著性差异(P>0.05),手术组大鼠造模后局部脑血流迅速下降,与术前比较差异具有统计学意义(P<0.01)。检测结果显示,双颈总动脉结扎术可导致实验大鼠局部脑血流显著下降,表明手术造模成功。见表1。
表1 手术造模前后局部脑血流变化情况(±s,PU)Tab.1 Regional cerebral blood flow changes before and after surgery building(±s,PU)

表1 手术造模前后局部脑血流变化情况(±s,PU)Tab.1 Regional cerebral blood flow changes before and after surgery building(±s,PU)
注:与同组手术前20min比较,**P<0.01;同时间假手术组比较,☆☆P<0.01。Note:Compared with the same group 20min before operation,**P<0.01;compared with the same time control group,☆☆P<0.01.
144.93±2.31 52.87±3.64☆☆**组别 n 手术前20min 手术后20min假手术组手术组12 36 151.96±3.19 154.94±12.79
2.1.2 电针治疗对局部脑血流变化的影响 各组大鼠rCBF进行检测结果显示:模型组、药物组、电针组与同时相假手术组比较rCBF下降显著,差异具有统计学意义(P<0.01);缺血30天后(处死前20min)模型组rCBF仍维持低灌注水平,差异具有统计学意义(P<0.01),提示结扎双侧颈总会造成实验大鼠持续性脑缺血;与同时相模型组相比,药物组、电针组rCBF上升,差异具有统计学意义(P<0.01),提示药物(美满霉素)、电针都能够明显改善CCH大鼠局部脑供血。见表2。
2.2 Morris水迷宫实验
2.2.1 定位航行试验 定位航行实验检测大鼠获取经验(学习)的能力,以平均逃避潜伏期表示。本实验显示:与假手术组比较,模型组平均逃避潜伏期显著延长,差异具有统计学意义(P<0.01),提示脑低灌注可致学习能力障碍;与模型组比较,除day1时点外电针组、药物组其余各时点平均逃避潜伏期均显著缩短,差异具有统计学意义(P<0.05或P<0.01),且两干预组动物平均逃避潜伏期随着训练时间的延长而缩短,且药物组与电针组之间比较差异无统计学意义(P>0.05)。提示药物、电针治疗能改善CCH大鼠的空间学习能力。见表3。
表2 药物、电针干预对CCH大鼠局部脑血流的影响(±s,PU)Tab.2 The influence of drugs,electric acupuncture intervention on regional cerebral blood flow in rats(±s,PU)

表2 药物、电针干预对CCH大鼠局部脑血流的影响(±s,PU)Tab.2 The influence of drugs,electric acupuncture intervention on regional cerebral blood flow in rats(±s,PU)
注:与同时相假手术组比较,☆☆P<0.01;与同时相模型组比较,★★P<0.01。Note:Compared with the same time control group,☆☆P<0.01;compared with the same time model group,★★P<0.01.
组别 n脑缺血时间造模手术前20min 造模手术后20min 处死前20min 148.46±7.52 62.84±16.10☆☆90.49±5.12☆☆★★83.77±9.12☆☆★★假手术组模型组药物组电针组12 12 12 12 151.96±3.19 150.52±2.05 163.61±7.75 150.68±4.69 144.93±2.31 54.59±4.68☆☆50.15±9.20☆☆53.86±6.91☆☆
表3 在不同时相及药物、电针干预后的各组平均逃避潜伏期(±s,秒)Tab.3 Average escape latency time of each group in different phases and drugs,after ele-acupuncture intervention(±s,s)

表3 在不同时相及药物、电针干预后的各组平均逃避潜伏期(±s,秒)Tab.3 Average escape latency time of each group in different phases and drugs,after ele-acupuncture intervention(±s,s)
注:与同时点假手术组比较,☆☆P<0.01;与同时点模型组比较,★P<0.05,★★P<0.01。Note:Compared with the same time sham operation group,☆☆P<0.01;compared with the same time model group,★P<0.05,★★P<0.01.
组别 n训练日期day1 day2 day3 day4 day5假手术组模型组药物组电针组5.77±2.40 30.63±4.99☆☆5.90±2.58★★7.81±2.13★★12 12 12 12 39.97±4.97 49.85±8.85☆☆47.10±6.42☆☆50.33±6.46☆☆21.11±2.11 42.38±3.56☆☆28.84±2.27★18.51±9.33★★18.15±4.56 36.72±6.40☆☆16.42±4.62★★17.23±10.26★★13.53±2.09 34.01±8.78☆☆9.91±5.90★★9.96±4.79★★
2.1.2 空间探索试验 空间探索试验即规定时间内在目标象限的游泳时间,可以反应大鼠的空间记忆能力,该时间越长说明空间记忆能力越强。实验显示,与假手术组比较,模型组大鼠在目标象限游泳时间明显较缩短,差异具有统计学意义(P<0.01);与模型组相比,药物组、电针组在目标象限的游泳时间明显延长,差异具有统计学意义(P<0.01);药物组与电针组在目标象限的停留时间有差异无统计学意义(P>0.05)。说明CCH可致空间记忆障碍,而药物及电针干预后可以提高CCH模型大鼠的空间记忆能力。见表4。
表4 各组在目标象限的停留时间(?±s,秒)Tab.4 Each group's residence time in the target quadrant(±s,s)
表4 各组在目标象限的停留时间(?±s,秒)Tab.4 Each group's residence time in the target quadrant(±s,s)
注:与假手术组比较,☆☆P<0.01;与模型组比较,★★P<0.01。Note:Compared with sham operation group,☆☆P<0.01;compared with model group,★★P<0.01.
25.12±1.91 18.40±1.27☆☆26.22±3.03★★26.79±3.44★★组别 n 目标象限停留时间假手术组模型组药物组电针组12 12 12 12
2.3 电针对脑低灌注大鼠海马CA1区反应性星形胶质细胞及海马促炎细胞因子TNF-α的影响
造模后GFAP在上述脑区均有表达,本实验主要检测海马CA1区域内阳性细胞。结果显示:与假手术组相比,各组大鼠GFAP阳性细胞数量均有增加,星形胶质细胞所分泌的TNF-α浓度均升高,其中模型组GFAP细胞增多显著,且胞体增大、突起肥厚(P< 0.01);与模型组相比,药物组、电针组GFAP阳性细胞数量减少,胞体减小、突起细长,且其数量与模型组比较具有统计学意义(P<0.01),药物组、电针组TNF-α浓度降低,其差异有统计学意义(P<0.05)。结果提示:电针与药物干预均可减少CCH后星形胶质细胞的数量及其反应性。见表5、图1。
2.4 电针对脑低灌注大鼠海马BACE1浓度及CA1区Aβ1-42表达的影响 与假手术组比较,模型组海马BACE1浓度升高,差异有统计学意义(P<0.01);与模型组比较,药物组与电针组海马BACE1浓度均降低,且差异有统计学意义(P<0.01);电针组BACE1浓度略高于药物组,但差异无统计学意义(P>0.05)。免疫组化染色结果显示,造模后Aβ1-42在额叶、颞叶、海马区均有表达,本实验主要检观测海马CA1区阳性细胞。与BACE1含量的变化趋势相似,与假手术组相比,各组大鼠Aβ1-42阳性细胞数量均有增多,其中模型组阳性细胞增多数量尤其显著(P<0.01);与模型组相比,药物组、电针组Aβ1-42细胞着色淡、阳性细胞数量明显低于模型组,差异具有统计学意义(P<0.05或P<0.01)。结果提示:电针与药物干预均可减少CCH大鼠海马BACE1含量及CA1区Aβ1-42的表达。见表6、图2。
表5 海马CA1区GFAP阳性细胞数及海马促炎细胞因子TNF-α浓度(±s)Tab.5 The number of GFAP positive cells and the concentration of TNF-α in hippocampaus(±s)

表5 海马CA1区GFAP阳性细胞数及海马促炎细胞因子TNF-α浓度(±s)Tab.5 The number of GFAP positive cells and the concentration of TNF-α in hippocampaus(±s)
注:与假手术组比较,☆P<0.05,☆☆P<0.01;与模型组比较,★P<0.05,★★P<0.01。Note:Compared with sham operation group,☆P<0.05,☆☆P<0.01;compared with model group,★P<0.05,★★P<0.01.
110.09±2.57 149.67±2.91☆☆129.78±3.23☆★132.12±2.46☆★组别 n GFAP阳性细胞数(个/视野) TNF-α(ng/L)假手术组模型组药物组电针组5 5 5 5 12.52±3.54 26.75±3.68☆☆15.38±4.09★★16.07±3.96★★

图1 海马CA1区GFAP阳性细胞免疫组化染色(400X)Fig.1 Immunohistochemical of GFAP positive cells in the hippocampal CA1(400X)
3 讨论
21世纪人口老龄化势不可挡,老年痴呆症将成为一个影响人类发展的至关重要的世界性卫生/健康问题[10]。AD是老龄人群最为常见且危害性极大的神经退行性疾病,其典型临床表现为进行性记忆损害、认知障碍以及行为改变。AD患者大脑病理变化包括神经元外Aβ沉积所形成的老年斑、tau蛋白过度磷酸化所形成的胞内神经纤维缠结(neurofibrillary tangles,NFT)、神经元及突触丢失、胶质细胞增生、脑淀粉样血管病及其他血管病变。尽管支持淀粉蛋白级联假说的证据仍存在问题和争议[11],但该假说依然是关于AD发病机制影响最广泛的著名假说[12,13]。
表6 电针对脑低灌注大鼠海马BACE1浓度及Aβ1-42表达的影响(±s)Tab.6 The effect of EA on the BACE1 concentration and the expression of Aβ1-42 in hippocampus with CCH rats(±s)

表6 电针对脑低灌注大鼠海马BACE1浓度及Aβ1-42表达的影响(±s)Tab.6 The effect of EA on the BACE1 concentration and the expression of Aβ1-42 in hippocampus with CCH rats(±s)
注:与假手术组比较,☆☆P<0.01;与模型组比较,★P<0.05,★★P<0.01。Note:Compared with sham operation group,☆☆P<0.01;compared with model group,★P<0.05,★★P<0.01.
9.42±1.78 25.21±3.03☆☆17.48±3.99★13.87±2.46★★组别 n BACE1(pg/ml) Aβ1-42阳性细胞数(个/视野)假手术组模型组药物组电针组5 5 5 5 154.79±3.57 194.21±3.23☆☆174.67±2.98☆☆★★179.27±3.28☆☆★★
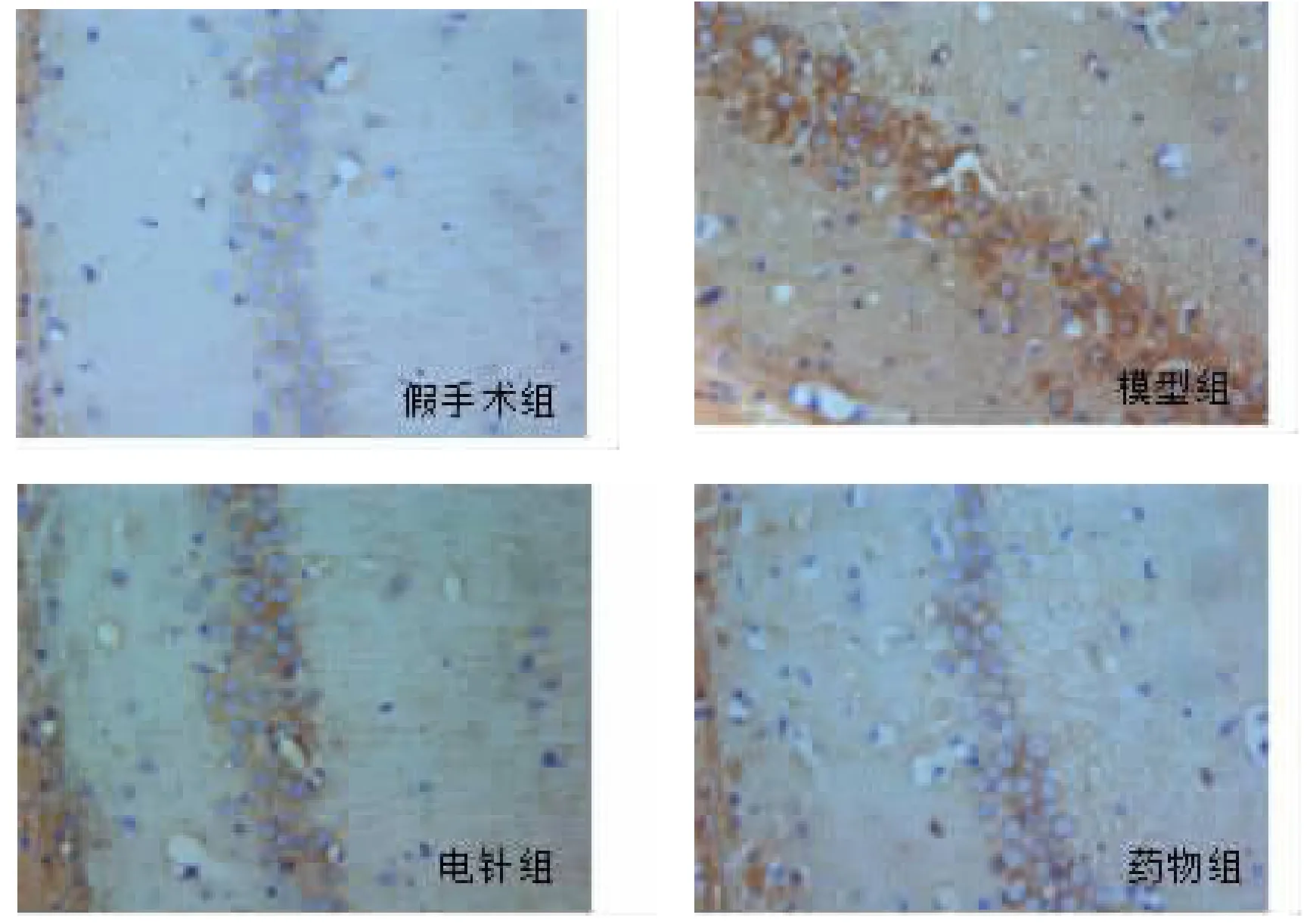
图2 海马CA1区Aβ1-42免疫组化染色(400)Fig.2 Immunohistochemical of Aβ1-42 in the hippocampal CA1(400)
研究证实[14],由遗传因素所致的AD病例不足5%,而绝大多数AD患者为散发性,年龄是其主要的风险因素(60岁以上)。散发性AD的确切病因依然不明,许多风险因素均可触发本病。大量的证据[15-17]表明脑血管疾病及其风险因素与AD密切相关;流行病学研究显示脑缺血可增加AD的发病率,而且脑缺血风险因素同样可增加AD的发病风险;大多数AD患者在学习记忆出现缺陷之前均经历过血管性脑缺血或卒中打击。随着现代神经影像学技术的迅猛发展,为准确观测局部微循环在AD病理进展过程中的变化提供了新机遇[18],大量相关研究提示[19-20],脑血管功能障碍是AD病理机制的早期事件,CBF的降低出现在AD病理发生的早期甚至更早,且其降低的幅度与痴呆的严重程度相关。因此可以推断,局部脑缺血是AD发病机制的重要启动子(增强剂),而非AD病理改变的结局。而且,脑缺血可损害认知功能并加剧Aβ诱导的认知缺陷。
脑血流量(CBF)是指动脉血液对脑组织毛细血管床的灌注速率,其衡量指标为血液毫升数/每100克脑组织/每分钟[21]。CBF和局部神经活动、新陈代谢密切相关,即所谓神经血管耦联,因此CBF是反应脑功能的替代指标[22]。新近神经影像学研究表明,CBF在AD患者相关脑区下降且低灌注是AD临床(症状出现)前敏感指标[23]。大鼠双侧颈总动脉结扎(2-vessel occlusion,2-VO)模型被广泛用于CCH所致的认知功能损害相关研究,2-VO模型可导致皮质总体CBF以及海马CBF分别下降为对照水平的35%~45%和60%,而空间学习和记忆也随之受到明显损害[24]。本实验采用激光多普勒组织血流仪对各组动物造模前、后及干预后大脑rCBF分别进行了监测,结果显示电针与药物干预均可显著改善模型动物rCBF,与此相应,模型动物的空间学习、记忆能力也得以显著地改善。
Aβ是老年斑的主要组成部分,可通过多种途径产生神经毒性诱导神经细胞凋亡、损伤;人体内Aβ最常见的亚型是 Aβ1-40和 Aβ1-42,其中Aβ1-42的毒性更强,更易聚集,从而形成Aβ沉淀的核心,引发神经毒性作用[25]。研究证实[1]104CCH可导致中枢炎症反应、氧化应激进而影响Aβ的代谢并诱导其在脑组织沉积,而Aβ的沉积又可加重胶质细胞反应性产生炎症反应与氧化应激,并进一步加重脑低灌注状态,这种恶性循环进而诱导相关脑区如海马神经元的损伤,导致大鼠空间学习记忆能力受损。
星形胶质细胞[26]主要存在于中枢神经系统,是神经胶质细胞中数目最多、极为重要的一类细胞;星型胶质细胞参与脑缺血、缺氧的病理损伤过程,并在其中发挥双重作用,在生理情况下其能营养保护神经元,而在病理情况下其长期、过度活化后可介导神经元凋亡和坏死。星形胶质细胞对脑缺血、缺氧反应敏感,能快速活化,参与免疫与炎症反应,还可促进Aβ的沉积[27]。新近有研究证实[28-29],反应性星形胶质细胞在AD的病理发展过程起着关键作用,其通过合成、分泌TNF-α,作用于表达于神经元或星形胶质细胞自身的TNF-α受体(TNFR),激活转录因子NF-κB启动APP和BACE1的表达;同时大量分泌、释放的TNF-α可刺激BACE1的活性,导致最具神经毒性肽Aβ1-42的生成。而抑制星形胶质细胞的反应性、降低其TNF-α合成与分泌,可显著降低APP、BACE1的表达、抑制BACE1的活性,减少Aβ1-42的生成。本实验证实,伴随着脑血流的持续低灌注状态,模型大鼠海马CA1区反应性星形胶质细胞(GFAP阳性)数量及海马TNF-α含量均显著升高,与之相应的Aβ1-42阳性细胞亦较假手术大鼠显著增多,同时模型大鼠空间学习与记忆能力出现显著的下降。
美满霉素是四环素的二代衍生物,大量研究证实其具有抑制神经炎性反应、抗氧化应激损伤以及降低BACE1表达并抑制其活性进而减少Aβ生成等,发挥着广泛的神经细胞保护作用[30]。因此,本实验采用美满霉素作为阳性对照,探讨电针干预的作用及其可能的作用机制。既往本研究团队及其他研究者证实[6,31]899,针灸对CCH所致的认知功能障碍及术后认知功能障碍等方面有良好的干预效果,可以在多水平、多层次通过多个靶点来改善慢性脑供血不足大鼠学习记忆能力。本实验结果表明,电针干预与美满霉素作用相仿,可提高CCH大鼠局部脑血流量、抑制星形胶质细胞反应性及其相关的TNF-α含量,抑制BACE1的表达与活性,减少Aβ1-42的生成,改善大鼠的空间学习、记忆能力。
本研究结果提示,电针作用机制可能通过改善局部脑血流,抑制星形胶质细胞的反应性、降低BACE1表达、调节Aβ的脑内代谢、改善海马微环境,从而抑制其对神经细胞的损伤作用,增强海马神经的重塑能力,进而改善CCH所致的学习记忆损害而实现的。
References:
[1]Zhao Y,Gong C X.From Chronic Cerebral Hypoperfusion to Alzheimer-Like Brain Pathology and Neurodegeneration[J].Cell Mol Neurobiol,2015,35(1):101-110.
[2]Wang XQ,Chen PJ.Population ageing challenges health care in China[J].Lancet,2014,383(9920):870.
[3]Huang Y,Mucke L.Alzheimer mechanisms and therapeutic strategies[J].Cell,2012,148(6):1204-1222
[4]Yan R,Vassar R.Targeting the β secretase BACE1 for Alzheimer's disease therapy[J].Lancet Neurol,2014,13(3): 319-329.
[5]Daulatzai MA.Cerebral hypoperfusion and glucose hypometabolism:Key pathophysiological modulators promote neurodegeneration,cognitive impairment,and Alzheimer's disease[J].J Neurosci Res,2017,95(4):943-972.
[6]叶雷,刘喆,冯培培,等.电针对POCD模型中老龄大鼠下丘脑-垂体-肾上腺轴及认知功能的影响[J].浙江中医药大学学报,2014,38(7):894-899.YE Lei,LIU Zhe,FENG Peipei,etal.EffectofElectroacupuncture on Middle-aged and Elderly POCD Rats’HPA Axis and Cognitive Function[J].Journal of Zhejiang Chinese Medical University,2014,38(7):894-899.
[7]Han D,Liu Z,Wang G,et al.Electroacupuncture Improves Cognitive Deficits through Increasing Regional Cerebral Blood Flow and Alleviating Inflammation in CCI Rats[J].Evid Based Complement Alternat Med,2017,2017:5173168.
[8]李忠仁.实验针灸学[M].北京:中国中医药出版社,2003:327. LI Zhongren.Experiment Acupuncture Science[M].Beijing: China Traditional Medicine Press,2003:327.
[9]Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc,2006,10(2):848-858.
[10]Bloom DE,Chatterji S,Kowal P,et al.Macroeconomic implications of population ageing and selected policy responses[J].Lancet,2015,385(9968):649-657.
[11]Robakis NK.Are Abeta and its derivatives causative agents or innocent bystanders in AD[J].Neurodegener Dis, 2010,7(3):32-37.
[12]Marchesi VT.An alternative interpretation of the amyloid Abeta hypothesis with regard to the pathogenesis of Alzheimer's disease[J].Proc Natl Acad Sci U S A,2005,102(26):9093-9098.
[13]Tanzi RE,Bertram L.Twenty years of the Alzheimer's disease amyloid hypothesis:a genetic perspective[J].Cell, 2005,120(4):545-555.
[14]Querfurth HW,LaFerla FM.Alzheimer's disease[J].N Engl J Med,2010,362(4):329-344.
[15]Sagare AP,Bell RD,Zlokovic BV.Neurovascular dysfunction and faulty amyloid β-peptide clearance in Alzheimer disease[J].Cold Spring Harb Perspect Med,2012,2(10):11452.
[16]Kelleher RJ,Soiza RL.Evidence of endothelial dysfunction in the developmentofAlzheimer's disease:Is Alzheimer's a vascular disorder[J].Am J Cardiovasc Dis, 2013,3(4):197-226.
[17]Di Marco LY,Venneri A,Farkas E,et al.Vascular dysfunction in the pathogenesis of Alzheimer's disease--A review of endothelium-mediated mechanisms and ensuing vicious circles[J].Neurobiol Dis,2015,82(6):593-606.
[18]Montagne A,Nation DA,Pa J,et al.Brain imaging of neurovascular dysfunction in Alzheimer's disease[J].Acta Neuropathol,2016,131(5):687-707.
[19]Pluta R1,Jab?oński M,Ulamek-Koziol M,et al.Sporadic Alzheimer's disease begins as episodes of brain ischemia and ischemically dysregulated Alzheimer's disease genes[J].Mol Neurobiol,2013,48(3):500-515.
[20]Hays CC,Zlatar ZZ,Wierenga CE.The Utility of Cerebral Blood Flow as a Biomarker of Preclinical Alzheimer's Disease[J].Cell Mol Neurobiol,2016,36(2):167-179.
[21]Zhang N,Gordon ML,Goldberg TE.Cerebral blood flow measured by arterial spin labeling MRI at resting state in normal aging and Alzheimer’s disease[J].Neurosci Biobehav Rev,2017,72:68-175.
[22]Vestergaard MB,Lindberg,Aachmann-Andersen NJ.A-cute hypoxia increases the cerebral metabolic rate-a magnetic resonance imaging study[J].J Cereb Blood Flow Metab,2016,36(6):1046-1058.
[23]Iturria-Medina Y,Sotero RC,Toussaint PJ,et al.Early role of vascular dysregulation on late-onset Alzheimer's disease based on multifactorial data-driven analysis[J].Nat Commun,2016,24(7):11934.
[24]Farkas E,Luiten PG,Bari F.Permanent,bilateral common carotid arteryocclusion in therat:amodelfor chronic cerebral hypoperfusion-related neurodegenerative diseases[J].Brain Res Rev,2007,54(1):162-180.
[25]Ballard C,Gauthier S,Corbett A,et al.Alzheimer's disease[J].Lancet,2011,377(97):1019-1031.
[26]Sofroniew MV,Vinters HV.Astrocytes:biology and pathology[J].Acta Neuropathol,2010,119(1):7-35.
[27]Osborn LM,Kamphuis W,Wadman WJ,et al.Astrogliosis:An integral player in the pathogenesis of Alzheimer's disease[J].Prog Neurobiol,2016,144:121-41.
[28]Cheng X,Shen Y,Li R.Targeting TNF:a therapeutic strategy for Alzheimer's disease[J].Drug Discov Today,2014,19(11):1822-1827.
[29]Decourt B,Lahiri DK,Sabbagh MN.Targeting Tumor Necrosis Factor Alpha for Alzheimer's Disease[J].Curr Alzheimer Res,2017,14(4):412-425.
[30]Budni J,Garcez ML,de Medeiros J,et al.The Anti-Inflammatory Role of Minocycline in Alzheimer′s Disease[J]. Curr Alzheimer Res,2016,13(12):1319-1329.
[31]Dong WG,Wang F,Chen Y,et al.Electroacupuncture Reduces Aβ Production and BACE1 Expression in SAMP8 Mice[J].Front Aging Neurosci,2015,27(7):148-149.
Electroacupuncture Improves Cognitive Dysfunction Through Regulating the Reactive Astrocytes and Metabolism of β-amyloid in Rats with Chronic Cerebral Hypoperfusion
ZHANG Qiaoling,HU Wenying,YIN Jie,et al Zhejiang University of Chinese Medicine Third Clinical Medical School, Hangzhou(310053),China
[Objective]To observe the effect of EA on the ability of learning and memory of chronic cerebral hypoperfusion(CCH)rats,and to explore its adjustment on β-amyloid(Aβ)mechanism.[Method]The rats models of CCH induced by ligation of bilateral common carotid arteries(2-V0)were randomly divided into sham operation group,model group,drug group and EA group.Stimulating their acupoints Baihui and Dazhui point with electroacupuncture (EA)treatment for 30 days;Using laser Doppler flowmeter observed differences in each group(before&after surgery and after treatment)time on regional cerebral blood flow(rCBF)changes in the evaluation model and improvement of rCBF due to the EA;Using Morris water maze observed groups of spatial learning and memory ability in rats;A change in the concentration of TNF-α and BACE1 was detected by Elisa method;Using immunohistochemical method to detect Aβ positive cells in the hippocampal CA1 area.[Result]The situation of rCBF improved compared with sham operation group,the rCBF of model group remained low perfusion levels,and the drug group,EA group rose in rCBF(P<0.01);the situation of MWM improved compared with model group,the average evasive latency of the drug group and the EA group was shortened(P<0.05 or P<0.01),the target quadrant swimming time was evidently increased also(P<0.01);the situation of Elisa improved compared with sham operation group,the TNF-α and BACE1 of the model group,the drug group,and the EA group were significantly elevated(P<0.05 or P<0.01),compared with the model group,the TNF-α and BACE1 of the drug group and the EA group were significantly lower(P<0.05 or P<0.01);immunohistochemical stain displayed that compared with the model group,drug group,EA group hippocampal CA1 reduced Aβ-positive cells and GFAP-positive cells(P<0.05 or P<0.01).[Conclusion]The increase in the number of Hippocampal reactive astrocytes because of persistent low brain perfusion,and the increase in proinflammatory cytokines,stimulating the expression of BACE1,which in turn stimulates the production of amyloid-β,may be a major pathogenesis of CCH for cognitive impairment;The needle improves local cerebral blood flow,inhibits hippocampal inflammation and the expression of BACE1,which in turn reduces the production of amyloid-β,may be one of the mechanisms by which it improves cognitive impairment in rats with chronic low brain perfusion.
chronic cerebral hypoperfusion;Aβ metabolism;reactive astrocytes;electroacupuncture;cognitive dysfunction
R331
A
1005-5509(2017)08-0644-08
10.16466/j.issn1005-5509.2017.08.002
2017-04-12)
浙江省自然科学基金(LY16H270004,LY13H270012,Y205389);浙江省科技创新团队项目(2013TD15);2016年国家级大学生创新创业训练计划项目(201610344014);浙江省大学生科技创新项目(2016R410024)Fund projects:Supported by Zhejiang ProvincialNaturalScience Foundation ofChina(LY16H270004,LY13H270012,Y205389);Key Science and Technology Innovation Team of Zhejiang Province(2013TD15);College students' innovative entrepreneurial training program of national level in 2016(201610344014);College students'innovative entrepreneurial training program of Zhejiang Province(2016R410024)
刘喆,E-mail:ssrsliu@163.com

