光谱法结合分子对接模拟技术研究头孢他啶与胰蛋白酶的相互作用机理
王金菊,刘保生,边 刚,段韶彤,李彤彤
光谱法结合分子对接模拟技术研究头孢他啶与胰蛋白酶的相互作用机理
王金菊,刘保生*,边 刚,段韶彤,李彤彤
(河北大学化学与环境科学学院 河北省分析科学技术重点实验室,河北 保定 071002)
本文主要通过荧光光谱法与分子对接技术研究了在298,303,310 K温度下头孢他啶(CFD)与胰蛋白酶(TRP)之间的作用机制。研究结果表明,CFD与TRP之间是通过1:1的静态猝灭方式相互作用。依照双对数方程处理荧光猝灭数据得到了CFD与TRP作用的结合常数Ka和结合位点数n。通过热力学方程求得了不同温度下CFD与TRP作用的热力学参数。实验数据表明,它们之间的作用力主要是疏水作用和氢键作用,这与分子对接技术所得的结果是一致的。
光谱法; 分子对接; 头孢他啶; 牛胰蛋白酶; 作用机理
1 引 言
头孢他啶(Ceftazidime,CFD)为第三代头孢菌素类抗生素,该药物通过抑制细菌细胞壁合成产生抗菌活性,对革兰阴性菌产生的β-内酰胺酶具有高度的稳定性,与第一、二代头孢菌素相比,抗菌活力较强,抗菌谱较广[1]。头孢他啶适用于敏感菌引起的下列感染:呼吸道感染、尿路感染、腹内感染、严重耳鼻喉感染、皮肤软组织感染、败血症、骨和关节感染等,也可用于手术预防感染[2]。胰蛋白酶(Trypsin,TRP)是由胰腺分泌的一种蛋白水解酶,它是自然界中发现的最为丰富的蛋白酶,在食物蛋白和其他生理过程的消化与分解过程中起着十分重要的作用,主要包括止血、细胞凋亡、信号转导、生殖和免疫反应等[3]。TRP的分子量大约为23 300,由223个氨基酸残基所组成[4],4个色氨酸、10个酪氨酸和6个苯丙氨酸是其固有荧光基团[5]。在立体结构中,它是由两个大小相似的结构域组成,二硫键连接着两个结构域,每个结构领域都是由6条反向平行的β-折叠组成[4,6]。在两个域之间,氨基酸His57、Asp102和Ser195为TRP的催化活性中心位点,形成了一种催化三联体[7-8]。TRP作为人体消化系统的一种重要的蛋白酶,由于其重要的生理功能,经常被选择作为目标蛋白[9]来研究药物小分子对其结构的影响,在生物、医学、化学等领域均具有重要的意义。
目前,TRP与各类药物及其化合物相互作用已有相关文章报道[10-11],但是对于CFD与TRP之间相互作用的研究却未见报道,本文利用荧光光谱法与分子对接模拟技术研究了不同温度条件下CFD与TRP之间的反应机理,利用CFD对TRP的荧光猝灭计算出结合常数以及结合位点数,进而算出它们之间的热力学参数。以药物为研究靶向来探讨它与蛋白的结合状况,有助于全方位地了解药物与蛋白之间的作用机理,更有助于医学研究者设计出作用性强、副作用小的药物。
2 实 验
2.1 仪器与试剂
试剂:胰蛋白酶(TRP,纯度≥ 99 %,Sigma公司),配成浓度为1.0×10-4mol/L的储备液;头孢他啶(CFD,标准品,纯度≥ 98.5%),配成1.0×10-3mol/L的储备液,用时逐级稀释;配制pH=7.40的Tris-HCl缓冲溶液(内含0.15 mol/L NaCl,用以调节生理条件下的离子强度)。实验用水均为二次石英蒸馏水,以上储备液均在冰箱中4 ℃下避光保存。
仪器:RF-5301PC荧光分光光度计(日本岛津);UV-3600紫外可见分光光度计(日本岛津);MOS-450/SFM300圆二色谱仪(法国Bio-logic);SYC-15B超级恒温水浴(南京桑力电子设备厂);CS501超级恒温水浴(南通科学仪器厂);SZ-93自动双重纯水蒸馏器。
实验中所测的荧光强度均采用“内滤光效应”公式(1)[12]进行校正:
Fcor=Fobse(Aex+Aem)/2,
(1)
式中Fcor和Fobs分别代表校正后和测得的荧光强度,Aex和Aem分别是所测药物在激发和发射波长处的吸光度。图1为头孢他啶的结构式。
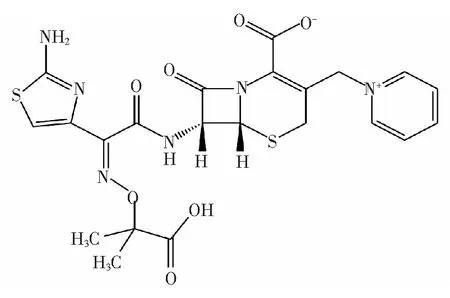
图1 头孢他啶结构式Fig.1 Chemical structure of CFD
2.2 实验方法
2.2.1 紫外吸收光谱法
将0.5 mL的Tris-HCl缓冲溶液和1.0 mL的1.0×10-5mol/L的TRP溶液加入到10 mL的比色管中,并加入不同体积的CFD溶液,用二次蒸馏水定容至5 mL后摇匀。在恒温水浴静置30 min后,用相应浓度的CFD溶液作为空白参比,测定溶液的紫外吸光度,并绘制CFD-TRP体系的紫外吸光谱图。
2.2.2 荧光猝灭法
在298,303,310 K下,于一系列10 mL比色管中依次加入1.0 mL pH=7.40的Tris-HCl缓冲溶液、1.0 mL 1.0×10-5mol/L的TRP溶液及不同体积的CFD溶液,用二次蒸馏水定容至5 mL,摇匀,在恒温水浴中放置30 min,使反应完全。将配好的溶液置于1 cm石英比色皿中,设定狭缝宽度为5 nm,固定激发波长λex=280 nm或295 nm,分别扫描荧光光谱,记录各溶液的荧光强度F。
2.2.3 同步荧光法
按以上同样方法操作,固定发射波长与激发波长的差Δλ分别为15 nm、60 nm扫描体系的同步荧光光谱并记录同步荧光强度F。
2.2.4 圆二色谱法
在298 K温度下,将1.0 mL Tris-HCl缓冲溶液、1.0 mL 2.0×10-5mol/L的TRP溶液和不同浓度的CFD溶液依次加入到10 mL比色管中,用二次蒸馏水定容至5 mL,摇匀,在恒温水浴静置20 min。使用1 mm的石英吸收池,扫描速度设置为1 nm·s-1,记录190~270 nm波长范围内CFD作用于TRP前后的圆二色谱谱图。
2.2.5 分子对接
TRP的晶体结构(PDB ID:2ZQ1)来自蛋白数据库(Protein data bank),CFD的结构式在ChemDraw Pro 14.0 软件中绘制,同时在ChemBio 3D Ultra 14.0 软件中对其三维结构进行能量最优化。最后使用 AutoDock 4.2.6 软件对CFD和TRP进行分子对接,应用拉马克(LGA)遗传算法来计算与蛋白质结合的药物分子的可能构象[13]。
3 结果与讨论
3.1 TRP与CFD体系的紫外光谱
按2.2.1操作,体系的紫外光谱图如图2所示。图中在208 nm有一个强吸收峰且在280 nm左右有一个较弱的吸收峰。随着药物CFD浓度的不断增大,CFD-TRP体系的紫外光谱在208 nm处的吸收峰强度降低并发生红移,280 nm处吸收峰强度增加且发生蓝移。这说明CFD的加入改变了TRP的构象,TRP与药物CFD间形成了新的复合物,CFD-TRP体系的猝灭方式为静态猝灭[14]。
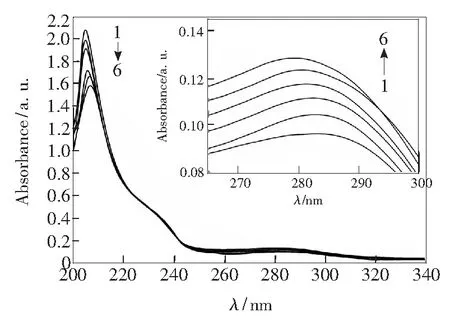
CTRP=2.0×10-5mol/L,1~6:CCFD=(0,5.0,6.0,8.0,10.0,30.0)×10-5mol/L
图2 CFD-TRP体系的紫外光谱(T=298 K)
Fig.2 Absorption spectra of CFD-TRP system(T=298 K)
3.2 TRP与CFD体系的荧光光谱
按2.2.2操作,考察浓度不同的CFD对TRP荧光光谱的影响,结果如图3所示(λex=295 nm时的荧光猝灭谱图与其类似)。由图3可知,随着CFD浓度的增大,TRP在340 nm处的荧光强度逐渐降低,表明CFD与TRP之间存在相互作用。为更深入地研究猝灭机理,将猝灭数据按Stern-Volmer方程[15]处理:
I0/I=1+Kqτ0[L]=1+Ksv[L],
(2)
式中,I0为CFD不存时体系的荧光强度,I为CFD存在时体系的荧光强度,τ0为分子荧光平均寿命(约10-8s),Ksv为Stern-Volmer猝灭常数,[L]为猝灭剂的浓度,Kq为猝灭速率常数。依据公式(2)可得TRP与药物的猝灭常数Ksv以及猝灭速率常数Kq,列于表1。由表1可知,随温度的升高,Ksv依次减小,由此可推断TRP-CFD体系的结合过程主要是静态猝灭过程[16]。对于该类猝灭过程,用方程(3)[17]来计算结合常数Ka和结合位点数n:
(3)
其中,[Dt] 为CFD的总浓度,Ka表示结合常数;[Bt]为蛋白质的总浓度,n为结合位点数。以lg(I0/I-1)对lg{[Dt]-n[Bt](1-I/I0)}进行作图,根据标准曲线的截距和斜率可得到体系的Ka及n,最终结果见表1。由表1可知,CFD与TRP两者的结合位点数n约为1,该体系的Ka值在λex=280 nm和295 nm时均随温度的升高而减小,表明CFD与TRP形成复合物的稳定性随温度升高而降低,更进一步说明CFD对TRP的猝灭方式为静态猝灭[18]。
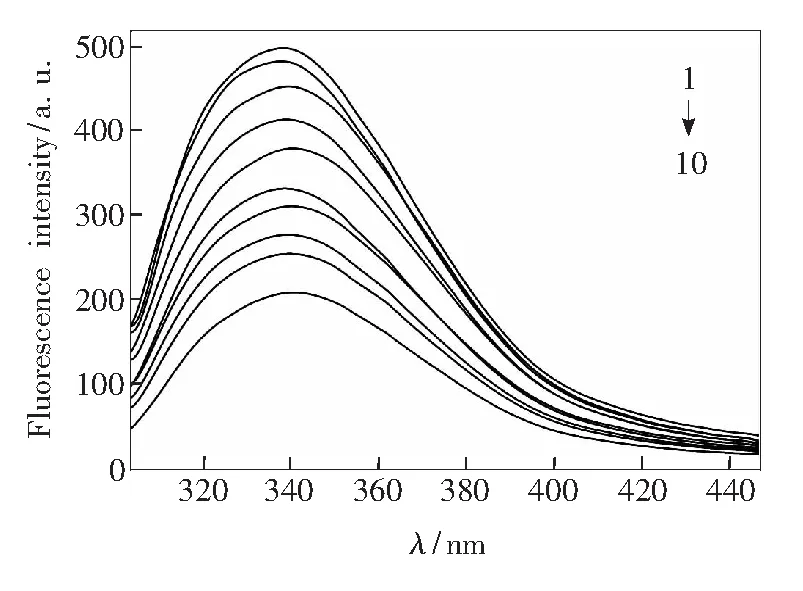
CTRP=2.0×10-6mol/L,1~10:CCFD= (0,0.2,0.4,1.0,2.0,3.0,4.0,5.0,6.0,10.0)×10-5mol/L
图3 CFD-TRP的荧光发射光谱 (T=298 K,λex=280 nm)
Fig.3 Fluorescence emission spectra of TRP-CFD (T=298 K,λex=280 nm)
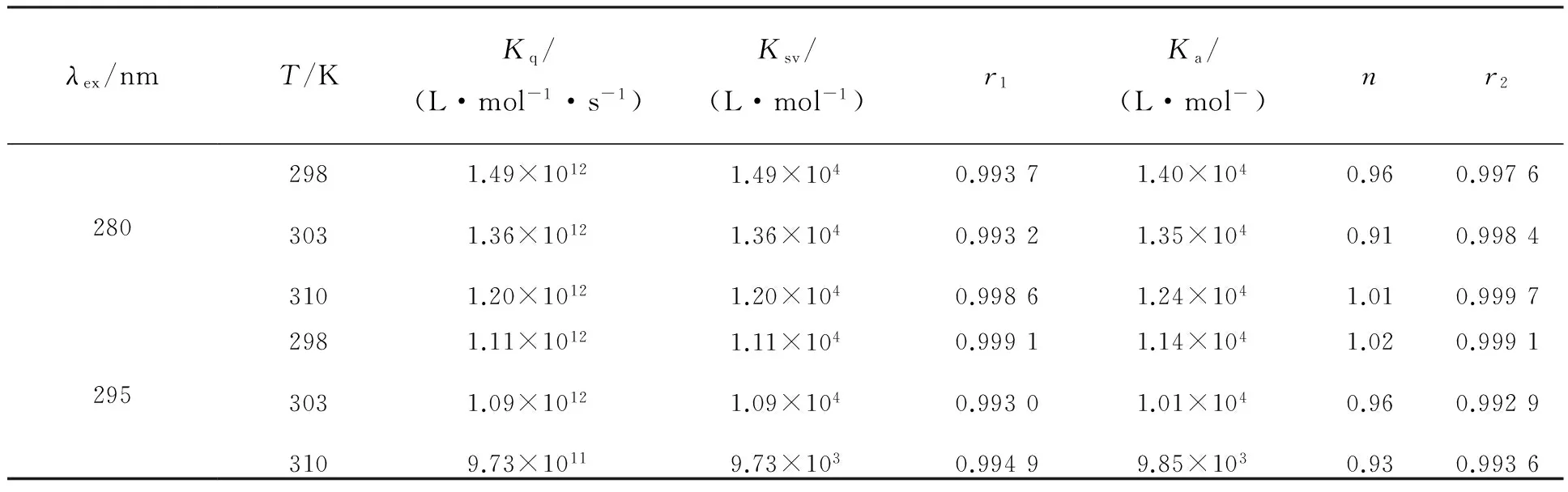
表1 不同温度下CFD-TRP体系的猝灭反应参数Tab.1 Quenching reactive parameters of CFD-TRP system at different temperatures
r1为方程I0/I-[L]的线性相关系数;r2为方程lg[(I0-I) /I]-lg{[Dt]-n[Bt] (I0-I)/I0}的线性相关系数。
3.3 TRP与CFD体系的同步荧光光谱
同步荧光光谱可以呈现出蛋白质荧光团的微环境信息,能够简单有效地测量荧光猝灭和最大发射波长可能发生的变化[19]。Δλ=60 nm仅反映TRP中色氨酸残基(Trp)的光谱信息,即包含残基的荧光强度和极性大小的改变,而Δλ=15 nm反映的是TRP中酪氨酸残基(Tyr)的光谱信息[20]。图4为CFD-TRP体系的同步荧光光谱。由图4可知,Δλ=15 nm时,随CFD浓度的增大,TRP的荧光强度逐渐降低,Tyr残基最大发射峰的位置从306 nm红移到307 nm。当Δλ=60 nm时,Trp残基最大发射峰的位置从344 nm红移到348 nm。该现象说明有少量的Tyr残基参与该反应,但参与该反应的主要是Trp残基。峰位置的改变说明CED与TRP的相互作用改变了Trp和Tyr所在的微环境[21]。由于Trp和Tyr微环境的改变使得TRP腔内疏水环境的极性增强,疏水性减弱,导致肽链变得松散,最终导致TRP的构象发生了变化。
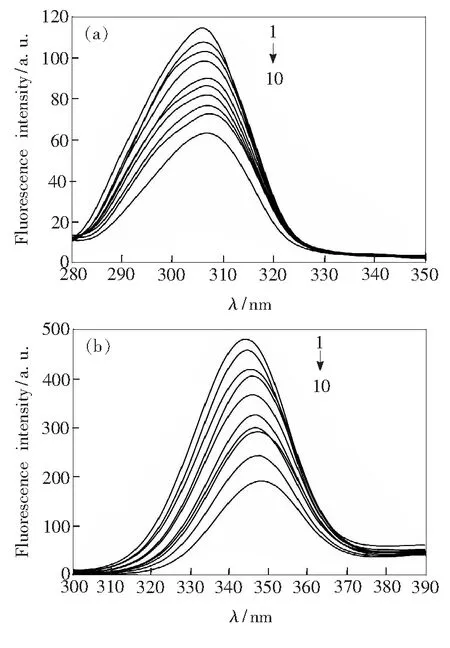
CTRP=2.0×10-6mol/L,1~10:CCFD= (0,0.2,0.4,1.0,2.0,3.0,4.0,5.0,6.0,10.0)×10-5mol/L
图4 CFD-TRP体系的同步荧光光谱(T=298 K)。 (a) Δλ=15 nm;(b) Δλ=60 nm。
Fig.4 Fluorescence spectra of TRP-CFD system(T=298 K).(a) Δλ=15 nm.(b) Δλ=60 nm.
3.4 TRP与CFD体系的作用力类型
CFD和TRP结合反应的作用力类型可以根据CFD与TRP相互作用的热力学参数进行推断。ΔGO、ΔSO、ΔHO等热力学参数由以下公式[22]得出:
RlnK=ΔSO-ΔHO/T,
(4)
ΔGO=ΔHO-TΔSO,
(5)
由以上方法计算得到TRP-CFD体系的热力学参数,见表2。由表2可知,ΔGO<0,ΔSO>0,说明CFD对TRP的猝灭反应是自发进行;ΔHO< 0,ΔSO> 0,表明CFD与TRP间以静电引力方式相互结合形成CFD-TRP复合物[23]。

表2 不同温度下CFD-TRP体系的热力学参数Tab.2 Thermodynamic parameters of CFD-TRP system at different temperatures
3.6 TRP与CFD体系的结合距离
根据Förster非辐射能量转移理论[24],能量供体TRP与能量受体CFD间距离r与能量转移效率为50%时所对应的临界能量转移距离R0及能量转移效率E之间有如下关系[25]:
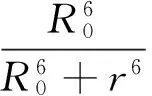
(6)
(7)
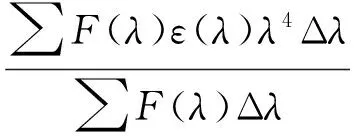
(8)
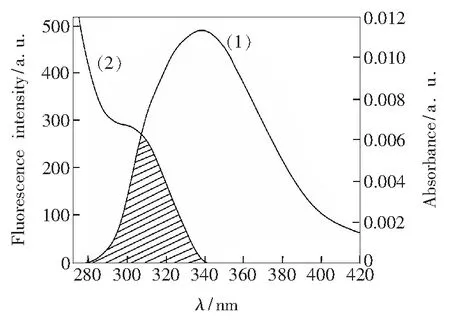
式中,F0为TRP的荧光强度;F为TRP和CFD浓度相等时的荧光强度;K2为取向因子,取TRP与CFD各向随机分布的平均值2/3;Φ为当CFD不存在时TRP的荧光量子产率,取TRP中Trp的量子产率0.118[26];N为溶剂的折射率,取水和有机物的平均值1.336;J为TRP的荧光发射光谱与CFD的紫外吸收光谱之间的重叠积分(图5中阴影部分);F(λ)为TRP在波长λ处的荧光强度;ε(λ)为CFD在波长λ处的摩尔吸光系数。通过图5 TRP的荧光发射光谱(λex=280 nm)(1)和CFD的紫外吸收光谱(2)(T=298 K)
Fig.5 Overlap of the fluorescence spectrum of TRP(λex=280 nm) (1) and the absorption spectrum of CFD (2) (T=298 K).CCFD=2CTRP=2.0×10-6mol/L.公式计算依次得到E值、J值、R0值和r值(表3)。从表3可以看出:r<7 nm,说明CFD与TRP间存在非辐射能量转移[27]。此外,随着温度的不断升高,能量转移效率逐渐降低,TRP和CFD之间的距离增大,导致CFD-TRP体系的结合稳定性降低,Ka值减小。
3.7 TRP与CFD体系的圆二色谱
圆二色谱法(CD)被广泛用来测定蛋白质的二级结构。CFD-TRP体系的CD谱图如图6所示。由图6可知,在208 nm处有一个负的吸收峰,且该负峰是TRP中α-螺旋结构的特征峰[28]。随着溶液中CFD浓度的不断增加,吸收峰的强度逐渐降低,表明CFD引起了TRP的二级结构发生了变化。为了进一步说明TRP中的α-螺旋含量的变化,利用以下计算公式[29],得到具体的含量变化:
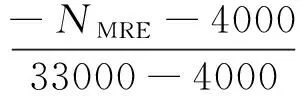
(9)
式中NMRE为在200 nm处的摩尔椭圆率;数字4 000为在200 nm处β-折叠和无规卷曲的NMRE值;数字33 000为在200 nm处纯粹的α-螺旋的NMRE值。
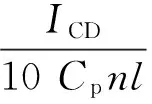
(10)
式中,n为TRP中氨基酸总数,l为样品池的光径 (cm),Cp为TRP的浓度,ICD为CD峰强度。
由计算结果可知,CFD的TRP的α-螺旋结构从10.95%降到3.22%,进一步说明随着CFD浓度的增大,负峰的强度逐渐降低但峰的位置和峰形没有明显变化,表明在CFD作用下导致TRP中的α-螺旋结构变得有些松散且蛋白的二级结构也随之发生改变,从而使得TRP荧光被猝灭,但是α-螺旋结构仍占有主导地位[30]。
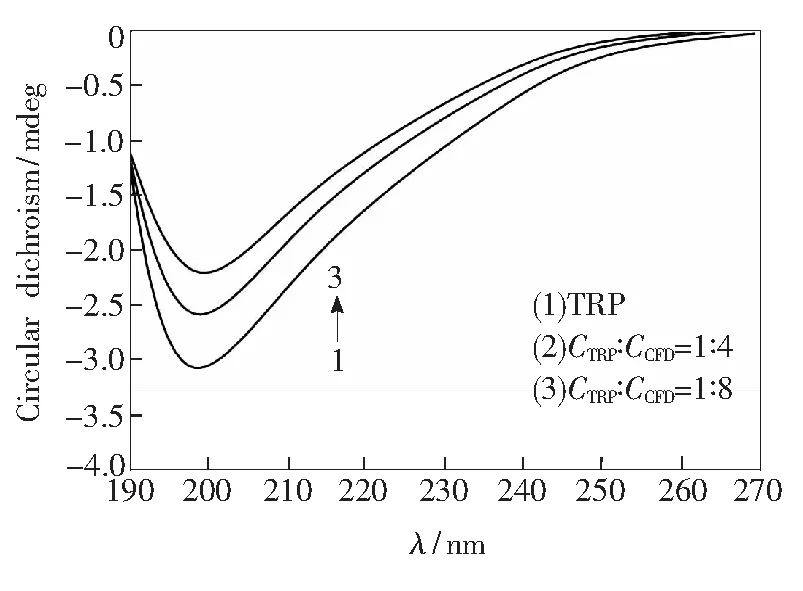
CTRP=2.0×10-5 mol/L,CCFD= (0.8,1.6)×10-4 mol/L
3.8 分子对接
分子模拟技术普遍地应用于分析蛋白与配体之间的相互作用。分子对接的目的主要是寻找底物分子和受体分子间的最佳结合位置[31]。通过分子对接软件,我们选取了TRP与药物CFD最佳的结合位置。由对接结果数据处理可知,CFD与TRP的结合能为-23.75 kJ/mol。这一结果与实验所得的热力学参数非常接近(ΔGO=-23.64 kJ/mol),从而更进一步证明了CFD与TRP的相互作用。
图7所示为CFD与TRP的分子对接最佳构象图,并且截取了CFD药物分子周围的氨基酸残基。CFD分子被氨基酸残基Phe41、His57、Ser195、Gly193、Gln192、Cys191、Gly219、Cys220、Trp215和Asp189所包围,其中多数氨基酸残基为疏水性氨基酸残基。这一结果表明,CFD与TRP之间存在疏水作用,其作用力主要以静电引力为主[32],并且CFD能有效地猝灭TRP的内源荧光,这与荧光光谱实验结果是一致的。
从图7中更清楚地发现CFD与Lly193、Ser195、Asp189和Gly219形成氢键,键长分别为0.211 2,0.183 3,0.178 6,0.196 6 nm。这一结果表明,CFD与TRP之间存在较强的氢键作用力。因此,分子对接的研究结果说明CFD与TRP的结合模式主要是疏水作用,同时存在氢键作用,与实验结果一致。
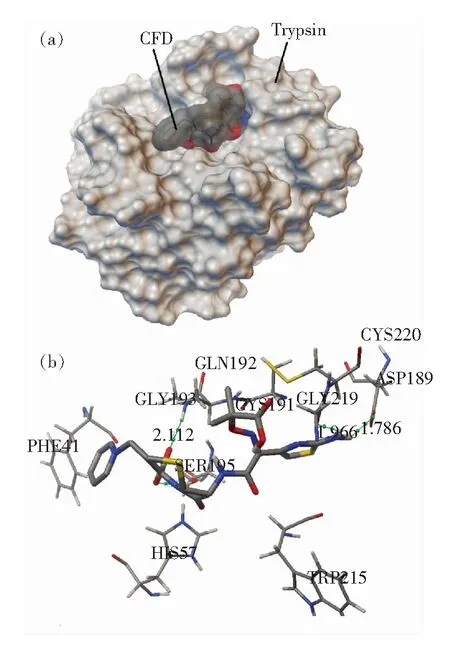
图7 CFD与TRP相互作用的分子对接图。 (a) CFD与TRP发生作用区域;(b) CFD与TRP活化中心发生作用的氨基酸残基。Fig.7 Computation docking model of the interaction between CFD and TRP.(a) Binding site in the TRP cavity.(b) Detailed illustration of the amino acid residues lining the binding sitein the TRP cavity.
4 结 论
通过光谱法和分子对接模拟技术对CFD与TRP之间的反应机理进行详细的研究。实验结果表明,CFD对TRP有荧光猝灭作用,该猝灭过程是由于生成CFD-TRP复合物所引起的静态猝灭过程,过程伴随着非辐射能量转移。CD谱图显示随着药物CFD的加入改变了TRP的微环境,TRP的二级结构发生了变化。随之通过热力学方程得到热力学参数,所得数据结果与分子对接技术相符,进一步表明CFD与TRP的结合模式主要是静电引力,同时也存在氢键以及疏水作用力。与此同时,所得到的实验结论对于了解药物药效的实质具有很大的帮助,为药物的研究发展提供了更具有意义的理论依据。
[1] 李祥,马承宣.第三代头孢菌素的合理应用 [J].中华医院感染学杂志,1997,7(3):187-189.LI X,MA C X.Reasonable application of the third generation cephalosporins [J].Chin.J.Nosocomiol.,1997,7(3): 187-189.(in Chinese)
[2] 霍彩霞,白林,任建坚.头孢他啶与牛血清白蛋白结合的光谱法研究 [J].甘肃科学学报,2008,20(4):56-59.HUO C X,BAI L,REN J J.Interaction between ceftazidime and bovine serum albumin found by spectroscopy [J].J.GansuSci.,2008,20(4):56-59.(in Chinese)
[3] GOMBOS L,KARDOS J,PATTHY A,etal..Probing conformational plasticity of the activation domain of trypsin: the role of glycine hinges [J].Biochemistry,2008,47(6):1675-1684.
[4] GHOSH S.Interaction of trypsin with sodium dodecyl sulfate in aqueous medium: a conformational view [J].ColloidsSurf.B:Biointerf.,2008,66(2):178-186.
[5] KOUTSOPOULOS S,PATZSCH K,BOSKER W T E,etal..Adsorption of trypsin on hydrophilic and hydrophobic surfaces [J].Langmuir,2007,23(4):2000-2006.
[6] STROUD R M,KAY L M,DICKERSON R E.The structure of bovine trypsin: electron density maps of the inhibited enzyme at 5 Å and at 2.7 Å resolution [J].J.Mol.Biol.,1974,83(2):185-208.
[7] IBARZ A,GARVN A,GARZA S,etal..Toxic effect of melanoidins from glucose-asparagine on trypsin activity [J].FoodChem.Toxicol.,2009,47(8):2071-2075.
[8] DING K K,ZHANG H X,WANG H F,etal..Atomic-scale investigation of the interactions between tetrabromobisphenol A,tetrabromobisphenol S and bovine trypsin by spectroscopies and molecular dynamics simulations [J].J.Hazard.Mater.,2015,299:486-494.
[9] CHEN J M,MONTIER T,FÉREC C.Molecular pathology and evolutionary and physiological implications of pancreatitis-associated cationic trypsinogen mutations [J].Hum.Genet.,2001,109(3):245-252.
[10] SONG W,YU Z H,HU X X,etal..Dissection of the binding of hydrogen peroxide to trypsin using spectroscopic methods and molecular modeling [J].Spectrochim.ActaA:Mol.Biomol.Spectrosc.,2015,137:286-293.
[11] LI X R,LI P H.Study on the interaction of β-carotene and astaxanthin with trypsin and pepsin by spectroscopic techniques [J].Luminescence,2015,31(3):782-792.
[12] HE W,DOU H J,ZHANG L,etal..Spectroscopic study on the interaction of trypsin with bicyclol and analogs [J].Spectrochim.ActaA:Mol.Biomol.Spectrosc.,2014,118:510-519.
[13] GÖKOGLU E,YILMAZ E.Fluorescence interaction and determination of sulfathiazole with trypsin [J].J.Fluoresc.,2014,24(5):1439-1445.
[14] 刘保生,闫潇娜,曹世娜,等.头孢匹胺钠与牛血清白蛋白的相互作用机理及共存金属离子的影响 [J].发光学报,2012,33(9):1018-1024.LIU B S,YAN X N,CAO S N,etal..Interaction of cefpiramide sodium with bovine serum albumin and the effect of coexistent metal ion on the reaction [J].Chin.J.Lumin.,2012,33(9):1018-1024.(in Chinese)
[15] YANG R,YU L L,ZENG H J,etal..The interaction of flavonoid-lysozyme and the relationship between molecular structure of flavonoids and their binding activity to lysozyme [J].J.Fluoresc.,2012,22(6):1449-1459.
[16] TIAN Z Y,ZANG F L,LUO W,etal..Spectroscopic study on the interaction between mononaphthalimide spermidine (MINS) and bovine serum albumin(BSA) [J].J.Photochem.Photobiol.B:Biol.,2015,142:103-109.
[17] BI S Y,DING L,TIAN Y,etal..Investigation of the interaction between flavonoids and human serum albumin [J].J.Mol.Struct.,2004,703(1-3):37-45.
[18] TOPRAK M,ARIK M.The investigation of the interaction between orientin and bovine serum albumin by spectroscopic analysis [J].Luminescence,2014,29(7):805-809.
[19] WANG Q,ZHANG S R,JI X H.Investigation of interaction of antibacterial drug sulfamethoxazole with human serum albumin by molecular modeling and multi-spectroscopic method [J].Spectrochim.ActaA:Mol.Biomol.Spectrosc.,2014,124:84-90.
[20] ZHANG G W,CHEN X X,GUO J B,etal..Spectroscopic investigation of the interaction between chrysin and bovine serum albumin [J].J.Mol.Struct.,2009,921(1-3):346-351.
[21] SONG H,CHEN C Y,ZHAO S L,etal..Interaction of gallic acid with trypsin analyzed by spectroscopy [J].J.FoodDrugAnal.,2015,23(2):234-242.
[22] ZHAO H W,GE M,ZHANG Z X,etal..Spectroscopic studies on the interaction between riboflavin and albumins [J].Spectrochim.ActaA:Mol.Biomol.Spectrosc.,2006,65(3-4):811-817.
[23] ROSS P D,SUBRAMANIAN S.Thermodynamics of protein association reactions: forces contributing to stability [J].Biochemistry,1981,20(11):3096-3102.
[24] SKLAR L A,HUDSON B S,SIMONI R D.Conjugated polyene fatty acids as fluorescent probes: binding to bovine serum albumin [J].Biochemistry,1977,16(23):5100-5108.
[25] JIN J,ZHANG X.Spectrophotometric studies on the interaction between pazufloxacin mesilate and human serum albumin or lysozyme [J].J.Lumin.,2008,128(1):81-86.
[26] BERTUCCI C,DOMENICI E.Reversible and covalent binding of drugs to human serum albumin: methodological approaches and physiological relevance [J].Curr.Med.Chem.,2002,9(15):1463-1481.
[27] 刘保生,韩荣,李志云,等.硝基羟乙唑与溶菌酶反应机制的荧光光谱研究 [J].发光学报,2015,36(12):1458-1463.LIU B S,HAN R,LI Z Y,etal..Investigation of the interaction mechanism between lysozyme and trichazol using fluorescence spectroscopic method [J].Chin.J.Lumin.,2015,36(12):1459-1463.(in Chinese)
[28] 张国文,王亚萍.邻苯二甲酸二丁酯与胰蛋白酶的相互作用 [J].吉首大学学报(自然科学学报),2015,36(1):46-51.ZHANG G W,WANG Y P.Interaction of dibutyl phosphate with trypsin [J].J.JishouUniv.(Nat.Sci.Ed.),2015,36(1):46-51.(in Chinese)
[29] BHOGALE A,PATEL N,MARIAM J,etal..Comprehensive studies on the interaction of copper nanoparticles with bovine serum albumin using various spectroscopies [J].ColloidsSurf.BBiointerf.,2014,113:276-284.
[30] ALI M S,AL-LOHEDAN H A,RAFIQUEE M Z A,etal..Spectroscopic studies on the interaction between novel polyvinylthiol-functionalized silver nanoparticles with lysozyme [J].Spectrochim.ActaA:Mol.Biomol.Spectrosc.,2015,135:147-152.
[31] 贾悦,杨洪芹,郭刘奇,等.头孢克肟与胃蛋白酶相互作用的光谱法研究 [J].化学研究与应用,2016,28(5): 673-680.JIA Y,YANG H Q,GUO L Q,etal..Investigation of interaction between cefixime and pepsin by spectroscopic methods [J].Chem.Res.Appl.,2016,28(5):673-680.(in Chinese)
[32] 曾华金,李梦婷,李晴,等.光谱法结合分子模拟技术研究左氧氟沙星与胃蛋白酶的相互作用机理 [J].发光学报,2016,37(4):481-486.ZENG H J,LI M T,LI Q,etal..Mechanism of interaction between levofloxacin and pepsin by spectroscopic and molecular docking methods [J].Chin.J.Lumin.,2016,37(4):481-486.(in Chinese)

王金菊(1990-),女,河北廊坊人,硕士研究生,2015年于沧州师范学院获得学士学位,主要从事分子发光学理论与应用的研究。
E-mail: 778948454@qq.com

刘保生(1963-),男,河北保定人,硕士,研究员,1992年于河北大学获得硕士学位,主要从事分子发光学理论与应用的研究。
E-mail: lbs@hbu.edu.cn
Mechanism of Interaction Between Ceftazidime and Trypsin by Spectroscopic and Molecular Docking Methods
WANG Jin-ju,LIU Bao-sheng*,BIAN Gang,DUAN Shao-tong,LI Tong-tong
(KeyLaboratoryofAnalyticalScienceandTechnologyofHebeiProvince,CollegeofChemistry&EnvironmentalScience,HebeiUniversity,Baoding071002,China)
The binding of ceftazidime (CFD) with trypsin (TRP) was investigated by spectroscopic and molecular docking methods under different temperature conditions (298,303 and 310 K).The results demonstrate that the interaction between CFD and TRP is taking placeviastatic quenching with 1:1 binding ratio.The fluorescence data were treated by using the double logarithmic equation,and the binding constantsKaof the interaction of CFD-TRP systems and the number of binding sitesnwere obtained.The thermodynamic parameters of CFD-TRP systems under different temperatures were obtained by the thermodynamic equation.The experimental data show that the interactions between them are mainly hydrophobic interaction and hydrogen bonding interaction,which is consistent with the molecular docking results.
spectrometry; molecular docking; ceftazidime; trypsin; interaction mechanism
1000-7032(2017)09-1256-08
2017-02-12;
2017-04-05
国家自然科学基金(21375032); 河北省重点基础研究项目(10967126D)资助
O657.3
A
10.3788/fgxb20173809.1256
*CorrespondingAuthor,E-mail:lbs@hbu.edu.cn
Supported by National Natural Science Foundation of China(21375032); Key Basic Research Project of Hebei Province (10967126D)

