不同养殖密度对紫贻贝和披针形蜈蚣藻生态混养的影响
白凯强,韩军军,林庆莹,吴 月,王 艺,霍元子,何培民
不同养殖密度对紫贻贝和披针形蜈蚣藻生态混养的影响
白凯强1,2,韩军军1,2,林庆莹1,2,吴 月1,2,王 艺1,2,霍元子1,2,何培民1,2
(1.上海海洋大学水产与生命学院,上海 201306;2.上海海洋大学海洋科学研究院海洋生态环境和修复研究所,上海 201306)
通过混养生态系统模拟试验研究了紫贻贝(Grateloupia lanceolata)和披针形蜈蚣藻(Mytilus edulis)不同养殖密度组合下的生态混养状况。选取壳长(45.14±3.85)mm的紫贻贝和长度(62.48±7.38)mm的披针形蜈蚣藻,采用5种湿重配比进行混养实验,分别为G1(1∶0)、G2(1∶0.25)、G3(1∶0.5)、G4(1∶1)和G5(1∶2)。每种组合中紫贻贝密度均为0.63 ind·L-1,而披针形蜈蚣藻密度分别为0 g·L-1、1.25 g·L-1、2.5 g·L-1、5 g·L-1、10 g·L-1。36 d后,G3组中紫贻贝特定生长率为(0.21±0.03)%·d-1,极显著高于其它混养组[(0.11±0.028)~(0.21±0.03)%·d-1,P<0.01],而单养组的紫贻贝特定生长率仅为(0.063±0.022)%·d-1;G3组中披针形蜈蚣藻特定生长率为(0.96±0.20)%·d-1,极显著高于其它混养组[(0.62±0.16)~(0.96±0.20)%·d-1,P<0.01]。G3组生态系统对营养盐(NO-3-N、NO-2-N、NH+4-N、PO3-4-P)的去除率分别达到(91.38±1.40)%、(96.79±1.97)%、(98.38±2.06)%、(96.86± 3.16)%,显著高于G2组(P<0.05),而与G4和G5组没有显著性差异(P>0.05)。本研究结果表明,当紫贻贝与披针形蜈蚣藻湿重比为1∶0.5时,可以取得较好的生态效应。
贝藻混养;紫贻贝;披针形蜈蚣藻;特定生长率;生态效应
我国是水产养殖大国,据2014年中国渔业统计年鉴显示,海水贝类养殖在整个海水养殖业的发展中已经起着举足轻重的作用[1]。然而,随着养殖面积和产量的逐年攀升,养殖环境恶化加剧导致了贝类病害大量爆发和种质的急剧退化。上世纪70年代就有学者开始以大型海藻作为海洋生物滤器,开展了大型藻类与各种贝类的综合养殖模式研究[2]。韦玮等[3]初步研究了栉孔扇贝(Chlamys farreri)和海带(Laminaria japonica)混养的互利机制,胡海燕等[4]研究了龙须菜(Gracilaria lemaneiformis)和黑鮶鱼(Sebastodes fuscescens)的混养状况,此外蔡泽平等[5]、卢光明等[6]、郑辉等[7-8]、孙伟等[9]和赖龙玉等[10]都进行过混养研究。这些结果均表明,营养盐可以通过大型藻类的吸收而去除,达到对养殖环境的生物修复和生态调控[11]且可以显著提高养殖生物的产量。
我国紫贻贝(Mytilus edulis)的养殖主要集中在浙江省舟山市嵊泗列岛海域[12]。枸杞岛素有“贻贝之乡”之称,许多当地人在其附近海域进行大面积的贻贝养殖活动,且规模逐年扩大[13]。据枸杞乡政府统计,贻贝养殖面积从2008年的667 hm2增至2015年的约1 000 hm2,而年产量从2010年的47.5万t增至2015年的62.9万t,平均年产量增加了6.48%。由于养殖面积的不断扩大,近年来出现了养殖海域富营养化严重,赤潮频繁爆发等环境问题[14]。
披针形蜈蚣藻(Grateloupia lanceolata)是枸杞岛附近海域普遍生长的一种大型经济海藻。该藻可供食用、提取藻胶,且具有很高的药用价值,如:具有防治各种心血管病、抗肿瘤、抗病毒、抗氧化及增强免疫力等作用[15-16],具有一定的开发利用前景。故本文选取紫贻贝与披针形蜈蚣藻进行混养实验,通过设定不同混养密度,以贝藻的生长、营养需要以及净化效果作为测量指标,比较不同比例贝藻的混养效果,研究结果可为今后开展贝藻生态混养生产提供理论参考,达到改善贻贝养殖区环境的效果,从而实现该地区贻贝养殖业的可持续发展。
1 材料与方法
1.1 实验材料
紫贻贝取自浙江省舟山市嵊泗县枸杞岛后头湾贻贝养殖区,其体质量(8.24±0.35)g、壳长(45.14±3.85)mm,实验前在实验室内暂养7 d,暂养条件:温度20℃,盐度30,用通气泵不间断通气,每3 d投喂1次饵料小球藻,6 d换1次水。披针形蜈蚣藻采自浙江省舟山市嵊泗县枸杞岛后头湾贻贝养殖筏架,通过形态学观察结合分子生物学方法进行披针形蜈蚣藻种类鉴定并除杂。实验前用消毒海水(过滤后加热至100℃,冷却至室温)将采集到的藻体反复洗净,用镊子和毛笔去除藻体表面的硅藻等杂藻以及其它原生动物,然后置于实验室暂养7 d确保其生理活动趋于正常。暂养条件:光照强度60μmol· m-2·s-1,温度20℃,盐度30,光照周期12 L∶12 D,不间断通气,每3 d加1次VSE营养盐,6 d换1次水。实验用海水取自上海市奉贤区近岸海域。
1.2 实验设计
按照紫贻贝与披针形蜈蚣藻的不同湿重比混养(如表1),设计G0、G1、G2、G3、G4、G5 6个组,其中G0为空白对照,G1为单养组,G2、G3、G4和G5为混养组,混养比例分别为1∶0.25、1∶0.5、1∶1和1∶2(贝湿重:藻湿重),每组设置3个重复。
实验在光照培养箱(GZX-300BS-III)中进行,养殖容器为40 cm×28 cm×22.5 cm的塑料透明养殖箱,箱内水体表层光照强度为60μmol·m-2·s-1,温度20℃,盐度30,光照周期12 L∶12 D。紫贻贝和披针形蜈蚣藻均匀放置于箱底,养殖水体积为16 L。采用连续充气培养,空气经CuSO4溶液过滤后充进养殖箱中。
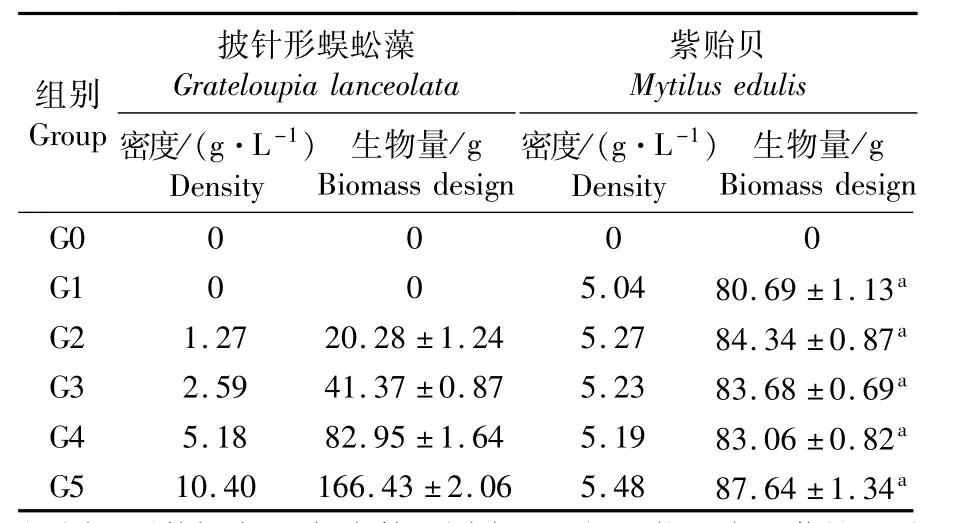
表1 各组养殖生物初始放养量Tab.1 Initial density and biomass of Grateloupia lanceolata and Mytilus edulis in each test group
1.3 实验日常管理
实验期间每3 d投喂饵料小球藻(Chlorella vulgaris)1次,每次投喂指数生长期小球藻150 ml(根据放养的紫贻贝滤水率而定),通过血球计数板的方法根据紫贻贝生长状况调整小球藻浓度为7.5×107个·mL-1。空白对照组不进行投喂,其它实验组保证投喂量相同,每天检查养殖生物的存活和设备的运转情况,发现死亡紫贻贝立即取出,实验期间不大规模换水,仅补充蒸发损失的水分,保持水体盐度在30。实验周期为6周。
1.4 取样和测定
实验期间每6 d取一次水样,测定水体中COD和营养盐(NO-3-N、NO-2-N、NH+4-N、PO3-4-P)的含量。COD用重铬酸钾法测定,营养盐用流动水质监测分析仪(Skalar,荷兰)测定。用吸水纸吸干紫贻贝和披针形蜈蚣藻表面水分的湿重,每6 d测定1次。养殖生物的生长指标用增重率(WGR)和特定生长率(SGR)表示,计算公式如下:

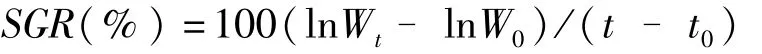
营养盐去除率(%)=(m0-mt)/mt×100%式中,WGR为增重率(%),SGR为特定生长率(%·d-1),W0为实验开始时养殖生物鲜重(g),Wt为实验结束时养殖生物鲜重(g),t为实验结束时的时间(d),t0为实验开始时的时间(d)。m0为实验开始时水体中营养盐含量(mg),mt为实验结束时水体中营养盐含量(mg)。
1.5 实验数据处理
采用Excel 2007整理数据及绘制图形,用SPSS 18.0进行单因素方差分析(one-way ANOVA),P<0.01表示各指标差异达到极显著水平,P<0.05表示各指标差异达到显著水平。所得数据以平均值±标准差(Mean±SD)形式表示。
2 结果与分析
2.1 养殖生物生长情况
图1为紫贻贝和披针形蜈蚣藻每周的特定生长率,表2为养殖生物的生长状况。结果显示:混养组G3中紫贻贝的特定生长率在整个实验过程中显著高于单养组G1和混养组G2(P<0.05);而从第2周开始显著高于混养组G5(P<0.05),从第3周开始显著高于混养组G4(P<0.05),直至实验结束。实验中混养组G3中的紫贻贝具有最高的特定生长率为(0.21±0.03)%·d-1。
实验第1、2、3和6周,混养组G3中披针形蜈蚣藻特定生长率显著高于G2组(P<0.05),第2周至实验结束G3组显著高于G4和G5组(P<0.05),实验第5和第6周,G2组显著高于G5和G6组(P<0.05)。实验中混养组G3中的披针形蜈蚣藻具有最高的特定生长率(0.96±0.20)%·d-1。
2.2 COD变化情况
图2为各组中每个取样周期的COD浓度变化和比较。结果显示:整个实验过程中单养组G1的COD浓度极显著高于其它组(P<0.01),并在第5个取样周期达到最大值7.26 mg·L-1;第2取样周期至实验结束,混养组G4和G5显著高于实验组G2和G3(P<0.05);整个实验过程中G4和G5之间差异不显著(P>0.05)。

图1 实验期间每个取样周期紫贻贝和披针形蜈蚣藻特定生长率Fig.1 Periodic specific grow th rates of Mytilus edulis and Grateloupia lanceolata
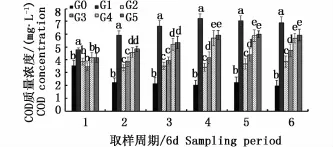
图2 COD质量浓度Fig.2 COD mass concentration
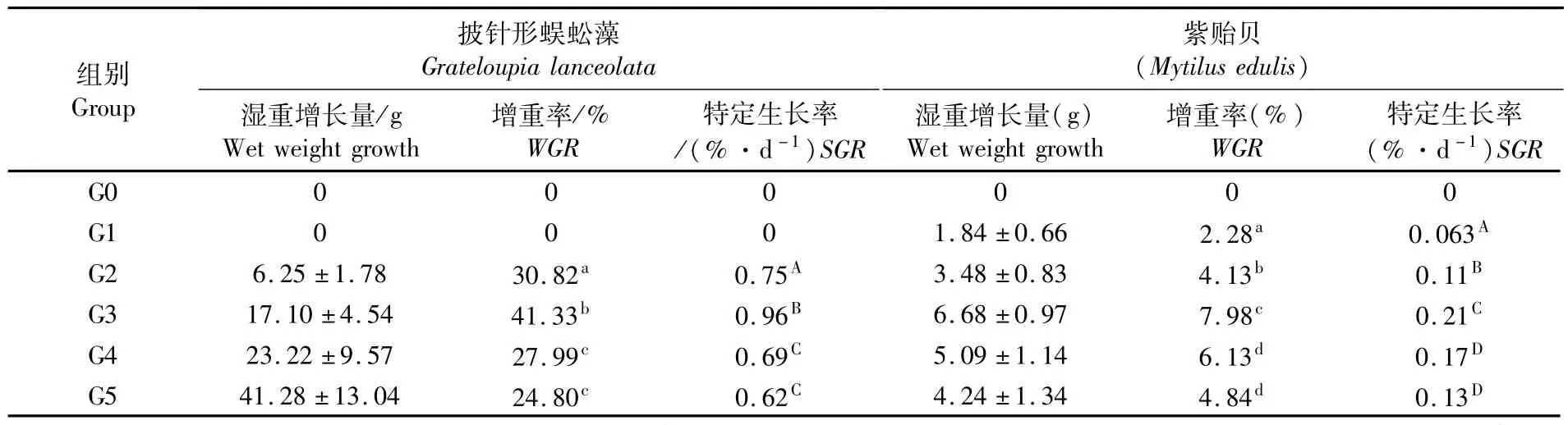
表2 实验期间披针形蜈蚣藻和紫贻贝的生长指标状况Tab.2 Grow th indices of Grateloupia lanceolata and Mytilus edulis during the experiment
2.3 水体营养盐变化情况
2.3.1 NH+4-N的变化
图3-A为不同组水体中NH+4-N的浓度变化情况和相互比较。结果显示,单养组G1水体中NH+4-N浓度在整个实验过程中极显著高于其它混养组(P<0.01),其NH+4-N浓度平均值为(1.41±0.071)mg·L-1;在实验第1和第2取样周期混养组之间NH+4-N浓度差异不显著(P>0.05);从第3取样周期至实验结束,混养组G2显著高于其它混养组(P<0.05)。与单养组G1相比,混养组G2、G3、G4和G5系统对NH+4-N的去除率分别为:(73.56%±3.39%)、(98.38% ±2.06%)、(98.71%±2.35%)和(98.63%± 3.35%)。
2.3.2 NO-3-N的变化
图3-B为不同组水体中NO-3-N的浓度变化情况和相互比较。结果显示,单养组G1水体中NO-3-N的浓度从第1采样周期开始即显著高于其它混养组(P<0.05),从第2采样周期到实验结束一直极显著高于其它混养组(P<0.01);混养组G2水体中NO-3-N的浓度从第3采样周期开始显著高于其它混养组(P<0.05);整个实验过程中,混养组G3、G4和G5之间差异并不显著(P>0.05)。与单养组G1相比,混养组G2、G3、G4和G5系统对NO-3-N的吸收率分别为(69.49%±1.02%)、(91.38%±1.40%)、(93.63%±1.34%)和(94.68%±3.23%)。
2.3.3 NO-2-N的变化
图3-C为不同组水体中NO-2-N的浓度变化情况和相互比较。结果显示,实验第1取样周期单养组G1水体中NO-2-N的浓度即显著高于混养组G3、G4和G5组(P<0.05),从第3采样周期至实验结束其极显著高于所有混养组(P<0.01);混养组G2水体中NO-2-N的浓度于第3采样周期至实验结束显著高于混养组G3、G4和G5(P<0.05)。与单养组G1相比,混养组G2、G3、G4和G5系统对NO-2-N的吸收率分别为(86.73%±2.10%)、(96.79%±1.97%)、(97.06%±1.29%)和(97.89%±2.27%)。
2.3.4 PO3-4-P的变化
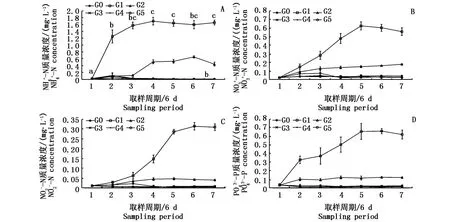
图3 氨氮、硝态氮、亚硝态氮和磷酸盐质量浓度分析结果Fig.3 Variation of NH+4-N,NO-3-N,NO-2-N and PO3-4-P concentrations in different trail groups during the experiment
3 讨论
3.1 贝类和大型海藻的养殖对环境的影响
在当下我国提倡生态经济和生态文明建设的大背景下,随着贝类养殖产业的发展,贝类养殖规模在不断扩大,贝类养殖区生态环境问题越来越受到关注。贝类养殖在一定程度上可控制浮游植物的群落组成及生物量,并通过生物沉积以及收获活动移除水体中的营养物质,降低富营养化程度[17-19]。LINDAHL等[20]对瑞典Gullmar湾贻贝养殖活动的模型研究结果显示,贻贝养殖活动使湾内水体氮浓度降低20%,但是其并没有讨论贻贝养殖对海洋中无机氮含量的影响。随着养殖规模的扩大和养殖密度的增加,单纯的贝类养殖活动会对养殖区水域环境产生负面影响[21-22]。贝类会对食物颗粒进行选择性摄食,在饵料密度较低时,贝类可以有效地摄食饵料,但当饵料密度超过一定阈值时,部分不适口或营养价值低的颗粒将以假粪的形式排除。当贝类产生大量假粪的同时会分泌更多的粘液,导致贝类氮磷的损失[23]。贝类排出的粪便及假粪会聚集并下沉到海底而形成生物性沉积,致使有机沉积物增加、间隙水中氧减少、氧消耗增加、硫还原加速和解氨作用增强,最终加速养殖水体中的营养盐再生,进而导致水体的富营养化[24-25]。KASPAR等[18]在对海湾筏式贻贝养殖区与自然海区对照研究时发现,养殖水域中的氮磷比、碳氮比,以及有机氮的含量均较高。还有研究显示,一定条件下,贝类养殖区铵态氮的释放率可达到非养殖区的5~10倍[26]。
大型海藻是可以进行光和放氧的多细胞海洋植物,其体内存贮的营养库使它们可以适应营养盐波动的水体环境。如当水体营养盐不足时,其体内氮库仍可较长时间的维持自身生长;而当水体营养盐含量较高时,大型海藻会吸收超过自身生长所需的营养盐,以充实其体内营养库以备其快速生长时利用。大型海藻在海洋环境中的生态作用包括优化海洋生态系统结构、参与海洋碳循环、延缓海域富营养化、控制赤潮、参与海水养殖清洁生产等方面。故大型海藻的养殖对于缓解海水富营养化、防止赤潮频发、恢复海洋生物资源、恢复受损的海底生态系统和改善近海生态环境均具有十分重要的意义[27]。
3.2 紫贻贝和蜈蚣藻混养的互利机制
本实验中的紫贻贝是通过自由延伸的吸管进行呼吸和觅食的滤食性贝类[28],通过其排泄废物为混养的蜈蚣藻提供生长所需的部分氮源(以NH+4-N为主,NO-3-N次之,NO-2-N最少[29-30])、磷源及光合作用所需的CO2。而混养的蜈蚣藻则为紫贻贝提供呼吸所需的O2,吸收水环境中NO-3-N、NO-2-N、NH+4-N、PO3-4-P等过量营养盐,为紫贻贝提供更适宜的生长环境[31]。
3.3 贻贝和蜈蚣藻混养的最适配比
许多学者已进行了养殖生物和海藻的混养匹配实验,证明该模型的可行性[3-11]。本实验选取的5种贝藻配比的养殖水体中适中COD的含量表明实验系统运行良好。实验第1采样周期中,单养组G1中紫贻贝生长状况良好,之后随着养殖系统中营养盐(NO-3-N、NO-2-N、NH+4-N、PO3-4-P)含量升高,紫贻贝特定生长率显著降低(P<0.05),最后停止生长。陈金凤等[32]研究发现养殖环境中氨积累会促进养殖生物的耗氧率增加和抑制其排氨率。G1组水体中NH+4-N在第3采样周其达到其最大值,之后其浓度没有显著性差异(P>0.05),且其紫贻贝的特定生长率从第3采样周期开始显著降低(P<0.05),表明氨氮的积累对紫贻贝的排氨率和生长造成了很大的影响。混养组中的披针形蜈蚣藻吸收了大量的营养盐(NO-3-N、NO-2-N、NH+4-N、PO3-4-P),长势良好,藻体颜色加深,藻体变厚。然而G2混养组中的营养盐含量自第3采样周期开始至实验显著高于其它混养组(P<0.05),且紫贻贝特定生长率也偏小,这表明该组中与紫贻贝匹配的披针形蜈蚣藻量偏少,养殖水体中营养盐未被完全去除,从而对紫贻贝的生长产生影响。混养组G4和G5中披针形蜈蚣藻特定生长率分别从第2和第5采样周期至实验结束显著小于G2和G3组(P<0.05);其紫贻贝特定生长率分别从实验第5和第6采样周期至实验结束显著低于G3组(P<0.05),表明与其匹配的披针形蜈蚣藻过量,蜈蚣藻因为水体中营养盐的不足而生长缓慢。大量研究表明大型海藻会与微藻进行营养竞争,它们向环境中的干扰化合物对微藻具有明显的生化抑制效应[33-35]。混养组G4和G5中过量的披针形蜈蚣藻对喂养贻贝的小球藻造成了营养竞争,从而导致紫贻贝饵料短缺,最终影响了紫贻贝的生长,但关于披针形蜈蚣藻、紫贻贝和单胞藻之间的定量关系还需进一步研究。G3组养殖水体中营养盐含量在整个实验过程中没有显著性差异(P>0.05),表明该比例匹配的系统可以完全去除系统水体中的营养盐,且G3组中紫贻贝和披针形蜈蚣藻均具有最大的特定生长率(P<0.05),表明混养组G3的放养密度最适合,即紫贻贝和披针形蜈蚣藻1∶0.5(湿重比)的放养密度最合理。
浙江省舟山市嵊泗县枸杞岛后头湾是贻贝养殖的主要养殖区,随着该地区贻贝养殖规模逐年扩大,开始出现海水富营养化现象,造成贻贝养殖成活率下降、产量减少等问题,改善养殖海区的环境条件刻不容缓。本研究通过选取该地区自然生长的披针形蜈蚣藻和紫贻贝进行匹配,结果表明,合适密度的披针形蜈蚣藻能显著降低养殖水体中过量的营养盐,从而改善并保持良好的养殖环境,为养殖的紫贻贝提供良好的生存环境。本研究结果对于改善和优化贻贝养殖模式,改善养殖海区生态环境条件,提高紫贻贝和披针形蜈蚣藻的产量具有积极的指导意义,可期望给当地渔民带来更大的经济效益,因此具有较为广阔的推广应用前景。
[1] 农业部渔业局.2014中国渔业统计年鉴[M].北京:中国农业出版社,2014:56-62.
Fishery Bureau in Ministry of Agriculture,China fishery statistical yearbook[M].Beijing:China Agriculture Press,2014:56-62.
[2] RYTHER JH,GOLDMAN JC,GIFFORD C E,et al.Physical models of integrated waste recyclingmarine polyculture systems[J].Aquaculture,1975,5(2):163-177.
[3] 韦 玮,方建光,董双林.贝藻混养生态系互利机制中的作用因子[J].中国水产科学,2005,12(2):220-224.
WEIW,FANG JG,DONG S L.Main factors of mutually beneficial mechanism in the polycultureecosystem of scallop(Chlamys farreri)and kelp(Laminaria japonica)[J].Journal of Fishery Sciences of China,2005,12(2):220-224.
[4] 胡海燕,卢继武,周 毅,等.龙须菜在鱼藻混养系统中的生态功能[J].海洋科学集刊,2003,46(45):169-175.
HU H Y,LU JW,ZHOU Y,et al.Ecological function of Gracilaria lemaneiformis in fish and seaweed ployculture system[J].Studia Marina Sinica,2003,46(45):169-175.
[5] 蔡泽平,胡超群,张俊彬.真鲷与石莼池塘混养试验[J].热带海洋学报,2005,24(4):1-6.
CAI Z P,HU C Q,ZHANG J B.Polyculture experiment of red sea bream Pagrosomusmajor with seaweed Ulva lactuca in fishpond system[J].Journal of Tropical Oceanography,2005,24(4):1-6.
[6] 卢光明,徐永健,陆慧贤.大黄鱼池塘不同混养模式生态学特征比较[J].应用生态学报,2011,22(5):1325-1331.
LU G M,XU Y J,LU H X.Ecological characteristics of different pseudosciaena crocea culture models[J].Chinese Journal of Applied Ecology,2011,22(5):1325-1331.
[7] 郑 辉,崔力拓,潘 娟.海带在贝藻混养生态系统中的生态效应模拟研究[J].渔业现代化,2014,41(3):26-29.
ZHENG H,CUI L T,PAN J.Ecological effect of Kelp in polyculture system with Argopecten irradias[J].Fishery Modernization,2014,41(3):26-29.
[8] 郑 辉,李志伟.贝藻混养生态系统模拟实验研究[J].海洋科学,2014,38(10):52-55.
ZHENG H,LI Z W.Simulation of the polyculture ecosystem of scallop(Argopecten irradias)and kelp(Ulva Pertusavar)[J].Marine Sciences,2014,38(10):52-55.
[9] 孙 伟,张 涛,杨红生,等.龙须菜在滩涂贝藻混养系统中的生态作用模拟研究[J].海洋科学,2006,30(12):72-76.
SUNW,ZHANG T,YANG H S,et al.Ecological function of Gracilaria lemaneiformis in polyculture system with Meretrixmeretrix[J].Marine Sciences,2006,30(12):72-76.
[10] 赖龙玉,严正凛,钟幼平,等.鲍藻混养配比密度的研究[J].福建农业学报,2014,29(9):832-838.
LAIL Y,YAN Z L,ZHONG Y P,et al.Density and composition of the polyculture of abalone(H.Discus)and two kinds of Alga(U.Lactuca and G.Asiatica)[J].Fujian Journal of Agricultural Sciences,2014,29(9):832-838.
[11] 毛玉泽,杨红生,王如才.大型藻类在综合海水养殖系统中的生物修复作用[J].中国水产科学,2005,12(2):225-231.
MAO Y Z,YANG H S,Wang R C.Bioremediation capability of large-sized seaweed in integrated mariculture ecosystem:A review[J].Journal of Fishery Sciences of China,2005,12(2):225-231.
[12] 付英杰.两种养殖模式下枸杞岛紫贻贝的生长特征及其对水域水质的影响[D].舟山:浙江海洋学院,2014.
FU Y J.The growth chracteristcs of Mytilus edulis Linnaeu in Gouqi Island and its effect on the water quality[D].Zhoushan:Zhejiang Ocean University,2014.
[13] 刘媛媛,张建伟,韩军军,等.枸杞岛瓦氏马尾藻养殖及其对水环境因子的影响[J].生态学杂志,2015,34(11):3214-3220.
LIU Y Y,ZHANG JW,HAN JJ,etal.Large-scale cultivation of Sargassum vachellianum in the coast of Gouqi Island and its effects on water environmental factors[J].Chinese Journal of Ecology,2015,34(11):3214-3220.
[14] 柴召阳,霍元子,于克锋,等.枸杞岛瓦氏马尾藻藻场生态系统健康评价[J].海洋环境科学,2013,32(3):386-389.
CHAIZ Y,HUO Y Z,YU K F,et al.Assessment of Sargassum vachellianum bed ecosystem health in Gouqi Island[J].Marine Environmental Science,2013,32(3):386-389.
[15] 曾呈奎,张德瑞,张竣甫,等.中国经济海藻志[M].北京:科学出版社,1962.
ZENG C K,ZHANG D R,ZHANG J F,et al.Economico Flora Algarum Marinarum Sinicarum[M].Beijing:Science Press,1962.
[16] 朱艳梅,王一飞,张美英,等.蜈蚣藻多糖的提取分离及抗病毒活性的研究[J].中药材,2006,29(3):256-259.
ZHU Y M,WANG Y F,ZHANG M Y,et al.The study on the extraction and the antivirus activity of amylose extracted from Grateloupia filicina[J].Journal of Chinese Medicinal Materials,2006,29(3):256-259.
[17] RODHOUSE PG,RODEN CM.Carbon budget for a coastal inlet in relation to intensive cultivation of suspension-feeding bivalve mollusks[J].Marine Ecology Progress,1987,36(3):225-236.
[18] KASPAR H F,GILLES P A,BOYER IC,et al.Effects of mussel aquaculture on the nitrogen cycle and benthic communities in Kenepuru Sound,Marlborough Sounds,New Zealand[J].Marine Biology,1985,85(2):127-136.
[19] OFFICER C B,SMAYDA T J,MANN R.Benthic filter feeding:A natural eutrophication control[J].Marine Ecology Progress,1982,9(2):203-210.
[20] LINDAHL O,HART R,HERNROTH B,et al.Improvingmarinewater quality bymussel farming:A profitable solution for Swedish society[J].Ambio,2005,34(2):131-138.
[21] DAME R F,WOLAWER T G,LIBES S M.The summer uptake and release of nitrogen by an intertidal oyster reef[J].Netherlands Journal of Sea Research,1985,19(3-4):265-268.
[22] ENG C T,PAW J N,GUARIN F Y.The environmental impact of aquaculture and the effects of pollution on coastal aquaculture development in Southeast Asia[J].Marine Pollution Bulletin,1989,20(7):335-343.
[23] HAVEN D S,MORALES-ALAMO R.Aspects of biodeposition by oysters and other invertebrate filter feeders[J].Limnology&Oceanography,1966,11(4):487-498.
[24] 季如宝,毛兴华,朱明远.贝类养殖对海湾生态系统的影响[J].黄渤海海洋,1998,16(1):21-27.
JIR B,MAO X H,ZHU M Y.Impacts of coastal shellfish aquaculture on bay ecosystem[J].Journal of Oceanography of Huanghai&Bohai Seas,1998,16(1):21-27.
[25] 杨红生,周 毅.滤食性贝类对养殖海区环境影响的研究进展[J].海洋科学,1998,22(2):42-44.
YANG H S,ZHOU Y.Progress in studies on effect of filter-feeding bivalve on environmentofmariculture area[J].Marine Sciences,1998,22(2):42-44.
[26] STRANG T J.Nutrient regeneration under mussel farms:The environmental effects of mussel aquaculture in coastal bays[M].Newfoundland:Memorial University of Newfoundland,2003.
[27] 安鑫龙,李雪梅,徐春霞,等.大型海藻对近海环境的生态作用[J].水产科学,2010,29(2):115-119.
AN X L,LIX M,XU CX,etal.Ecological effects of seaweeds on the coastal environment[J].Fisheries Science,2010,29(2):115-119.
[28] 王祯瑞.中国动物志(软体动物门双壳纲贻贝目)[M].北京:科学出版社,1997:50-51.
WANG Z R.Fauna Sinica Phylum Mollusca Order Mytiloida[M].Beijing:Science Press,1997:50-51.
[29] PANDIAN T L,VERNBERGE J.Animal energetics.Volume 1.Protozoa through Insecta[M].Animal Energetics,1987:1-88.
[30] 周 毅,杨红生,何义朝,等.四十里湾几种双壳贝类及污损动物的氮、磷排泄及其生态效应[J].海洋与湖沼,2002,33(4):424-431.
ZHOU Y,YANG H S,HE Y C,etal.Nitrogen and phosphorus excretion and its ecological effect by several bivalves and fouling animals[J].Oceanologia Et Limnologia Sinica,2002,33(4):424-431.
[31] 岳维忠,黄小平,黄良民,等.大型藻类净化养殖水体的初步研究[J].海洋环境科学,2004,23(1):13-15,40.
YUE W Z,HUANG X P,HUANG L M,et al.Preliminary study on purification ofmariculture water by macroscopic algae[J].Marine Environmental Science,2004,23(1):13-15,40.
[32] 陈金凤,黄鹤忠,徐汗富,等.氨氮对文蛤存活及能量收支的影响[J].海洋科学,2010,34(3):40-46.
CHEN JF,HUANG H Z,XU H F,et al.Ammonia effects the survival and the energy budget of clam Meretrix meretrix[J].Marine Sciences,2010,34(3):40-46.
[33] 杨清心.富营养水体中沉水植物与浮游藻类相互竞争的研究[J].湖泊科学,1996,8(增刊):17-24.
YANG Q X.Studies on the interaction of submerged plant and phytoplankton in eutrophic waters[J].Journal of Lake Sciences,1996,8(Suppl.):17-24.
[34] JEONG JH,JIN H J,SOHN CH.Algicidal activity of the seaweed Corallina pilulifera,against red tide microalgae[J].Journal of Applied Phycology,2000,12(1):37-43.
[35] JIN Q,DONG S.Comparative studies on the allelopathic effects of two different strains of Ulva pertusa,on Heterosigma akashiwo,and Alexandrium tamarense[J].Journal of Experimental Marine Biology&Ecology,2003,293(1):41-55.
Effects of different culture densities on the ecological polyculture of Mytilus edulis and Grateloupia lanceolata
BAIKai-qiang1,2,HAN Jun-jun1,2,LIN Qing-ying1,2,WU Yue1,2,WANG Yi1,2,HUO Yuan-zi1,2,HE Pei-min1,2
(1.College of Life and Fisheries of ShanghaiOcean University,Shanghai 201306,China;2.Institutes of Marine Sciences of Shanghai Ocean University,Shanghai 201306,China)
Grateloupia lanceolata is a kind of seaweed which widely grows in the waters of Gouqi Island.It can be used for eating and algin extraction,sowith high economic andmedicinal values,whichmakes ithave the exploitment and utilization prospects.Mytilus edulis is one of the most important marine shellfishes in China whose cultivation mainly concentrates around the Shengsi Island of Zhoushan City in Zhejiang Province and the scale is expanding year by year.However,due to the continuous expansion of cultivation area and the increasing cultivation density,in recent years,the eutrophication of the mariculture area has been serious,leading the red tide breaking out frequently.This paper studied on the polyculture of Mytilus edulis and Grateloupia lanceolata in order to improve the environment of the regional aquaculture area.Polyculture systems of Mytilus edulis and Grateloupia lanceolata were set as 5 treatment groups and the polyculture of the Mytilus edulis with the Grateloupia lanceolata densitieswere G1(1∶0),G2(1∶0.25),G3(1∶0.5),G4(1∶1)and G5(1∶2).The Mytilusedulis was bred at the density of0.63 ind·L-1in each group,while the Grateloupia lanceolata were cultivated at different densities of 0 g·L-1,1.25 g·L-1,2.5 g·L-1,5 g·L-1and 10 g·L-1.After 36 d,the specific growth rate of Mytilus edulis in G3 was 0.21± 0.03%·d-1,significantly higher than those in the other polyculture groups(0.11±0.028-0.21± 0.03%·d-1,P<0.01),and the specific growth rate of Mytilus edulis monoculture was only 0.063± 0.022%·d-1(P<0.01).The specific growth rate of Grateloupia lanceolata in G3 group was0.96±0.20 %·d-1,which was significantly higher than those of the other polyculture groups(0.62±0.16-0.96± 0.20%·d-1,P<0.01).The removal rates of nutrients(NO-3-N,NO-2-N,NH+4-N,PO3-4-P)in G3 were 91.38±1.40%,96.79±1.97%,98.38±2.06%and 96.86±3.16%respectively,which were significantly higher than G2(P<0.05),but had no significant difference between G4 and G5(P>0.05).In conclusion,the polyculture of Mytilus edulis with Grateloupia lanceolata can exert reasonable ecological effectswhen the density ratio is 1∶0.5.
Polyculture;Mytilus edulis;Grateloupia lanceolata;specific growth rate;ecological effects
S 968.9
A
1004-2490(2017)04-0454-09
2017-02-27
国家科技支撑计划项目(2012BAC07B03);上海市海洋局科研项目(沪海科2015-02)
白凯强(1991-),男,硕士研究生,主要研究方向为海洋生态环境修复。
何培民,教授。E-mail:Pmhe@shou.edu.cn

